Количественное планирование нейтрон-захватной терапии по данным кинетики комплексов Gd (III) при магнитно- резонансной томографии
Автор: Карпович Н.И., Вагнер А.Р., Бахметьева М.И., Белянин М.Л., Савелло Н.В., Усов В.Ю.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: В помощь практическому врачу
Статья в выпуске: 3 т.32, 2017 года.
Бесплатный доступ
Нейтрон-захватная терапия (НЗТ) пучками тепловых нейтронов (n0) с высокой плотностью частиц является наиболее перспективным методом терапии неоперабельных злокачественных новообразований головного мозга с использованием Gd в форме устойчивых ацетатных комплексов с возможностью визуальной оценки методом магнитно-резонансной томографии (МРТ). Эффективность НЗТ определяется максимальной дозой, которая создается в опухолевых клетках продуктами реакции захвата n0 атомами Gd. Проанализировав кинетику прямого поглощения и обратной диффузии комплексов Gd в ткани опухолей мозга при МРТ, нам удалось показать, что она во всех случаях линейна и концентрация Gd в опухоли в момент T определяется как Соп(Т) = kпл-оп ∙ ∫ Спл(t)∙exp(-kоп-пл (T-t))dt. При этом величина коэффициента прямого транспорта kплазма-опухоль=5,87±0,31 на порядок превосходит скорость обратной диффузии kопухоль-плазма=0,91±0,23. Тогда по данным однократного диагностического динамического исследования возможно рассчитать оптимальную схему дозирования Gd для достижения терапевтического эффекта нейтронного пучка известной плотности при НЗТ, одновременно избегая высвобождения Gd в здоровых тканях.
Нейтрон-захватная терапия, гадолиний, магнитно-резонансная томография, парамагнитное контрастирование, фармакокинетическое моделирование
Короткий адрес: https://sciup.org/149125175
IDR: 149125175 | DOI: 10.29001/2073-8552-2017-32-3-77-82
Текст научной статьи Количественное планирование нейтрон-захватной терапии по данным кинетики комплексов Gd (III) при магнитно- резонансной томографии
Несмотря на успехи в лучевой и химиотерапии в последние десятилетия, проблема лечения больных с некоторыми радиорезистентными опухолями остается нерешенной, так как оба метода лечения оказывают сильное повреждающее воздействие на здоровые клетки. Одним из наиболее многообещающих методов избирательного поражения опухолевых клеток является НЗТ, она наиболее эффективна и практически безальтернативна при лечении агрессивных форм опухолей головного мозга. В качестве нейтрон-захватного агента в данной работе рассматривается изотоп 157Gd, который обладает большим сечением захвата n0, высоким повреждающим действием вследствие образования высокоэффективных оже-электронов, пробег которых в биологической ткани составляет несколько нм, что вызывает множественные повреждения ДНК и индуцирует гибель опухолевой клетки при относительно небольшом воздействии на примыкающие к опухоли нормальные ткани.
Эффективность НЗТ определяется максимальной дозой, которая создается в опухолевых клетках продуктами реакции захвата n0 атомами Gd, она прямо пропорциональна плотности потока нейтронов и концентрации Gd в опухоли. Таким образом, для успешной реализации НЗТ необходимо знать индивидуальное накопление гадолиния в опухоли и окружающих тканях непосредственно в организме пациента, которое варьируется у разных больных в широких пределах.
Диагностика и детализация опухолей центральной нервной системы (ЦНС) на сегодняшний день наиболее эффективно осуществляется средствами МРТ с парамагнитным контрастированием (ПМК). Более чем в 95% случаев использования ПМК оно осуществляется с помощью соединений Gd (III) как линейных, так и циклических [1]. Таким образом, гадолиний в данной работе выполняет двойную роль: как акцептор n0 и как парамагнетик-основа. Для оценки накопления 157Gd в опухолевых и нормальных тканях нами был разработан безопасный и нетравматичный для пациентов метод с использованием динамической МРТ и введением болюса парамагнитного гадолиний-содержащего контраста.
Материал и методы
Задачей данной работы является подбор оптимального количества агента для НЗТ для обеспечения заданной величины поглощенной дозы в опухоли и окружающих тканях. Как показано ранее [2],
MDH3 = Ф ■ ^""i™'^ ■ <т ■ Е ■ К, где MD нз — мощность дозы продуктов реакции захвата n0 атомами акцептора, сГр/с; Ф — средняя плотность потока n0 в зоне опухоли, н/см2·с; С опухоль — концентрация Gd в опухоли, г/г ткани; σ — сечение реакции захвата n0, барн; Е — энергия продуктов реакции захвата n0; Nа — число Авогадро, 1/моль; М — молекулярная масса Gd, г/моль; К — коэф- фициент согласования размерностей, сГр·г/МэВ. По этой формуле рассчитывается необходимая концентрация Gd в терапевтическом очаге для достижения заданной величины поглощенной дозы. Затем исследуют кинетику накопления Gd при динамической МРТ (введение ПМК внутривенно в диагностической дозе) для достижения необходимой концентрации препарата.
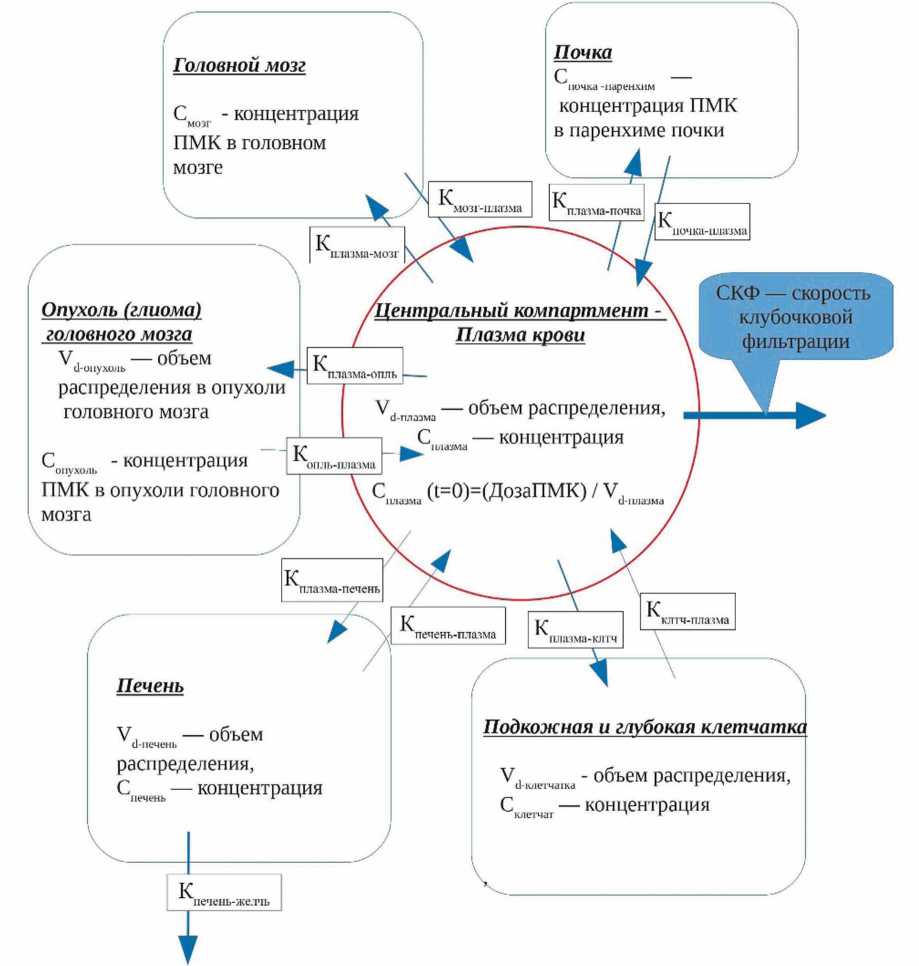
В основе исследования лежало использование муль-тикомпартментной математической модели фармакокинетики циклических и линейных комплексов Gd, на основе известного в целом распределения в организме производных циклических и линейных полиацетатных хелатов — комплексообразователей Gd [3, 6]. Схема модели представлена детально на рисунке 1.
В частности, фармакокинетическая модель включала в себя центральный компартмент — плазму циркулирующей крови, при этом внутриклеточное поглощение ПМК как ядерными клетками крови, так и эритроцитами и тромбоцитами считалось пренебрежимо малым, а объем распределения при этом фактически соответствовал объему плазмы. Элиминация ПМК предполагалась путем клубочковой фильтрации, пропорционально скорости клубочковой фильтрации (СКФ).
При формулировке модели предполагалось, что как почечная фильтрация, так и перенос парамагнетиков через гистогематические барьеры представляет собой линейный процесс, без насыщения и без облегченного транспорта, т.е. линейный во всем диапазоне диагностических концентраций ПМК. В качестве периферических компартментов рассматривались отдельно в частности: головной мозг, ткань опухоли головного мозга, паренхима печени, паренхима почки и — как единое целое — мышечная и соединительная ткань и подкожная клетчатка. Ткань опухолевых глиальных новообразований головного мозга выделялась в качестве отдельного компартмента модели, поскольку все верификационные исследования затем проводились на материале пациентов с новообразованиями ЦНС. Тканевым поглощением контрастного препарата в структурах легких и костного скелета пренебрегали как малозначимыми по величине Vd . Тогда величина концентраций ПМК в опухолевой ткани подчиняется системе уравнений, представленной фармакокинетической модели:
dCопухоль(t)/dt = k
· плазма()— опухоль-плазма· опухоль(), где Ci — концентрации ПМК в соответствующих ком-партментах, а коэффициенты kA-B — линейные коэффициенты пассивного переноса из компартмента А в ком-партмент В, как, в частности, представлено на рисунке 1. Записывая подобные уравнения для остальных компар-тментов, получаем систему уравнений, которая может быть однозначно численно решена [4] в отношении действительных значений коэффициентов межчастевого переноса kA-B при условии известных непрерывных зависимостей Ci (t) для органных компартментов. В качестве начального условия принималось, что во всех случаях
(^0)=(ДозаПМК)/У,,_и
'Центральный компартмент Плазма крови
Подкожная и глубокая клетчатка
V, - объем распределения, d-клегчагка г г п -
С — концентрация клетчат 1 г з
V. — объем d-печень распределения,
С — концентрация печень г
Головной мозг
Печень
ПМК в опухоли головного мозга
СКФ — скорость клубочковой фильтрации
С - концен трация ОПУХОЛЬ 1 * ’
V. — объем распределения, d-плазма г г г п С — концентрация плазма 1 г
Опухоль (глиома) головного мозга
V, —объем _
U-Oliyxvjb распределения в опухоли головного мозга к Г
| опль-плазма
С - концентрация ПМК в головном мозге
Почка
С — почка-паренхим концент рация ПМК в паренхиме почки
Рис. 1. Схема структуры фармакокинетической модели, использованной для количественной оценки кинетики и тканевого накопления гадолиний-содержащего ПМК
парамагнетик вводится в центральную камеру — в плазму крови — одномоментно, с равномерным разведением в объеме распределения ( Vd — объем циркулирующей плазмы) в течение пренебрежимо малого времени так, что Cплазма(t=0) = (Доза ПМК)/Vd . Таким образом, концентрация Gd в опухоли в момент времени Т определяется как С оп (Т) = k пл-оп · ∫ С пл (t)·exp(–k оп-пл (T–t))dt.
Для количественного анализа кинетики поглощения и распада в плазме и тканях в соответствии с использованной моделью были проведены динамические МРТ-исследования кинетики поглощения зарегистрированных на момент начала исследования ПМК — линейных — гадодиамида (у 9 пациентов), гадопентетата димеглюминовой соли (у 10 пациентов), гадоверсета- мида (у 9 пациентов) и циклического — гадобутрола (у 11 пациентов). Все исследования у пациентов были проведены с помощью томографов Toshiba Titan Vantage (Toshiba Medical) и Siemens Magnetom Open (Siemens Medical). Исследования проводились в рамках текущего клинического обследования пациентов с низкодифференцированными глиомами и глиобластомами ЦНС и включали запись динамики накопления ПМК в органах и тканях по данным фронтальных срезов головы, грудной и брюшной полости, как последовательность Т1-взвешенных спин-эхо изображений при TR=400– 550 мс, TE=10–15 мс. Одновременно из вены руки, противоположной к месту инъекции, отбирали по 5 мл крови на 1-й, 3-й, 7-й, 15-й и 40-й мин, с последующим определением содержания свободного и связанного
(в составе ПМК) гадолиния. Количественное содержание Gd и комплексов в плазме крови проводили методом масс-спектрометрии. Содержание контраста-парамагнетика в тканях при динамическом МРТ-исследовании оценивалось путем сравнения изображений с жидкостными фантомами с известным содержанием ПМК в физиологическом растворе [5].
Вычислительно представленная выше модель была реализована в средах специализированных пакетов математических вычислений, моделирования и анализа изображений MatLab (версия 6.2 под управлением ОС Windows 7.0) и SciLab (под управлением ОС AltLinux —
Кентавр). В рамках пакета графического представления данных и их статистической обработки Origin 6.1 (OriginLab Inc, Техас) проводилась проверка распределения полученных значений на согласие с нормальным законом. Все результаты представлены как «Среднее ± ошибка среднего».
Результаты и обсуждение
Константы скорости переноса между плазмой и периферическими компартментами по данным динамического МРТ-исследования составили для представленной модели величины, приведенные в таблице 1.
Таблица 1
|
Константы переноса в направлении «плазма — периферический компартмент» (скорости органного поглощения) |
||||
|
Константы прямого транспорта, мл/мин/100 см3 |
Гадодиамид |
Гадопентетата димеглюминат |
Гадоверсетамид |
Гадобутрол |
|
k плазма-мозг |
0,90±0,09 |
0,86±0,11 |
0,92±0,10 |
0,83±0,09 |
|
k плазма-опухоль |
5,87±0,31 |
5,98±0,29 |
5,69±1,08 |
5,42±0,37 |
|
k плазма-печень |
2,93±0,26 |
2,89±0,25 |
2,85±0,41 |
3,12±0,15 |
|
k плазма-клтч |
1,82±0,09 |
1,76±0,28 |
1,73±0,25 |
1,55±0,12 |
|
k плазма-моча |
57,95±3,02 |
61,05±4,02 |
60,09±3,19 |
56,50±3,62 |
Константы скорости обратного переноса из компартментов в плазму крови составили в свою очередь величины, представленные в таблице 2.
Таблица 2
Константы обратного переноса ПМК — в направлении «периферический компартмент — плазма»
|
Константы обратной диффузии, Гадодиамид Гадопентетата димеглю- Гадоверсетамид мл/мин/100 см3 минат |
Гадобутрол |
|
kмозг-плазма 0,65±0,2 0,66±0,12 0,57±0,15 |
0,63±0,14 |
|
kопухоль-плазма 0,91±0,23 0,85±0,19 0,58±0,14 |
0,71±0,17 |
|
kпечень-плазма 1,12±0,12 0,98±0,15 1,05±0,14 |
0,86±0,24 |
|
kклтч- плазма 0,63±0,23 0,56±0,18 0,59±0,12 |
0,49±0,09 |
Как видно из таблиц 1, 2, накопление ПМК в тканях мозга, печени и соединительной ткани практически не отмечено. С другой стороны, в глиальной опухоли наблюдается задержка гадолиния, хорошо видимая уже при визуальном анализе МРТ пациента с низкодифференцированной глиомой задней комиссуры мозолистого тела, проходившего комплексную химио- и иммунотерапию (рис. 2), в то же время изменений интенсивности окружающего белого вещества не отмечено.
Были рассчитаны соотношения между коэффициентами транспорта ПМК в прямом (из крови в ткань) и обратном (из ткани в кровь) направлениях. Если для головного мозга и печени такие соотношения составляли 1,2–1,8, и для компартмента клетчатки лишь чуть больше — 2,8–3,2, то для ткани глиальной опухоли это соотношение составляло 9,5–10, т.е. обратный перенос был медленнее на порядок. Очевидно, что именно такая ситуация обеспечивала достаточное время пребывания молекул ПМК в области ткани опухоли при незначительном накоплении в нормальных тканях, что и является залогом успешного проведения НЗТ с избирательным поражением опухолевых клеток [2]. В дальнейшем при условии детального анализа характера входной функции — фармакокинетической кривой содержания комплекса гадолиния в крови при введении его диагностической дозы — на основе предложенного здесь подхода может быть выполнена индивидуализация фармакокинетической модели для конкретного случая опухолевого поглощения парамагнитного контраста [5], может быть выполнен расчет такого дозного режима, который гарантированно обеспечит накопление парамагнетика в опухоли в количестве, достаточном для ее необратимого повреждения имеющимся нейтронным пучком с известными характеристиками потока тепловых нейтронов [2].
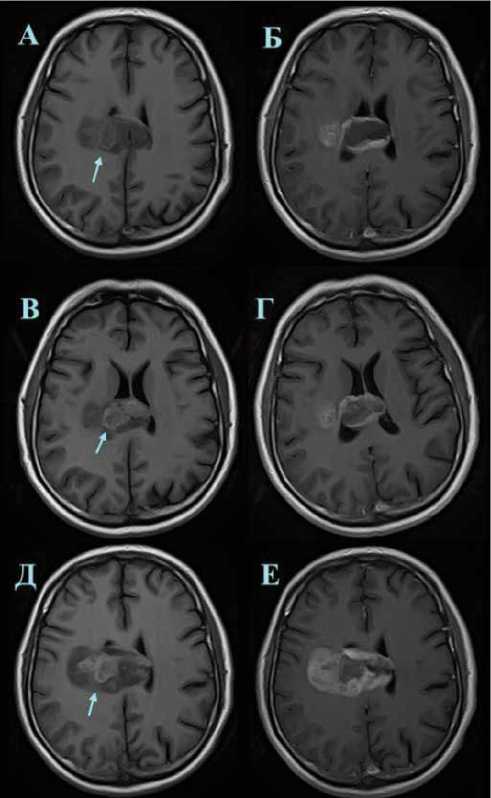
Рис. 2. Картина накопления гадобутрола в дозировке 0,05 мМ/кг веса тела пациента. Изображения: А, Б — в день начала лечения перед ним; В, Г — на 7-й день лечения, Д, Е — на 25-й день лечения. Справа приведены исходные изображения, слева — контрастированные
Выводы
Разработан способ количественной оценки содержания комплексов Gd (III) в опухоли и окружающих тканях на основе мультикомпартментной феноменологической модели фармакокинетики, адаптированной к реальным данным исследований пациентов с возможностью визуальной оценки методом МРТ. Были проведены исследования зависимости интенсивности МР-сигнала от содержания Gd в фантомах. Полученная аппроксимация позволяет транслировать интенсивность сигнала в величины абсолютного содержания контрастного агента в опухоли в физиологических единицах.
Транспорт гадолиний-содержащих ПМК из крови в ткань можно считать линейным во всем диапазоне концентраций. Величина коэффициента прямого транспорта kплазма-опухоль = 5,87±0,31 на порядок превосходит скорость обратной диффузии kопухоль-плазма = 0,91±0,23. Соотношение между коэффициентами транспорта ПМК в прямом (из крови в ткань) и обратном (из ткани в кровь) направлениях для головного мозга и печени составляли 1,2–1,8, для компартмента клетчатки чуть больше — 2,8–3,2, для ткани глиальной опухоли это соотношение составляло 9,5–10. Данный факт говорит о длительной задержке ПМК в терапевтическом очаге по сравнению с нормальными тканями. Тогда по данным однократного диагностического динамического исследования возможно установить целесообразность проведения терапии для конкретного пациента, определить момент начала облучения нейтронами, а также рассчитать оптимальную схему дозирования Gd для достижения терапевтического эффекта нейтронного пучка известной плотности при НЗТ, одновременно избегая высвобождения Gd в здоровых тканях. Методика расчета может быть использована для терапевтических пучков n0 как ядерных реакторов, так и малогабаритных ускорителей.
Список литературы Количественное планирование нейтрон-захватной терапии по данным кинетики комплексов Gd (III) при магнитно- резонансной томографии
- Тюрин И.Е. Лучевая диагностика в Российской Федерации 2012//Лучевая диагностика и терапия. -2013. -№ 4(4). -С. 116-120.
- Корякин С.Н., Ульяненко С.Е., Савина Е.П. и др. Использование меченного радиоактивным йодом меркаптододекабората натрия для планирования нейтрон-захватной терапии//Мед. радиология и мед. безопасность. -2005. -Т. 50, № 2. -С. 56-60.
- Шимановский Н.Л. Контрастные средства/Руководство по рациональному применению. -М.: ГЭОТАР Медиа, 2009. -485 с.
- Гутер Р.С., Янпольский А.Р. Дифференциальные уравнения. -М.: Высшая школа, 1976. -304 с.
- Усов В.Ю., Бородин О.Ю., Величко О.Б. и др. Оценка эндотелиальной проницаемости опухолей мозга методом динамической магнитно-резонансной томографии с контрастированием Магневистом на низкопольном МР-томографе//Вестн. рентгенологии и радиологии. -2001. № 3. -С. 22-29.
- Peters A.M., Glass D.M., Bird N.J. Extracellular fluid volume and glomerular filtration rate: their relation and variabilities in patients with renal disease and healthy individuals//Nucl. Med. Commun. -2011. -Vol. 7, No. 32. -P. 649-653.


