Количественный анализ изображений МРТ головного мозга у пациентов с депрессивными нарушениями после перенесенного острого инфаркта миокарда
Автор: Шелковникова Т.А., Нонка Т.Г., Лебедева Е.В., Репин А.Н., Усов В.Ю.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: В помощь практическому врачу
Статья в выпуске: 1 т.27, 2012 года.
Бесплатный доступ
Совершенствование нейровизуализационных технологий позволило получить доказательства того, что аффективные расстройства связаны со структурными изменениями в областях мозга, отвечающих за настроение. Одна ко картина магнитнорезонансной томографии (МРТ) у пациентов, перенесших острый инфаркт миокарда (ОИМ), с последующим развитием у них депрессивных состояний, пока изучена недостаточно для практического использования. Цель: изучить особенности изменений мозговых структур у больных ишемической болезнью сердца (ИБС), перенесших острый инфаркт миокарда в сроки 2-4 мес. в сочетании с депрессией, в сравнении с пациентами с ИБС без депрессивных расстройств. Были проанализированы результаты магнитнорезонансной томографии головного мозга у 52 больных ИБС, перенесших ОИМ мужского пола (средний возраст - 55,5±5,3 лет). На основании результатов тестирования и консультации психиатра пациенты были разделены на 2 группы. В 1-ю группу вошел 31 пациент с ИБС в сочетании с депрессией, во 2-ю группу - 21 пациент без депрессивных нарушений. У больных как основной, так и контрольной групп выявлены изменения вещества мозга, соответствующие хронической дисциркуляторной энцефалопатии (ДЭП) атеросклеротической и гипертонической этиологии. Обнаружена прямая положительная связь между степенью выраженности ДЭП в баллах и уровнем депрессии по шкале HADS (R=0,32) и BDI (R=0,33), р
Мрт, головной мозг, депрессия, дисциркуляторная энцефалопатия
Короткий адрес: https://sciup.org/14919711
IDR: 14919711 | УДК: 616.12-008.331.1-06:616.831]-073.756.8
Текст научной статьи Количественный анализ изображений МРТ головного мозга у пациентов с депрессивными нарушениями после перенесенного острого инфаркта миокарда
В рамках программы ВОЗ MONICA установлено, что у пациентов в возрастной группе 55–64 года относительный риск развития ОИМ в течение 8 лет при наличии депрессии возрастает в 4,9 раза [14]. После ОИМ депрессия ухудшает течение соматического заболевания, повышая риск смерти и повторной госпитализации больных ИБС [1, 2, 5, 10].
Учитывая эти данные, не вызывает сомнения необходимость своевременного выявления расстройств депрессивного спектра в общемедицинской сети и, в первую очередь, – у пациентов с сердечно-сосудистыми заболеваниями (ССЗ).
Диагностика депрессивных расстройств у больных ИБС затруднена тем, что многие симптомы этих комор-бидных заболеваний являются общими, в частности, такие как кардиалгии, слабость, утомляемость, приступы сердцебиения, одышки и т.д. В результате врачи, как правило, диагностируют и лечат только ССЗ [18]. Современная модель патогенеза депрессии основана на особенностях нарушений функции гипоталамо-гипофизарно-над-почечниковой (ГГНС) [3, 6], гипоталамо-гипофизарно-тиреоидной (ГГТС) [15], иммунной [17] систем организма. Большую роль играет также подавление активности серотонинергической системы [7]. Стресс приводит к ряду патологических изменений в гиппокампе, которые влекут за собой депрессивные проявления [16].
Совершенствование нейровизуализационных технологий, таких как спиральная рентгеновская компьютерная томография (СРКТ), магнитно-резонансная томография (МРТ), магнитно-резонансная спектроскопия (МРСС), позитронно-эмиссионная томография (ПЭТ), позволило получить доказательства того, что аффективные расстройства связаны со структурными изменениями в областях мозга, отвечающих за настроение. Последние характеризуют уменьшение объема и толщины ростральной орбитофронтальной, префронтальной коры, коры переднего отдела поясной и парагиппокампальной извилин, объема базальных ганглиев и т.д. Эти морфологические особенности ранее не считались патогенетически значимыми, по-видимому, вследствие доминирования представлений о “функциональном” характере аффективных расстройств [9]. Современные нейробио-логические исследования показали, что головной мозг – чрезвычайно динамичная система, способная к морфологическим изменениям на многих уровнях. Как оказалось, при стрессе и депрессии возникают выраженные ультраструктурные и макроморфологические повреждения нервной ткани (нейродегенерация), которые являются частично обратимыми, благодаря ее нейропластичности [9, 11].
Полиморфизм изменений структурного и функционального состояния головного мозга при депрессивных расстройствах в различных возрастных группах представляет собой одну из сложных проблем как психиатрии, так и лучевой диагностики. Цель исследования: попытка изучить особенности МРТ-картины головного мозга у пациентов, у которых после развития острого инфаркта миокарда были верифицированы депрессивные расстройства, и сравнить полученные данные с результатами МРТ пациентов без депрессивной симптоматики, но полностью эквивалентных по тяжести ИБС как основного заболевания.
Материал и методы
Обследовано 52 больных ИБС мужского пола (средний возраст – 55,5±5,3 лет), страдавших стенокардией напряжения II–III ФК в сочетании с гипертонической болезнью, перенесших ОИМ в сроки 2–4 мес., подписавших информированное согласие на исследование. Длительность течения ИБС у пациентов составила 4,5±5,0 лет. Всем больным, помимо общеклинических исследований, проводилось скрининговое тестирование госпитальной шкалой HADS для самооценки тревоги (Т) и депрессии (Д): по подшкале Д: 0–7 баллов – “норма”, 8–10 баллов – “субклинически выраженная депрессия”, 11 баллов и выше – “клинически выраженная депрессия”. Также изучалась самооценка социального функционирования пациентов шкалой Шихана. При выявлении повышенного уровня депрессии (более 8 баллов по шкале HADS) пациенты дополнительно тестировались шкалой самооценки депрессии Бека (BDI).
На основании результатов тестирования и консультации психиатра сформированы две клинические группы. Первая – основная – 31 пациент с выявленным депрессивным расстройством средней степени тяжести без когнитивных нарушений. Во вторую группу (группу сравнения) вошел 21 больной ИБС без депрессивной симптоматики. По основным клинико-демографическим характеристикам – полу, возрасту, локализации и давности перенесенного ИМ, стажу ИБС и гипертонической болезни и другим характеристикам – группы не различались. Обе группы были сопоставимы по параметрам, которые могли бы повлиять на клиническое течение ИБС: гемодинамическим показателям (по данным ультразвукового исследования – УЗИ сердца, уровню артериального давления и ЧСС), количеству пораженных коронарных артерий, уровню холестерина и триглицеридов. Все пациенты были осмотрены неврологом для исключения неврологического дефицита.
Оценка структурной картины головного мозга с помощью магнитно-резонансной томографии. МРТ го- ловного мозга использовали для оценки особенностей состояния церебральных структур (открытый МР-сканер “Magnetom-OPEN”, производства Siemens AG, Германия, 0,2Т). Открытый сканер был использован в связи со значительным количеством жалоб пациентов по типу клаустрофобии при обследовании их в высокопольном закрытом МРТ. Для получения Т1- и Т2-взвешенных изображений использовалась импульсная последовательность спин-эхо, оптимизированная для визуализации головного мозга (для Т1-взв. изображений в аксиальной и сагиттальной плоскостях: TR=450 ms, TE =15 ms, угол=70°; для Т2-взв. сканов: TR=6000 ms, TE=117 ms, при толщине срезов 5–6 мм).
По данным МРТ определялись показатели толщины коры в височных, лобных и затылочных долях, гиппокампа. Оценивали степень нейродистрофии базальных структур по соотношению интенсивности Т2-взвешанно-го изображения в них и в области боковых желудочков, как индекс нейродистрофии (ИН)=(ИС Т2-взв. баз.ядр)/ (ИС Т2-взв. ликв.), где ИС Т2-взв. баз.ядр – интенсивность изображения в области базальных ядер, ИС Т2-взв. ликв. – интенсивность изображения в области ликвора в просвете боковых желудочков. Также описывали наличие МР-признаков нарушения ликвородинамики, дисциркуляторных расстройств и повреждений вещества мозга ишемического генеза. Оценивали линейные размеры ликворопроводящих структур в аксиальной плоскости в режиме Т2 поперечных размеров тел, передних и задних рогов боковых желудочков, третьего желудочка и субарахноидального пространства во фронтальных, париетальных и окципитальных областях. За нормальные размеры структур головного мозга принимали данные группы здоровых лиц, где в норме ширина боковых желудочков на уровне тела не превышала 0,55 см, а поперечный размер субарахноидальных пространств составлял не более 0,25 см [2].
Для оценки МР-изменений головного мозга использовали балльную систему: при наличии признака присуждался 1 балл, при его отсутствии – 0. Количественная оценка тяжести дисциркуляторной энцефалопатии представляла собой суммарный показатель, выраженный в баллах нарушения ликвородинамики и цереброваскуляр- ных повреждений вещества головного мозга. Степень выраженности зон повышенной интенсивности МР-сиг-нала в белом веществе головного мозга оценивали по 5-балльной шкале [8]: 0 баллов – признаков повышенной интенсивности сигнала не выявлено; 1 балл – менее чем 5 мелких локальных и/или менее чем 2 крупных локальных очага; 2 балла – 5–12 мелких и/или 2–4 крупных локальных очага; 3 балла – более чем 12 мелких и/или более чем 4 крупных локальных или несколько сливающихся очагов; 4 балла – преимущественно сливающиеся очаги. Пеpивентpикуляpный лейкоареоз (ЛА) оценивали по следующей шкале: 0 баллов – очагов нет; 1 балл – “шапочки” около pогов боковых желудочков; 2 балла – тонкие линии вдоль желудочков; 3 балла – ровное “гало” около желудочков; 4 балла – неpегуляpные зоны повышенной интенсивности сигнала, pаспpостpаняющиеся на глубинные отделы белого вещества. Нарушения ликвородинамики складывались из баллов расширения желудочков и субарахноидальных пространств.
Минимальные проявления энцефалопатии оценивали в 1–3 балла, умеренные – 4–5 баллов, выраженные изменения – 6–8 баллов.
Статистический анализ выполнялся с использованием пакета прикладных программ STATISTICA for Windows ver 6.0 фирмы “Stat Soft, Inc”. При создании базы данных использовался редактор баз данных MS Access 97. Данные представлены в виде M±SD; n (%); Me [25; 75%]. Статистически значимым считалось различие при р<0,05.
Результаты
У пациентов обеих групп выявлено умеренное расширение наружного ликворного пространства и расширение боковых желудочков мозга, без статистически значимой разницы величин между группами. Показатели толщины коры лобной, височной и теменной долей в обеих группах были ниже нормальных значений (р>0,05), но существенно между группами не различались (табл. 1).
В остальном у пациентов обеих групп выявлен комплекс структурных изменений перивентрикулярного и подкоркового белого вещества, укладывающийся в кар-
Таблица 1
Сравнение данных МРТ у пациентов основной и контрольной групп
|
Показатели |
Основная группа, n=31 |
Контрольная группа, n=21 |
р |
|
Тело бокового желудочка справа, мм (M±SD) |
8,5±2,2 |
8,3±1,8 |
р=0,8 |
|
Тело бокового желудочка слева, мм (M±SD) |
8,4±2,2 |
9,4±2,4 |
р=0,1 |
|
Передний рог справа, мм (M±SD) |
5,6±2,8 |
6,0±2,6 |
р=0,7 |
|
Передний рог слева, мм (M±SD) |
5,9±2,5 |
6,3±2,6 |
р=0,6 |
|
Задний рог справа, мм (Me [25%; 75%]) |
12 [11; 14] |
12 [10; 13] |
р=0,07 |
|
Задний рог слева, мм (M±SD) |
12,6±2,7 |
12,1±2,7 |
р=0,07 |
|
Поперечник III желудочка, мм (M±SD) |
6,7±1,9 |
6,9±2,5 |
р=0,07 |
|
Субарахноидальное пространство, мм (Me [25; 75%]) |
5 [5; 7] |
5 [4; 6] |
р=0,5 |
|
Толщина лобной коры, мм (M±SD) |
0,29±0,07 |
0,27±0,07 |
р=0,4 |
|
Толщина затылочной коры, мм (M±SD) |
0,29±0,04 |
0,28±0,07 |
р=0,4 |
|
Толщина височной коры, мм (M±SD) |
0,29±0,06 |
0,29±0,05 |
р=0,2 |
|
Перивентрикулярная отечность, степень (Me [25%; 75%]) |
1 [1; 2] |
1 [1; 1] |
р=0,03 |
|
Толщина парагиппокампальной извилины справа, мм (M±SD) |
12,5±2,1 |
14,1±2,7 |
р=0,02 |
|
Толщина парагиппокампальной извилины слева, мм (M±SD) |
12,4±2,3 |
13,9±3,1 |
р=0,04 |
Таблица 2
Сравнение интенсивности Т2 сигнала в области базальных ядер, ликвора и индекса нейродистрофии у больных основной и контрольной групп
При наличии депрессии установлены существенные различия по степени выраженности лейкоареоза (1 [1; 2] vs 1 [1; 1], p=0,03) в сравнении с пациентами без расстройств психики. “Колпаки” лейкоареоза у пациентов контрольной группы визуализировались только в области передних рогов латеральных желудочков (у 100%), тогда как у больных основной группы достоверно чаще лейкоареоз определялся и в окружении задних рогов, захватывая большую область перивентрикулярного белого вещества (у 11 больных, 35,5%; χ 2=9,45, р=0,002). Также у пациентов основной группы в отличие от пациентов группы сравнения были выявлены меньшие размеры толщины правой и левой парагиппокампальной извилин: 12,5±2,1 мм vs 14,1±2,7 мм (р=0,02) и 12,4±2,3 мм vs 13,9±3,1 мм (р=0,04) соответственно (табл. 2).
При депрессивных нарушениях чаще выявлялись очаги дисциркуляции (размером до 5 мм): у 19 чел. (61,3%) vs 4 чел. (19%) в контроле ( χ 2=9,06, р=0,003). Необходимо подчеркнуть, что у лиц основной группы отмечалась тенденция к более частому поражению лобно-теменной области: 16,1% vs 0% ( χ 2=3,2, р=0,07). У 9,7% больных с депрессией выявлены очаги повреждения в таламусе (рис. 1А, 1Б). В группе контроля патологических изменений в проекции таламуса обнаружено не было. При балльной оценке степени выраженности зон повышенной интенсивности сигнала (очагов дисциркуляции) отмечены статистически значимые отличия между основной и контрольной группами: 1 [0; 1] vs 0 [0; 0] (p=0,003). У пациентов с депрессивными расстройствами в сравнении с пациентами без аффективных расстройств значительно чаще наблюдались множественные очаги повреждения, достигавшие 3–4 баллов: 5 чел. (16,1%) vs 1 (4,8%), χ 2=1,29; р=0,3 соответственно.
Линейные участки лейкодистрофии выявлены преимущественно в перивентрикулярных отделах у 16 пациентов основной группы (51,6%) и у 9 – из группы контроля (42,8%). Однако в группе контроля участки лейкодистрофии были представлены преимущественно единичными линейными усилениями Т2-взвешанного изображения, тогда как в основной группе была отмечена тенденция к увеличению количества пациентов с распространенной симметричной нейродегенерацией вещества мозга: 6 чел. (19,3%) vs 0 чел. (0%), χ 2=3,8, р=0,05. Это наблюдение подтверждено и более высокой интенсивностью Т2-сигнала от вещества мозга в проекции базальных ядер (р<0,05), таблица 2, рисунки 1, 2. Выявление участков нейродегенерации также подтверждено статистически значимо более высоким индексом нейродистрофии у
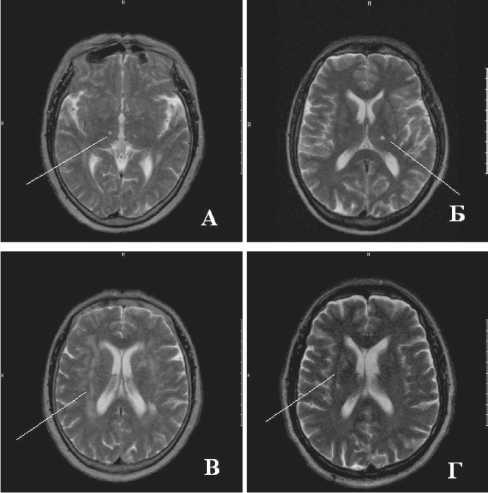
Рис. 1. Типичные изменения картины МРТ головного мозга у пациентов ИБС и постинфарктной депрессией: очаговые изменения в различных участках таламуса (А, Б), распространенные нейродегенеративные изменения вещества мозга в пери-вентрикулярных отделах (В, Г)
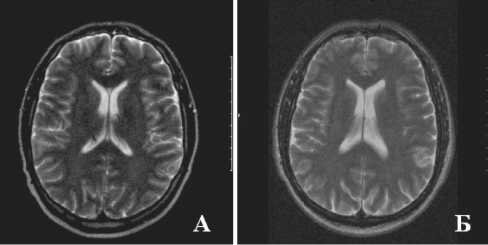
Рис. 2. Сравнительная картина МРТ состояния перивентрику-лярного вещества мозга у пациентов с ИБС, перенесших ОИМ без депрессивных нарушений, – очаговые изменения вещества мозга отсутствуют (А, Б)
депрессивных больных в сравнении с таковыми без депрессии: справа 0,34±0,04 против 0,31±0,04 (р=0,01); слева 0,34±0,04 против 0,30±0,02 (0,04).
При количественной оценке ДЭП у пациентов основной группы в сравнении с пациентами контрольной вы- явлено статистически значимо более выраженное поражение головного мозга: 4 [3; 5] балла vs 3 [3; 3] баллов (p=0,004). В основной группе отмечалось меньшее количество больных с минимальными проявлениями хронической ишемии головного мозга – 11 чел. (35,5%) vs 17 чел. (81%), χ2=3,0; р=0,08 и большее количество больных с умеренными изменениями – 14 чел. (45,2%) vs 4 чел. (19%), χ2=1,92; р=0,2. У 28,5% пациентов с депрессивными нарушениями установлены выраженные проявления дисциркуляторной энцефалопатии (ДЭП), в то время как в контрольной группе таких больных не наблюдалось – 6 чел. (19,3%) vs 0 чел. (0%), χ2=3,8; р=0,05.
При выполнении корреляционного анализа обнаружена прямая положительная связь между степенью выраженности ДЭП в баллах и уровнем депрессии по шкале HADS (R=0,32) и BDI (R=0,33); р<0,05. Установлена слабая корреляция между уровнем депрессии по шкале BDI и интенсивностью Т2-сигнала в области базальных ядер слева (r=0,3), а также между показателями шкалы HADS и интенсивностью Т2-сигнала в области базальных ядер как слева (r=0,43), так и справа (r=0,32) и индексом нейродистрофии слева (r=0,3); p<0,05. Полученные данные корреляционного анализа свидетельствовали о том, что при более выраженных структурных изменениях головного мозга наблюдается более высокий уровень депрессии.
Обсуждение
В случае обследованных нами постинфарктных пациентов с развившейся депрессией вопрос о генезе повреждения мозга патофизиологически очевиден. Установленные нами изменения носят вторичный к нарушениям кровообращения характер и сводятся к ишемическим микроциркуляторным расстройствам в соответствующих отделах ЦНС (в лимбической системе, базальных ганглиях и ростральных отделах коры). Такие нарушения могут вызывать как и собственно аффективные (снижение настроения, тревога, раздражительность), так и моторные и вегетативные расстройства при депрессии.
У обследованных нами пациентов статистически значимыми различиями между лицами с постинфарктной депрессией и пациентами контрольной группы служили распространенная симметричная нейродегенерация вещества мозга и уменьшение толщины извилины гиппокампа. Полученные результаты анатомических размеров извилин гиппокампа совпадали с таковыми у пациентов с депрессией, но без соматической патологии [5, 11, 12]. Известно, что гиппокамп является наиболее стрессочувствительной областью мозга вследствие того, что в нем находится большое количество рецепторов к глюкокортикоидам и 5-HT1A-рецепторы. Это позволяет предположить, что при распространенном атеросклерозе КА и развитии ОИМ, в случае дисциркуляторного повреждения именно гиппокампа и базальных ядер сокращается число нормально функционирующих нейронов, количество синаптических контактов и ухудшается нервная проводимость. Как следствие, это клинически проявляется симптомами депрессии [6].
Кроме того, представляет несомненный интерес воп- рос о времени возникновения выявленных патологических особенностей ЦНС – носят ли они постинфарктный характер, или же их появление предшествовало коронарной катастрофе? Имеющиеся данные одномоментных исследований не позволяют судить об этом, в связи с чем планируется динамическое изучение состояния головного мозга у больных ИМ в остром периоде заболевания и спустя 2–3 мес. с синхронной нейропсихиатрической оценкой.
Однако уже имеющиеся данные подтверждают целесообразность выполнения МРТ головного мозга у пациентов с перенесенным ОИМ с целью выявления у них сосудистых изменений, которые могут способствовать развитию депрессии, основываясь на установленных ней-роморфологических особенностях.
Выводы
-
1. У больных ИБС как основной, так и контрольной групп по результатам магнитно-резонансной томографии выявлены изменения вещества мозга, соответствующие проявлениям хронической дисциркуляторной энцефалопатии атеросклеротической и гипертонической этиологии, более выраженные у пациентов с депрессивными расстройствами средней степени тяжести.
-
2. Обнаружена прямая взаимосвязь между степенью выраженности патологических изменений головного мозга и уровнем депрессии.
-
3. Установлено, что у пациентов с депрессивными расстройствами имеет место значимое уменьшение толщины парагиппокампальной извилины.
Список литературы Количественный анализ изображений МРТ головного мозга у пациентов с депрессивными нарушениями после перенесенного острого инфаркта миокарда
- Васюк Ю.А., Довженко Т.В. Депрессивные и тревожные расстройства в кардиологии. -М.: Анахарсис, 2009. -200 с.
- Вознесенская Т.Г. Хроническая боль и депрессия//Фарматека. -2008. -№ 6. -С. 10-16.
- Дробижев М.Ю. Лечение депрессий в общесоматической сети//Психиатрия и психотерапия. -2003. -Т. 5, № 5. -С. 8-12.
- Корниенко В.Н., Пронин И.Н. Диагностическая нейрорадиология. -М.: ИП Андреева Т.Н., 2007. -1368 с.
- Погосова Г.В. Современные подходы к диагностике и лечению расстройств депрессивного спектра в общемедицинской практике//Кардиоваскулярная терапия и профилактика. -2007. -№ 1, прил. -23 c.
- Сыркин А.Л., Смулевич А.Б., Дробижев М.Ю. и др. Особенности патогенеза, клиники и течения психогенно провоцированных инфарктов миокарда//Клиническая медицина. -2005. -№ 2. -С. 30-33.
- Сыркин А.Л. Ишемическая болезнь сердца и соматизированные депрессии: особенности клиники, дифференциальной диагностики и терапевтических подходов//Consilium Medicum. -2002. -Экстравыпуск. -С. 7-9.
- Яхно Н.Н., Левин О.С., Дамулин И.В. Сопоставление клинических и МРТ-данных при дисциркуляторной энцефалопатии//Неврол. журн. -2001. -Т. 6, № 3. -С. 10-19.
- Bearden C.E., Thompson P.M., Avedissian C. et al. Altered hippocampal morphology in unmedicated patients with major depressive illness//ASN neuro. -2009. -Vol. 1. -P. 265-273. 99
- Blumenthal J.A. Depression and coronary heart disease: association and implications for treatment//Cleve. Clin. J. Med. -2008. -Vol. 75, suppl. 2. -P. S48-S53.
- McKinnon M.C., Yucel K., Nazarov A. et al. A metaanalysis examining clinical predictors of hippocampal volume in patients with major depressive disorder//Psychiatry Neurosci. -2009. -Vol. 34. -P. 41-45.
- MacQueen G.M., Campbell S., McEwen B.S. et al. Course of illness, hippocampal function, and hippocampal volume in major depression//Proc. Natl. Acad. Sci. USA. -2003. -Vol. 100. -P. 1387-1392.
- Mohapatra P.K., Kar N., Kar G.C. et al. Effectiveness of sertraline in treatment of depression in a consecutive sample of patients with acute myocardial infarction: six month prospective study on outcome//Clin. Pract. Epidemiol. Ment. Health. -2005. -Vol. 9. -P. 26.
- Spertus J.A., McDonell M., Woodman C.L. et al. Association between depression and worse diseasespecific functional status in outpatients with coronary artery disease//Am. Heart J. -2000. -Vol. 140. -P. 105-110.
- Jackson I.M. The thyroid axis and depression//Thyroid. -1998. -Vol. 8. -P. 951-956.
- Jacobson L., Sapolsky R. The role of the hippocampus in feedback regulation of the hypothalamicpituitary adrenocortical axis//Endocr. Rev. -1991. -Vol. 12. -P. 118-134.
- Redwine L.S. Cardiacrelated hospitalization and/or death associated with immune dysregulation and symptoms of depression in failure patients//Psychosom. Med. -2007. -Vol. 69. -P. 23-29.
- Tylee A.T. Why do general practitioners recognize major depression in one woman patient yet miss it in another?//Br. J. Gen. Pract. -1993. -Vol. 43. -P. 327-330.


