Коллекция картофеля ВИР как источник улучшения хозяйственно-ценных признаков и устойчивости к возбудителям болезней "черная ножка" и "кольцевая гниль"
Автор: Родионов К.И., Ситников М.Н.
Журнал: АгроЗооТехника @azt-journal
Рубрика: Общее земледелие и растениеводство
Статья в выпуске: 1 т.8, 2025 года.
Бесплатный доступ
В мире существует проблема, вызванная потерями картофеля до и после сбора урожая из-за бактериальных болезней. Ежегодные потери урожая, обусловленные ими, составляют 10-15%, а в эпифитотийные годы могут превышать 50%. В настоящее время ни один из коммерческих сортов картофеля не обладает высокой устойчивостью по отношению к бактериозам, поскольку в большинстве существующих программ селекции этот признак ранее не относился к приоритетным. В последние годы во всех странах мира, включая Россию, потери картофеля, связанные с черной ножкой и кольцевой гнилью, существенно возросли, что увеличивает востребованность устойчивых к бактериозам сортов картофеля, а также эффективных методик идентификации пораженных образцов картофеля в процессе хранения. Цель исследования - провести мониторинг картофеля из коллекции Всероссийского института растениеводства имени Н.И. Вавилова (ВИР) на наличие возбудителей вида Pectobacterium и Dickeya, штаммы которых вызывают заболевание «черная ножка», и бактерии Clavibacter michiganensis subsp. sepedonicus (Cms), вызывающей заболевание «кольцевая гниль», и оценить ряд хозяйственно-ценных признаков картофеля у выделившихся устойчивых образцов. Проведена визуальная оценка клубней на наличие поражений, вызванных предполагаемыми возбудителями. На отобранном материале осуществлена дифференциальная диагностика методом ПЦР в реальном времени на наличие изучаемых заболеваний. В результате исследования большинство образцов коллекции проявили устойчивость к данным возбудителям, но обнаружены и слабоустойчивые формы, показавшие наличие комплексной инфекции. Результаты исследования могут применяться в будущих селекционных программах по устойчивости растений к различным заболеваниям.
Селекция, картофель, хозяйственно-ценные признаки, бактериальные инфекции, черная ножка, кольцевая гниль
Короткий адрес: https://sciup.org/147247155
IDR: 147247155 | УДК: 635.21:579.842.1/2:579.871.1 | DOI: 10.15838/alt.2025.8.1.4
Текст научной статьи Коллекция картофеля ВИР как источник улучшения хозяйственно-ценных признаков и устойчивости к возбудителям болезней "черная ножка" и "кольцевая гниль"
Картофель является наиболее распространенной незерновой сельскохозяйственной культурой разностороннего использования, занимая четвертое место среди наиболее важных сельскохозяйственных культур в мире после пшеницы, риса и кукурузы (Juyo Rojas, 2019; Park et al., 2021). В последние годы в Российской Федерации отмечаются значительные изменения в видовом составе возбудителей бактериозов растений и усиление их вредоносности, особенно в ВосточноСибирском регионе (Охлопкова и др., 2020). Наиболее вредоносными бактериальными заболеваниями картофеля являются черная ножка, вызываемая бактериями рода Pectobacterium и Dickeya, и кольцевая гниль, вызываемая бактерией рода Clavibacter michiganensis subsp. sepedonicus. Ежегодные потери урожая от этих болезней составляют до 60% (Beňo et al., 2022; Jee et al., 2020). В условиях постоянно возрастающей вредоносности большинства патогенов, появления новых штаммов, резистентных к химическим средствам защиты растений, селекция устойчивых к болезням сортов приобретает особую актуальность. Важными резервами увеличения производства картофеля могут служить знание о генетических аспектах устойчивости картофеля к заболеваниям, применение бактериофагов (Мирошников и др., 2018; Лукьянова, Мирошников, 2019) и выведение новых, более продуктивных сортов картофеля, устойчивых к наиболее распространенным и вредоносным инфекциям с использованием разнообразия мировой коллекции ВИР (Баранник и др., 2018; Трускинов, Ситников, 2019; Васильева и др., 2024; Vasilyeva et al., 2024).
В Европейской базе данных культурного картофеля (ECPD)1 есть сорта, проявляющие различное сопротивление бактериальным инфекциям, некоторые из них присутствуют в коллекции ОГР картофеля ВИР и возделываются на полях НПБ «Пушкинские и Павловские лаборатории ВИР» и на Полярной опытной станции.
Сорта картофеля, полностью устойчивые к бактериальным заболеваниям, отсутствуют. Так, в исследовании (Лазарев, 1986) выявлены наиболее устойчивые к черной ножке районированные в Ленинградской области и перспективные для Северо-Западного региона сорта: Каме-раз, Гатчинский, Детскосельский, Невский и др. Большинство из них присутствует в коллекции ОГР картофеля ВИР и возделывается на полях НПБ «Пушкинские и Павловские лаборатории ВИР», однако им уже более 70 лет и они имеют ограничен-
ECPD. URL: (accessed 12.12.2024).
ные регионы возделывания. Помимо этого, устойчивость к некоторым бактериальным заболеваниям была обнаружена у отдельных диких видов картофеля, например дисомного тетраплоидного вида 2EBN Solanum acaule Bitt., что указывает на возможность ее переноса в культурный картофель (Kriel et al., 1995). Следовательно, S. acaule кажется хорошим источником иммунитета для исследований интрогрессии. Соматические гибриды между S. acaule и S. tuberosum с тремя различными соотношениями геномов проявляли симптомы кольцевой гнили и были восприимчивы к инфекции; состав генома гибридов влиял на бактериальный титр (Osdaghi et al., 2022). В коллекции Всероссийского института генетических ресурсов растений содержатся клоны межвидовых гибридов2 (Хлопюк и др., 2021), при изучении которых было выяснено, что линии в их родословных имеют различную устойчивость к бактериальным заболеваниям.
Цель данного исследования – мониторинг коллекции картофеля ВИР им. Н.И. Вавилова на наличие возбудителей черной ножки и кольцевой гнили клубней и оценка хозяйственно-ценных признаков образцов, перспективных для селекции, на устойчивость к этим заболеваниям.
Возбудители черной ножки стеблей и мокрой гнили картофеля и других сельскохозяйственных культур принадлежат к группе пектолитических энтеробактерий, включающей виды рода Pectobacterium (ранее – Erwinia ) ( P. carotovorum – комплекс ( P. carotovorum subsp. actinidiae; P. carotovorum subsp. brasiliense; P. carotovorum subsp. carotovorum; P. carotovorum subsp. odoriferum), P. atrosepticum, P. betavasculorum и P. wasabiae ) и отдельный род Dickeya ( D. dianthicola и D. solani ) (Игнатов и др., 2018a). Представители рода Pectobacterium включены в список десяти самых вредоносных фитопатогенов.
Виды Pectobacterium характеризуются большим диапазоном распространения, различными средами обитания и чрезвычайно широким спектром хозяев (Loc et al., 2022). В последние годы массово распространяются новые разновидности возбудителей черной ножки – P. carotovorum subsp. Brasiliense, P. carotovorum subsp. odoriferum и P. wasabiae (новое название штаммов, поражающих картофель – P. parmentieri (Nykyri et al., 2012) – фитопатоген, вызывающий заболевание мягкой гнилью за счет выработки ферментов, разрушающих клеточную стенку растений (Portier et al., 2019)). P. carotovorum subsp. brasiliense преобладал на картофеле в России, и он принципиально не отличается от P. carotovorum subsp. carotovorum или P. atrosepticum по своей агрессивности. Вероятно, его массовое распространение в Российской Федерации было связано с импортом овощей и фруктов из субтропической зоны, где P. carotovorum subsp. brasiliense поражает растения как в открытом, так и в защищенном грунте (Игнатов и др., 2018b).
Болезни растений, вызываемые Pectobacterium atrosepticum van Hall, часто сопровождаются обширными симптомами гнили. Кроме того, эти бактерии способны взаимодействовать с растениями-хозяевами, не вызывая заболеваний в течение длительных периодов времени, даже на протяжении нескольких поколений растений-хозяев. На сегодняшний день нет информации о физиологобиохимических симптоматических и бессимптомных взаимодействиях растения с P. atrosepticum . Типичные (симптоматические) инфекции P. atrosepticum связаны с индукцией реакций растений, опосредованных жасмонатами, которые являются одним из продуктов липоксигеназного каскада, дающего начало многим другим оксилипинам с физиологической активностью (Gorshkov, 2022).
Представители рода Dickeya впервые были обнаружены и идентифицированы как возбудители стеблевой гнили картофеля в Нидерландах (Стацюк, Кузнецова, 2018). Не прошло много времени с момента выявления комплекса видов Dickeya spp. , вызывающих мокрые (мягкие) гнили частей растений и черную ножку стеблей, как фитопатогенные виды этого рода распространились по всей территории России (Белов, Хютти, 2022). Эти бактерии вызывают либо мягкую гниль, либо увядание сосудов у растений-хозяев в умеренном, тропическом и субтропическом климате. Симптомы мягкой гнили обусловлены действием бактериальных пектиназ, связанных с другими ферментами, разрушающими клеточную стенку растений, которые повреждают основные структурные компоненты средней пластинки и первичной клеточной стенки растений. Опасность видов Dickeya spp. заключается в возросшей в разы агрессивности по сравнению с типичными видами Pectobacterium spp. , вызывающими ту же симптоматику, и большей вредоносности. D. dianthicola включены Европейской и Средиземноморской организацией по карантину и защите растений (ЕОКЗР) в список А2 организмов, рекомендованных для регулирования как карантинные фитопатогены с ограниченным распространением на территории стран – членов ЕОКЗР.
Бактериальная кольцевая гниль картофеля (Solanum tuberosum) вызывается грамположительной коринеформной бактерией Clavibacter michiganensis subsp. sepedonicus (Spiek. et Kotth.) Davis et al. (Bacteria: Actinobacteria, Microbacteriaceae). Патоген включен в список А2 Европейской организации карантина и защиты растений (ЕОКЗР) и был включен в список А3 Перечня карантинных объектов РФ. Картофель является основным хозяином возбудителя. Симптомы болезни на растущих растениях картофеля: межжилковый хло- роз на листочках, приводящий к некрозу и системному увяданию; на зараженных клубнях: сосудистые ткани становятся желтовато-коричневыми с творожистой консистенцией из-за бактериальной колонизации и распада (Игнатов и др., 2018b; Nelson, 1982; Franc, 1999; Osdaghi et al., 2022). Распространен данный патоген в 60 странах, в Российской Федерации обнаружен в центральных регионах, Восточной и Западной Сибири и на Севере России.
Основным способом распространения кольцевой гнили является передача болезни клубнями, пораженными ямчатой гнилью. Заражение клубней происходит главным образом во время уборки картофеля. Заболеванию способствует незрелость и влажность клубней, а также наличие свежих механических повреждений (содранная кожура, трещины, порезы и т. п.), куда попадают энтеробактерии, которые развиваются при двойном заражении. Кроме того, в засушливых условиях черная ножка вообще не развивается, так как в подобное время сильно преобладает грибное увядание. Это можно объяснить тем, что в клубнях, зараженных бактериальными патогенами, происходит смена микроорганизмов от паразитных бактерий до сапрофитов, очень быстрый рост фитопатогенных грибов, в результате – подавление (антагонизм) медленно растущих колоний бактерий.
Материалы и методы исследования
Исследованы 17 гибридных клонов из коллекции генетических ресурсов растений ВИР (табл. 1) , рекомендованных для селекции как источники устойчивости к бактериальным заболеваниям, также в исследование включены три районированных в Республике Саха (Якутия) сорта из коллекции Якутского НИИСХ, которые были изучены на полях НПБ «Пушкинские и Павловские лаборатории ВИР».
Тулунский ранний (Тулунский × смесь пыльцы сортов Berlichingen, Katahdin, Фи-
Таблица 1. Происхождение и селекционные ценные признаки клонов межвидовых гибридов картофеля
Венчик красно-фиолетовый, с белыми кончиками с наружной стороны. Ягоды не образует. Сорт устойчив к раку картофеля. Достаточно сильно поражается фитофторозом и паршой обыкновенной. Средневосприимчив к сухой фузариозной гнили.
Якутянка к-24760 (Пензенская скороспелка × Пересвет). Cорт селекции Якутского НИИСХ совместно с ВНИИКХ. В Гос-реестре с 2006 года. Районирован в Яку- тии с 2007 года. Раннеспелый. Урожайность – 182–276 ц/га. Масса товарных клубней – 82–176 г. Среднее число клубней – 9–12 шт./куст. Содержание крахмала – 10,5–12,9%. Вкусовые качества хорошие. Клубни овально-округлые. Цвет кожуры красный. Цвет мякоти белый. Глазки средней глубины. Венчик белый. Среднеустойчив к фитофторозу ботвы и клубней, устойчив к раку картофеля, восприимчив к золотистой картофельной цистообразующей нематоде.
Вармас (Вирулане × Сеянец 1040-45). Cорт выведен на Йыгеваской селекционной станции в Эстонии. Районирован в Якутии с 1977 года по всем зонам. Раннеспелый. Урожайность – 212–380 ц/га. Масса товарных клубней – 90–120 г. Содержание крахмала – 10–14%. Вкус удовлетворительный или хороший. Клубень овальной формы. Кожура белая. Мякоть белая. Глазки поверхностные. Венчик белый. Устойчив к раку картофеля, среднеустойчив к вирусам, относительно устойчив к парше обыкновенной и ризоктониозу, восприимчив к фитофторозу (Охлопкова и др., 2014; Костина, Косарева, 2018).
Клоны межвидовых гибридов из коллекции ВИР и районированные сорта из коллекции Якутского НИИСХ оценивали по комплексу хозяйственно-ценных признаков в соответствии с общепринятой методикой по поддержанию и изучению мировой коллекции картофеля. В качестве стандартов использовали районированные в Северо-Западном регионе сорта: для раннеспелых – Удача; для среднеспелых и среднепоздних – Наяда.
Также на полях Пушкинских и Павловских лабораторий ВИР проводили фенологические наблюдения, отмечали начало всходов, цветения и ягодообразования.
Метеоусловия периода вегетации в 2024 году отличались от средних многолетних данных по региону, лето выдалось засушливым, температура воздуха превышала или была на уровне средних многолетних значений. Среднесуточная температура воздуха составила 12,6–16,7 °С. Осадков за летние месяцы выпало 246,3 мм, что близко к среднемноголетнему значению (261,1 мм).
Была проведена визуальная оценка на наличие мокрой и кольцевой гнили клубней в процессе хранения, согласно методическим указаниям по оценке селекционного материала картофеля на устойчивость к черной ножке (Будин и др., 1987). Изучены селекционные сорта Solanum tuberosum L., образцы Solanum andigenum Juz. et Buk., а также межвидовые гибриды картофеля из коллекции ВИР, которые составляют более 3000 образцов и поддерживаются на полях НПБ «Пушкинские и Павловские лаборатории ВИР». Исследовались клубни урожая 2023 года. Первый мониторинг проводился через месяц после уборки, второй – через три месяца.
Для идентификации фитопатогенов в клубнях картофеля выделение ДНК (на микрочастицах) проводили коммерческими наборами согласно инструкции научнопроизводственной компании «СИНТОЛ» EW-001.
В ходе исследования дифференциальную диагностику возбудителей заболевания картофеля «черная ножка» P. carotovorum subsp. сarotovorum (Pcc), P. brasiliensis (Pbr), P. odoriferum (Pod), P. atrosepticum (Pa), Dickeya spp. и «кольцевая гниль» Clavibacter michiganensis subsp. sepedonicus (Cms) проводили методом полимеразной цепной реакции в реальном времени. В качестве устойчивого контроля был взят сорт Вар-мас, как восприимчивый к бактериальным патогенам – сорт картофеля Гренадер, так как на нем были видны четкие симптомы мокрой гнили, продуцирующие грамотри-цательными энтеробактериями. Интерпретацию результатов анализа осуществляли по общепринятым протоколам и инструкциям производителя НПК «СИНТОЛ». Так, результат ПЦР по каналу флуоресцен- ции ≥ 40 ct принимали за то, что в пробе содержится ДНК бактерий. Все, что ниже 40 ct, принимали за ложноотрицательный результат ингибирования ПЦР-РВ.
Результаты и обсуждение
Селекционные и хозяйственно-ценные признаки клонов межвидовых гибридов ВИР и сортов картофеля из коллекции Якутского НИИСХ на полях Пушкинских и Павловских лабораторий ВИР
В2024годупродолжительностьвегетации межвидовых гибридов из коллекции ВИР и сортов картофеля из коллекции Якутского НИИСХ составила 68–92 дня. Первые всходы были отмечены у раннего сорта Вармас (14 ± 2 день). На 16 ± 2 день взошли межвидовые гибриды 135-5-2005, 97-152-8, 39-1-2005, 94-4-1, 99-6-10, 12/1/09, 13/1109. Остальные взошли на 17 ± 2 – 20 ± 2 день. Первая бутонизация (36 ± 1 день) отмечена у межвидовых гибридов 135-5-2005, 39-1-2005, 171-3, 12/1/09. У остальных на 37 ± 1 – 39 ± 1 день. Первое цветение отмечено на 31 ± 5 день у образцов 99-4-1, 99-6-10,13/11-09. На 35 ± 5 день цветение отмечено у сорта Тулунский ранний. У остальных – на 43 ± 5 – 50 ± 5 день. Первое ягодообразование было отмечено на
42 ± 16 день у образцов 99-6-10, 16/27-09; на 44 ± 16 – у образца 13/11-09; у остальных – на 50 ± 16 – 57 ± 16 день. У таких образцов, как Тулунский ранний, Вар-мас, 173-3 и 97-159-3, ягодообразование не произошло. Уборка началась на 78– 102 день от посадки. По результатам данных была оценена физиологическая спелость образцов (число дней от посадки до уборки). К среднеранним относится сорт Якутянка. В среднеспелой группе оказались образцы Тулунский ранний, Вармас, 135-5-2005, 138-3-2006, 97-152-8, 135-12006, 160-1, 99-6-10, 16/27-09, 97-159-3, 13/11-09, 12/1/09, 40-2000, 118-6-2011. В среднепозднюю группу вошли 173-3, 99-4-1, 39-1-2005, 24-1, 190-4.
В результате сравнительного изучения продуктивности в 2024 году в условиях Северо-Западного региона стабильную урожайность на уровне сорта-стандарта или выше имели образцы: 118-6-2011, 97-159-3 для среднепоздних; 160-1, 99-6-10 для среднеспелых; 97-152-8, 135-5-2005, Вармас, Тулунский ранний для раннеспелых (рис. 1).
Товарность изученных образцов находится в пределах 93–53%. Наибольший показатель (≥ 90%) отмечен среди средне-
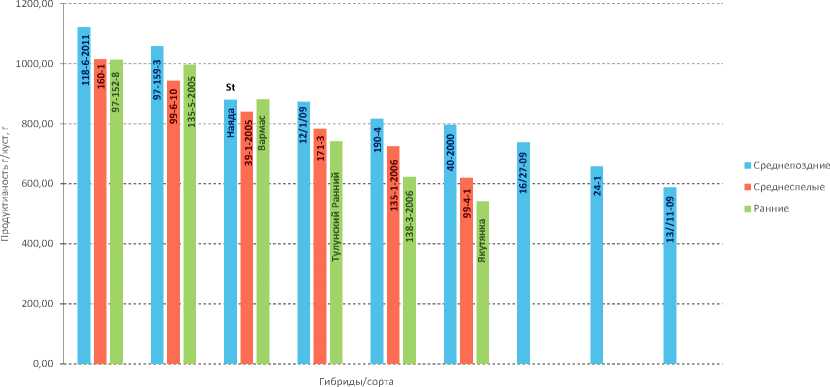
Рис. 1. Оценка продуктивности клонов межвидовых гибридов ВИР и районированных сортов картофеля Якутского НИИСХ
Источник: данные авторов.
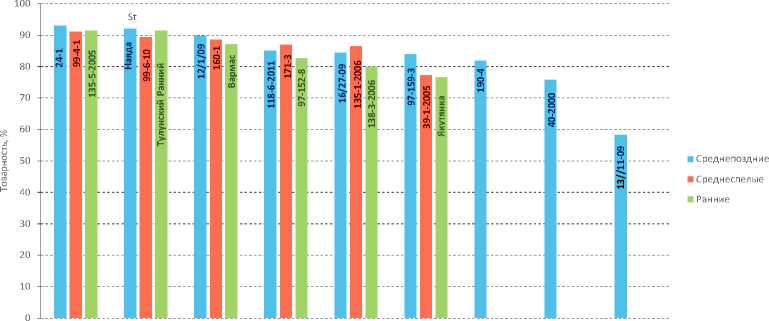
Гибриды/сорта
Рис. 2. Оценка товарности клонов межвидовых гибридов ВИР и районированных сортов картофеля Якутского НИИСХ
Источник: данные авторов.
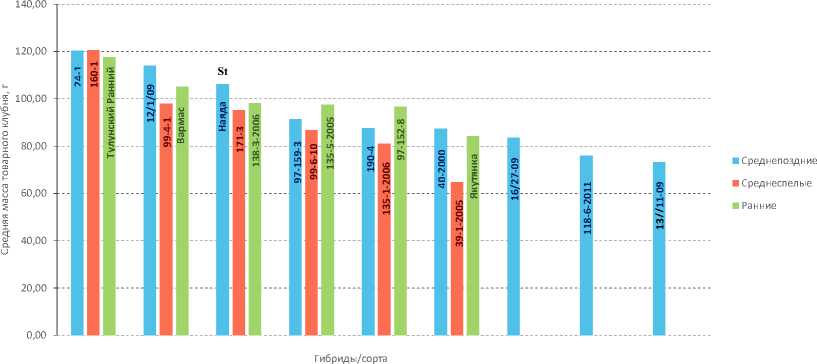
Рис. 3. Оценка средней массы клубней у клонов межвидовых гибридов ВИР и районированных сортов картофеля Якутского НИИСХ
Источник: данные авторов.
поздних образцов – 24-1; среди среднеспелых – 92; раннеспелых – 135-5-2005 (рис. 2) .
Среднее число клубней в гнезде для среднепоздних сортов варьируется от 7–20 штук на куст. В целом большинство образцов имеют значения выше сорта-стандарта. Однако средняя масса товарного клубня для среднепоздних образцов находится ниже сорта-стандарта. Лидируют в этом показателе лишь два межвидовых гибрида: 24-1 и 12/1/09. Следует отметить, что данные гибриды занимали низ- шую строчку по показателю среднего числа клубней в гнезде.
Большинство среднеспелых образцов имеют показатель среднего числа клубней в гнезде выше сорта-стандарта. Этот показатель варьировал от 8 до 19 клубней на куст. Наибольшее значение средней массы товарного клубня имел межвидовой гибрид 160-1, остальные – ниже сорта-стандарта (рис. 3) .
В раннеспелой группе сорта Якутянка, Вармас и межвидовой гибрид 97-152-8 по среднему числу клубней превышали сорт-стандарт. Остальные были ниже и на уровне сорта-стандарта. Значение средней массы товарного клубня для всех образцов раннеспелой группы было выше, чем у сорта-стандарта.
Мониторинг возбудителей мокрой и кольцевой гнили клубней картофеля в коллекции ВИР
Проведен мониторинг клоновой коллекции картофеля ВИР. Признаки предполагаемых заболеваний были выявлены в результате визуальной оценки на клубнях 50 образцов, включающих селекционные сорта и межвидовые гибриды. Наличие возбудителей бактериальных заболеваний у образцов картофеля из коллекции ВИР определяли методом полимеразной цепной реакции в реальном времени. Результаты приведены в табл. 2 .
Данные, представленные в табл. 2, показывают наличие возбудителя Clavibacter michiganensis subsp. sepedonicus (Cms) у сорта Гренадер и межвидового гибрида 912-1-2018, также у сорта Гренадер бы- ло идентифицировано комплексное инфекционное поражение, вызванное такими бактериями, как P. brasiliensis (Pbr), P. odoriferum (Pod), P. atrosepticum (Pa), Dickeya spp. Бактерии вида P. carotovorum subsp. сarotovorum были обнаружены у сортов Вымпел и Hinderburg и у межвидового гибрида 116-2021. Также у этого образца было обнаружено ДНК P. odoriferum. Несмотря на наличие внешних признаков поражения, проведенное ПЦР-исследова-ние не подтвердило наличие возбудителей у образцов Атлетик, Вармас, Solanum andigenum (к-3599) и межвидовых гибридов 952-8-2017, 117-5-2004.
Полностью устойчивых к бактериальным заболеваниям сортов или межвидовых гибридов картофеля на сегодняшний день не известно. Однако некоторые родительские формы сортов и гибридов, по Европейской базе данных культурного картофеля, обладают разной степенью устойчивости. Так, у гибридов 117-5-2004 и 116-2021 одним из родителей является сорт
Таблица 2. Наличие возбудителей P. carotovorum subsp. сarotovorum (Pcc), P. brasiliensis (Pbr), P. odoriferum (Pod), P. atrosepticum (Pa), P. wasabiae (Pw), Dickeya spp. Clavibacter michiganensis subsp. sepedonicus (Cms) картофеля из коллекции ВИР (real-time ПЦР)
|
Образец |
Результаты ПЦР по каналу флуоресценции |
||||||
|
Pcc |
Pbr |
Pod |
Pa |
Pw |
Dickeya spp. |
Cms |
|
|
FAM |
R6G |
ROX |
ROX |
FAM |
FAM |
FAM |
|
|
Атлетик |
N/A |
33,27 |
N/A |
24,51 |
15,55 |
N/A |
34,25 |
|
Вармас |
N/A |
31,38 |
30,98 |
N/A |
N/A |
N/A |
33,55 |
|
Вымпел |
49,97 |
46,43 |
11,99 |
N/A |
10,75 |
N/A |
N/A |
|
Гренадер |
20,59 |
48,74 |
48,35 |
40,70 |
38,12 |
42,69 |
41,42 |
|
Elan |
N/A |
N/A |
N/A |
N/A |
47,06 |
N/A |
N/A |
|
Foxton |
N/A |
21,97 |
N/A |
N/A |
8,76 |
2,32 |
2,68 |
|
Hinderburg |
46,84 |
46,50 |
2,78 |
43,47 |
40,29 |
25,79 |
9,00 |
|
Solanum andigenum (к-3599) |
N/A |
N/A |
N/A |
25,47 |
38,40 |
N/A |
35,66 |
|
117-5-2004 |
N/A |
N/A |
33,72 |
N/A |
39,62 |
N/A |
37,36 |
|
16//27-09 |
N/A |
26,95 |
N/A |
1,45 |
3,44 |
N/A |
N/A |
|
952-8-2017 |
N/A |
N/A |
N/A |
31,26 |
34,87 |
N/A |
31,14 |
|
912-1-2018 |
N/A |
N/A |
N/A |
N/A |
36,53 |
N/A |
40,80 |
|
4-1-2012 |
45,42 |
4,04 |
44,43 |
16,63 |
N/A |
N/A |
33,39 |
FAM, R6G, ROX – флуорофоры.
≥ 40 ct – ложноотрицательный результат ингибирования ПЦР-РВ.
≤ 40 ct – в пробе содержится ДНК изучаемых бактерий.
N/A – not available.
Источник: данные авторов.
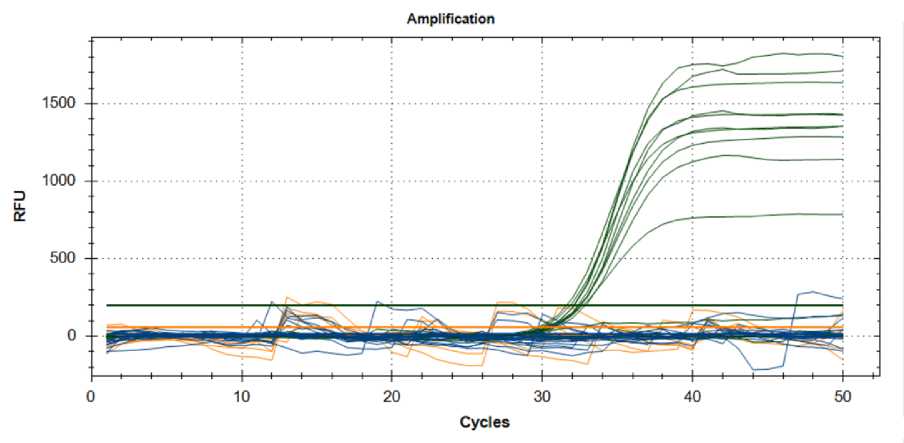
Рис. 4. Результаты анализа образцов картофеля на наличие возбудителей P. carotovorum subsp. сarotovorum , P. brasiliensis, P. odoriferum
Источник: данные авторов.
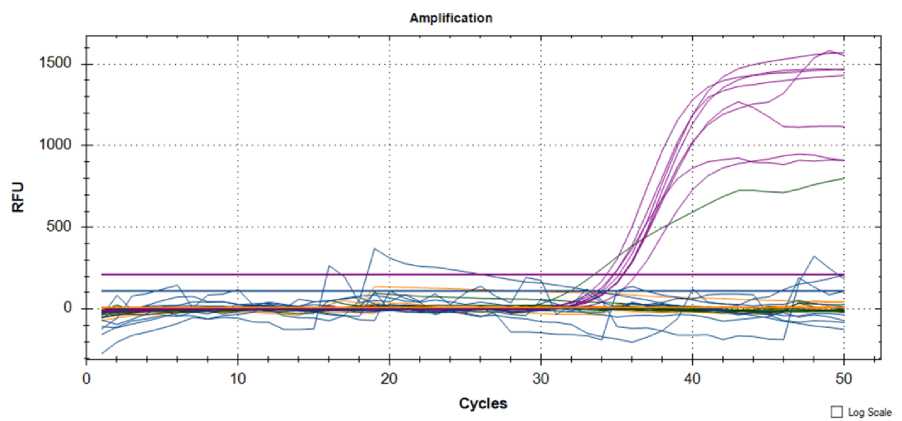
Рис. 5. Результаты анализа образцов картофеля на наличие возбудителей P. atrosepticum, P. wasabiae, Clavibacter michiganensis subsp. sepedonicus
Источник: данные авторов.
Atzimba, в родословной которой имеется сорт Leona, обладающий устойчивостью к бактериальной гнили (Pectobacterium и Dickeya spp.) от средней степени до высокой. У межвидового гибрида 16/27-09 имеются в родословной три сорта, обладающие разной степенью устойчивости: например, сорта Тайга или Gitte обладают устойчивостью к заболеванию «черная ножка» от средней степени до высокого, а сорт Омега имеет высокую устойчивость к бактериальному заболеванию «черная ножка».
Результат анализа ПЦР-РВ показал, что изучаемые патогены (рис. 4) обнаруживаются в образцах Вымпел, Гренадер и межвидовом гибриде 116-2021.
Результат анализа ПЦР-РВ показалналичие пектолитических энтеробактерий в образцах Гренадер, Elan, Hinderburg, а Clavibacter
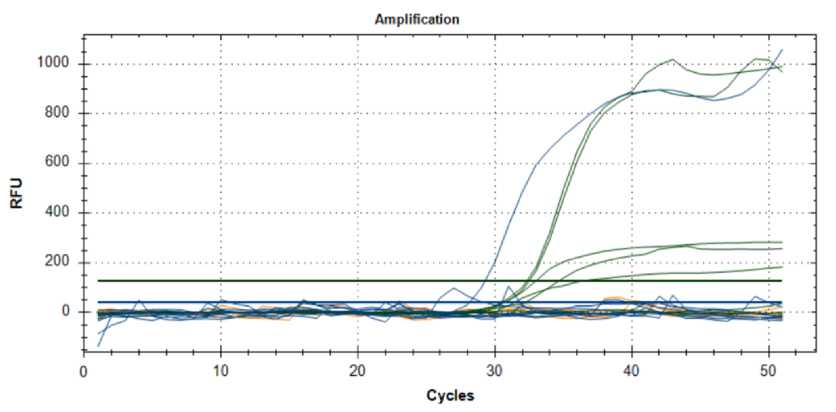
Рис. 6. Результаты анализа образцов картофеля на наличие возбудителя Dickeyа spp.
Источник: данные авторов.
michiganensis subsp. sepedonicus – в образце Гренадер и межвидовом гибриде 912-1-2018 (рис. 5) .
Результат анализа ПЦР-РВ по обнаружению патогена Dickeyа spp. показал, что изучаемые бактерии присутствуют лишь в образце Гренадер (рис. 6) .
Выводы
В 2024 году проведено полевое испытание межвидовых гибридов ВИР и сортов из коллекции Якутского НИИСХ, исследованы их хозяйственно-ценные признаки. Изученная выборка, выращенная в условиях Северо-Западного региона, показала стабильную урожайность на уровне сорта-стандарта или выше, особенно выделились образцы с селекционным номером: для среднепоздней группы 118-6-2011,
97-159-3; для среднеспелых 160-1, 99-6-10; для раннеспелых 97-152-8 и 135-5-2005.
Впервые охарактеризованы образцы картофеля из коллекции ВИР на устойчивость к бактериальным инфекциям. Мы пришли к выводу, что условия СевероЗападного региона Российской Федерации плохо подходят для развития исследуемых микроорганизмов, не наблюдается массового инфицирования коллекции картофеля в период вегетации. Однако для других почвенно-климатических регионов РФ уровень инфицирования картофеля изучаемыми патогенами может быть существенно выше. Большинство образцов коллекции проявило полевую устойчивость к данным возбудителям, однако были обнаружены и слабоустойчивые формы, показавшие наличие комплексной инфекции.
Список литературы Коллекция картофеля ВИР как источник улучшения хозяйственно-ценных признаков и устойчивости к возбудителям болезней "черная ножка" и "кольцевая гниль"
- Баранник А.П. Симонов Р.А., Васильев Д.М. [и др.] (2018). Дифференцирование пектолитических патогенов картофеля Pectobacterium и Dickeya spp. генетическим фингерпринтингом // Современные технологии и средства защиты растений-платформа для инновационного освоения в АПК России: мат-лы Междунар. науч.-практ. конф. С. 25.
- Белов Д.А., Хютти А.В. (2022). Современные фитопатогенные комплексы болезней картофеля и меры по предотвращению их распространения в России // Картофель и овощи. № 5. С. 18–24. URL: https://doi.org/10.25630/PAV.2022.52.94.003
- Будин К.З., Бушкова Л.Н., Власов Н.М., Арсентьева Л.Н. (1987). Оценка селекционного материала картофеля на устойчивость к черной ножке: метод. указания / Всесоюзный НИИ растениеводства им. Н.И. Вавилова (ВИР). Ленинград. 8 с.
- Васильева А.А., Игнатов А.Н., Джалилов Ф.С.У. (2024). Оценка устойчивости различных сортов картофеля к возбудителям черной ножки и мягкой гнили // Достижения науки и техники АПК. Т. 38. № 3. С. 10–16.
- Игнатов А.Н., Лазарев А.М., Панычева Ю.С., Проворов Н.А., Чеботарь В.К. (2018a). Бактериальные патогены картофеля рода Dickeya: мини-обзор по систематике и этиологии заболеваний // Сельскохозяйственная биология. № 53 (1). С. 123–131.
- Игнатов А.Н., Панычева Ю.С., Воронина М.В., Джалилов Ф.С. (2018b). Бактериозы картофеля в Российской Федерации // Картофель и овощи. № 1. С. 1–3.
- Костина Л.И., Косарева О.С. (2018). Генеалогия селекционных сортов картофеля // Картофелеводство. № 26 (1). С. 46–50.
- Лазарев А.М. (1986). Устойчивость перспективных для Северо-Западного региона Нечерноземья сортов картофеля к возбудителю черной ножки // Рациональные методы и средства защиты сельскохозяйственных культур от вредных организмов: Труды Латвийской ордена Трудового Красного Знамени с.-х. академии / Гос. агропромышленный комитет, Латвийская ордена Трудового Красного Знамени с.-х. академия, Великолукский с.-х. ин-т. Т. 234. Елгава: Латвийская ордена Трудового Красного Знамени с.-х. академия. С. 19–21.
- Лукьянова А.А., Мирошников К.А. (2019). Оценка терапевтического потенциала фага Q51 для лечения бактериальных инфекций картофеля // Биотехнология в растениеводстве, животноводстве и сельскохозяйственной микробиологии: сб. тезисов докладов 19-й Всерос. конф. молодых ученых, посв. памяти акад. РАСХН Г.С. Муромцева (г. Москва, 15–16 апреля 2019 г.) / Всерос. науч.-иссл. ин-т с.-х. биотехнологии. Москва: Всерос. науч.-иссл. ин-т с.-х. биотехнологии. С. 156–157.
- Мирошников К.А., Кабанова А.П., Шнейдер М.М. [и др.] (2018). Принципы использования бактериофагов для контроля мягкогнилостных бактериозов картофеля // Современные технологии и средства защиты растений – платформа для инновационного освоения в АПК России: сб. мат-лов Междунар. науч.-практ. конф. Санкт-Петербург – Пушкин. С. 106–107.
- Охлопкова П.П., Лукина Ф.А., Алексеева А.В. (2014). Сорта картофеля, возделываемые в Республике Саха (Якутия). Якутск. 30 с.
- Охлопкова П.П., Яковлева Н.С., Протопопова А.В. (2020). Фитосанитарный Мониторинг посадок картофеля в условиях Центральной Якутии // Научная жизнь. Т. 15. № 12 (112). С. 1606–1612. DOI: 10.35679/1991-9476-2020-15-12-1606-1612
- Стацюк Н.В., Кузнецова М.А. (2018). Лабораторные методы оценки устойчивости растений и клубней картофеля к возбудителям черной ножки и мягкой гнили клубней // Сельскохозяйственная биология. Т. 53. С. 111–122.
- Трускинов Э.В., Ситников М.Н. (2019). Особенности изучения и поддержания коллекции картофеля на фоне вирусных и вирусоподобных заболеваний // Труды по прикладной ботанике, генетике и селекции. № 180 (4). С. 75–80. DOI: 10.30901/2227-8834-2019-4-75-80
- Хлопюк М.С., Чалая Н.А., Рогозина Е.В. (2021). Стабильность агрономически ценных признаков у клонов межвидовых гибридов картофеля в условиях Центрального региона европейской территории России // Труды по прикладной ботанике, генетике и селекции. Т. 182. № 4. С. 79–89. DOI: 10.30901/2227-8834-2021-4-79-89
- Beňo F., Horsáková I., Kmoch M.[et al.] (2022). Bacteriophages as a strategy to protect potato tubers against Dickeya dianthicola and Pectobacterium carotovorum Soft Rot. Microorganisms, 10 (12), 2369. DOI: 10.3390/microorganisms10122369
- Franc G.D. (1999). Persistence and latency of Clavibacter michiganensis subsp. sepedonicus in field‐grown seed potatoes. Plant Disease, 83, 247–250.
- Gorshkov V.Y., Toporkova Y.Y., Tsers I.D. [et al.] (2022). Differential modulation of the lipoxygenase cascade during typical and latent Pectobacterium atrosepticum infections. Ann Bot., 129 (3), 271–286. DOI: 10.1093/aob/mcab108
- Jee S., Choi J.G., Lee Y.G. [et al.] (2020). Distribution of Pectobacterium species isolated in South Korea and comparison of temperature effects on pathogenicity. Plant Pathology Journal, 36 (4), 346–354. DOI: 10.5423/PPJ.OA.09.2019.0235
- Juyo Rojas D.K., Soto Sedano J.C., Ballvora A., Léon J., Mosquera Vásquez T. (2019). Novel organ-specific genetic factors for quantitative resistance to late blight in potato. PLoS One, 14 (7), e0213818. DOI: 10.1371/journal.pone.0213818
- Kriel C.J., Jansky S.H., Gudmestad N.C., Ronis D.H. (1995). Immunity to Clavibacter michiganensis subsp. sepedonicus: Screening of exotic Solanum species. Euphytica, 82, 125–132.
- Loc M., Milošević D., Ivanović Ž. [et al.] (2022). Genetic diversity of Pectobacterium spp. on potato in Serbia. Microorganisms, 10 (9), 1840. DOI: 10.3390/microorganisms10091840
- Nelson G.A. (1982). Corneybacterium sepedonicum in potato: Effect of inoculum concentration on ring rot symptoms and latent infection. Canadian Journal of Plant Pathology, 4, 129–133.
- Nykyri J., Niemi O., Koskinen P. [et al.] (2012). Revised phylogeny and novel horizontally acquired virulence determinants of the model soft rot phytopathogen Pectobacterium wasabiae SCC3193. PLoS Pathog., 8 (11), e1003013. DOI: 10.1371/journal.ppat.1003013
- Osdaghi E., van der Wolf J.M., Abachi H. [et al.] (2022). Bacterial ring rot of potato caused by Clavibacter sepedonicus: A successful example of defeating the enemy under international regulations. Molecular Plant Pathology, 23 (7), 911–932. DOI: 10.1111/mpp.13191
- Park J., Massa A.N., Douches D. [et al.] (2021). Linkage and QTL mapping for tuber shape and specific gravity in a tetraploid mapping population of potato representing the russet market class. BMC Plant Biol., 21 (1), 507. DOI: 10.1186/s12870-021-03265-2
- Portier P., Pédron J., Taghouti G. [et al.] (2019). Elevation of Pectobacterium carotovorum subsp. Odoriferum to species level as Pectobacterium odoriferum sp. nov., proposal of Pectobacterium Brasiliense sp. nov. and Pectobacterium actinidiae sp. nov., emended description of Pectobacterium carotovorum and description of Pectobacterium versatile sp. nov., isolated from streams and symptoms on diverse plants. Int. J. Syst. Evol. Microbiol., 69, 3207–3216. DOI: 10.1099/ijsem.0.003611
- Vasilyeva A.A., Evseev P.V., Ignatov A.N., Dzhalilov F.S.U. (2024). Pectobacterium punjabense causing blackleg and soft rot of potato: The first report in the Russian Federation. Plants, 13 (15).


