Комбинированная пластика метаэпифизарных костных дефектов при эндопротезировании коленного сустава с применением костнопластического биоматериала
Автор: Гиркало М.В., Гаврилов М.А., Козлов В.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Травматология и ортопедия
Статья в выпуске: 4 т.8, 2012 года.
Бесплатный доступ
Костнопластический биоматериал, костный дефект, тотальная артропластика коленного сустава
Короткий адрес: https://sciup.org/14917663
IDR: 14917663
Текст статьи Комбинированная пластика метаэпифизарных костных дефектов при эндопротезировании коленного сустава с применением костнопластического биоматериала
Адрес: 410002, Саратов, ул. Чернышеского, 148.
Тел.: +7 905 3251732
ления лечение дегенеративных заболеваний коленного сустава приобретает особую актуальность [1]. Отсутствие клинического эффекта от проводимого консервативного лечения является показанием для хирургического вмешательства. При этом чаще всего используются артроскопический дебридмент, опера- ции на связках, остеотомии с целью восстановления нормальной оси конечности, артродез, тотальная (либо одномыщелковая) артропластика коленного сустава [2]. Первые три группы хирургических вмешательств особенно актуальны у лиц молодого возраста при умеренно выраженных дегенеративных изменениях в коленном суставе. Однако, проводя анализ литературы, можно сделать вывод, что практически все виды костнопластических и корригирующих операций имеют довольно короткий «светлый промежуток» и носят паллиативный характер, после чего наступает прогрессирование патологического процесса в суставе. В настоящее время наиболее эффективным способом лечения осложнённых форм гонартроза является тотальная артропластика коленного сустава, которая за последние десятилетия стала одной из наиболее часто применяемых реконструктивных операций в травматологии и ортопедии [3]. Тотальная артропластика коленного сустава наиболее эффективна на стадиях до появления осложнений. Однако на практике распространённым является обращение больных на стадии грубых анатомо-функциональных изменений, когда уже имеется нестабильность связочного аппарата, комбинированные контрактуры и деформации с дефектами метаэпифизов. Причинами образования костных дефектов являются посттравматическая импрессия суставной поверхности, кистовидное поражение метаэпифизов, первичный или вторичный остеонекроз. Наличие этих осложнений и выбор неадекватных способов их устранения снижают эффективность тотальной артропластики [4].
Независимо от причины костный дефицит мыщелков бедренной и большеберцовой костей значительно усложняет биомеханически адекватную и стабильную установку компонентов эндопротеза и требует его адекватной компенсации [5]. Для замещения дефектов 2-го типа при тотальной артропластике коленного сустава в последние годы широко применяются аугменты — модульные трабекулярные металлические имплантаты. Они имеют несколько стандартных размеров, а по форме различаются на прямые или косые и специализированы по модели эндопротеза и локализации: центральные бедренные и тибиальные втулки, бедренные и тибиальные аугменты. Практика использования стандартных металлических имплантатов с заранее определенными размерами и формами не позволяет полноценно восполнить костный дефект без его расширения. При этом в условиях дефицита костной ткани производятся дополнительные резекции. Всё это ведёт к потере большого костного массива и в перспективе значительно осложняет ревизию. Известные способы замещения костных метафизарных дефектов имеют своё клиническое и социально-экономическое обоснование и в своей основе должны учитывать перспективу ревизионной артропластики. Поэтому одним из акцентов выбора способа пластики дефектов должно являться сохранение или восстановление костного массива метаэпифизов.
Цель исследования : сравнительная характеристика разработанного способа комбинированной пластики дефектов метаэпифизов большеберцовой и бедренной костей при тотальной артропластике коленного сустава, обеспечивающего сопоставимую или более стабильную фиксацию компонентов эндопротеза и превосходящего существующие в сохранении или восстановлении костного массива.
Методы . Под нашим наблюдением находился 91 больной с дегенеративными поражениями коленного сустава в возрасте от 40 до 77 лет (средний возраст 62,2 ±0,8 года). Среди пациентов было 19 мужчин (20,8%) и 72 женщины (79,1%). Продолжительность заболевания составила от 5 до 25 лет (в среднем 7,3±0,9 года). Операцию тотальной артропластики коленного сустава выполняли при следующих нозологических формах: ревматоидный артрит, вторичный гонартроз 3-й стадии — 11 человек (12%); посттравматический гонартроз 3-й стадии — 3 человека (3,3%), идиопатический гонартроз — 77 человек (84,7%). Дефект метаэпифиза большеберцовой и бедренной костей встречался у 21 (23%) пациента. Все больные были распределены на три группы: 1-я группа — пациенты с гонартрозами различной этиологии без костных дефектов мыщелков (n=70); 2-я группа — пациенты с гонартрозами различной этиологии, имеющие дефект мыщелков T2A или F2A, которым проводилась цементная пластика дефекта с армированием винтами или без (n=11); 3-я группа — пациенты с гонартрозами различной этиологии, имеющие дефект мыщелков T2A или F2A, пластика которых проводилась по разработанному нами способу (n=10) [9]. Срок наблюдения составил от 6 до 36 месяцев.
Для сравнительного анализа предлагаемого способа комбинированной костной пластики выбран способ цементной пластики дефекта с армированием винтами или без (cement filing) как наиболее распространённый и доступный (технически и экономически) [7, 8] и позволяющий благодаря пластичности цемента в период полимеризации выполнить костную пластику дефекта любой формы в пределах 2-го типа, обеспечивая стабильную первичную фиксацию компонентов эндопротеза.
До операции всем больным определяли объём движений в коленном суставе гониометрическим и биомеханическим методом. Биомеханические исследования проводили больным с целью уточнения статико-динамической функции нижних конечностей, для этого использовали стабилометрию и электропо-дографию. При электромиографическом исследовании изучалась активность параартикулярных мышц. Функциональные и субъективные характеристики оценивали с помощью шкалы WOMAC [8].
Предоперационное планирование включало определение размера и локализации дефекта, состояние костной ткани: локальный остеопороз, состояние связочного аппарата, угол варусной / вальгусной деформации, глубины предполагаемой костной резекции, модель и размеры эндопротеза.
После проведения анестезии в положении больного на спине и сгибания в коленном суставе осуществляли медиальный парапателлярный доступ. Удаляли остеофиты дистального отдела бедренной и проксимального отдела большеберцовой кости. Острым путем удаляли мягкие ткани, располагающиеся между коллатеральными связками и суставными поверхностями. Производили мобилизацию мягких тканей, обеспечивая обнажение проксимальной части большеберцовой кости. При наличии костного дефекта большеберцовой кости выполнялось резецирование мыщелка бедренной кости путем опила последней на 2–4 мм дистальнее от запланированного уровня, а затем на запланированном уровне.
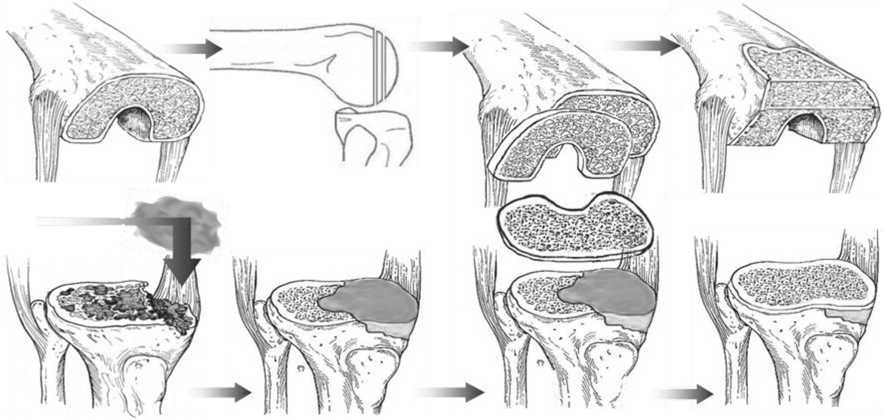
Рис. 1. Этапы комбинированной пластики метафизарного дефекта
При наличии костного дефекта бедренной кости выполняли резецирование мыщелка большеберцовой кости путем опила последней на 2–4 мм проксимальнее от запланированного уровня, а затем на запланированном уровне (рис. 1).
Производили пластику костного дефекта поврежденного мыщелка. Ложе костного дефекта подготавливали путем зачищения острой ложкой. Дно дефекта перфорировали сверлом диаметром 1–2 мм на глубину до 5 мм для стимуляции эффекта новообразования сосудов. Затем укладывали остеокондук-тивный материал MIIG (Wright Medical Technology, США) на дно костного дефекта и формировали его, восстанавливая анатомическую форму поврежденного мыщелка. На восстановленную поверхность поврежденного мыщелка укладывали полученный губчатый аутотрансплантат. Далее устанавливали тибиальный компонент эндопротеза на резецированный метаэпифиз большеберцовой кости с обеспечением введения опорной ножки компонента эндопротеза в подготовленный ранее направляющий канал в метаэпифизе большеберцовой кости и фиксировали данный компонент эндопротеза с помощью костного цемента. Устанавливали феморальный компонент на резецированный дистальный отдел бедренной кости и также фиксировали его с помощью костного цемента. Затем устанавливали вкладыш и производили окончательное вправление эндопротеза. Рану послойно ушивали с выведением дренажа. В послеоперационном периоде проводили стандартную медикаментозную терапию и физиотерапию.
Для оценки функционального состояния коленного сустава до и после операции производили гониометрию: на момент выписки из стационара (10-е сутки после операции) и через 3 месяца. Биомеханические исследования проводились больным до операции и спустя 3 месяца после операции с целью уточнения статико-динамической функции нижних конечностей. При стабилометрическом тестировании проводили запись проекции центра тяжести обследуемого, стоящего на платформе в стандартной основной позе. Определяли отклонение проекции центра тяжести на площадь опоры с учётом того факта, что весовые нагрузки, приходящиеся на каждый из отделов стоп, должны равняться в сумме весу больного. Подографию проводили больным для изучения осо- бенностей акта ходьбы с определением показателей коэффициента ритмичности (в норме 0,98 ± 0,02) и длительности двойного шага (в норме 1,2 ± 0,1 с). Удовлетворённость пациента операцией определяли с помощью субъективных показателей шкалы WOM-AC (до операции, через 10 суток после операции и через 3 месяца).
Полученные данные подвергали статистической обработке с использованием методов вариационной статистики с определением критерия достоверности по Стьюденту. Достоверным считали результаты при р<0,05, что соответствует требованиям, предъявляемым к медико-биологическим исследованиям.
Результаты. Пациенты 1-й группы до операции не имели выраженных деформаций и контрактуры в коленном суставе, что позволило без особых технических сложностей имплантировать эндопротез и полностью восстановить баланс мягких тканей. Это демонстрируется достаточно большим объёмом движений сразу после операции. Контрольный осмотр через 3 месяца после операции свидетельствовал о полном восстановлении функции коленного сустава в данной группе больных. Пациенты 2-й группы до операции имели угловую деформацию оси конечности более 15о и ограничение амплитуды движений в суставе в основном за счёт имевшейся разгибательной контрактуры. В процессе операции приходилось выполнять релиз разгибательного аппарата. В результате этих манипуляций амплитуда движений сразу после операции составила 111,8±8,3, однако травматичность вмешательства сказалась на выраженности болевого синдрома в послеоперационном периоде. К 10-м суткам после операции амплитуда движений составила 89,5±5,4, что отличалось от показателей 1-й группы. Через 3 месяца после операции амплитуда движений составила 112,9±5,6 градуса. На рентгенограммах через 3 месяца после операции в 62% случаев имелось просветление на границе «цемент — кость», на рентгенограммах через 3 года линия просветления сохранялась без прогрессирования, в одном случае развилась асептическая нестабильность. Пациенты 3-й группы до операции имели показатели угловой деформации и амплитуды движений, сходные с таковыми во 2-й группе. Сразу после операции объём движений в коленном суставе составил 113,1±9,1, что не отлича- лось от таковых в 1-й и 2-й группах. При контрольном осмотре через 3 месяца после операции объём движений в суставе у больных 3-й группы достоверно не отличался от 1-й и 2-й групп. На рентгенограммах через 3 месяца после операции линии просветления на границе «цемент — кость» не отмечалось, на рентгенограммах через 3 года признаков асептической нестабильности не отмечено ни в одном случае, во всех случаях отмечено ремоделирование костной ткани в зоне дефекта.
При сравнительной оценке показателей шкалы WOMAC установлено, что к 10-м суткам после операции неудовлетворительные результаты чаще встречались во 2-й и 3-й группах. Отличных и хороших результатов не отмечено ни в одной из исследуемых групп. При контрольном осмотре на 3-м месяце послеоперационного периода в 1-й и 3-й группах отличные результаты получены у более половины пациентов, а во 2-й группе в 48,5%. Удовлетворительные результаты встречались в 1-й группе в 7,2%, во 2-й и 3-й группах в 11,3 и 10,8% случаев. Неудовлетворительные результаты были во всех перечисленных группах и колебались от 1,2 до 2,1% случаев.
Обсуждение. Тотальная артропластика коленного сустава в условиях анатомо-функциональных нарушений является сложной актуальной проблемой, решение которой невозможно без комплексной диагностики, выявляющей объективные критерии предоперационного планирования. Процент ошибок, осложнений и неудовлетворительных результатов при первичной тотальной артропластике на фоне грубых анатомо-функциональных нарушений достоверно выше, чем при неосложнённом гонартрозе. В распоряжении хирурга имеется узко ограниченный выбор способов пластики костных дефектов. Максимально эффективны они, если их применение чётко дифференцировано по своим клиническим и социально-экономическим показаниям и противопоказаниям. Выбор способа должен учитывать перспективы ревизионной артропластики, поэтому первичная артропластика должна быть функционально выгодной и максимально органосберегающей. Нами предложен алгоритм ведения больных с анатомо-функциональными нарушениями коленного сустава и способ комбинированной пластики, включающий положительные качества ауто- и аллопластики и исключающий их отрицательные свойства. Сравнительная характеристика показывает, что достоверных отличий в реабилитации пациентов не наблюдалось. Ближайшие результаты были сходны, и восстановление наступало в стандартные сроки. В отдалённом периоде при использовании разработанного способа получали восстановление костного массива. Благодаря прочностным свойствам костнопластического биоматериала обеспечивалась первичная фиксация имплантата, а при последующем ремоделировании комбинированного трансплантата обеспечивалась стабильность конструкции в сроки наблюдения до 36 месяцев. Замещение костного дефекта по разработанной методике позволяет восстановить анатомическую форму метаэпифиза большеберцовой и бедренной костей, равномерно распределить нагрузку на подлежащую кость, повысить прочность фиксации компонентов эндопротеза и обеспечить полноценное имплантационное плато, расширяя возможности систем первичного эндопротезирования, усиленные при необходимости интрамедуллярными стержнями.
Заключение. При использовании костнопластического биоматериала для пластики метафизар-ных дефектов при эндопротезировании коленного сустава достоверно снижается риск возникновения послеоперационных осложнений, включающих нестабильность компонентов эндопротеза и сустава, а в перспективе сохраняется достаточный костный массив для ревизионной артропластики.
Список литературы Комбинированная пластика метаэпифизарных костных дефектов при эндопротезировании коленного сустава с применением костнопластического биоматериала
- Дейкало В. П., Болобошко К. Б. Структура травм и заболеваний коленного сустава//Новости хирургии. 2007. № 1. С. 26-31
- Замещение костных дефектов при первичном эндопро-тезировании коленного сустава/Н. Н. Корнилов, Т.А. Куляба, P.M. Тихилов [и др.]//Травматология и ортопедия России. 2008. №1. С. 76-81
- Новоселов К. А. Оперативное лечение дегенеративно-дистрофических заболеваний коленного сустава: дис... д-ра мед. наук. СПб., 1994. 400 с.
- Опыт эндопротезирования коленного сустава в специализированном отделении ЦИТО им. Н.Н. Приорова/О.А. Кудинов, В. И. Нуждин, Т.П. Попова [и др.]//Вестник травматологии и ортопедии им. Н.Н. Приорова. 2005. № 3. С. 16-18
- Шпаковский Д. Е. Тотальное эндопротезирование коленного сустава при деформирующем артрозе III-IV стадии (клинико-морфологическое исследование): автореф. дис.... канд. мед. наук. М., 2006. 23 с.
- Способ замещения костных дефектов мыщелков болыиеберцовой и бедренной кости при ТЭКС/М. В. Гиркало, М.А. Гаврилов/заявка на изобр. № 2011140249 от 05.10.2011 г.
- Scuderi G.R., Tria A.J. Knee Arthroplasty: Handbook 1-st. ed.//Springer, 2007. 220 p.
- Bellemans J., Ries M.D., Jan M.K. Total Knee Arthroplasty//Springer, 2005. 414c.
- McConnell S., Kolopack P., Davis A.M. The Western Ontario and McMaster Universities Osteoarthritis Index (WOMAC): a review of its utility and measurement properties//Arthr. Care Res. 2001. Vol. 45. P. 453-546.


