Комбинированный протокол дистантного ишемического кондиционирования как метод кардиопротекции у пациентов с острым инфарктом миокарда с подъемом сегмента ST
Автор: Коренева Е.А., Денисевич Т.Л., Мрочек А.Г., Стельмашок В.И.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.36, 2021 года.
Бесплатный доступ
Введение. В настоящее время не существует общепринятой стратегии по ограничению реперфузионного повреждения (РП), наступающего после восстановления коронарного кровотока у пациентов с инфарктом миокарда (ИМ). В данной статье исследована эффективность одного из перспективных методов кардиопротекции.Материал и методы. Настоящее исследование являлось открытым проспективным рандомизированным контролируемым. Пациенты с диагнозом: ИМ с подъемом сегмента ST (ИМпST) передней стенки левого желудочка (ЛЖ) были распределены в контрольную группу (КГ, n = 44), где выполнялось стандартное первичное чрескожное коронарное вмешательство (пЧКВ), и основную группу (ОГ, n = 43), где на фоне пЧКВ проводилось дистантное ишемическое перкондиционирование (ДИперК) в комбинации с посткондиционированием (ДИпостК). Эффективность ДИК оценивалась по данным магнитно-резонансной томографии (МРТ) сердца.Результаты. Медианы объема зоны некроза (ЗН) миокарда ЛЖ были достоверно выше у пациентов КГ: 44,8 (33,6; 55,5) против 52,7 (35,5; 73,9) мл в ОГ, р = 0,039) на 10-е сут ИМ и через 6 мес. (34,0 (25,8; 39,8) мл и 46,0 (32,8; 55,0) мл соответственно, р = 0,004). Пациенты обеих групп не различались по показателю зоны рискованного миокарда (ЗР) относительно объема миокарда (ОМ) ЛЖ: 40 (35; 45)% и 43 (34; 49)% в ОГ и КГ соответственно, р = 0,232. Группы статистически значимо различались по показателю ЗН/ЗР: 70,3 (65,1; 86,6)% в КГ и 63,5 (52,7; 72,0)% в ОГ, р = 0,014, индексу спасенного миокарда (ИСМ): 29,7 (13,5; 34,9)% в КГ и 36,5 (28,0; 47,3)% в ОГ, р = 0,014. Выявлена тенденция к большей сохранности ОМ ЛЖ в ОГ по сравнению с КГ к 6-му мес. наблюдения (р = 0,073). Группы статистически значимо различались по медиане объема микроваскулярной обструкции (МВО): 1,9 (1,4; 2,9) мл в ОГ и 2,5 (1,8; 8,1) мл в КГ, p = 0,049 и доле МВО в ОМ ЛЖ: 0,94 (0,79; 1,37)% в ОГ; 1,50 (0,89; 3,66)% в КГ, р = 0,046.Заключение. Метод ДИК способствует ограничению размера инфаркта и МВО, а также связан с увеличением ИСМ у пациентов с ИМпST.
Инфаркт миокарда, ишемически-реперфузионное повреждение, дистантное ишемическое кондиционирование, зона некроза, зона риска, микроваскулярная обструкция
Короткий адрес: https://sciup.org/149136656
IDR: 149136656 | УДК: 616.127-005.8-036.11-085.224 | DOI: 10.29001/2073-8552-2021-36-2-76-83
Текст научной статьи Комбинированный протокол дистантного ишемического кондиционирования как метод кардиопротекции у пациентов с острым инфарктом миокарда с подъемом сегмента ST
Острый инфаркт миокарда (ИМ) является одной из ведущих причин смертности в развитых странах. Своевременная реперфузия миокарда считается наиболее эффективным способом в борьбе с ишемическим поражением сердечной мышцы, однако восстановление кровотока в инфаркт-связанной артерии (ИСА) может спровоцировать развитие дальнейшей парадоксальной дисфункции кардиомиоцитов, известной как реперфузионное повреждение (РП) [1]. Морфологически ишемическое повреждение характеризуется истощением запасов гликогена, набуханием митохондрий и разрывами сарколеммы за счет дисфункции ионных насосов, ацидоза и перегрузки Ca2+. Вышеописанные трансформации приводят к образованию активных формы кислорода (АФК)
и разрушению ДНК. Реперфузия миокарда усугубляет эти изменения, вызывая нескоординированное миофибрил-лярное сокращение в ответ на увеличение циркулирования Ca2+ между саркоплазматическим ретикулумом и цитозолем [2]. Реперфузия связана с еще более избыточным образованием АФК, чем при ишемии и повышенной протеолитической активностью кальпаина [3], который переваривает цитоскелет и белки сарколеммы. РП может проявляться аритмиями, «оглушением» и геморрагическим пропитыванием миокарда, микроваскулярной обструкцией (МВО) и, как следствие, увеличением зоны инфаркта. Все вышеописанные проявления РП могут стать причиной злокачественного течения сердечной недостаточности и внезапной коронарной смерти [4]. Среди пациентов, перенесших острый ИМ, подвергавшихся реперфузионной терапии, общемировой показатель сердечно-сосудистой смертности в течение первого года составляет 11% [5]. Своевременная постановка диагноза, применение оптимального способа реваскуляризации и адекватная медикаментозная терапия могут значительно ограничить ишемическое повреждение при остром ИМ. Однако стратегии по созданию условий, ограничивающих вклад РП, пока не принято. Одним из наиболее перспективных направлений по защите миокарда можно считать ишемическое кондиционирование – собирательный термин, объединяющий феномены, суть которых заключается в активации эндогенных механизмов кардиопротекции в ответ на кратковременную ишемию самого миокарда или анатомически удаленного от сердца органа ( дистантное ишемическое кондиционирование – ДИК ) [6]. ДИК как метод неинвазивен, легко воспроизводим, и может быть вызван до (прекондиционирование), во время коронарной окклюзии ( перкондиционирова-ние ) и после реперфузии ( посткондиционирование ). ДИК не создает временной задержки для восстановления кровотока в ИСА. Некоторые одноцентровые исследования продемонстрировали уменьшение размера некроза (основного фактора, определяющего прогноз у пациентов с ИМ с подъемом сегмента ST – ИМп ST), после выполнения процедуры дистантного ишемического перконди-ционирования (ДИперК) или дистантного ишемического посткондиционирования (ДИпостК) на фоне первичного чрескожного коронарного вмешательства (пЧКВ) по сравнению только со стандартным пЧКВ [7]. Однако более значимые кардиопротективные эффекты следует ожидать при сочетанном применении различных видов ДИК, что может быть обусловлено суммированием реализуемых при их применении позитивных свойств за счет различных механизмов действия [8]. Также следует констатировать, что эффект комбинации различных видов ДИК у пациентов с ИМ ранее не изучался. В связи с этим обозначенная проблема нам представляется актуальной и нерешенной, что послужило основанием для проведения дальнейших исследований в указанном направлении.
Цель исследования: оценить эффективность ДИперК в комбинации с поздним ДИпостК (ДИК) у пациентов с острым ИМпST в течение 6 мес.
Материал и методы
Данное исследование являлось открытым проспективным рандомизированным контролируемым. Использовалась рандомизация методом конвертов. Пациенты, поступившие в РНПЦ «Кардиология» с диагнозом: ИМпST передней стенки левого желудочка (ЛЖ), после подписа- ния информированного согласия (протокол заседания этического комитета, одобрившего исследование, № 7 от 19.12.2016 г.) были случайным образом распределены в контрольную группу (КГ), где выполнялось стандартное пЧКВ, и основную группу (ОГ), где на фоне пЧКВ проводилась процедура ДИК (4 последовательных пятиминутных цикла компрессии/декомпрессии верхней конечности манжетой тонометра до и через 90 мин после реперфузии). Критериями исключения из исследования являлись: возраст менее 18 лет, длительность болевого синдрома менее 90 мин либо более 6 ч, ИМ, реваскуляризация или тромболитическая терапия в анамнезе, кардиогенный шок, сахарный диабет, наличие абсолютных противопоказаний к выполнению магнитно-резонансной томографии (МРТ). Пациенты направлялись в ангиографический кабинет без задержек, минуя приемное отделение. В ходе проведения коронарографии ранее включенные пациенты исключались из исследования, если выявлялась любая из нижеперечисленных особенностей: мультифокальное поражение, отсутствие острого окклюзирования в бассейне ИСА, ИСА являлась любая артерия, за исключением передней межжелудочковой ветви. Следует отметить, что пациенты обеих групп получали стандартную медикаментозную терапию согласно клиническим протоколам лечения ИМ (постановление МЗ РБ № 59 от 06.06.2017 г.). За период с 01.01.2017 г. по 01.01.2020 г. в исследование включены 87 пациентов. Ниже в таблице 1 представлены их клинические характеристики, достоверно не различающиеся между изучаемыми группами на момент поступления.
Таблица 1. Клинико-анамнестические характеристики и лабораторные показатели пациентов основной и контрольной групп при поступлении в стационар
Table 1. Baseline clinical characteristics, medical history, and laboratory parameters of patients in control and intervention groups at admission to hospital
|
Признаки Parameters |
ОГ ( n = 43) Intervention group ( n = 43) |
КГ ( n = 44) Control group ( n = 44) |
p |
|
Мужской пол, n (%) Male sex, n (%) |
36 (84,4) |
39 (88,6) |
>0,05 |
|
Возраст, лет , M ± σ Age, years, M ± σ |
55,7 ± 9,0 |
54,5 ± 7,0 |
>0,05 |
|
Индекс массы тела, кг/м2, M ± σ Body mass index, kg/m2 , M ± σ |
27,4 ± 2,3 |
27,9 ± 2,5 |
>0,05 |
|
Текущие курильщики и ранее курившие лица, n (%) Previous and current smokers, n (%) |
21 (48,8) |
23 (52,7) |
>0,05 |
|
Артериальная гипертензия, n (%) Hypertension, n (%) 1-й степени, n (%) Stage 1, n (%) 2-й степени, n (%) Stage 2, n (%) 3-й степени, n (%) Stage 3, n (%) |
28 (65,1) 18 (67,9) 8 (29,0) 2 (7,1) |
30 (75) 16 (53,3) 12 (40,0) 2 (6,7) |
>0,05 |
|
Killip I, n (%) |
42 (97,7) |
39 (97,5) |
>0,05 |
|
Гликемия при поступлении, ммоль/л ( Ме ( Q 1; Q 3)) Glycemia at admission, mmol/L ( Ме ( Q 1; Q 3)) |
8,2 (7,1;9,5) |
8,5 (6,7; 9,4) |
>0,05 |
|
Время боль-баллон, мин ( Ме ( Q 1; Q 3)) Pain to balloon time, min ( Ме ( Q 1 ; Q 3)) |
200 (155;217) |
174 160; 260) |
>0,05 |
Окончание табл. 1
End of table 1
|
Тромбаспирация, n (%) Thrombectomy, n (%) |
20 (46,5) |
18 (41,9) |
>0,05 |
|
Количество стентов ( Ме ( Q 1; Q 3)) Stents ( Ме ( Q 1; Q3)) |
1,23 (1,00; 2,00) |
1,28 (1,00; 2,00) |
>0,05 |
|
TIMI = 0 до реканализации, n (%) TIMI = 0 before recanalization, n (%) |
32 (74,4) |
32 (72,7) |
>0,05 |
|
TIMI = 3 после реканализации, n (%) TIMI = 3 after recanalization, n (%) |
38 (88,4) |
40 (90,9) |
>0,05 |
Для оценки повреждения миокарда ЛЖ проводилась МРТ с контрастным усилением на томографе Siemens Aera напряженностью 1,5 Т в раннем (7–10-е сут) и в среднесрочном (6 мес.) периодах после включения пациента в исследование. Статистический анализ полученных данных был выполнен при помощи компьютерного пакета программ STATISTICA. При сравнении двух независимых выборок использовался U -критерий Манна – Уитни. Количественная оценка величины межгрупповых различий проводилась по размеру эффекта (ES – Effect Size), который вычислялся по методу Г. Вендта (ES < 0,50 – малый эффект, ES 0,50–0,79 – средний эффект, ES ≥ 0,80 – большой эффект). Количественные величины представлены как медиана, верхняя граница первого квартиля выборки, верхняя граница третьего квартиля выборки ( Ме (Q 1; Q3 )). При описании качественных величин приведены их абсолютные значения, а также доли в процентах ( n , %).
Результаты
В большинстве исследований размер ИМ является наиболее надежным критерием оценки ишемически-ре-перфузионного повреждения, а уменьшение размера инфаркта – наиболее значимым показателем эффективности метода кардиопротекции [9]. Для оценки эффективности метода ДИК в остром периоде ИМ и в течение последующих 6 мес. наблюдения использовали абсолютные значения зоны рискованного миокарда (ЗР) и зоны некроза (ЗН), а также относительные показатели, выраженные в процентах: отношение ЗН к ЗР, ЗР к объему миокарда (ОМ) ЛЖ. С помощью абсолютных значений ЗН и ЗР определяли такой важный показатель, как индекс спасенного миокарда (ИСМ) (часть кардиомиоцитов, которые удалось спасти от необратимого повреждения). В данном исследовании на 10-е сут после развития острого ИМ медианы объема ЗН миокарда ЛЖ, оцениваемые по данным МРТ сердца в фазу отсроченного накопления гадолиний-содержащего вещества, были достоверно выше у пациентов КГ по сравнению с ОГ ( р = 0,039), таблица 2. Аналогичные межгрупповые различия сохранились и на этапе обследования через 6 мес. после ИМ ( р = 0,004). В обеих группах к 6-му мес. наблюдения выявлено статистически значимое уменьшение абсолютных значений данного показателя ( р < 0,001). Значения ES свидетельствовали о большом размере статистического эффекта в ОГ (ES = 0,87) и о среднем размере в КГ (ES = 0,73).
Таким образом, в ОГ не только размер инфаркта был изначально меньше, но и степень его уменьшения была больше, что свидетельствует о достоверном ограничении размера необратимого повреждения миокарда ЛЖ после выполнения процедуры ДИК по сравнению со стандартным лечением ( р = 0,039).
Таблица 2. Показатели объема зоны некроза левого желудочка после изолированного пЧКВ и пЧКВ в сочетании с ДИК у пациентов в остром периоде и через 6 мес. от развития инфаркта миокарда ( Ме (Q 1; Q3 )), мл
Table 2. Infarct size parameters in the left ventricle of patients after primary percutaneous intervention (PPCI) and PPCI combined with remote ischemic perconditioning and postconditioning at day 10 and six months after myocardial infarction ( Ме (Q1; Q3 )), mL
|
Сроки Time |
Группы Groups |
р (по критерию Манна – Уитни) p (Mann – Whitney) |
|
|
ОГ ( n = 43) Intervention group ( n = 43) |
КГ ( n = 44) Control group ( n = 44) |
||
|
Через 10 сут Day 10 |
44,8 (33,6; 55,5) |
52,7 (35,5; 73,9) |
0,039 |
|
Через 6 мес. Month 6 |
34,0 (25,8; 39,8) |
46,0 (32,8; 55,0) |
0,004 |
|
р (по критерию Вилкоксона) p (Wilcoxon test) |
<0,001 |
<0,001 |
– |
Часть миокарда, подвергающуюся ишемии вследствие окклюзии ИСА, называют ЗР. Во время ишемического повреждения в ЗР формируется интерстициальный отек миокарда вследствие повышенной проницаемости капилляров, который сохраняется не менее 4 нед., поэтому ЗР может быть оценена методом МРТ в течение всего острого периода ИМ [10]. В данном исследовании ОГ и КГ не различались по относительному показателю ЗР, определенному на 10-е сут, который составил 40 (35; 45)% и 43 (34; 49)% в ОГ и КГ соответственно ( р = 0,232).
Не получено значимых межгрупповых различий и по медианам абсолютных размеров ЗР на стадии острого ИМ: 74,8 (59,4; 92,1) мл в ОГ и 75,6 (60,0; 93,1) мл в КГ ( р = 0,772). Группы исследования были также сопоставимы по показателю ЗР относительно ОМ ЛЖ, скорректированного на площадь поверхности тела пациента: 18,7 (16,2; 22,4)%/м2 в ОГ и 20,9 (16,7; 25,1)%/м2 в КГ, р = 0,138. Полученные нами данные указывают на отсутствие влияния метода ДИК на размер ЗР.
Медиана и интерквартильный размах отношения ЗН к ЗР в группах исследования отражены на рисунке 1. ОГ и КГ статистически значимо различались по данному показателю, что свидетельствует об ограничении размера повреждения у пациентов, перенесших ИМ и прошедших процедуру ДИК на верхней конечности. Следует отметить, что в исследовании G. Crimi и соавт. (2013), в котором кардиопротекция выполнена методом ДИперК на нижней конечности, не получено значимого различия групп после стандартного пЧКВ и после пЧКВ в сочетании с ДИперК по показателю отношения ЗН к ЗР (72 ± 19% и 72 ± 17% соответственно, р = 0,980) [11].
Таким образом, межгрупповые различия по показателю отношения ЗН к ЗР могут быть обусловлены предлагаемым методом кардиопротекции.
Общепринятым показателем оценки эффекта кардиопротекции у пациентов с ИМ является ИСМ, который позволяет нивелировать различия в размерах ЗР, обусловленные вариабельностью зон васкуляризации ИСА [12]. В целом, ИСМ – это количественная мера эффективности воздействия. Данный показатель особенно важен, так как с его помощью можно унифицировать результаты, что позволяет сравнивать данные различных исследований между собой.
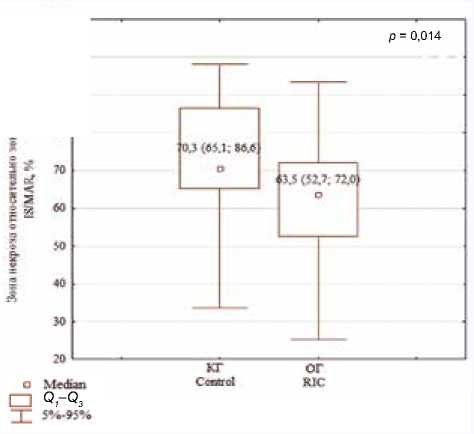
Рис. 1. Показатели зоны некроза относительно зоны риска миокарда левого желудочка после изолированного пЧКВ и пЧКВ в сочетании с ДИК у пациентов на 10-е сут инфаркта миокарда ( Ме ( Q1; Q3 )), % Fig. 1. Infarct size to area at risk ratios (%) in the left ventricular myocardium in patients after primary percutaneous intervention (PPCI) and PPCI combined with remote ischemic perconditioning and postconditioning at day 10 after myocardial infarction ( Ме (Q1; Q3 )), %
Структурно-геометрическая адаптация миокарда к новым условиям функционирования, наступающим после ИМ, выражается изменением формы и толщины стенок ЛЖ. В результате преобладания скорости дилатации над процессом гипертрофии миокарда ЛЖ он становится более тонкостенным, нарушается геометрия его полости с переходом к гемодинамически невыгодной сферической форме [17]. Как видно из таблицы 3, не получено значимого различия групповых медиан показателя ОМ ЛЖ в острый период после перенесенного ИМ ( р = 0,270). В течение 6 мес. наблюдения сердечная мышца пациентов подвергалась процессу структурных и геометрических изменений, который выражался в уменьшении ОМ ЛЖ в обеих группах ( р < 0,001). При анализе данного параметра через 6 мес. выявлена тенденция к большей сохранности массы кардиомиоцитов в ОГ по сравнению с КГ ( р = 0,073). Более выраженное прогрессирование истончения миокарда в КГ подтверждали индивидуальные показатели динамики ОМ ЛЖ: медианные значения снижения показателя на 11% по сравнению со снижением на 3% в ОГ ( р < 0,001). Полученные результаты могут свидетельствовать о дезадаптационном характере ремоделирования ЛЖ в группе, где не применялось ДИК. Размер статистического эффекта разницы значений ОМ ЛЖ на 10-е сут и через 6 мес. после ИМ в КГ соответствовал большому негативному эффекту (ES = 0,95), в ОГ – среднему эффекту (ES = 0,77).
ИСМ после применения пЧКВ в сочетании с ДИК отражен на рисунке 2. Аналогичные данные были получены и в нескольких других исследованиях, где применяли различные виды ДИК. Так, ИСМ был выше после ДИК, как продемонстрировано в работах J. Lonborg и соавт. (2010) (34 против 25% в контроле, p = 0,012) [13] и H.E. Botcker и соавт. (2010) (45% по сравнению с 25% в контроле, p = 0,033) [14]. При этом в исследованиях S.K. White и соавт. (2015) [15] и K. Munk и соавт. (2010) [16] не показаны преимущества методов ДИК по влиянию на ИСМ.
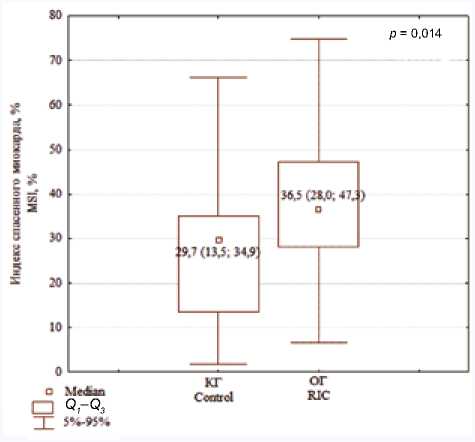
Рис. 2. Показатели индекса спасенного миокарда левого желудочка после изолированного пЧКВ и пЧКВ в сочетании с ДИК у пациентов на 10-е сутки инфаркта миокарда ( Ме ( Q1; Q3 )), %
Fig. 2. Myocardial salvage index in patients after primary percutaneous intervention (PPCI) and PPCI combined with remote ischemic perconditioning and postconditioning at day 10 after myocardial infarction ( Ме (Q1; Q3 )), %
Таблица 3 . Показатели объема миокарда левого желудочка после изолированного пЧКВ и пЧКВ в сочетании с ДИК у пациентов в остром периоде и через 6 мес от развития инфаркта миокарда ( Ме ( Q1; Q3 )) , мл
Table 3. Left ventricular volume in patients after primary percutaneous intervention (PPCI) and PPCI combined with remote ischemic perconditioning and postconditioning at day 10 and six month after myocardial infarction ( Ме (Q1; Q3 )) , mL
|
Сроки Time |
Группы Groups |
р (по критерию Манна – Уитни) p (Mann– Whitney) |
|
|
ОГ ( n = 43) Intervention group ( n = 43) |
КГ ( n = 44) Control group ( n = 44) |
||
|
Через 10 сут Day 10 |
181 (160; 204) |
202 (164; 218) |
0,270 |
|
Через 6 мес. Month 6 |
178 (159; 190) |
166 (142; 184) |
0,073 |
|
р (по критерию Вилкоксона) p (Wilcoxon) |
< 0,001 |
< 0,001 |
– |
Наши данные согласуются с результатами J. Lonborg и соавт., опубликованными в 2012 г., которые также продемонстрировали тенденцию к меньшему ОМ ЛЖ в отсроченном периоде после развития ИМ (3 мес.) в группе пациентов с изолированным пЧКВ: 150 ± 33 по сравнению с 165 ± 41 мл в группе пациентов, подвергавшихся ДИпостК после пЧКВ ( р = 0,055) [13].
Отсутствие адекватной перфузии миокарда на ми-крососудистом уровне после успешно выполненной реваскуляризации коронарной артерии получило название «no-reflow». В основе развития данного феномена лежит, в первую очередь, МВО, что, по данным МРТ в режиме позднего отсроченного накопления, может быть оценено качественно и количественно. Не было выявлено межгруппового различия по частоте МВО на 10-е сут развития ИМ: 46,5% в ОГ и 56,8% в КГ соответственно (p = 0,444), таблица 4. При этом группы статистически значимо различались по количественному показателю объема МВО: 1,9 (1,4; 2,9) мл в ОГ и 2,5 (1,8; 8,1) мл в КГ (p = 0,049), рисунок 3.
Таблица 4. Показатели микроваскулярной обструкции после изолированного пЧКВ и пЧКВ в сочетании с ДИК у пациентов на 10-е сут после инфаркта миокарда
Table 4. Microvascular obstruction in patients after primary percutaneous intervention (PPCI) and PPCI combined with remote ischemic perconditioning and postconditioning at day 10 and six month after myocardial infarction
|
Показатели Parameters |
Группы Groups |
р (по критерию Манна – Уитни) p (Mann – Whitney) |
|
|
ОГ ( n = 43) Intervention group ( n = 43) |
КГ ( n = 44) Control group ( n = 44) |
||
|
МВО, n (%) Microvascular obstration, n (%) |
20 (46,5) |
25 (56,8) |
0,444 |
|
МВО/ОМ ЛЖ, % ( Ме (Q1; Q3 )) Microvascular obstration/ left ventricular myocardial volume, % ( Ме (Q1; Q3 )) |
0,94 (0,79; 1,37) |
1,50 (0,89; 3,66) |
0,046 |
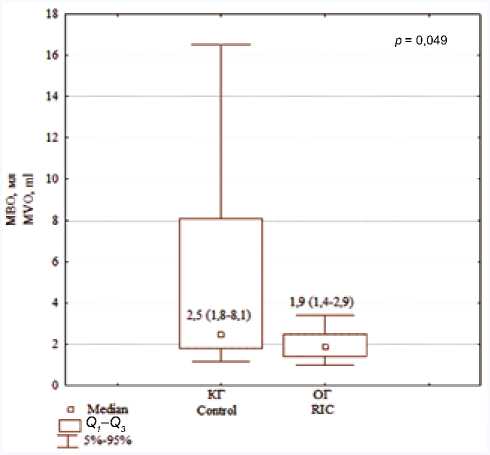
Рис. 3. Показатель микроваскулярной обструкции после изолированного пЧКВ и пЧКВ в сочетании с ДИК на 10-е сут после инфаркта миокарда ( Ме (Q 1; Q3 )), мл
Fig. 3. Microvascular obstruction in patients after primary percutaneous intervention (PPCI) and PPCI combined with remote ischemic perconditioning and postconditioning at day 10 after myocardial infarction ( Ме (Q1; Q3 )), mL
Доля МВО в общем объеме миокарда ЛЖ после пЧКВ в сочетании с процедурой ДИК была достоверно меньше, чем после изолированного пЧКВ ( р = 0,046).
Согласно исследованию M. Van Kranenburg и соавт., МВО является не менее значимым, чем размер ЗН независимым предиктором ремоделирования миокарда ЛЖ и неблагоприятных исходов через 2 года от развития у пациентов ИМпST [18]. Ценность МВО в сочетании с размером ЗН в прогнозировании смертности от всех причин и частоты повторных госпитализаций по поводу сердечной недостаточности в течение 1 года была продемонстрирована S. De Waha и соавт. в метаанализе из 7 рандомизированных контролируемых исследований ( n = 1688) [19]. Значимость комплексной оценки МВО и ЗН в прогнозировании указанных исходов в более отдаленном периоде наблюдения (в течение 5,5 лет, n = 810) подтверждена в работе R. Symons и соавт. [20].
Заключение
Выполнение ДИК на фоне пЧКВ способствовало существенному ограничению размера необратимого по- вреждения миокарда ЛЖ, о чем свидетельствовали больший ИСМ (р = 0,014), более низкие, чем после изолированного пЧКВ значения абсолютного показателя ЗН ЛЖ в остром (р = 0,039) и среднесрочном периодах ИМ (р = 0,004), отношения ЗН к ОМ ЛЖ через 6 мес. наблюдения (р = 0,017).
После ДИК пациенты характеризовались меньшим абсолютным и относительным размерами МВО ( р = 0,049; р = 0,046) по сравнению с изолированным пЧКВ.
Предложенный метод кардиопротекции предотвращал прогрессирование ремоделирования ЛЖ в среднесрочном периоде после ИМ, что подтверждается менее выраженным снижением ОМ ЛЖ (на 3% по сравнению с 11% в КГ, р < 0,001).
Таким образом, на основании полученных результатов можно считать, что метод дистантного ишемического перкондиционирования в комбинации с поздним посткондиционированием обладает выраженной кар-диопротективной силой в ограничении ишемически-ре-перфузионного повреждения у пациентов с острым ИМпST.
Список литературы Комбинированный протокол дистантного ишемического кондиционирования как метод кардиопротекции у пациентов с острым инфарктом миокарда с подъемом сегмента ST
- Heusch G. Postconditioning: Old wine in a new bottle? J. Am. Coll. Cardiol. 2004;44(5):1111—1112. DOI: 10.1016/jjacc.2004.06.013.
- Piper H.M., Meuter K., Schifer C. Cellular mechanisms of ischemia-reperfusion injury. Ann. Thorac. Surg. 2003;75(2):644-648. DOI: 10.1016/s0003-4975(02)04686-6.
- Inserte J., Hernando V., Garcia-Dorado D. Contribution of cal-pains to myocardial ischaemia/reperfusion injury. Cardiovasc. Res. 2012;96(1):23-31. DOI: 10.1093/cvr/cvs232.
- Yellon D.M., Ackbarkhan A.K., Balgobin V., Bulluck H., Deelchand A., Dhuny M.R. et al. Remote ischemic conditioning reduces myocardial infarct size in STEMI patients treated by thrombolysis. J. Am. Coll. Cardiol. 2015;65(25):2764-2765. DOI: 10.1016/j.jacc.2015. 02.082.
- Kleinbongard P., Baars T., Mohlenkamp S., Kahlert P., Erbel R., Heusch G. Aspirate from human stented native coronary arteries vs. saphenous vein grafts: more endothelin but less particulate debris. Am. J. Physiol. Heart Circ. Physiol. 2015;305(8):1222-1229. DOI: 10.1152/ ajpheart.00358.2013.
- Мрочек А.Г., Басалай М.В., Барсукевич В.Ч., Гурин А.В. Эндогенные феномены кардиопротекции и их механизмы. Кардиология в Беларуси. 2014;(3):88-109.
- Hausenloy D.J., Kharbanda R.K., M0ller U.K., Ramlall M., Aar0e J., Butler R. et al. Effect of remote ischemic conditioning on clinical outcomes at 12 months in acute myocardial infarction patients: the CONDI-2/ ERIC-PPCI trial. Lancet. 2019;394(10207):1415-1424. DOI: 10.1016/ S0140-6736(19)32039-2.
- Schulz R., Kelm M., Heusch G. Nitric oxide in myocardial ischemia/reper-fusion injury. Cardiovasc. Res. 2004;61(3):402-413. DOI: 10.1016/j.car-diores.2003.09.019.
- Reimer K.A., Jennings R.B. The "wavefront phenomenon" of myocardial ischemic cell death. II. Transmural progression of necrosis within the framework of ischemic bed size (myocardium at risk) and collateral flow. Lab. Invest. 1979;40(6):633-644.
- Garcia-Dorado D., Andres-Villarreal M., Ruiz-Meana M., Inserte J., Barba I. Myocardial edema: A translational view. J. Mol. Cell Cardiol. 2012;52(5):931-939. DOI: 10.1016/j.yjmcc.2012.01.010.
- Crimi G., Pica S., Raineri C., Bramucci E., De Ferrari G.M., Klersy C. et al. Remote ischemic postconditioning of the lower limb during primary percutaneous coronary intervention safely reduces enzymatic infarct size in anterior myocardial infarction: A randomized controlled trial. JACC Cardiovasc. Interv. 2013;6(10):1055-1063. DOI: 10.1016/j. jcin.2013.05.011.
- B0tker H.E., Kaltoft A.K., Pedersen S.F., Kim W.Y. Measuring myocardial salvage. Cardiovasc. Res. 2012;94(2):266-275. DOI: 10.1093/cvr/ cvs081.
- L0nborg J., Kelbaek H., Vejlstrup N., J0rgensen E., Helqvist S., Sau-namäki K. et al. Cardioprotective effects of ischemic postconditioning in patients treated with primary percutaneous coronary intervention, evaluated by magnetic resonance. Circ. Cardiovasc. Interv. 2010;3(1):34-41. DOI: 10.1161/CIRCINTERVENTIONS.109.905521.
- B0tker H.E., Kharbanda R., Schmidt M.R., B0ttcher M., Kaltoft A.K., Ter-kelsen C.J. et al. Remote ischaemic conditioning before hospital admission, as a complement to angioplasty, and effect on myocardial salvage in patients with acute myocardial infarction: A randomised trial. Lancet. 2010;375(9716):727-734. DOI: 10.1016/S0140-6736(09)62001-8.
- White S.K., Frohlich G.M., Sado D.M., Maestrini V., Fontana M., Trei-bel T.A. et al. Remote ischemic conditioning reduces myocardial infarct size and edema in patients with ST-segment elevation myocardial infarction. JACC Cardiovasc. Interv. 2015;8(1B):178-188. DOI: 10.1016/j. jcin.2014.05.015.
- Munk K., Andersen N.H., Schmidt M.R., Nielsen S.S., Terkelsen C.J., Sloth E. et al. Remote ischemic conditioning in patients with myocardial infarction treated with primary angioplasty: Impact on left ventricular function assessed by comprehensive echocardiography and gated single-photon emission CT. Circ. Cardiovasc. Imaging. 2010;3(6):656-662. DOI: 10.1161/CIRCIMAGING.110.957340.
- Willenheimer R. Left ventricular remodelling and dysfunction. Can the process be prevented? Int. J. Cardiol. 2000;72(2):143-150. DOI: 10.1016/s0167-5273(99)00182-5.
- Van Kranenburg M., Magro M., Thiele H., de Waha S., Eitel I., Cochet A. et al. Prognostic value of microvascular obstruction and infarct size, as measured by CMR in STEMI patients. JACC Cardiovasc. Imaging. 2014;7(9):930-939. DOI: 10.1016/j.jcmg.2014.05.010.
- De Waha S., Patel M.R., Granger C.B., Ohman E.M., Maehara A., Eitel I. et al. Relationship between microvascular obstruction and adverse events following primary percutaneous coronary intervention for ST-seg-ment elevation myocardial infarction: an individual patient data pooled analysis from seven randomized trials. Eur. Heart J. 2017;38(47):3502-3510. DOI: 10.1093/eurheartj/ehx414.
- Symons R., Pontone G., Schwitter J., Francone M., Iglesias J.F., Bari-son A. et al. Long-Term Incremental Prognostic Value of Cardiovascular Magnetic Resonance After ST-Segment Elevation Myocardial Infarction: A Study of the Collaborative Registry on CMR in STEMI. JACC Cardiovasc. Imaging. 2018;11(6):813-825. DOI: 10.1016/j. jcmg.2017.05.023.


