Компьютерное моделирование органических форм цинка и селена на основе белка коллагена
Автор: Болхонов Б.А., Жамсаранова С.Д., Шалбуев Д.В., Тумурова Т.Б.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Статья в выпуске: 2 (93), 2024 года.
Бесплатный доступ
Данная статья представляет результаты исследований, целью которых являлась разработка теоретической компьютерной модели формирования органических форм цинка и селена на основе возможности их взаимодействия с коллагеновой матрицей. В качестве органического носителя был выбран коллаген. С применением программного обеспечения HyperChem v8.0 были использованы квантово-химические, полуэмпирические и молекулярно-динамические методы для изучения изменений молекулярных свойств и проведения квантово-механического моделирования атомных структур. Молекулярные структуры органических форм микроэлементов с аминокислотами были созданы и оптимизированы геометрически. Рассмотрены различные варианты и комбинации соединений цинка и селена с четырьмя аминокислотами, наиболее часто встречаемыми в коллагене. Оценка корректности геометрической оптимизации, минимизации потенциальной энергии и сбалансированности энергетических свойств системы проводилась на основе суммарной энергии компонентов. Полученные результаты указывают на потенциально возможное взаимодействие микроэлементов с аминокислотами коллагена.
Коллаген, микронутриенты, микроэлементы, молекулярный докинг, энергия связи
Короткий адрес: https://sciup.org/142241935
IDR: 142241935 | УДК: 641.11:577.117 | DOI: 10.53980/24131997_2024_2_46
Текст научной статьи Компьютерное моделирование органических форм цинка и селена на основе белка коллагена
В современном мире в условиях глобального дефицита микроэлементов биохимия и биология органических форм таких микроэлементов, как цинк и селен, занимают центральное ме- сто. Эти микроэлементы играют ключевую роль в биологических процессах, регулируя активность ферментов, участвуя в обмене веществ и обеспечивая правильное функционирование иммунной системы [1, 2]. Однако, несмотря на огромный объем исследований, проведенных в этой области, механизмы их получения и действия в организме остаются недостаточно изученными [3]. На сегодня большинство исследователей, работающих в области микроэлементологии, склоняются к большей эффективности и перспективности органических форм по сравнению с неорганическими формами микроэлементов. В ряде работ обсуждаются способы получения комплексов эссенциальных микроэлементов с белками, пептидами, со свободными аминокислотами и исследование их биодоступности [4]. Одной из перспективных матриц для образования хелатных комплексов с эссенциальным микроэлементами являются побочные белковые продукты пищевой промышленности.
Коллаген становится все более популярным в качестве основного строительного биоматериала в различных направлениях биоинженерии благодаря своей превосходной биосовместимости, допустимой биоразлагаемости и низкой иммуногенности [5]. Животные являются основными источниками коллагена, так как в их тканях содержится большое количество этого белка до 30 % от их сухого веса [6]. Коллаген - это фибриллярный белок, составляющий структурный каркас соединительных тканей, придающий им прочность и эластичность. Он также участвует в процессах клеточной коммуникации и регуляции клеточных функций. В основном коллаген получают из субпродуктов и отходов мясной промышленности, перерабатывающих мясо крупных жвачных животных, свиней, птицы и рыбы. В классических методиках коллаген выделяют из ахилловых сухожилий быков, хвостов крыс или тканей свиней. Исследователи выделяют коллаген из различных животных источников, таких как свиные шкуры, сухожилия лошадей, шкуры рептилий, сухожилия крыс, хвосты кенгуру, сухожилия оленей, кости аллигаторов, конечности перепелов, кожа колибри, ткани морских организмов, чешуя рыб и другие побочные продукты рыболовства.
В тканях млекопитающих идентифицировано более 29 различных типов коллагенов, однако только коллагены I, II и III типов являются истинными фибриллярными белками. Наиболее распространенным типом является коллаген I типа, составляющий около 90 % от общего количества в организме. Структура коллагена состоит из трех полипептидных цепей - α-цепей, которые могут образовывать правосторонние тройные спирали, содержащие повторы Gly-X-Y [7]. В позициях X и Y часто обнаруживаются пролин и гидроксипролин. Глицин составляет до 30 % от общего содержания аминокислот в коллагене. Тройная спираль стабилизируется за счет водородных связей и электростатических взаимодействий [7, 8].
Недавнее исследование показало, что коллаген I типа может связывать воспалительные интерлейкины, такие как IL-1β, IL-6 и IL-8, и способен формировать физиологическую среду раны, которая поддерживает процесс заживления [9]. Более того, коллаген I типа продемонстрировал способность связывания эластазы и матриксной металлопротеиназы 2 (ММП-2) [10, 11]. Разнообразные молекулярные сочетания коллагена в тканевых структурах способны вступать в комплексное взаимодействие с трансмембранными рецепторными комплексами, где главенствующую роль играют α-1β-1 и α-2β-1 интегрины. Эти рецепторные образования выступают в качестве своеобразных молекулярных мостиков, объединяющих клеточные структуры с внеклеточным матриксом [12]. Также стоит отметить способность молекул коллагена образовывать хелатные комплексы с Са2+, что оказывает влияние на его структурные и механические свойства. Несмотря на высокие механические свойства нативного коллагена в тканях, биоматериалы на основе коллагена не всегда обладают достаточной механической прочностью.
Таким образом коллаген является весьма перспективным, биогенным, экологически и экономически выгодным объектом для использования его в качестве матрицы.
Одним из перспективных направлений в научных исследованиях является разработка компьютерных моделей для изучения взаимоотношений между матрицей и микроэлементами, в частности между цинком или селеном. Эти модели помогут нам не только понять, как моле- кулы взаимодействуют друг с другом, но и то, как эти взаимодействия могут выглядеть и каковы их свойства. Теоретические модели, основанные на такой системе, позволяют узнать много интересного о различных биологических системах, а также раскрыть некоторые механизмы действия [13, 14].
Цинк и селен имеют большое значение для сельского хозяйства, биотехнологии и медицины. В медицине, например, цинк и селен успешно применяются при лечении онкологических заболеваний, помогают предотвратить болезнь Альцгеймера, болезнь Паркинсона, диабет и другие заболевания. Понимание того, как эти два элемента взаимодействуют с биологическими молекулами, может привести к появлению новых методов лечения или профилактики различных заболеваний. Кроме того, будучи ценными микроэлементами в сельском хозяйстве и цепочках поставок продуктов питания, цинк и селен необходимы для здорового роста сельскохозяйственных животных, а также для повышения урожайности в процессе производства [15, 16]. Аналогичные исследования были проведены с использованием гидролизата соевого белка в качестве органической матрицы при моделировании взаимодействий микроэлементов, таких как йод, цинк и селен, с различными биомолекулами гидролизата [17]. Успешное выполнение этой задачи может привести к созданию инструмента, который сможет значительно углубить наше понимание роли цинка и селена в биологических системах [18, 19].
Таким образом, создание компьютерной модели органических форм микроэлементов, таких как цинк и селен, открывает новые перспективы и возможности для дальнейших исследований, а также имеет огромный потенциал для практического применения в медицине, сельском хозяйстве и биотехнологии.
Целью данной работы явилась разработка гипотетической модели связывания цинка и селена с белком коллагеном.
Материалы и методы исследования
Метод молекулярного докинга был выбран для исследования взаимодействия коллагена с неорганическими формами цинка и селена. Данный метод позволяет предсказать и оценить возможные конформации комплексов, образуемых между молекулами-лигандами (белками, пептидами) и целевыми мишенями (неорганическими формами цинка и селена), а также оценить их взаимосвязь и силу связывания [20, 21].
В качестве объектов исследования была выбрана модель белка коллагена, которая использовалась в качестве лиганда для молекулярного докинга с неорганическими формами цинка и селена.
Для проведения молекулярного докинга было использовано программное обеспечение HyperChem v8.0. Оно обладает широким спектром инструментов для моделирования и расчета химических структур и свойств. HyperChem v8.0 предоставляет возможность проведения молекулярного докинга с высокой точностью и предсказуемостью, что делает его предпочтительным при выборе используемого метода.
Для наиболее вероятного подтверждения возможности гипотетического паттерна неподвижности в качестве эталона была использована энергия связи, рассчитанная полуэмпириче-ским методом (PM3) [22]. Энергетическая теория химических связей гласит: чем ниже суммарный энергетический баланс молекулы, тем она стабильнее и устойчивее. Опираясь на этот принцип, для выстраивания гипотетических моделей органических форм селена и цинка использовались имеющиеся литературные сведения и базы данных, содержащие информацию о белковых молекулярных структурах [23].
Результаты и их обсуждения
Анализ аминокислотного состава коллагена позволил выявить характерные особенности его структуры. Коллаген, будучи белковым компонентом соединительной ткани, содержит высокую концентрацию глицина, пролина, гидроксипролина и аланина [24]. Данные аминокислоты играют важную роль в формировании тройных спиралей, характерных для коллагеновых 48
волокон, и определяют уникальные механические свойства коллагена. Полученные результаты являются важным предварительным этапом для исследования низкомолекулярных пептидов коллагенового происхождения, взаимодействующих с неорганическими формами цинка и селена, и их последующего моделирования с использованием метода молекулярного докинга.
Атом цинка может быть связан с аминокислотами, образуя структуру, аналогичную цинковому пальцу. В молекулярной докинговой модели атом цинка может взаимодействовать с определенными аминокислотными остатками, обеспечивая их координацию вокруг себя. Такое взаимодействие может играть ключевую роль в стабилизации белковых структур, регулировании их активности.
На рисунке 1 представлены наиболее вероятные варианты моделей взаимодействия ионов цинка с различными аминокислотными остатками.
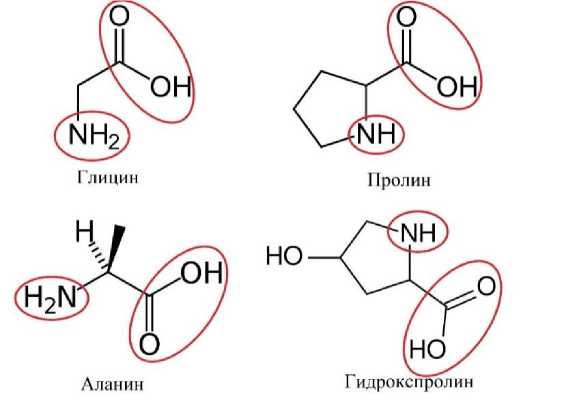
Рисунок 1 – Функциональные группы различных аминокислот, способные взаимодействовать с цинком
Результаты компьютерного моделирования в программе HyperChem v8.0, где были смоделированы четыре различных варианта координационного связывания ионов цинка с аминокислотными остатками и выполнены расчеты энергетических характеристик образующихся связей, показали, что наибольшей энергией связывания с цинком обладала аминокислота гидроксипролин, для которой рассчитанное значение энергии составило -1755,93 ккал/моль (табл. 1).
Таблица 1
Энергия связи, характеризующая различные взаимодействия с аминокислотами
|
Название аминокислоты |
Значения энергии связи (E), ккал/моль |
|
Глицин |
-928,01 |
|
Пролин |
-1656,34 |
|
Аланин |
-1209,86 |
|
Гидроксипролин |
-1755,93 |
В ходе компьютерного моделирования были рассмотрены различные возможные варианты координационного связывания ионов цинка с аминокислотными остатками, при которых цинк мог взаимодействовать как с аминогруппами, так и с карбоксильными группировками аминокислот. Результаты расчетов энергетических характеристик полученных модельных структур (рис. 2) показали, что наибольшей энергией связывания (-6945,75 ккал/моль) обладает комплекс, в котором ион цинка координирован с гидроксипролином посредством связи с аминогруппой данного аминокислотного остатка. Следует отметить, что ионы цинка, как правило, не склонны к образованию стабильных координационных комплексов при связывании через карбоксилатные группы, что делает такие цинк-карбоксилатные структуры менее прочными и менее распространенными по сравнению с другими типами цинксодержащих соединений. На основе полученных данных в качестве базовой модели для дальнейшего компьютерного моделирования была выбрана структура, в которой атом цинка связан с аминокислотным остатком посредством координационного взаимодействия с аминогруппой.
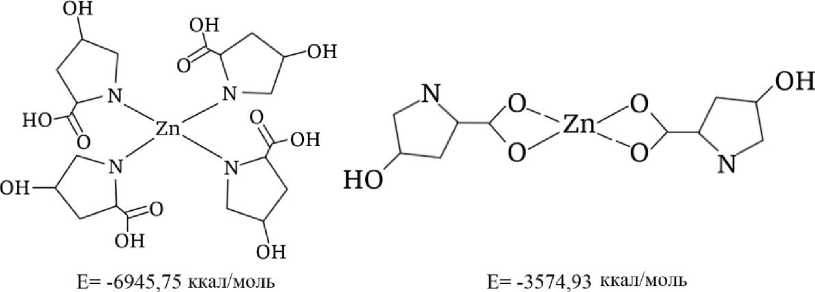
Рисунок 2 - Возможные варианты взаимодействия цинка с аминокислотами
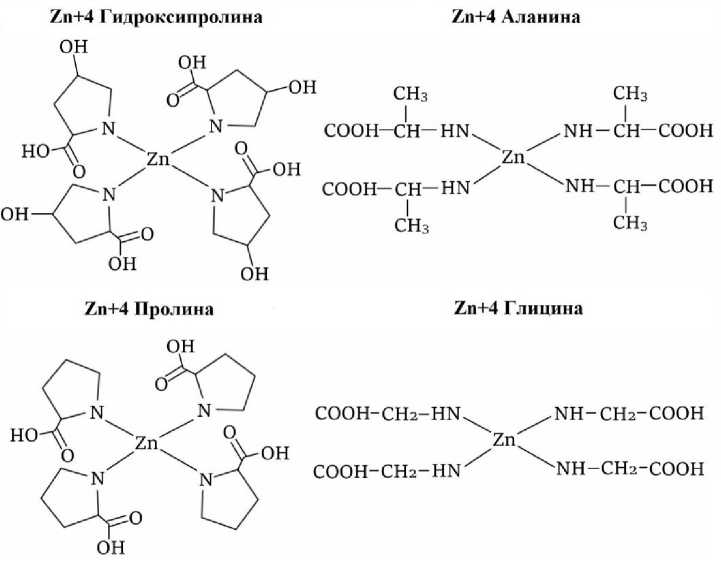
Рисунок 3 - Возможные варианты взаимодействия цинка с различными аминокислотами
Следующим этапом исследований стало компьютерное моделирование взаимодействия ионов цинка с четырьмя аминокислотами: глицином, пролином, аланином и гидроксипролином. При этом связывание цинка с указанными аминокислотами осуществлялось посредством координации через их аминогруппы (рис. 3).
Проведенные расчеты энергетических параметров образующихся цинк-аминокислотных комплексов, результаты которых представлены в таблице 2, показали, что наибольшей энергией связи (-6945,75 ккал/моль) обладает модель, включающая цинк и гидроксипролин.
Именно данная модельная структура цинк-гидроксипролинового комплекса была выбрана в качестве основы для дальнейших теоретических расчетов и компьютерного моделирования.
Взаимодействие аминокислот с цинком: расчетные значения энергии связи
Таблица 2
|
Название аминокислоты |
Значение энергии связи (E), ккал/моль |
|
Глицин |
-3410,23 |
|
Пролин |
-5909,98 |
|
Аланин |
-4049,22 |
|
Гидроксипролин |
-6945,74 |
Следующим шагом нужно было присоединить селен. Селен может связываться с карбоксильными группами аминокислот, что дает возможность присоединить его в различных местах (рис. 4) [25].
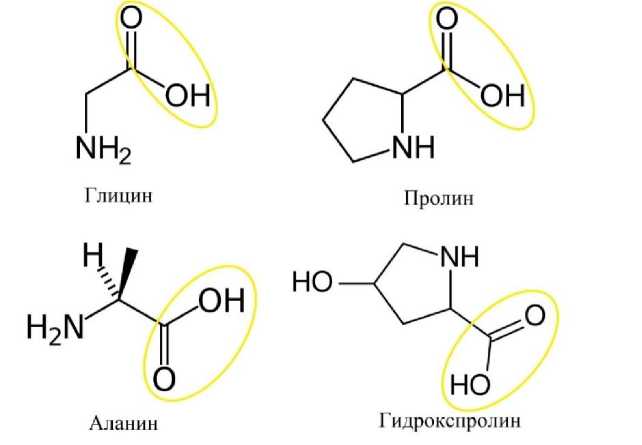
Рисунок 4 - Функциональные группы различных аминокислот, способные взаимодействовать с цинком
После определения базовой модели в виде комплекса цинка, связанного с гидроксипролином через аминогруппу, следующим этапом исследований стало компьютерное моделирование процессов присоединения атомов селена к данной структуре. Были построены и изучены модели с введением одного и двух атомов селена в цинк-гидроксипролиновый комплекс. Проведенные расчеты энергетических характеристик полученных структур показали, что максимальной энергией связывания (-7540,99 ккал/моль) обладает конфигурация, в которой два атома селена присоединены к карбоксильным группам гидроксипролина по обеим сторонам от центрального иона цинка (табл. 3). Таким образом, результаты расчетов продемонстрировали, что среди рассмотренных вариантов наибольшей энергией связи обладает модель с двумя атомами селена, связанными с цинк-гидроксипролиновым комплексом по обеим сторонам от центрального цинкового иона.
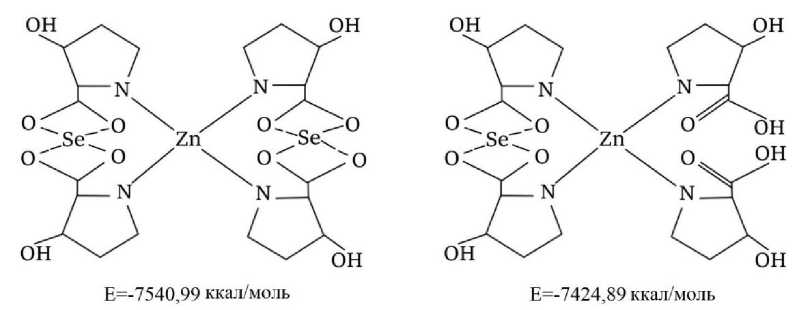
Рисунок 5 - Возможные варианты взаимодействия селена с полученным комплексом
Таким образом, с учетом полученных данных мы можем заключить, что наиболее вероятной структурой комплекса, образованного аминокислотой в координации с ионами цинка и селена, может быть конфигурация, представленная на рисунке 6. Этот комплекс проявил наивысшую энергию связи (E=-7540,99 ккал/моль). Следует подчеркнуть, что предложенная гипотетическая модель применима лишь к конкретным аминокислотам, поскольку свободное пространство для координации отдельных пептидных цепочек отсутствует.
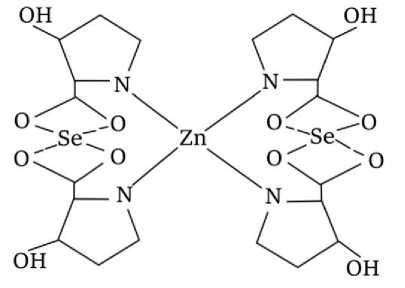
Рисунок 6 - Гипотетическая модель органической формы цинка и селена
Заключение
В завершение работы можно утверждать, что результаты представленного исследования значительно обогатили наше понимание молекулярных взаимодействий между цинком, селеном и аминокислотами. Полученные данные подтверждают возможность образования стабильных комплексов между этими микроэлементами и аминокислотами, что может иметь большое значение для понимания и использования биологической активности и функциональных свойств пищевых добавок. Однако необходимо отметить, что предложенная гипотетическая модель применима только к определенным аминокислотам, учитывая ограниченное пространство для связывания отдельных пептидных цепочек. Дальнейшие исследования в этом направлении позволят детальнее изучить молекулярные механизмы, определяющие взаимодействие между данными компонентами, и оценить потенциальные области их практического применения.
Список литературы Компьютерное моделирование органических форм цинка и селена на основе белка коллагена
- Shini S., Sultan A., Bryden W.L. Selenium Biochemistry and Bioavailability: Implications for Animal Agriculture // Agriculture. - 2015. - Vol. 5, N 4. - P. 1277-1288. - DOI: 10.3390/agriculture5041277.
- Wang J., Um P., Dickerman B.A. et al. Zinc, Magnesium, Selenium and Depression: A Review of the Evidence, Potential Mechanisms and Implications // Nutrients. - 2018. - Vol. 10, N 5. - P. 584. - DOI: 10.3390/nu10050584.
- Maret W. Zinc biochemistry: from a single zinc enzyme to a key element of life // Biofactors. - 2013. - Vol. 40, N 1. - P. 27-40. - DOI: 10.1002/biof.1114.
- Мазо В.К., Гмошинский И.В., Ширина Л.И. Новые пищевые источники эссенциальных микро-элементов-антиоксидантов. - М.: Миклош, 2009. - 208 с.
- MeyerM. Processing of collagen based biomaterials and the resulting materials properties // Biomedical Engineering Online. - 2019. - Vol. 18, N 1. - P. 24.
- Wang Y. [et al.]. Advanced functional biocomposites based on collagen nanofibers for high-quality leather processing: a review // Journal of Science: Advanced Materials and Devices. - 2021. - Vol. 6, N 2. -P.153-166.
- Shoulders M.D., Raines R.T. Collagen structure and stability // Annual Review of Biochemistry. -2009. - Vol. 78. - P. 929-958.
- Heino J. The collagen family members as cell adhesion proteins // Bioessays. - 2007. - Vol. 29, N 10. - P.1001-1010.
- Sklenarova R. [et al.]. Collagen as a biomaterial for skin and cornea wound healing // Journal of Functional Biomaterials. - 2022. - Vol. 13, N 4. - P. 249.
- Metzmacher I. [et al.]. In vitro binding of matrix metalloproteinase-2 (MMP-2), MMP-9, and bacterial collagenase on collagen wound dressings // Wound Repair and Regeneration. - 2007. - Vol. 15, N 4. -P.549-555.
- Schonfelder U. [et al.]. Influence of selected wound dressings on PMN elastase in chronic wound fluid and their antioxidative potential in vitro // Biomaterials. - 2005. - Vol. 26, N 33. - P. 6664-6673.
- Dhavalikar P., Maleckis K., Lorenz C. et al. Review of integrin-targeting biomaterials in tissue engineering // Advanced Healthcare Materials. - 2020. - Vol. 9, N 23. - P. 2000795.
- Ramachandran K.I., Deepa G., Namboori K. Computational chemistry and molecular modeling: principles and applications. - Springer Science & Business Media, 2008.
- Миронов А. Роль компьютерного моделирования в биохимических исследованиях // Журнал компьютерной химии. - 2015. - Т. 20, № 3. - С. 112-125.
- Трошина Е.А., Сенюшкина Е.С. Роль цинка в процессах синтеза и метаболизма гормонов щитовидной железы // КЭТ. - 2020. - № 3. - С. 25-30.
- Заикина И.В., Комлева Н.Е., Микеров А.Н. Роль витамина D, цинка и селена в развитии неинфекционных заболеваний (обзор литературы) // Гигиена и санитария. - 2021. - Т. 100, № 7. - С. 730-735.
- Жамсаранова С.Д., Лыгденов Д.В., Соколов Д.В. и др. Создание гипотетической компьютерной модели органических форм микроэлементов // Вестник ВСГУТУ. - 2019. - № 3 (74). - С. 26-34.
- Тарасова Л.В. Роль селена, цинка и марганца в патогенезе хронического гастрита и язвенной болезни двенадцатиперстной кишки // Медицинский альманах. - 2012. - № 2.
- Schwarz M. [et al.]. Crosstalk of Nrf2 with the trace elements selenium, iron, zinc, and copper // Nutrients. - 2019. - Vol. 11, N 9. - P. 2112.
- Pinzi L., Rastelli G. Molecular docking: shifting paradigms in drug discovery // International journal of molecular sciences. - 2019. - Vol. 20, N 18. - P. 4331.
- Ning C. et al. Efficient multivariate analysis algorithms for longitudinal genome-wide association studies // Bioinformatics. - 2019. - Vol. 35, N 23. - P. 4879-4885.
- Блатов В.А., Шевченко А.П., Пересыпкина Е.В. Полуэмпирические расчетные методы квантовой химии. - 2-е изд. - Самара: Универс-групп, 2005. - 32 с.
- Protein Data Bank. - URL: http://www.rcsb.org
- Ricard-Blum S. The collagen family // Cold Spring Harbor Perspectives in Biology. - 2011. - Vol. 3, N 1. - P. a004978. - DOI: 10.1101/cshperspect.a004978.
- Sahi P.K., Giri D.K., Singh R. et al. Selenium nanoparticles as a potential agent for treating inflammatory bowel diseases // Journal of Biomedical Materials Research Part A. - 2019. - Vol. 107, N 1. - P. 202215. - DOI: 10.1002/jbm.a.36533.


