Компьютерное моделирование потока крови при наличии сосудистых патологий
Автор: Трегубов В.П., Жуков Н.К.
Журнал: Российский журнал биомеханики @journal-biomech
Статья в выпуске: 2 (76) т.21, 2017 года.
Бесплатный доступ
Патологические изменения в кровеносных сосудах очень часто являются причиной таких тяжелых случаев, как инсульт, инфаркт миокарда, легочная эмболия и т.д. Современные неинвазивные методы диагностики не позволяют определить необходимые количественные характеристики измененного потока крови. Некоторые параметры может установить зондовая диагностика, но она вносит в характеристики потока существенные искажения. В этой ситуации все больше возрастает роль компьютерных моделей, которые позволяют не только установить качественные изменения пульсирующего потока, но и получить его количественные характеристики. В связи с этим и была поставлена задача компьютерного моделирования течения крови в зонах патологических изменений кровеносных сосудов. Для моделирования крови была выбрана степенная модель неньютоновской жидкости, которая в целом ряде публикаций признана как в большей степени отражающая реологические свойства крови. Пульсовый характер изменения поля скоростей на входе в рассматриваемые участки сосудов представлен в виде части параболоида вращения, высота которой изменяется в соответствии с пульсовым режимом потока. Более того, для учета физико-химического взаимодействия клеток крови со стенкой сосуда в качестве граничного условия предлагается использовать так называемый режим полупроскальзывания. В качестве объектов моделирования были выбраны четыре вида сосудистых патологий: мешотчатая аневризма, фузиформная аневризма, стеноз и бляшка. Их геометрические модели были построены при помощи пакета ABAQUS с использованием инструментов «фигура вращения» ( revolved solid ) и «фигура выдавливания» ( extruded solid ). Расчет количественных характеристик течения крови методом конечных элементов и визуализация результатов также выполнялись в системе ABAQUS. В результате были получены распределения давления и скорости течения крови с шагом по времени 0,01 с в каждом узле вычислительной сетки. В качестве примеров на рисунках приведены наиболее интересные моменты распределения давления в зонах патологий, а также образования вихря в аневризме.
Компьютерное моделирование, поток крови, неньютоновская жидкость, стеноз, аневризма, бляшка
Короткий адрес: https://sciup.org/146216238
IDR: 146216238 | УДК: 531/534:
Текст научной статьи Компьютерное моделирование потока крови при наличии сосудистых патологий
В настоящее время методы компьютерного моделиро в ания широко используются в исследованиях процесса гемодинамики [3]. Основная трудност ь при этом состоит в сложной внутренней структуре к р ови, а также в сложной структуре пульсирующего потока крови в артериях. Как известно, кровь состоит из плазмы, содержащей 93 % воды, и клеток крови (форменных элементов) – эритроцитов, лейкоцитов, тромбоцитов и моноцитов. Строго говоря, кровь представляет собой двухфазную среду, при этом она включает в себя деформируемые частицы со сложной внутренней структурой, механические свойства которых, к сожалению , мало изучены. Это не позволяет использовать известные модели двухфазных сред, и отдельные попытки описания крови как двухфазной среды содержали значительные упрощения [13, 20]. Наибольший относительный объем в составе крови составляют эритроциты (около 46 %), которые в значительной степени влияют на свойства крови и на структуру потока. В частности, эритроциты ми г рируют по поперечному сечению, смещаясь ближе к оси сосуда. Тромбоциты, напротив, смещаются к стенке сосуда. Кроме того, эритроциты могут образовывать временные агрегаты в виде так называемых «монетных столбиков» (рис. 1), что та к же изменяет структуру потока и его свойства [18]. Особое внимание этому эффекту было уделено в р аботе [4]. Это обстоятельство свидетельствует о том, что кровь можно, хотя и с оговорками, рассматривать как жидкость тол ь ко в тех сосудах, диаметр ко т орых намного больше не только самих клеток, но и их а грегатов, причем жидкость должна обладать неньютоновскими свойствами, чтобы учесть, хотя бы частично, специфические свойства крови. Влияние неньютоновских с в ойств к рови исследовалось, в частности, в работе [11]. В работе [7] проводилось численное исследование неньютоновского потока крови в зоне бифуркации. На н еньютоновские свойства крови обращалось внимание и при моделировании течения крови в зонах сосудистых патологий. Так, в [8] анализировалось влияние неньютоновской вязкости на поток крови в больных артериях, однако лишь для стационарного случая. В работе [19] исследовалось взаимодействие неньютоновского потока с пористой бляшкой.
Следует, однако, отметить, что для неньютоновских жидкостей существует около двух десятков конкретных моделей, в которых формулируется соответству ю щий закон, связывающий тензор напряжений с тензором скоростей деформации. Поэтому адекватность модели в сильной степени зависит от выбора этого закона.
Наиболее полный обзор работ, посвященных различным аспектам моделирования, приводится в работе [5].

Рис. 1. Образование «мо н етных столбиков»
Что касается кровеносных сосудов, то следует отметить, что их механические свойства варьируются в широких пределах. В частности, стенки аорты являются достаточно жесткими и их можно считать недеформируемыми [14, 21]. По мере удаления от сердца стенки сосудов становятся все более мягкими и их деформируемость увеличивается. Однако для некоторых сосудов при решении ряда задач все еще сохраняется возможность не учитывать их деформируемость [10, 12, 15, 16]. В противном случае приходится прибегать к гидроупругой постановке задачи [22].
С учетом вышесказанного целью представленной работы было построить математическую модель течения крови в окрестностях сосудистых патологий, которая учитывала бы в должной мере неньютоновские свойства крови, пульсовый характер ее течения и специфику взаимодействия плазмы и клеток крови со стенкой сосуда.
Модели потока крови и сосудистых патологий
В качестве объектов моделирования были выбраны четыре вида сосудистых патологий: мешотчатая аневризма, фузиформная аневризма, стеноз и бляшка. Как и в приведенных выше работах, стенки сосудов считались недеформируемыми.
Кровь рассматривалась как неньютоновская жидкость, для которой уравнение неразрывности и уравнение движения можно записать следующим образом div v = 0, (1)
P — = V- ( - p I + T ), (2)
dt где v – скорость жидкости; ρ – плотность; p – давление; I – единичный тензор и T – тензор напряжений.
В качестве конкретного реологического соотношения был выбран степенной закон зависимости тензора напряжений от тензора скоростей деформаций, а именно
Г n - 1 )
T = 2 k\T 2 |lJ D , (3)
где I 2 – второй главный инвариант тензора напряжений; k и n – кэффициенты ( n > 1), являющиеся параметрами модели; D – тензор скоростей деформации. Этот закон примечателен тем, что он способен описывать реологические свойства не только жидкостей, но и суспензий.
В качестве начальных условий для решения уравнений (1) и (2) при выполнении соотношения (3) выбирается состояние покоя при постоянном давлении, т.е.
v t = 0 = 0 и p\t = 0 = p 0 - (4)
После того как процесс вычислений интересующих нас величин запускается, он продолжается до достижения устойчивого режима.
Для задания граничного условия на входе в рассматриваемый участок артерии было предложено задавать пульсирующее распределение скорости по поперечному сечению в виде части параболоида вращения (рис. 2). Высота этой части параболоида меняется во времени от нуля до максимального значения v max так, чтобы суммарный поток крови через это поперечное сечение в каждый момент времени был равен потоку, определяемому при клиническом обследовании пациента,
В цилиндрической системе координат r , φ, z это граничное условие можно записать следующим образом:
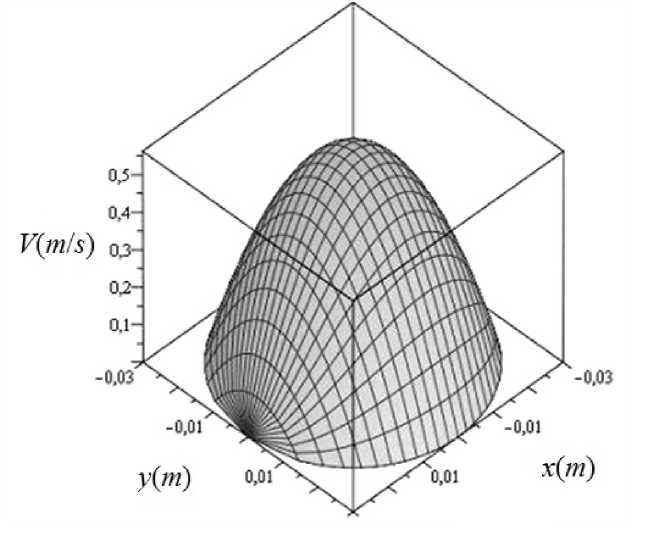
Рис. 2. Пространственное распределение скорости на входе r2
v ( М ) вх = - v max ( t ) ( 2 + 1), (5)
r 0
где r 0 – радиус сосуда.
Для задания граничного условия на противоположном конце используется известный прием. Выходное поперечное сечение мысленно располагается настолько далеко, чтобы скорость и давление на нем были постоянными.
v | вых = v cp = const и p\ вых = P 0 = const, (6)
где p 0 – средняя скорость потока.
Во-первых, такой подход оправдан, поскольку пульсовой характер течения ослабевает по мере удаления от сердца. Во-вторых, в этом случае не происходит «навязывания» характера распределения скорости и давления на реальном конце рассматриваемого участка.
При определении граничного условия на стенке сосуда следует отметить, что необходимо учитывать взаимодействие со стенкой не только плазмы крови, но и содержащихся в ней клеток крови. Известно, что стенка сосуда изнутри выстлана однослойным пластом из клеток эндотелия, через который осуществляются обменные процессы. Этот слой и препятствует оседанию доминирующих в пристенном слое тромбоцитов на стенках сосудов, а тромбы образуются в местах разрушения эндотелия. В противном случае упомянутые обменные процессы были бы блокированы, тромбоциты образовали бы сплошной слой нарастающей толщины. В результате жизнь новорожденного продолжалась бы несколько часов.
Сомнения в справедливости условий прилипания для кровеносных сосудов высказывались еще С.А. Регирером и его коллегами [1, 2]. В работе [6] условия полупроскальзывания также предлагается использовать в качестве граничного условия при моделировании потока крови. Следует также отметить, что это граничное условие применяется и для других случаев течения жидкостей [9, 23], в том числе идеальных
[17, 24, 25].
Существует несколько видов аналитического задания условия частичного проскальзывания. Мы использовали линейный случай такого задания:
v wall
dv
= b dy
В этом случае продольная составляющая скорости уменьшается при приближении к стенке сосуда до некоторого наперед заданного значения v0 (рис. 3), которое и является граничным условием на стенке, т.е.
v ( r0 , Ф, t ) = v 0 •
Степень полупроскальзывания характеризуют параметром b , который является расстоянием от стенки до точки пересечения касательной к огибающей линии профиля скорости с осью y , как показано на рис. 3.
Таким образом, система дифференциальных уравнений (1) и (2) с учетом соотношения (3) в сочетании с начальными (4) и граничными условиями (5), (6) составляет математическую постановку задачи о течении пульсирующего потока крови.
Для построения механических моделей перечисленных выше сосудистых патологий использовался программный пакет ABAQUS , схема работы которого приведена на рис. 4. Он позволяет создавать сложную геометрию сосудов без использования сторонних систем автоматизированного проектирования продуктов. Для этого сначала были созданы вспомогательные элементы: сфера и цилиндр с помощью инструментов «фигура вращения» ( revolved solid ) и «фигура выдавливания» ( extruded solid ). К полученным объектам была применена операция сложения, а затем на стыке – операция сглаживания. В результате были получены геометрические модели мешотчатой и фузиформной аневризмы, стеноза и атеросклеротической бляшки, на которые затем накладывались объемные вычислительные сетки.
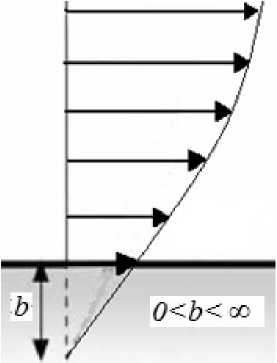
Рис. 3. Профиль скорости при режиме полупроскальзывания на стенке сосуда
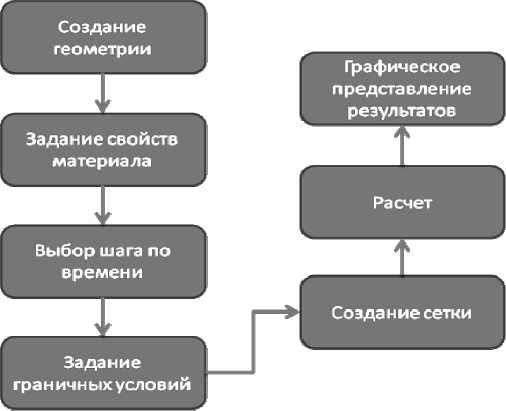
Рис. 4. Схема работы пакета ABAQUS
Результаты расчета и их анализ
Численный расчет течения крови, определяемого уравнениями (1) и (2), осуществлялся методом конечных элементов с использованием упомянутого выше пакета ABAQUS . Для этого предварительно задавались реологические с войства крови, определенные соотношением (3), начальные условия (4) и граничные условия по формулам (5)–(7).
В результате проведенных расчетов были получены распределения скорости и давления в каждом узле вычислительной сетки с шагом по времени 0,01 с в течение одного пульсового периода. Наиболее интересные результаты были получены в м о мент времени t = 0,5 с, который соответствует максимальному значению потока крови.
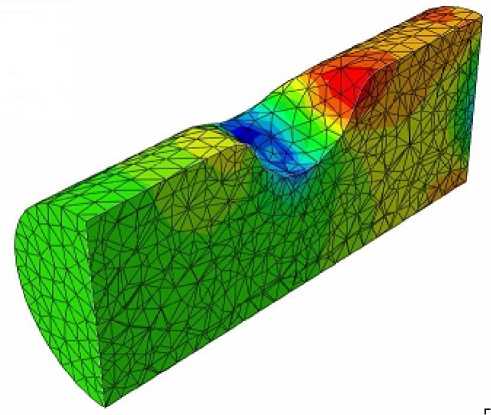
В частности, в стенозированном сосуде и н терес представляет распределение давления в потоке крови (рис. 5, a ). Перед зоной сужения оно повышается до максимального значения, падает в зоне сужения и достигает минимального значения перед расширением. После выхода из зоны сужения появляется зона незначительного повышения давления, соответствующая пульсово м у режиму, что свидетельствует об ослаблении пульсового характера потока.
При наличии бляшки распределение давления более сложное и не с толь ожидаемое, как в зоне стеноза (рис. 5, б ). Давление возрастает в небольшой зоне потока перед бляшкой, потом падает при огибании бляшки до минимума и возрастает до средних значений после ее огибания.
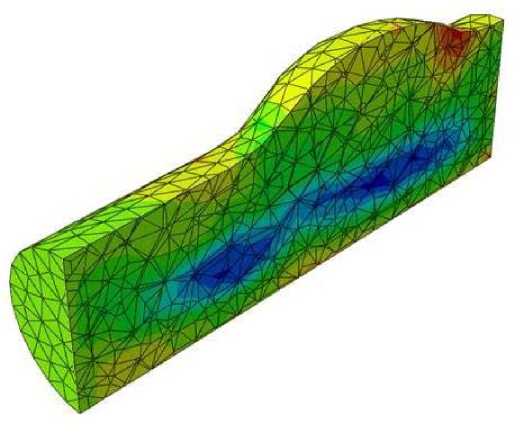
При моделировании потока в зоне фузиформной аневризмы обнаружено появление области пониженного давления под осевой линией сосуда (рис. 5 , в ). В случае мешотчатой аневризмы наблюдается вихрь, занимающий всю об л асть патологии (рис. 6). Его зарождение начинается в момент времени, равный 0,3 с, что соответствуетмоменту смены знака производной функции потока на входе в артерию. Вихрь развивается в течение 0,2 с и затем исчезает. Кроме того, в пристеночном слое возникают кратковременные обратные токи крови. Внутри самой аневризмы наблюдается повышенное давление, что само по себе вполне ожидаемо (рис. 5, г ). Однако наличие небольших зон пониженного давления до и после бляшки свидетельствует о весьма опасном перепаде давления по сравнению с остал ь ным сосудом, что в реальности может привести к прорыву его стенки.
а
б
в
Рис. 5. Распределение давления в области стеноза ( а ), бляшки ( б ), мешотчатой аневризмы ( в ), фузиформной аневризмы ( д ) при t = 0,5 с
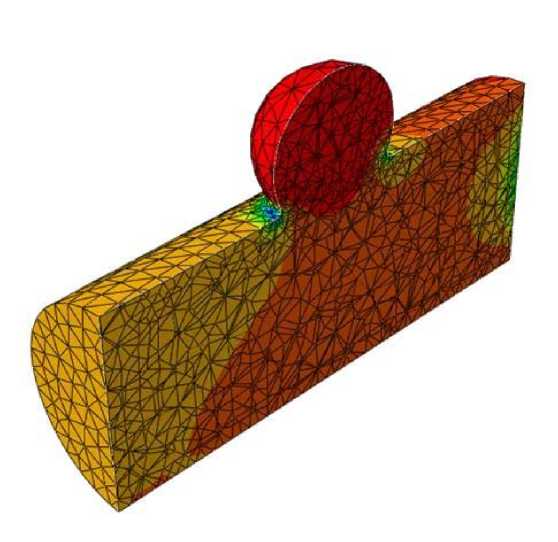
д
Рис. 5. Окончание
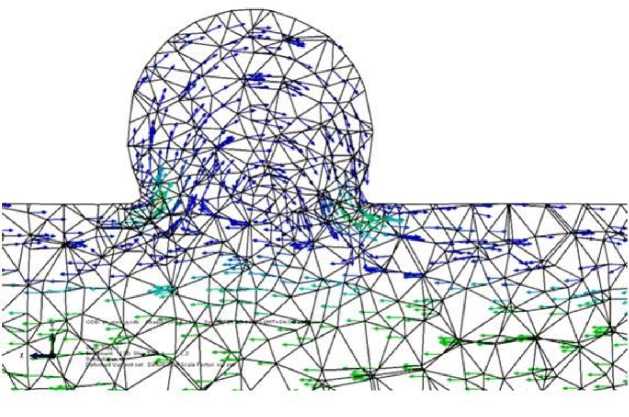
Рис. 6. Наличие вихря в зоне мешотчатой аневризмы
Заключение
Таким образом, разработанная математическая модель течения крови в окрестностях сосудистых патологий позволяет получить более адекватное представление о характере течения крови за счет учета ее неньютоновских свойств, предложенного способа задания пульсового режима и использования режима полупроскальзывания при взаимодействии крови со стенкой сосуда. Следует отметить, что в приведенных рисунках представлено только несколько частных примеров полученных результатов в отдельные моменты времени, иллюстрирующих работу предложенной модели в условиях нескольких видов сосудистой патологии. Несмотря на идеализированные формы патологий, модели дают не только качественное представление о характере течения, но и позволяют получить количественные характеристики потока. При этом они предполагают возможность изменения геометрических форм патологий, приближая их к реальным формам конкретных пациентов, полученных при их обследовании.
Список литературы Компьютерное моделирование потока крови при наличии сосудистых патологий
- Регирер С.А. О моделях биологических сплошных сред//Прикладная математика и механика. -1982. -Т. 46, № 4. -С. 531-542.
- Регирер С.А., Левтов В.А., Шадрина Н.Х. Реология крови. -М.: Медицина, 1982. -272 с.
- Скобцов Ю.А., Родин Ю.В., Оверко В.С. Моделирование и визуализация поведения потоков крови при патологических процессах. -Донецк, 2008. -212 с.
- Baskurt O.K., Meiselman H.J. Blood rheology and haemodynamics//Seminars in thrombosis and hemostasis. -2003. -Vol. 29, № 5. -P. 435-445.
- Bessonov N., Sequeira A., Simakov S.,Vassilevskji Yu., Volpert V. Methods of blood flow modelling//Mathematical modelling of natural phenomena. -2016. -Vol. 11, № 1. -P. 1-25.
- Buick J.M., Cosgrove J.A., Tonge S.J., Mulholland A.J., Steves B.A., Collins M.W. The Lattice Bolzmann equation for modelling arterial flows: review and application.//Proceedings of the 4th International congress on progress in bioengineering and the vascular endothelium basic and clinical aspects. -Pisa-San Romano, Italy, 2002.
- Chen J., Lu X.-Y. Numerical investigation of the non-Newtonian blood flow in a bifurcation model with non-planar branch//Journal of Biomechanics. -2004. -Vol. 37, № 12. -P. 1899-1911.
- Cho Y.I., Kensey K.R. Effects of the non-Newtonian viscosity of blood on flows in a diseased arterial vessel. Part 1: Steady flows//Biorheology. -1991. -Vol. 28. -P. 241-262.
- Craig V.C.J., Neto C., Williams D.R.M. Shear-dependent boundary slip in an aqueous Newtonian fluid//Physical Review Letters. -2001. -Vol. 87, № 5. -P. 1-4.
- Fung Y.C. Biomechanics circulation. -New York, 1997. -572 p.
- Gijsen F.J.H., Allanic E., Van De Vosse F.N., Janssen J.D. The influence of the non-Newtonian properties of blood on the flow in large arteries: unsteady flow in a 900 curved tube//Journal of Biomechanics. -1999. -Vol. 32. -P. 705-713.
- Hoogstraten H.W., Kootstra J.G., Hillen B., Krijger J.K.B., Wensing P.J.W. Numerical simulation of blood flow in an artery with two successive bends//Journal of Biomechanics. -1996. -Vol. 29, №8. -P. 1075-1083.
- Jung J., Lyczkowski R.W., Panchal C.B., Hassanein A. Multiphase haemodynamic simulation of pulsative flow in a coronary artery//Journal of Biomechanics. -2006. -Vol. 39, № 20. -P. 64-73.
- Numata S., Itatani K., Kanda K., Doi K., Yamazaki S., Morimoto K., Manabe K., Ikemoto K., Yaku H. Blood flow analysis of the aortic arch using computational fluid dynamics//European Journal of Cardio-Thoracic Surgery. -2016. -Vol. 49, № 6. -P. 1-8.
- Papaharilaou Y., Doorly D.J., Sherwin S.J. The influence of out-in-plane geometry on pulsative flow within a distal end-to-side anastomosis//Journal of Biomechanics. -2002. -Vol. 35, № 9. -P. 1225-1239.
- Ravensbergen J., Krijger J.K.B., Hillen B., Hoogstraten H.W. The influence of the angle of confluence on the flow in a vertebro-basilar junction model//Journal of Biomechanics. -1996. -Vol. 29, № 3. -P. 281-299.
- Robertson I., Sherwina S.J., Graham J.M.R. Comparison of the wall boundary condition for numerical viscous free surface flow simulation. -UK: Elsevier Science, 2004. -31 p.
- Schmid-Schonbein H. Rheological properties of human erythrocytes and their influence upon anomalous viscosity of blood//Physiology Revew. -1971. -Vol. 63. -P. 147-219.
- Shojaeizadeh M., Yeganegi A.R. Effects of the non-Newtonian viscosity of blood on flow field in a constricted artery with a porous plaque//Science and Engineering Investigations. -2015. -Vol. 14, № 38. -P. 15-18.
- Srivastava V.P. Two-phase model of blood flow through stenosed tubes in the presence of a peripheral layer: applications//Journal of Biomechanics. -1996. -Vol. 29, № 10. -P. 1377-1382.
- Tokuda Y., Song M.H., Ueda Y., Usui A., Akita T., Yoneyama S., Maruyama S. Three-dimensional numerical simulation of blood flow in the aortic arch during cardiopulmonary bypass//European Journal of Cardio-thoracic Surgery. -2008. -Vol. 33. -P. 164-167.
- Tregubov V. Mathematical modelling of biological fluid flows. Selected papers of the Int. Conf. on Computer Technologies in Physical and Engineering Applications. -Saint Petersburg, IEEE, 2014. -P. 193-194.
- Tretheway D.C., Zhu L., Petzold L., Meinhart C.D. Examination of the slip boundary condition by μ-PIV and lattice Bolzmann simulations//Proceedings of IMECE’ 2002. -New Orleans, Louisiana, USA, 2002. -P. 1-6.
- Yong Peng. Lattice Boltzmann simulation of enviromental flow problems in shallow water flows. -Ph.D. Thesis. Liverpool, 2012. -133 p.
- Zhou J.G. Lattice Boltzmann methods for shallow water flows. -Berlin, Heidelberg: Springer, 2004. -112 p.


