Комплексное фитобактериальное средство при экспериментальном токсическом гепатите на фоне дисбактериоза
Автор: Максарова Дарима Дамбаевна
Журнал: Вестник Бурятского государственного университета. Биология, география @vestnik-bsu-biology-geography
Статья в выпуске: 2, 2017 года.
Бесплатный доступ
В статье представлены результаты работы по исследованию эффективности комплексного фитобактериального средства в отношении подавления патогенной флоры толстого отдела кишечника бел^хх крыс и нормализации морфологического и функционального состояния печени при экспериментальном токсическом гепатите. Гепа- тозащитное действие, по-видимому, объясняется сочетанным действием биологически активных веществ, входящих в состав экстракта плодов шиповника, метаболической активностью бифидобактерий и сорбционными, каталитическими и антиокси- дантными свойствами природного цеолита. Предположительно, испытуемое комплексное средство реализует свое положительное влияние на морфологическое состояние, физиологическую функцию и биохимические реакции либо непосредственно участвуя в метаболизме клеток соответствующих органов и тканей, либо опосредовано, через регуляцию функционирования биоплёнок на слизистых организма.
Морфология животных, токсический гепатит, природные лекарственные средства
Короткий адрес: https://sciup.org/148316870
IDR: 148316870 | УДК: 591.43
Текст научной статьи Комплексное фитобактериальное средство при экспериментальном токсическом гепатите на фоне дисбактериоза
Введение. Дисбактериозы различной этиологии остаются важной медикосоциальной и экологической проблемой, согласно статистике около 90% россиян страдают заболеваниями органов системы пищеварения, которые характеризуются хронизацией и рецидивирующим течением [4]. Известно, что желудочнокишечная экосистема человека и животных рассматривается как одна из важных систем защиты организма. В физиологических условиях микрофлора, главным образом, анаэробные представители индигенной микрофлоры, обеспечивают колонизационную резистентность пищеварительного тракта — устойчивость к колонизации его слизистых оболочек условно патогенными или патогенными бактериями [5]. Природные, техногенные и другие экстремальные факторы негативно воздействуют на микрофлору организма и приводят к синдрому нарушений микроэкологии пищеварительного тракта — дисбактериозам [6].
Кишечную микрофлору можно характеризовать как индикаторный показатель благополучия организма, который реагирует на агенты, вызывающие нарушения гомеостаза [8].
Микрофлора кишечника — один из дезинтоксикационных факторов, осуществляющих защиту организма от токсических соединений посредством восстановительных процессов в кишечнике.
Результаты современных отечественных и зарубежных исследований указывают на значительную роль индигенной микрофлоры в патогенезе воспалительных заболеваний кишечника. Микрофлора ЖКТ состоит более чем из 1014 бактериальных клеток, что примерно в 10 раз больше количества соматических и гаметных клеток в теле человека [9]. Можно предположить, что такая высокая концентрация микрофлоры в просвете кишечника может служить причиной того, что многие микробные патогены могут быть потенциальным этиологическим фактором воспалительных заболеваний кишечника [1].
В патогенезе повреждений печени существенную роль играют эндотоксины кишечной микрофлоры, продукция которых существенно увеличивается при дисбиотических состояниях. Необходимый эффект достигается за счет бактериальных препаратов из представителей индигенной, или транзиторной микрофлоры, обладающих антагонистическим действием в отношении условнопатогенных бактерий, и стимулирующих неспецифическую резистентность и иммунитет макроорганизма[2].
Основываясь на том, что бифидобактерии относятся к категории биологически активных добавок, которые выполняют функции замещения и активации регенеративных процессов при патологических состояниях организма, применение их в терапии и профилактике заболеваний органов пищеварения, сопровождаемых нарушениями состава микрофлоры, представляется актуальным в ситуациях загрязнения окружающей среды ксенобиотиками. Перспективным является использование комплексного фитобактериального средства в профилактике и лечении дисбактериозов для нормализации кишечной микрофлоры, повышения иммунного статуса, улучшения общего состояния организма [3].
Цель исследования . Целью настоящего исследования явилось определение влияния комплексного фитобактериального средства в состав которого входят: чистая культурабифидобактерий на молочной основе В. longum 379M, природный цеолит, экстракт плодов шиповника на течение экспериментального токсического гепатита на фоне дисбактериоза кишечника.
Материал и методы исследований
Экспериментальные исследования с целью изучения влияния комплексного фитобактериального средства на морфофункциональные повреждения печени проводили на белых беспородных крысах обоего пола массой 180-220 г, полученных из питомника филиала № 5 ГНЦ «Институт биофизики федерального управления «Медбиоэкстрем» при Минздраве России г. Ангарск. Животные находились в стандартных условиях содержания вивария на обычном рационе кормления. Экспериментальные исследования осуществляли в соответствии с правовыми и этическими нормами при проведении научных исследований в области биологии, медицинских наук и экспериментальных работ в смежных областях в соответствии с действующим в Российской Федерации законодательством, нормативными документами и Международными стандартами по лабораторной практике (GoodLaboratoryPractice, GLP) и в соответствии с Европейской Конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях(Страсбург, 18 марта 1986 г.).
Штаммы бифидобактерий B. longum В 379 M получены из МНИИЭМ им. Г. Н. Габричевского (Москва).
Эксперименты по активизации и культивированию бифидобактерий проводили на основе обезжиренного стерильного коровьего молока.
Сухой экстракт плодов шиповника Rosa (ГФ XI, ст. 38) получен водным экстрагированием с последующим высушиванием и представлял собой легкорастворимый аморфный порошок коричневого цвета.
Цеолитсодержащая порода Холинского месторождения Бурятии по ТУ 2163002-12763074-97 представляла собой порошок серого цвета с размерами частиц 0,1-1,0 мм и содержанием клиноптилолита в среднем 55%.
Морфологию микроорганизмов содержимого толстого отдела кишечника белых крыс и чистой культуры бифидобактерий B.longum В 379 M изучали с помощью фазово-контрастной микроскопии. Препараты для световой микроскопии готовили по стандартной методике, окрашивали по Грамму и микрофотографи-ровали.
КФС вводили peros в дозе 1 мл/100 мг массы животных. В качестве препарата сравнения использовали кверцетин в изоэффективной дозе 50 мг/кг массы 1 раз в сутки. Контрольная группа животных получала дистиллированную воду в экви-объемном количестве.
Опыты по моделированию острого токсического гепатита проводили на белых беспородных крысах подкожным введением 50%-ного масляного раствора тетрахлорметана (CCl 4 ) (ГОСТ 20288-86) в объеме 0,4 мл/100 г массы крысы ежедневно в течение четырех дней, который разводили extempore в стерильном оливковом масле в соотношении 1:1.
Для оценки морфофункционального состояния печени при ее токсических повреждениях CCl 4 были выбраны следующие методы исследования: определение интенсивности перекисного окисления липидов (ПОЛ) — малонового диальдегида (МДА) в гомогенате ткани печени; сукцинатдегидрогеназы (СДГ) — в свежезамороженных срезах печени; патоморфологическое исследование печени.
Микрофотографирование гистологических препаратов проводили с использованием микроскопа «Carl Zeiss».
Определение состава микрофлоры кишечника крыс, патоморфологические исследования печени проводили на 7, 14, 21-е сутки при моделировании острого токсического гепатита. Микробиологические исследования содержимого толстого отдела кишечника белых крыс проводили методом предельных разведений посевом на элективные питательные среды: бифидобактерии выявляли на среде Блаурокк, лактобактерии на среде МРС-4, клостридии на среде Вильсон-Блера, кишечную палочку на среде Эндо, Плоскирева, Левина, стафилококки на желточно-солевом агаре, грибы рода Candida на среде Сабуро, энтерококки на среде Калины с последующим изучением биохимических свойств и морфологической характеристики выделенных микроорганизмов.
Статистическую обработку полученных экспериментальных и клинических данных проводили методами вариационной статистики с использованием критериев Стьюдента. Различия между средними величинами считали статистически достоверными при Р≤0,05. Компьютерную обработку экспериментальных данных проводили с использованием программ «Microsoft Office Excel 7.0».
Результаты исследований и их обсуждение
КФС готовили на стерильном обезжиренном коровьем молоке с использованием активизированной чистой культуры бифидобактерий шт. B. longum B 379 M , сухого экстракта плодов шиповника Rosa (ГФ XI, ст.38) (в экстракте из плодов шиповника аскорбиновой кислоты не менее 0,2%) и природным цеолитом (ПЦ)Холинского месторождения (клиноптилолит) фракцией 0,1-1,0 мм (ТУ 2163002-12763074-97). Содержание клеток бифидобактерий в готовом средстве 8-9 lg КОЕ/см3.
При исследовании возможности культивирования бифидобактерий на молочной основе с экстрактом плодов шиповника и ПЦ выявлено ускорение роста бифидобактерий с повышением их кислотообразующей способности.
Характерная для бифидобактерий штамма B.longum B379M микроскопическая картина свидетельствует о том, что условия культивирования, состав питательной среды в МФС отвечают требованиям нормального роста бифидобактерий в молоке.
В процессе приготовления бифидосодержащих средств на молочной основе самым важным свойством бактерий считают их быстрый рост и способность сквашивать молоко.
Известно, что бифидобактерии (облигатные анаэробы) почти не растут в молоке, в отличие от молочнокислых бактерий. Развитие бифидобактерий может зависеть от особых веществ, так называемых бифидус-факторов, которые практически отсутствуют в коровьем молоке. Химические исследования показали, что бифидус-факторы представляют собой смесь близких по составу олигосахаридов.
В настоящее время существует несколько направлений для получения олигос-ахаридов-промоторов (стимуляторов роста) для бифидобактерий. Одним из таких направлений является выделение олигосахаридов из растительного сырья. Стимулирующее действие олигосахаридов объясняется тем, что они играют важную роль в синтезе пептидогликана клеточных стенок бифидибактерий.
Гепатопротекторное действие МФС показано на экспериментальных моделях в условиях острого токсического поражения печени белых крыс CCl 4 .
По патогистологических исследованиях в печени животных на 7-е сутки после введения CCl 4 выявлены структурные изменения, которые сводятся к гемодинамическим нарушениям в виде полнокровия междольковых кровеносных сосудов, расширения центральных вен, утолщения стенок вен с миграцией клеток крови в паренхиму органа, развитием периваскулярного отека и расширениемпе-риваскулярного пространства, также выраженными морфологическими изменениями в форме жировой дистрофии.
В ранние сроки исследования внекротических очагахи вокруг патологически измененных зон отмечено снижение активности сукцинатдегидрогеназы (рис. 1).
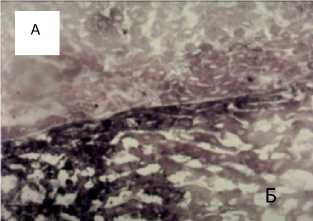
Рис. 1. Острый токсический гепатит, 7-е сутки. Гистопрепарат печени белой крысы. Снижение активности сукцинатдегидрогеназы (А) по сравнению с интактом (В). Окраска по Нахласу. Увел. 10 х 10.
В паренхиме печени в различной степени отмечается выраженная клеточная инфильтрация. Острый процесс повреждения печени CCl 4 протекает посредством пролиферативноинфильтрационных реакций с образованием в портальных и перипортальных зонах инфильтратов по ходу кровеносных сосудов и внутри долек печени.
В печени животных на 7-е сутки (контрольная группа) выявлены резкие структурные изменения в виде периваскулярного отёка с очагами некроза. Морфологические повреждения носят характер жировой дистрофии: мелкокапельной и среднекапельной, также отмечена клеточная инфильтрация. Для данного срока исследований характерны гемодинамические нарушения в печени.
На 14-е сутки опыта в контрольной группе животных отмеченные нарушения продолжают сохраняться. Кроме того, выявлена деструкция стенок кровеносных сосудов, краевое стояние лейкоцитов около стенок сосудов с миграцией клеточных элементов в паренхиму печени. Выявлены гепатоциты с боковым расположением ядра, увеличенные в размерах. Выражена клеточная инфильтрация внутри долек по ходу сосудов (рис. 2).
В паренхиме печени опытной группы животных обнаруживали очаги некроза, локализованные преимущественно в центролобулярных зонах.
На фоне введения КФС в группе опытных животных в печени слабее выражены признаки токсического гепатита, в частности, жировая и клеточная инфильтрация, сопутствующие гемодинамические нарушения. На 7-е сутки введения фи-тобактериального средства в паренхиме органа отмечены гипертрофированные двуядерные гепатоциты и клетки Купфера. Тем не менее, в большинстве случаев отсутствовали выраженные аль-
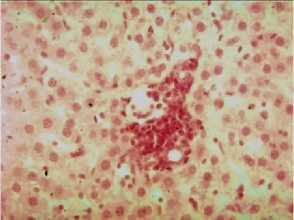
Рис. 2. Острый токсический гепатит, 14-е сутки. Контрольная группа. Гистопрепарат печени белой крысы. Выраженная клеточная инфильтрация внутри долек по ходу сосудов и желчному протоку. Окраска гематоксилином и эозином. Увел. 10 х 20
теративные изменения, отмечалась сохранность структуры долек и балок печени.
На 14-е сутки опытов у животных, получавших КФС, гемодинамические нарушения и морфологические изменения в печени были выражены в меньшей степени, чем у контрольной группы животных. Центролобулярные очаги некроза не наблюдались, хотя гепатоциты, заполнившие их, еще не приблизились к норме. Об активности регенераторных процессов судили по выявлению крупных темноокрашенных гепатоцитов с гипохромными ядрами, также по частоте митозов и увеличению количества двуядерных гепатоцитов.
Клеточная инфильтрация по ходу сосудов, внутри долек менее выражена. В инфильтратах преобладали лимфоцитарные и макрофагальные элементы.
У животных, получавших КФС на 21-сутки — быстрее нормализовались гемодинамические нарушения, отечный процесс, значительно раньше, по сравнению с контрольной группой, происходило замещение некротических очагов в центре долек печени вновь образованными гепатоцитами, а также за счет гипертрофии печеночных клеток, не подвергавшихся альтеративным изменениям.
Во все сроки исследования — 7-е, 14-е, 21-е сутки — вышеописанные признаки регенерации выявляли в печени опытной группы животных, получавших КФС гораздо чаще, чем у животных контрольной группы.
В экспериментальных исследованиях на модели острого гепатита выявлена способность КФС подавлять процессы цитолиза, нормализовать метаболизм в поврежденных клетках печени. Гепатопротекторное действие КФС сочетается с гиполипидемическим эффектом, тем самым предупреждая развитие дегенеративных процессов жировой дистрофии, перерождение клеток печени и возникновение фиброза.
Назначение исследуемого средства привело к торможению свободнорадикальных реакций в биологических мембранах гепатоцитов. Скорость накопления МДА к 7 суткам развития токсического гепатита снижалась под действием фито-бактериального средства в 2,4 раза. Регуляция интенсивности ПОЛ испытуемым средством уменьшала проницаемость сосудов и стабилизировала клеточные мембраны гепатоцитов, о чем свидетельствовало снижение активности АлАТ под действием КФС на 61%. Активность щелочной фосфатазы в сыворотке крови при введении КФС снижалась почти в 2 раза, содержание общего билирубина также в значительной степени снижалось.
К 14-м суткам моделирования острого токсического гепатита и экспериментальных исследований у белых крыс испытуемое средство также оказывало благоприятное воздействие. Активность щелочной фосфатазы в сыворотке крови при введении КФС снижалась на 38%. Концентрация гликогена возрастала, по сравнению с показателями в контроле, в 1,5 раза.
К 21-м суткам эксперимента при введении КФС у животных с экспериментальным гепатитом в значительной степени тормозился процесс ПОЛ: содержание МДА в печени снижалось под действием КФС в 1,8 раза. Также стимулировались процессы синтеза гликогена в ткани печени.
При микробиологическом исследовании содержимого толстого отдела кишечника белых крыс отмечали, что КФС оказывало положительное действие на состав микрофлоры толстого отдела кишечника (табл. 1).
Так, повышался титр бифидобактерий и лактобацилл, снижалось количество энтерококков, стафилококков, клостридий, грибов рода Кандида, снижалось число бактерий с ослабленными свойствами.
Таблица 1
Воздействие комплексного фитобактериального средства при остром токсическом гепатите на состав микрофлоры кишечника белых крыс (М±m, n=6) lgKOE/см3
|
Группы бактерий |
Интактная группа (Н 2 О) |
Контрольная группа |
Опытные группы, получавшие КФС |
||
|
7 сутки |
14 сутки |
21 сутки |
|||
|
Bifidobacteriumsp. |
7,26±0,39 |
4,71±0,32* |
5,84 ±0,22 |
6,08 ±0,31** |
6,63 ±0,26** |
|
Lactobacillussp. |
6,07±0,29 |
4,30±0,18* |
4,39 ±0,26 |
4,92 ±0,17 |
5,53 ±0,24** |
|
Clostridiumsp. |
1,48±0,13 |
3,62±0,19* |
2,83 ±0,20** |
2,53 ±0,14** |
2,00 ±0,16** |
|
E.coli |
5,31±0,23 |
5,58±0,26 |
5,44 ±0,16 |
5,53 ±0,18 |
5,64 ±0,14 |
|
Enterococcussp. |
4,35±0,20 |
6,63±0,25* |
6,21 ±0,23 |
4,93 ±0,22** |
4,09 ±0,21** |
|
Staphylococcus |
3,16±0,15 |
5,00±0,18* |
4,77 ±0,21 |
4,58 ±0,17 |
4,31 ±0,18 ** |
|
Candidasp. |
1,29±0,10 |
3,64±0,18* |
3,23 ±0,14 |
3,08 ±0,22 |
2,63 ±0,18** |
Примечание: * — данные достоверны по сравнению с интактной группой при Р≤ 0,05;** — данные достоверны по сравнению с контрольной группой при Р≤ 0,05.
Положительный эффект КФС на организм проявлялся через нормализацию микрофлоры толстого отдела кишечника за счет увеличения количества представителей индигенной микрофлоры, в результате синтеза витаминов и других ростстимулирующих факторов, нормализации кислотности, нейтрализации токсинов, изменения микробного метаболизма.
При гепатите развиваются нарушения микрофлоры кишечника, и, как следствие, увеличивается продукция эндотоксинов кишечной микрофлорой. При применении КФС, нормализующего состав кишечной микрофлоры, отмечена положительная динамика функционального состояния печени при ее токсическом повреждении. Как реагирует состав микрофлоры, мы рассмотрим ниже.
Микроорганизмы, населяющие кишечник, являются очень лабильной системой, тонко реагирующей на изменения гомеостаза макроорганизма. При интоксикации СС1 4 , наряду с повреждением печени, отмечаются дисбиотические изменения микрофлоры толстого отдела кишечника. Поэтому функциональное состояние печени при введениитоксикантаСС1 4 отражается и на состоянии микрофлоры кишечника.
Характерно, что возникшие дисбиотические изменения наблюдаются во всех исследуемых группах микроорганизмов, — это проявляется в снижении содержания штатных анаэробов — бифидобактерий, лактобацилл, и в повышении количества клостридий, энтерококков, стафилококков, грибов рода Кандида, кишечной палочки за счет форм со сниженной ферментативной активностью и лактозонегативных форм (5%).
Курсовое введение модифицированного фитобактериального средства снижает дисбиотические явления, наблюдаемые в толстом отделе кишечника экспериментальных животных на фоне токсического гепатита. Позитивные изменения отмечаются уже на 7-е сутки эксперимента: повышается содержание бифидобактерий, лактобактерий в опытной группе, на фоне введения КФС. Под воздействием фитобактериального средства уменьшается количество стафилококков, снижается уровень клостридий, Е. coli.На фоне применения КФС количество лактозоположительных форм кишечной палочки от их общего количества составляет 85%, со сниженной ферментативной активностью — 15%. Подобная тенденция сохраняется на 14-е сутки опыта.
Заключение
Выявленная в наших экспериментах эффективность модифицированного фи-тобактериального средства в отношении подавления патогенной флоры, по-видимому, объясняется сочетанным действием биологически активных веществ, входящих в состав экстракта плодов шиповника, метаболической активностью бифидобактерий и сорбционными, каталитическими и антиоксидантными свойствами природного цеолита.
Предположительно, испытуемое комплексное средство КФС реализует свое положительное влияние на морфологическое состояние, физиологическую функцию и биохимические реакции либо непосредственно участвуя в метаболизме клеток соответствующих органов и тканей, либо опосредовано, через регуляцию функционирования биоплёнок на слизистых организма.
Таким образом, можно предположить, что под действием исследуемого средства происходит нормализация морфофункционального состояния печени и восстановление микрофлоры толстого отдела кишечника белых крыс при экспериментальном остром токсическом гепатите. Возникшие морфофункциональные изменения обратимы, а коррекция их возможна, в частности, при применении комплексного фитобактериального средства.
Список литературы Комплексное фитобактериальное средство при экспериментальном токсическом гепатите на фоне дисбактериоза
- Ипатова М. Г. Роль индигенной микрофлоры при воспалительных заболеваниях кишечника у детей: дис. … канд. мед.наук. М., 2010. 141 с.
- Никулина И. В. Клинико-эпидемиологическая характеристика воспалительных заболеваний кишечника в Московской области: дис. … канд. мед. наук. М., 1997. 24 с.
- Постникова Е. А., Пикина А. П., Кафарская Л. И., Ефимов Б. А. Изучение качественного и количественного состава микрофлоры кишечника у клинически здоровых детей в раннем возрасте // Журнал микробиологии, эпидемиологии и иммунобиологии. 2004. № 1. С. 62-67.
- Рачкова Н. С., Хавкин А. И. Воспалительные заболевания кишечника. Проблемы дифференциальной диагностики и лечения // Детская гастроэнтерология и нутрициология. 2006. Т. 14, № 3. С. 154-159.
- Рот М., Бернхардт В. Воспалительные заболевания кишечника / Др. Фальк Фар-маГмбх // Практическое руководство. 2004. С. 39-43.
- Пинегин Б. В., Мальцев В. Н., Коршунов В. М. Дисбактериозы кишечника. М.: Медицина, 1984. 143 с.
- Якушенко М. Н., Тхапсогоева Ж. М., Бондаренко В. М. Регуляция микроэкологических нарушений кишечника новорожденных детей с перинатальной патологией новым пробиотиком «Бифидумбактерином форте» // ЖМЭИ. 1997. № 6. С. 18-22.
- Aby-Tarabosh Н.М., Al-Dagal М.М., Al-Royli М. А. Growth Viability and proteolitic activity of bifido, acterif in whole camel milk / J. Dairy Sci. 1998. У.81, № 2. P. 354-361.
- Backhed F., Ley R. E., Sonnenburg J. L., Peterson D. A., Gordon J. I. (2005) Host- bacterial mutualism in the human intestine // Science. 1915-1920. 307.


