Концентрационные эффекты при нуклеофильном присоединении циклических третичных аминов к кислотам акрилового ряда в водных растворах
Автор: Казанцев Олег Анатольевич, Барута Дарья Сергеевна, Ширшин Константин Константинович, Каморин Денис Михайлович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 2 т.8, 2016 года.
Бесплатный доступ
Определен вид зависимостей начальных скоростей и равновесных конверсий в реакциях нуклеофильного присоединения циклических третичных аминов (1,4-диазабицикло-[2,2,2]октана, пиридина, N-метилпиперидина) к кислотам акрилового ряда (акриловой кислоте, N-акрилоиламиноуксусной кислоте, 2-акриламидо-2-метилпропансульфокислоте) в водных растворах от исходных концентраций реагентов при их постоянном соотношении. Различный характер таких зависимостей связан с особенностями ассоциации исходных реагентов и образующихся продуктов.
Пиридин, n-метилпиперидин, 4-диазабицикло-[2, 2]октан, нуклеофильное присоединение, акриловая кислота, 2-акриламидо-2-метилпропан-сульфокислота, n-акрилоиламиноуксусная кислота, бетаины, вода, кинетика, концентрационные эффекты
Короткий адрес: https://sciup.org/147160352
IDR: 147160352 | УДК: 547.333.4.:547.391.1 | DOI: 10.14529/chem160203
Текст научной статьи Концентрационные эффекты при нуклеофильном присоединении циклических третичных аминов к кислотам акрилового ряда в водных растворах
Синтетические бетаины различного строения применяются в качестве компонентов многих косметических и фармацевтических препаратов [1, 2]. Реакции нуклеофильного присоединения третичных аминов к кислотам акрилового ряда (реакции (1)–(3)) являются удобным одностадийным методом синтеза карбокси- и сульфобетаинов [3, 4].
R3N + СН2=СНСООН ; R3N+СН2СН2COO-(1)
R3N + СН2=СНCONHCH2СООН ;---* R3N+СН2СН2CONHCH2COO-(2)
R3N + СН2=СНCONHС(СН3)2CH2SО3Н ; R3N+CH2CH2CONHС(СН3)2CH2SО3-(3)
Известно [4, 5], что скорость присоединения аминов к электрофильно активированным С=С-связям возрастает при повышении нуклеофильности амина и стерической доступности его реакционного центра. Поэтому для третичных аминов, содержащих стерически доступные атомы азота, реакции (1)–(3) протекают в мягких условиях в водной среде с селективностью, близкой к 100 % [3, 6, 7]. В частности, в указанных работах в качестве нуклеофильных реагентов использованы гетероциклические соединения – пиридин (Пир, рКа 5.23), N-метилпиперидин (МП, рКа 10,08), 1,4-диазабицикло-[2,2,2]октан (ДАБЦО, рКа 8,8). ДАБЦО содержит две равноценные аминогруппы, но при эквимольных соотношениях с кислотами акрилового ряда в водных растворах образует монобетаины, поскольку после моноприсоединения активность второй аминогруппы резко снижается [7].
В последние годы при исследовании реакций нуклеофильного присоединения или замещения третичных аминов различного строения в водных растворах были выявлены необычные концентрационные эффекты [8–10]. Они заключаются в резком ускорении или торможении реакций, повышении или понижении равновесных конверсий в определенных интервалах исходных концентраций реагентов (при неизменном их соотношении), причем отдаленные от реакционного центра изменения в строении аминов могут значительно влиять на границы этих интервалов и степень выраженности эффектов. В указанных работах выдвинуто предположение о связи этих эффектов с «благоприятной» или «неблагоприятной» для протекания реакций структурой ассо- циатов, образующихся в растворах с различными концентрациями исходных реагентов и получаемых продуктов.
Целью данной работы было изучение особенностей кинетических концентрационных эффектов в реакциях нуклеофильного присоединения Пир, МП, ДАБЦО к кислотам акрилового ряда (АК, АУК, АМПСК) в водных растворах. Выбор аминов был обусловлен тем, что они, обладая высокой активностью в исследуемых реакциях, являются представителями разных типов гетероциклических третичных аминов (рис. 1) и существенно отличаются по константам основности, что позволяло обобщить найденные закономерности.
Кинетические закономерности реакции (1) в разбавленных водных растворах были изучены в работе [11] на примере пары Пир–АК. Из-за реакции нейтрализации амины и карбоновые кислоты при совместном присутствии в водных растворах находятся в разных равновесных формах – в виде исходных молекул, контактных и сольватно разделённых ионных пар, диссоциированных ионов. Равновесия между этими формами зависят от исходных концентраций реагентов, ионной силы растворов и других факторов. При связывании молекул реагентов в соли происходит резкое снижение активности ненасыщенной кислоты и потеря нуклеофильных свойств аминогруппой, которая не содержит свободной пары электронов в аммониевой форме [5]. Кроме того, в воде разными маршрутами может происходить завершающий нуклеофильное присоединение перенос протона в переходном состоянии. В результате адекватное кинетическое уравнение должно включать несколько разных констант скорости, причем вычисленный для одних условий набор значений констант «не работает» при других условиях (например, при повышении концентрации реагентов от 0,05 М до 1,0 М). Поэтому в данной работе в качестве критерия влияния начальных концентраций реагентов на кинетику присоединения гетероциклических аминов к кислотам акрилового ряда были выбраны легко измеряемые и надежные экспериментальные показатели – начальные скорости и достигаемые равновесные конверсии.
Рис. 1. Структурные формулы использованных аминов
Экспериментальная часть
В экспериментах без дополнительной очистки использовались промышленные образцы АК (ТУ 6-09-4131-75), образцы Пир, МП, ДАБЦО и АМПСК фирмы Aldrich, АУК была синтезирована по реакции Шоттена–Баумана из акрилоилхлорида и аминоуксусной кислоты по стандартной методике [12]. Присоединение аминов к АК проводили при температуре 50 °С при экви-мольном соотношении реагентов; взаимодействие ДАБЦО с АУК – при 70 °С и соотношении 1,5:1,0; реакцию ДАБЦО с АМПСК – при 50 °С и мольном соотношении 1,2:1,0. Начальные концентрации реагентов варьировались от 0,5 ммоль/г до максимально возможных (предела растворимости или до проведения реакции в массе). Для исключения радикальной полимеризации мономерных кислот в исходные реакционные смеси вводился гидрохинон (0,5 % от массы мономера). Кинетические данные получали, определяя текущую концентрацию С=С-связей кислот акрилового ряда методом бромид-броматного титрования.
Результаты и их обсуждение
При варьировании исходных концентраций реагентов (при постоянстве их соотношений и температуры) для систем Пир-АК, МП-АК, ДАБЦО-АК, ДАБЦО-АУК, ДАБЦО-АМПСК были получены кинетические кривые реакций (1)–(3) и на их основе определены начальные скорости и равновесные конверсии. Примеры кинетических кривых представлены на рис. 2, а зависимости начальных скоростей от исходных концентраций реагентов показаны на рис. 3 и 4. Эти концентрационные зависимости можно разбить на 2 группы – одни проходят через максимум (реакции
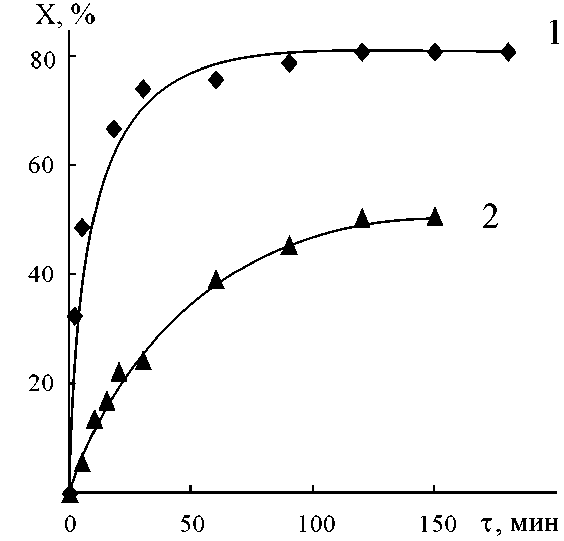
Рис. 2. Зависимость конверсии реагентов от времени в реакции присоединения Пир(1), МеП (2) к АК. С 0 = 3 ммоль/г
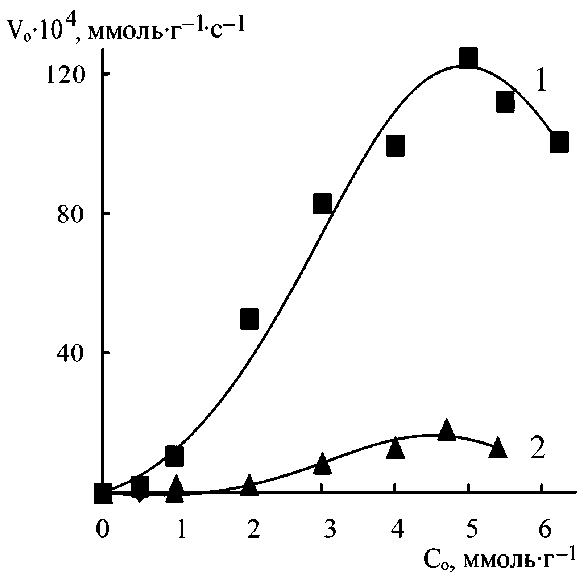
Рис. 3. Влияние исходных концентраций реагентов на начальные скорости присоединения Пир (1) и МП (2) к АК в водных растворах
Пир и МП с АК, ДАБЦО с АУК), другие имеют S-образный характер (присоединение ДАБЦО к АК или АМПСК).
Во всех случаях при исходных концентрациях выше определенного (от 0,5 до 2,0 ммоль/г для разных систем), которое можно назвать первой «пороговой» концентрацией, происходит резкое повышение начальной скорости. Но при значениях С 0 выше второго «порогового» значения начальная скорость или перестает увеличиваться, или начинает снижаться (особенно резко – в системах Пир-АК, ДАБЦО-АУК). Интервалы между первой и второй пороговой концентрацией составляют около 4,0 и 2,7 ммоль/г при присоединении соответственно Пир или МП к АК. Для реакций с участием ДАБЦО он значительно снижается – до 0,8–1,0 ммоль/г. Из-за различий в концентрационных кинетических зависимостях соотношение начальных скоростей в различных системах зависит от исходных концентраций реагентов. Например, присоединение ДАБЦО к АК при значениях С 0 = 1,0 ммоль/г происходит в 3 раза быстрее, чем присоединение к АУК, но уже при С 0 = 1,7 ммоль/г в этих системах начальные скорости реакций (1) и (2) практически одинаковы.
Значительные изменения соотношений активностей наблюдаются также при сравнении скоростей присоединения Пир, ДАБЦО или МП к АК при различных исходных концентрациях реагентов. Поскольку кинетические данные для ряда систем получены в широких интервалах исходных концентраций реагентов, то необходимо учитывать значительное изменение мольного соотношения реагентов и воды в таких реакционных смесях. Вода не только является полярным растворителем, стабилизирующим образование промежуточных цвиттер-ионов в исследуемых реакциях нуклеофильного присоединения, но участвует в бетаино-образовании и в других ролях. Подтверждением этого являются кинетические уравнения с участием концентраций воды и ионов гидроксония, предложенные в работе [11] для нуклеофильного присоединения Пир к АК в разбавленных растворах (это связано с возможным участием воды и ионов гидроксония в переходных состояниях за счет образования водородных связей). В таблице пред-
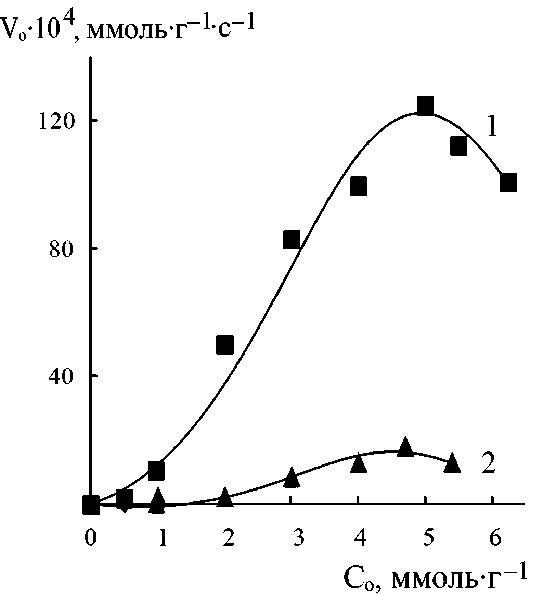
Рис. 4. Влияние исходных концентраций реагентов на начальные скорости реакций присоединения ДАБЦО к АК (1), АУК (2), АМПСК (3) в водных растворах
ставлены концентрации и мольные отношения реагентов и воды, соответствующие первой (С1) и второй (С2) «пороговым» концентрациям.
Значения С 1 , С 2 и соответствующие им мольные соотношения реагентов и воды для исследуемых систем
|
Амин |
Кислота |
Первая «пороговая» концентрация |
Вторая «пороговая» концентрация |
|||
|
С 1 , моль/г |
Амин:кислота:вода (мольн.) |
С 2 , моль/г |
Амин:кислота:вода (мольн.) |
|||
|
Пир |
АК |
1,0 |
1 |
1:47 |
5,0 |
1:1:2.7 |
|
МП |
АК |
2,0 |
1 |
1:37 |
4,7 |
1:1:2,4 |
|
ДАБЦО |
АК |
1,2 |
1 |
1:43 |
2,0 |
1:1:21 |
|
ДАБЦО |
АУК |
1,0 |
1 |
1:42 |
2,0 |
1:1:14 |
|
ДАБЦО |
АМПСК |
0,5 |
1 |
1:47 |
1,3 |
1.2:1:26 |
С учетом данных, представленных в таблице, можно рассмотреть основные возможные причины наблюдаемых кинетических изменений на различных концентрационных участках. Наиболее вероятным является суммарное действие ряда факторов. В частности, при повышении концентрации аминов и кислот в водных растворах происходит снижение степени их ионизации [13] . Подобный эффект в исследуемых системах должен приводить к повышению концентрации аминов, не участвующих в солеобразовании, т.е. способных к нуклеофильному присоединению к активированным алкенам. Кроме того, в относительно разбавленных растворах, соответствующих первой пороговой концентрации, ускорение реакций, вероятно, связано также с образованием ассоциативных структур, благоприятствующих нуклеофильному присоединению аминов к ненасыщенным кислотам. В исследуемых нами системах реагенты содержат много потенциальных центров сильных нековалентных межмолекулярных ассоциативных взаимодействий – ионных или обусловленных водородными связями. Известно [14–16], что ассоциация аминов, амидов, карбоновых или сульфоновых кислот за счет водородных связей значительно усиливается при повышении концентрации органических соединений перечисленных классов в водных растворах. В индивидуальных растворах таких соединений при достижении определенных концентраций происходят изменения структуры преобладающих ассоциатов, а при небольших содержаниях воды начинается структурирование растворов.
В последние годы в литературе появляется всё больше данных о том, что при определенных условиях ассоциативные взаимодействия могут играть важную роль в кинетике гомогенных жидкофазных реакций с участием ассоциирующихся реагентов. Методом моделирования показано [17], что наблюдаемые константы скорости реакций в ассоциирующихся жидкофазных системах могут возрастать или снижаться с изменением концентрации ассоциирующихся реагентов в зависимости от константы равновесия и соотношения констант скорости для свободных и ассоциированных молекул.
При использовании Пир (ароматического моноциклического амина), МП (неароматического моноцикла) и ДАБЦО (неароматического бицикла), структуры которых значительно отличаются, типы ассоциатов и концентрации, при которых они формируются, могут существенно различаться. Это же происходит при замене карбоксильной кислоты АК на амидокарбоксильную кислоту АУК или амидосульфокислоту АМПСК. При совместном присутствии аминов и таких соединений вариативность образования водородных связей с участием разных функциональных групп значительно возрастает. В то же время благоприятные для протекания реакций (1)–(3) ассоциативные структуры образовываются при близких соотношениях реагентов и воды.
При достижении вторых пороговых концентраций исходных реагентов мольное содержание воды в системах снижается до такого уровня, когда происходит фактическое структурирование растворов, уменьшается подвижность молекул, снижаются возможности для сольватации водой промежуточно образующихся цвиттер-ионов, для участия молекул воды и ионов гидроксония в переносе атомов водорода на второй стадии нуклеофильного присоединения. Поэтому при превышении таких исходных концентраций реагентов прекращается рост начальных скоростей (или даже происходит их снижение). Можно отметить, что в системах, содержащих диамин ДАБЦО, вторая пороговая концентрация соответствует гораздо большей мольной доле воды, чем в системах на основе Пир и МП.
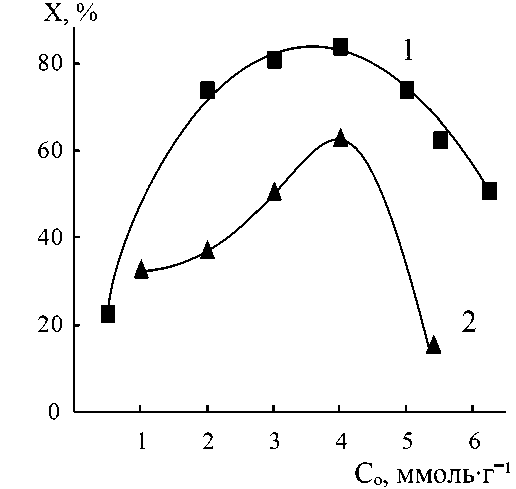
Рис. 5. Влияние исходных концентраций реагентов на равновесные конверсии в реакциях АК с Пир (1), МП (2) в водных растворах
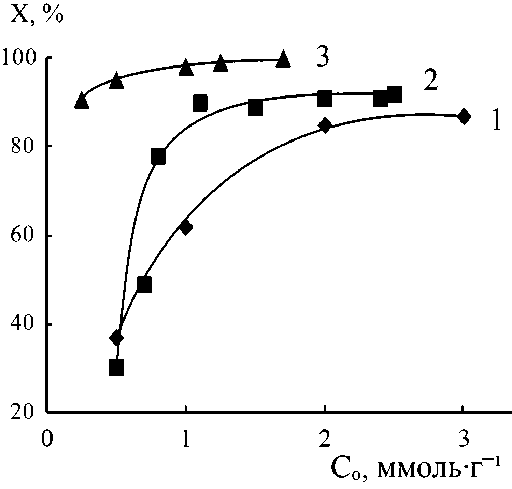
Рис. 6. Влияние исходных концентраций реагентов на равновесные конверсии в реакциях присоединения
ДАБЦО к АК (1), АУК (2), АМПСК (3) в водных растворах
Образующиеся в ходе реакций многофункциональные бетаины также могут участвовать в ионных взаимодействиях и образовании Н-связей, поэтому они способны входить в состав общих ассоциатов с молекулами непрореагировавших аминов и ненасыщенных кислот. В результате в большинстве исследуемых систем влияние суммарной исходной концентрации реагентов на кинетику реакций (1)–(3) сохраняется и при проведении процесса до глубоких конверсий. Это наглядно показывают данные по равновесным конверсиям, достигаемым при различных значениях С 0 (см. рис. 4 и 5). Исключением является система ДАБЦО-АМПСК (в которой использовался начальный избыток амина): равновесная конверсия во всем интервале исходных концентраций составляет 90 % и выше (т. е. концентрационный эффект практически отсутствует).
В остальных системах при росте значений С 0 сначала наблюдается значительный сдвиг равновесия в сторону образования продуктов – равновесная конверсия увеличивается в 2–4 раза (рис. 6). В реакциях присоединения Пир и МП к АК после достижения максимальных равновесных конверсий (при значениях С 0 = 4,0 ммоль/г) начинается их резкое снижение при дальнейшем повышении исходных концентраций. В реакциях присоединения ДАБЦО к АК или АУК после достижения высоких равновесных конверсий их снижения при росте С0 не происходит. Такие отличия, вероятно, связаны с особенностями ассоциации в сравниваемых многокомпонентных системах.
Можно также отметить, что описанные концентрационные кинетические эффекты представляют интерес не только в теоретическом, но и в практическом плане. Они позволяют выбрать оптимальные концентрации исходных реагентов для синтеза бетаинов на основе гетероциклических аминов по реакциям (1)–(3) с достижением конверсий не менее 80 % (Пир-АК), 60 % (МП-АК), 87 % (ДАБЦО-АК), 92 % (ДАБЦО-АУК), 98 % (ДАБЦО-АМПСК).
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований – проект № 14-03-31549 мол_а.
Список литературы Концентрационные эффекты при нуклеофильном присоединении циклических третичных аминов к кислотам акрилового ряда в водных растворах
- Hoover, M.F. Cationic quaternary polyelectrolytes -A literature review/M.F. Hoover//Journal of Macromolecular Science: Part A -Chemistry. -1970. -V. 4, I. 6. -P. 1327-1417.
- Dega-Szafran, Z. Synteza, struktura i właściwości betain oraz ich zastosowania/Z. Dega-Szafran, I. Kowalczyk, P. Barczyński//Przemysł Chemiczny. -2010. -V. 89, № 11. -P. 1189-1192.
- Патент 3689470 А США. Method of producing betaines, monomers and polymers containing betaine-type units and novel and useful copolymers thereby obtained/N. Shachat, R. Haggard, S. Lewis. -05.09.1972.
- Синтез карбокси-и сульфобетаинов на основе третичных аминов и ненасыщенных кислот/О.А. Казанцев, С.А. Казаков, К.В. Ширшин, С.М. Данов//Журнал органической химии. -2000. -Т. 36. -№ 3. -C. 363-369.
- Суминов, С.И. Нуклеофильное присоединение аминогруппы к активированной двойной углерод-углерод связи/С.И. Суминов, А.Н. Кост//Успехи химии. -1969. -Т. 38. -Вып. 11. -С. 1933-1963.
- Le Berre, A. L’addition des sels d’amines tetriaires aux composes ethyleniques electrophiles. III. Betaines et sels quaternaries a partir d’acides α,β-insatures/A. Le Berre, A. Delacroix//Bull. Soc. Chim. Fr. -1973. -V. 7. -P. 2404-2408.
- Синтез бетаинов на основе 1,4-диаза-бициклооктана/О.А. Казанцев, С.А. Казаков, К.В. Ширшин и др.//Химия гетероциклических соединений. -1998. -№ 4. -C. 547-550.
- Концентрационные эффекты в нуклеофильных реакциях третичных аминов в водных растворах. Алкилирование аминов этиленхлоргидрином/О.А. Казанцев, Д.С. Барута, К.В. Ширшин и др.//Журнал физической химии. -2010. -Т. 84. -№ 12. -С. 2265-2270.
- Концентрационные эффекты в нуклеофильных реакциях третичных аминов в водных растворах. Алкилирование аминов хлоруксусной кислотой/О.А. Казанцев, Д.С. Барута, К.В. Ширшин и др.//Журнал физической химии. -2011. -Т. 85. -№ 3. -С. 479-484.
- Концентрационные эффекты в нуклеофильных реакциях третичных аминов в водных растворах. Присоединение аминов к акриламидным мономерам в присутствии хлористого водорода/О.А. Казанцев, А.П. Сивохин, Д.С. Барута и др.//Журнал физической химии. -2011. -Т. 85. -№ 4. -С. 660-665.
- Le Berre, A. L’addition des sels d’amines tetriaires aux composes ethyleniques electrophiles. IV. Cinetique de l,addition de la pyridine a l,acide acrylique/A. Le Berre, A. Delacroix//Bull. Soc. Chim. Fr. -1974. -№ 9-10. -P. 1896-1900.
- Коломейцева, О.П. Синтез и свойства макросетчатых анионитов/О.П. Коломейцева, Н.Н. Кузнецова//Журнал прикладной химии. -1972. -Т. 45. -С. 1978-1982.
- Крестов, Г.А. Физико-химические свойства бинарных растворителей: справ./Г.А. Крестов, В.Н. Афанасьев, Л.С. Ефремова. -Л.: Химия, 1988. -688 с.
- Akiyama, Y. Self-assembling of alcohol and carboxylic acid through hydrogen-bonding and inter-alkyl group interaction: Pap. 36th IUPAC Congr. "Front. Chem., New Perspect. for 2000s"/Y. Akiyama, A. Wakisaka//Chimia. -1997. -V. 51, № 7. -Р. 419.
- Barton, D. Comprehensive organic chemistry. Vol. 2/D. Barton, W.D. Ollis. -Pergamon press, 1983. -728 p.
- Кийко, C.M. Степень ассоциации бинарных водных растворов некоторых неэлектролитов/C.M. Кийко, B.B. Уржунцева//Журнал физической химии. -2004. -Т. 78, № 9. -С. 1706-1708.
- Кулагина, Т.П. Зависимость кинетики жидкофазных реакций от супрамолекулярной структуры реагентов/Т.П. Кулагина, Л.П. Смирнов//Доклады академии наук. -2009. -№ 4. -С. 502-507.


