Конденсация s-замещенных 6-амино-2-тиоурацилов с бензальдегидами
Автор: Петрова Ксения Юрьевна, Ким Дмитрий Гымнанович, Сергеев Михаил Юрьевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 1 т.12, 2020 года.
Бесплатный доступ
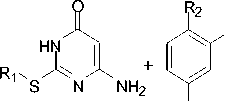
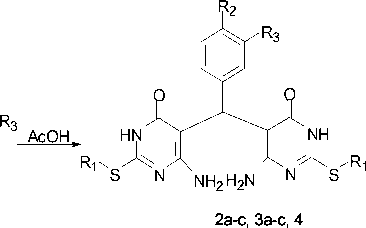
В настоящей работе взаимодействием 2-аллилсулфанил-, 2-металлилсульфанил- и 2-пропаргилсульфанил-6-аминопиримидин-4(3 Н )-онов с бензальдегидом в концентрированной уксусной кислоте при комнатной температуре получены 5,5'-(фенилметилен) бис (2-органилсульфанил-6-аминопиримидин-4(3 H )-оны), реакцией 2-аллилсулфанил-, 2-бензилсульфанил- и 2-пропаргилсульфанил-6-аминопиримидин-4(3 Н )-онов с 4,4-диметиламинобензальдегидом и 2-бензилсульфанил-6-аминопиримидин-4(3 Н )-она с 3,4-диметоксибензальдегидом в аналогичных условиях получены 5,5'-((4-(диметиламино)фенил)метилен) бис (2-органилсульфанил-6-аминопиримидин-4(3 H )-оны) и 5,5'-((3,4-диметоксифенил)метилен) бис (2-бензилсульфанил-6-аминопиримидин-4(3 H )-он), соответственно. Исходные 2-органилсульфанил-6-аминопиримидин-4(3 Н )-оны получены по известной методике алкилированием 6-амино-2-тиоурацила органилгалогенидами (аллилбромидом, металлилхлоридом, пропаргилбромидом и бензилхлоридом) в водно-спиртовой среде при комнатной температуре в присутствии щелочи. Структуры полученных в результате реакций с ароматическими альдегидами дипиримидинов подтверждены методом протонного магнитного резонанса на приборах Bruker AVANCE-500 и Bruker DRX-400 и методом масс-спектрометрии при электронной ионизации на газовом хромато-масс-спектрометре GCMS-QP2010 UltraShimadzu. В ЯМР 1H спектрах полученных дипиримидинов отсутствует синглет при 4,90-5,05 м.д., принадлежащий протону в 5 положении пиримидинового кольца, но присутствует сигнал CHPh в области 5,35-5,50 м.д. Сигналы монозамещенного фенильного кольца проявились в области 7,00-7,25 м.д., а в случае ди- и тризамещенных производных сигналы в более сильном поле - при 6,55-6,90 м.д. и при 6,60-6,70 м.д., соответственно. Характерной особенностью всех изученных масс-спектров является наличие пика молекулярного иона, а также разрыв связи С5-CHPh и образование фенил-катионов. В масс-спектрах всех изученных соединений присутствуют пики, характерные для фрагментации исходных 2-органилсульфанил-6-аминопиримидин-4(3 Н )-онов, что обусловлено разрывом связи С5-CHPh. Взаимодействие с замещенными ароматическими альдегидами происходит в две стадии, о чем свидетельствует образование смеси 6-амино-5-(гидрокси(фенил)метил)-2-металлилсульфанилпиримидин-4(3 H )-она и 5,5'-(фенилметилен) бис (2-металлилсульфанил-6-аминопиримидин-4(3 H )-она) при взаимодействии 2-металлилсульфанил-6-аминопиримидин-4(3 Н )-она с бензальдегидом при эквимольном соотношении. Все попытки получить трициклическую систему, а именно замещенные пиридо[2,3- d :6,5- d ’]дипиримидины, внутримолекулярным элиминированием молекулы аммиака оказались безуспешными. Реакция 5,5'-(фенилметилен) бис (2-аллилсульфанил-6-аминопиримидин-4(3 H )-она с иодом приводит к образованию иодида 6,6'-(фенилметилен)бис(5-амино-3-(иодометил)-7-оксо-2,3,7,8-тетрагидротиазоло[3,2- a ]пиримидиния), что доказано методом ЯМР 1Н. В спектре появляется характерный сигнал группы NCH+ при 5,29 м.д.
5, 5'-(арилметилен)бис(2-органилсульфанил-6-аминопиримидин-4(3h)-он), 2-алкенилсульфанил-6-аминопиримидин-4(3н)-он, 2-пропаргилсульфанил-6-аминопиримидин-4(3н)-он, бензальдегид, гетероциклизация
Короткий адрес: https://sciup.org/147233160
IDR: 147233160 | УДК: 547.854.83 | DOI: 10.14529/chem200109
Текст научной статьи Конденсация s-замещенных 6-амино-2-тиоурацилов с бензальдегидами
Высокую медико-биологическую активность проявляют разнообразные производные урацила. Известно, что синтетические аналоги урацила обладают противовирусной [1, 2], противоопухолевой [3–5] и антимикотической [6–8] активностью. В частности среди производных пиримидинов найдены антиметаболиты фолиевой кислоты [9], доказано, что некоторые производные проявляют противовирусную активность в отношении ВИЧ-1 в микромолярных концентрациях [10].
Из литературных данных известно, что конденсация 6-метил(фенил, амино, алкиламино, бензиламино)пиримидин-4-онов с альдегидами может привести к образованию дипиримидинов
[11–17]. В случае наличия в 6 положении первичной аминогруппы возможно протекание дальнейшей внутримолекулярной циклизации с образованием замещенных пиридо[2,3- d :6,5- d ’]дипиримидинов [15, 16], которые также могут быть получены трехкомпонентной циклизацией барбитуровой кислоты с ароматическими альдегидами и аммиаком (или анилином) [17]. В то же время в литературе отсутствуют данные об исследовании 2-бензилсульфанил- ( 1a ), 2-пропаргилсульфанил- ( 1b ), 2-аллилсульфанил- ( 1c ) и 2-металлилсульфанил-6-аминопиримидин-4(3 Н )-онов ( 1d ) в реакциях с ароматическими альдегидами, что является целью настоящей работы.
Обсуждение результатов
Органилсульфиды 1a-d получены нами в водно-спиртовой среде в присутствии щелочи по методике, описанной в работе [19]. В литературе алкилированием 6-амино-2-тиоурацила получены различные S-замещенные производные, в том числе пропаргилсульфид 1a [19], аллилсульфид 1b [19, 20], металлилсульфид 1c [19, 20] и бензилсульфид 1d [18].
Нами найдено, что взаимодействие сульфидов 1a-c с бензальдегидом в соотношении 2:1 протекает с образованием 5,5’-(фенилметилен) бис (6-аминопиримидин-4(3 H )-онов ( 2a-c ). Все попытки получить трициклическую систему А оказались безуспешными (схема 1).
CHO
1a-d
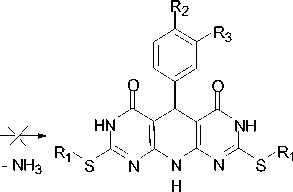
A
Схема 1
1a, 2a, 3a R 1 = CH 2 C≡CH; 1b, 2b, 3b R 1 = CH 2 CH=CH 2 ; 1c, 2c R 1 = CH 2 C(CH 3 )=CH 2 ; 1d, 3c, 4 R 1 = CH 2 C 6 H 5 ; 2a-c R 2 = H, R 3 = H; 3a-c R 2 = N(CH 3 ) 2 , R 3 = H; 4 R 2 = R 3 = OCH 3
О протекании реакций с образованием дипиримидинов 2a-c свидетельствует отсутствие в ЯМР 1H спектрах синглетов при 4,90–5,05 м.д., принадлежащих протону в 5 положении пиримидинового кольца, а также наличие однопротонного сигнала CHPh в области 5,35–5,50 м.д. и пятипротонного мультиплета фенильного кольца в области 7,00–7,25 м.д. (табл. 1).
Таблица 1
Спектральные данные соединений 2а-с, 3а-с, 4
|
Соединение |
Спектр ЯМР 1Н, δ, м.д. ( J , Гц) |
|
2a |
3,21 с (2H, ≡CH), 4,02 c (4H, SСН 2 ), 5,50 с (1Н, CНPh), 7,03 д (2Н, орто -Ph, J 7,6 Гц), 7,11 д (1Н, пара -Ph, J 6,7 Гц), 7,21 м (2Н, мета -Ph, J 7,6; 6,7 Гц), 12,07 c (2Н, NH) |
|
2b |
3,80 д (4H, SСН 2 , J 5,7 Гц), 5,14 д (2Н, =CHH, J 9,9 Гц), 5,35 д (2Н, =CHH, J 17,0 Гц), 5,50 с (1Н, СHPh), 5,95 м (2Н, =СH, J 5,7; 9,9; 17,0 Гц), 7,06–7,21 м (5Н, Ph), 11,91 c (2Н, NH) |
|
2c |
1,80 с (6H, CH 3 ), 3,85 c (4H, SСН 2 ), 4,89 и 5,10 c (2H, CHH), 5,45 с (1Н, CНPh), 7,01–7,23 м (5Н, Ph), 12,00 c (4Н, NH) |
|
3a |
2,82 c (6H, NCH 3 ), 3,16 c (2H, ≡CH), 4,00 c (4H, SCH 2 ), 5,42 c (1H, CHPh), 6,59–6,87 м (4Н, Ph), 11,91 (4H, NH 2 ) |
|
3b |
3,76 д (4H, SСН 2 , J 6,1 Гц), 5,11 д (2Н, =CHH, J 10,0 Гц), 5,32 д (2Н, =CHH, J 16,9 Гц), 5,40 с (1Н, СHPh), 5,92 м (2Н, =СH, J 6,1, 10,0, 16,9 Гц), 6,55 д (2Н, мета -Ph, J 8,4 Гц), 6,87 д (2Н, орто -Ph, J 8,4 Гц), 11,81 c (2Н, NH) |
|
3c |
2,87 c (6H, NCH 3 ), 4,37 c (4H, SCH 2 ), 5,35 c (1H, CHPh), 6,56 д (2Н, мета -Ph, J 8,4 Гц), 6,89 д (2Н, орто -Ph, J 8,4 Гц), 7,23 д (2Н, пара -Ph, J 7,5 Гц), 7,30 т (4Н, мета -Ph, J 7,5, 7,6 Гц), 7,42 д (2Н, орто -Ph, J 7,6 Гц), 11,41 (2H, NH) |
|
4 |
3,66 с (3Н, пара- OCH 3 ), 3,72 с (3Н, мета- OCH 3 ), 4,35 с (4Н, SCH 2 ), 5,45 c (1H, CHPh), 6,59 д (1H, J 8,1 Гц), 6,61 с (1H), 6,71 д (1H, J 8,1 Гц), 7,22 т (2Н, орто -Ph, J 7,3 Гц), 7,28 т (4Н, мета -Ph, J 7,3 Гц), 7,42 т (2Н, пара- Ph, J 7,3 Гц), 11,87 (4H, NH 2 ) |
В масс-спектрах дипиримидинов 2a-c присутствует пик молекулярного иона, характерным является образование фенил-катионов и разрыв связи С5-CHPh, обуславливающий наличие в масс-спектрах пиков характерных для фрагментации исходных 2-органилсульфанил-6-аминопиримидин-4(3 Н )-онов.
Найдено, что взаимодействие сульфидов 1a, b, d c 4,4-диметиламинобензальдегидом приводит к образованию 5,5'-((4-(диметиламино)фенил)метилен) бис (2-органилсульфанил-6-амино-пиримидин-4(3 H )-онов) ( 3a - c ), а реакция бензилсульфида 1d с 3,4-диметоксибензальдегидом – к образованию 5,5'-((3,4-диметоксифенил)метилен) бис (2-бензилсульфанил-6-аминопиримидин-4(3 H )-она) ( 4 ).
В спектрах ЯМР 1H дипиримидинов 3a - c и 4 , как и в спектрах соединений 2а-с , присутствует однопротонный сигнал CHPh. Сигналы ароматических колец проявились в более сильном поле – при 6,55–6,90 м.д., что обусловлено влиянием электронодонорных заместителей в кольце.
В масс-спектре соединения 4 отсутствует пик молекулярного иона, но присутствует пик с m/z 383, обусловленный разрывом связи С5-CHAr. Максимальной интенсивностью обладает пик тро-пилий-катиона ( m/z 91).
При взаимодействии сульфида 1c с бензальдегидом при эквимольном соотношении образуется смесь 6-амино-5-(гидрокси(фенил)метил)-2-металлилсульфанилпиримидин-4(3 H )-она ( 5 ) и дипиримидина 2c (схема 2). По-видимому, реакция протекает в две стадии: на первой происходит образованием 5-(гидрокси(фенил)метил)-2-органилсульфанилпиримидинонов, которые на второй стадии реагируют со второй молекулой пиримидина, что сопровождается элиминированием воды и образованием дипиримидинов 2–4 .
AcOH
1c + PhCHO
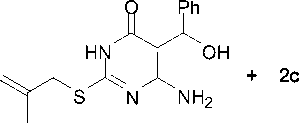
Схема 2
Из литературных данных [17, 18] известно, что аллилсульфид 1c с иодом вступает в реакцию иодциклизации с образованием тиазолопиримидиновых систем.
На примере дипиримидина 2c нами изучено взаимодействие с иодом. Реакция приводит к образованию иодида 6,6'-(фенилметилен) бис (5-амино-3-(иодометил)-7-оксо-2,3,7,8-тетрагидро-тиазоло[3,2- a ]пиримидиния) ( 6 ) (схема 3). В спектре ЯМР 1Н иодида 6, в отличие от спектра ал-лилсульфида 2b , отсутствуют сигналы терминальных протонов аллильной группы, но присутствует сигнал CH 2 I при 3,62 м.д. и появляется сигнал протона NCH+ при 5,29 м.д.
1) I 2 , AcOH 2)NaI, Me2CO
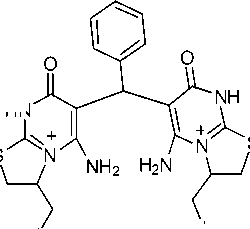
HN
2I
I
I
Схема 3
Экспериментальная часть
Спектры ЯМР 1Н (500 МГц) соединений 3c , 3b , 4 записаны на приборе Bruker AVANCE-500. Спектры ЯМР 1Н (400 МГц) соединений 2a-c , 3a , 5 , 6 записаны на приборе Bruker DRX-400. Внутренний стандарт – ТМС, растворитель – ДМСО-d6.
Масс-спектры электронного удара соединений 2a–c и 4 сняты на газовом хромато-масс-спектрометре GCMS-QP2010 UltraShimadzu (ЭУ, 70 эВ).
Синтез соединений 2a-c, 3a-c, 4. Общая методика
К раствору 0,5 ммоль сульфидов 1a-d в 5 мл ледяной уксусной кислоты добавляли раствор 0,25 ммоль бензальдегида, 4,4-диметиламинобензальдегида или 3,4-диметоксибензальдегида в 5 мл ледяной уксусной кислоты и оставляли на 48 часов. Полученный осадок отфильтровывали, сушили.
5,5'-(фенилметилен)бис(2-пропаргилсульфанил-6-аминопиримидин-4(3H)-он) (2a)
Выход 0,105 г (93 %), белый порошок, т. пл. 225–226 ºС. ИК-спектр, ν, см - 1: 3444 o.c (NH 2 ), 3342 o.c (NH 2 ), 3184 (NH 2 ), 3292 (≡СH), 3026 (C-H), 1614 (C=O), 1568 (C-С аром ), 1494 (C-С аром ), 1290 (≡С-H), 651 (≡С-H). Масс-спектр, m/z ( I отн. , %): 450 [ M ]+• (10,3), 336 (5,1), 309 (5,0), 269 [С 14 H 11 N 3 OS]+• (10,2), 181 [ M – С 14 H 11 N 3 OS]+• (35,9), 156 (20,5), 153 (15,4), 141 (9,8), 127 (12,8), 114 [С 3 H 4 N 3 S]+ (100), 105 (10,0), 77 (15,4), 72 (41,0), 71 (50,3), 68 (24,6), 45 (27,3).
5,5'-(фенилметилен)бис(2-аллилсульфанил-6-аминопиримидин-4(3H)-он) (2b)
Выход 0,082 г (72 %), бежевый порошок, т.пл. 279–282 ºС. Спектр ЯМР 1Н, δ, м.д.: 3,80 д (4H, SСН 2 , J 5,7 Гц), 5,14 д (2Н, =CHH, J 9,9 Гц), 5,35 д (2Н, =CHH, J 17,0 Гц), 5,50 с (1Н, СHPh), 5,95 м (2Н, =СH, J 5,7, 9,9, 17,0 Гц), 7,06–7,21 м (5Н, Ph), 11,91 c (2Н, NH). Масс-спектр, m/z ( I отн. , %): 454 (100) [ M ]+•, 413 [ M – С 3 H 5 ]+ (14,6), 396 (7,3), 354 [ M – СO – C 3 H 4 ]+• (24,4), 337 [ M – СO – C 3 H 4 – NH 3 ]+• (68,3), 311 [ M – СO – C 3 H 4 – NH 3 – C 2 H 2 ]+• (9,8), 297 [ M – СO – C 3 H 4 – NH 3 – C 3 H 4 ]+• (15,1), 272 [C 14 H 14 N 3 OS]+ (19,5), 254 (10,4), 238 (10,8), 230 (14,6), 221 (6,3), 210 (5,4), 195 (9,8), 183 (22,4), 168 (49,31), 155 (21,0), 150 (24,4), 143 (19,0), 140 (12,2), 128 (19,5), 122 (9,8), 117 (29,3), 115 (17,0), 110 (17,2), 105 (16,9), 95 (12,2), 91 (20,0), 85 (14,6), 83 (14,1), 77 [C 6 H 5 ]+ (25,0), 68 (43,4), 60 (12,7), 55 (14,6), 51 (14,1), 45 (24,3).
5,5'-(фенилметилен)бис(2-металлилсульфанил-6-аминопиримидин-4(3H)-он) (2c)
Выход 0,090 г (75 %), белый порошок, т. пл. 251–254 ºС. Масс-спектр, m/z ( I отн. , %): 482 [ M ]+• (9,5), 351 (7,1), 285 (9,4), 270 (11,9), 268 (14,3), 230 (22,4), 197 (33,3), 182 (90,5), 172 (8,5), 164 (59,5), 143 (69,0), 128 (16,7), 115 (45,2), 110 (50,0), 104 (16,7), 102 (9,5), 97 (23,8), 95 (19,5), 91 (32,4), 85 (28,6), 77 (14,3), 68 (100), 59 (17,1), 55 (69,0), 53 (23,8), 51 (13,3), 45 (16,7). ИК-спектр, ν, см - 1: 3178 (NH 2 ), 3082 (=CH 2 ), 3026 (C-H), 1687 (C=C), 1614 (C=O), 1562 (C-С аром ), 1492 (C-С аром ).
5,5'-((4-(диметиламино)фенил)метилен)бис(2-пропаргилсульфанил-6-аминопиримидин-4(3H)-он) (3a)
Выход 0,092 г (74 %), масло.
5,5'-((4-(диметиламино)фенил)метилен)бис(2-аллилсульфанил-6-аминопиримидин-4(3H)-он) (3b)
Выход 0,108 г (87 %), голубой порошок, т. пл. 267–268 ºС.
5,5'-((4-(диметиламино)фенил)метилен)бис(2-бензилсульфанил-6-аминопиримидин-4(3H)-он) (3c)
Выход 0,120 г (80 %), голубой порошок, т. пл. 208–210 ºС.
5,5'-((3,4-диметоксифенил)метилен)бис(2-бензилсульфанил-6-аминопиримидин-4(3H)-он) (4)
Выход 0,115 г (75 %), бежевый порошок, т. пл. 272–273 ºС.
Взаимодействие 2-металлилсульфанил-6-аминопиримидин-4(3 H )-она с бензальдегидом
К раствору 0,099 г (0,5 ммоль) 2-металлилсульфанил-6-аминопиримидин-4(3 H )-она 1c в 5 мл ледяной уксусной кислоты добавляли раствор 0,05 мл (0,5 ммоль) бензальдегида в 5 мл ледяной уксусной кислоты и оставляли на 48 часов. Полученный осадок смеси соединений 2с и 4 отфильтровывали, сушили. Выход смеси 0,089 г (59 %).
6-Амино-5-(гидрокси(фенил)метил)-2-металлилсульфанилпиримидин-4(3 H )-он (5) (в смеси с 2с). Спектр ЯМР 1Н, δ, м.д.: 1,91 с (3H, CH 3 ), 3,33 c (2H, SСН 2 ), 4,71 и 5,36 c (2H, CHH), 6,36 с (1Н, CHPh), 6,77 с (2Н, NH 2 ), 6,80 с (1Н, OH), 7,05–7,23 м (5Н, Ph).
Иодид 6,6'-(фенилметилен)бис(5-амино-3-(иодометил)-7-оксо-2,3,7,8-тетрагидротиазоло[3,2- a ]пиримидиния (6). К раствору 45 мг (0,1 ммоль) cоединения 2b в 2 мл уксусной кислоты при перемешивании прибавляют раствор 102 мг I2 (0,4 ммоль) в 3 мл того же растворителя. Смесь выдерживают 24 ч при комнатной температуре. Растворитель испаряют, остаток обрабатывают раствором NaI в ацетоне. Выпавший желтый осадок отфильтровывают. Выход 0,030 г (32 %), желтый порошок, т. пл. 219–220 ºС. Спектр ЯМР 1Н, δ, м.д.: 3,46 д (2H, SСН 2 , J 9,0 Гц), 3,62 м
(4H, СН 2 I), 3,99 д (2H, SСН 2 , J 9,0 Гц), 5,29 м (2Н, NCН), 5,63 c (1Н, СНPh), 7,11–7,28 м (5Н, Ph), 7,97 c (4Н, NН 2 ).
Выводы
Таким образом, 2-алкенил(бензил, пропаргил)сульфанил-6-аминопиримидин-4(3 Н )-оны вступают в реакцию конденсации с ароматическими альдегидами с образованием замещенных 5,5’-(арилметилен) бис (2-алкенил(бензил, пропаргил)сульфанил-6-аминопиримидин-4(3 H )-онов. Реакция 5,5'-(фенилметилен) бис (2-аллилсульфанил-6-аминопиримидин-4(3 H )-она с иодом приводит к образованию иодида 6,6'-(фенилметилен)бис(5-амино-3-(иодометил)-7-оксо-2,3,7,8-тетрагидротиазоло[3,2- a ]пиримидиния).
Список литературы Конденсация s-замещенных 6-амино-2-тиоурацилов с бензальдегидами
- Solution-Phase Parallel Synthesis of S-DABO Analogues / A. Togninelli, C. Carmi, E. Petricci et al. // Tetrahedron Lett. - 2006. - № 47. - P. 65-67. DOI: 10.1016/j.tetlet.2005.10.142
- Synthesis and Antiviral Evaluation of 3-(2,3-Dihydroxypropyl)furo[2,3-d]pyrimidin-2(3H)-ones / Z. Janeba, A. Holý, R. Snoeck et al. // Antiviral Res. - 2010. - V. 86, № 1. - Р. 57. DOI: 10.1016/j.antiviral.2010.02.442
- Ondi, L. Brominated 4-(Trifluoromethyl)pyrimidines: A Convenient Access to Versatile Intermediates / L. Ondi, O. Lefebire, M. Schlosser // Eur. J. Org. Chem. - 2004. - P. 3714-3718. DOI: 10.1002/ejoc.200400209
- Новаков, И.А. Синтез новых N2-адамантилпроизводных 2-амино-6-метил-4(3Н)-пиримидинона - потенциальных активаторов выработки фактора некроза опухоли / И.А. Новаков, Б.С. Орлинсон // Химия гетероциклических соединений. - 2006. - № 10. - С. 1541-1544.
- Abu-Hashem, A. Synthesis and Antitumor Activity of New Pyrimidine and Caffeine Derivatives / A. Abu-Hashem, H. Hussein // Lett. Drug Des. Discovery. - 2015. - V. 12, № 6. - P. 471-478. DOI: 10.2174/1570180812666150429234237
- Fathalla, O.A. Synthesis of New 2-Thiouracil-5-suiphonamide Derivatives with Antibacterial and Antifungal Activity / O. A. Fathalla, S. M. Awad, M. S. Mohamed // Arch. Pharmacal Res. - 2005. - V. 28, № 11. - P. 1205-1212.
- DOI: 10.1007/bf02978199
- Synthesis and Antifungal Activity Evaluation of Novel Substituted Pyrimidine-5-Carboxamides Bearing the Pyridine Moiety / S.-C. Wang, F.-X. Wan, S. Liu et al. // J. Chin. Chem. Soc. - 2018. - V. 65, № 4. - P. 445-451.
- DOI: 10.1002/jccs.201700310
- Miyamoto, Y. Synthesis and Antifungal Activity of [1,2,4]Triazolo-[1,5-c]pyrimidine Derivatives / Y. Miyamoto // J. Pestic. Sci. - 1986. - V. 11, № 1. - P. 39-48.
- DOI: 10.1584/jpestics.11.39
- Vaidya, C. Synthesis and Antifolate Activity of New Pyrrolo[2,3-d]pyrimidine and Thieno[2,3-d]pyrimidine Inhibitors of Dihydrofolate Reductase / C. Vaidya, J.E. Wright, A. Rosowsky // J. Heterocycl. Chem. - 2004. - V. 41, № 5. - P. 787-793.
- DOI: 10.1002/jhet.5570410523
- Сим, О.Г. Синтез биологически активных новых 5-замещенных производных 2-аминопиримидин-4(3H)-она: автореф. дис. … канд. фарм. наук / О.Г. Сим. - Волгоград, 2006. - 22 с.
- Lam, B.L. An Acid-catalyzed Hydroxyalkylation of Uracil: a Facile Synthesis of 5-(Arylhydroxymethyl)uracils / B.L. Lam, L.N. Pridgen // J. Org. Chem. - 1986. - V. 51, № 13. - P. 2592-2594.
- DOI: 10.1021/jo00363a036
- Facile Synthesis of 5,5′-Methylenebis[1,3-disubstituted 6-methyl-2,4(1H,3H)-pyrimidinedione] Derivatives / T. Kinoshita, M. Kondo, H. Tanaka et al. // Synthesis. - 1986. - № 10. - P. 857-859.
- DOI: 10.1055/s-1986-31806
- Kinosita, T. Synthesis of 5, 5'-Mehylenebispyrimidine Derivatives and 3, 4-Dithia[6.1](1.5)pyrimidinophane / T. Kinoshita, H. Tanaka, S. Furukawa // Chem. Pharm. Bull. - 1986. - V. 34, № 4. - P. 1809-1813.
- DOI: 10.1248/cpb.34.1809
- Jezequel, H. Structure of Phenylbis(6-methyl-1,2,3,4-tetrahydro-2,4-dioxopyrimidin-5-yl)methane / H. Jezequel, T.J. Willcox // Chem. Ind. - 1980. - № 2. - P. 82-83.
- Youssif, Sh. 6-Amino-2-thio- and 6-Aminouracils as Precursors for the Synthesis of Antiviral and Antimicrobial Methylenebis(2-thiouracils), Tricyclic Pyrimidines, and 6-Alkylthiopurine-2-ones / Sh. Youssif, S.F. Mohamed // Monatsh. Chem. - 2008. - V. 139, № 2. - P. 161.
- DOI: 10.1007/s00706-007-0753-8
- Yoneda, F. A New Synthesis of Pyrimido[4,5-b]quinoline-2,4(1H,3H)diones (5-Deazaalloxazines) by Oxidative Cyclization of Aryl-bis(6-amino-1,3-dimethyluracil-5-yl)-methanes with Diethyl Azodicarboxyle / F. Yoneda, F. Takayama, A. Koshiro // Chem. Pharm. Bull. - 1979. - V. 27, № 10. - P. 2507-2510.
- DOI: 10.1248/cpb.27.2507
- Москвин, А.В. Конденсация гидроксипиримидинов с карбонильными соединениями: 1. Барбитуровые кислоты / А.В. Москвин, Н.Р. Резникова, Б.А. Ивин // Журнал органической химии. - 2002. - Т. 38, № 4. - С. 487-498.
- Discovery and Optimization of Aminopyrimidinones as Potent and State-dependent Nav1.7 Antagonists / H.N. Nguyen, H. Bregman, J.L. Buchanan et al. // Bioorg. Med. Chem. Lett. - 2012. - V. 22, № 2. - P. 1055-1060.
- DOI: 10.1016/j.bmcl.2011.11.111
- Ким, Д.Г. Галогенциклизация 2-aллилсульфанил- и 2-пропаргилсульфанил-6-аминопиримидин-4(3H)-онов / Д.Г. Ким, К.Ю. Ошеко, Т.В. Фролова // Журнал органической химии. - 2017. - Т. 53, № 12. - С. 1863.
- Сливка, Н.Ю. Галогенциклизация замещенных 2-(алкенилтио)пиримидин-6-онов / Н.Ю. Сливка, Ю.И. Геваза, В.И. Станинец // Химия гетероциклических соединений. - 2004. - Т. 40, № 5. - С. 776-783.


