Кондуктометрический метод для контроля прироста микробной биомассы пробиотических микроорганизмов
Автор: Асташкина А.П., Бакибаев А.А., Демешева М.И.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2-2 т.26, 2011 года.
Бесплатный доступ
Показана целесообразность применения кондуктометрического метода для контроля стационарной фазы роста микробной биомассы пробиотических микроорганизмов (лакто- и бифидобактерий) в технологическом процессе. Предлагаемый метод позволяет более точно определить технологически важный момент перехода экспоненциальной фазы в стационарную фазу кривой роста микробной суспензии.
Кондуктометрический метод, прирост микробной биомассы микроорганизмов, лактобактерии, бифидобактерии
Короткий адрес: https://sciup.org/14919490
IDR: 14919490 | УДК: 543.068.8:
Текст научной статьи Кондуктометрический метод для контроля прироста микробной биомассы пробиотических микроорганизмов
Одна из основных задач периодического культивирования – остановить развитие популяции в начале стационарной фазы роста культуры, т.е. заставить клетки находиться неограниченно долго в желаемом состоянии [4]. Количество микроорганизмов в периодической культуре нарастает и останавливается либо из-за исчерпания субстрата, либо из-за ингибирования продуктами жизнедеятельности.
В процессе роста микробной биомассы в культуральной среде происходит накопление заряженных частиц, следовательно, кондуктометрический метод можно использовать для контроля прироста микробной биомассы в технологическом процессе.
Цель работы: исследование прироста микробной биомассы лактобактерий и бифидобактерий в процессе периодического культивирования кондуктометрическим методом.
Материал и методы
Исследования проводили в отделении производства бактерийных препаратов филиала ФГУП НПО “Микроген” Минздравсоцразвития в г. Томск НПО “Вирион”.
Для определения электропроводности использовали прибор “Экспресс-анализатор метаболической активно- сти биокатализаторов” [1].
Глубинное культивирование лактобактерий и бифидобактерий осуществляли в реакторе на казеиново-дрожжевой среде при температуре (37±1) °С, при постоянном перемешивании, подаче углеводных добавок и рН-стати-ровании в интервале от 5,5 до 6,0. Посевной материал вносили в питательную среду в объеме 20%. В качестве углеводной добавки в процессе культивирования лактобактерий и бифидобактерий использовали 40%-й раствор глюкозы и глюкозо-лактозной смеси (15% лактозы и 25% глюкозы) соответственно. Прирост микробной биомассы определяли с помощью стандарта мутности 10 ед. и коэффициента светорассеяния в зависимости от культуры. Параллельно содержание общего количества клеток лактобактерий и бифидобактерий определяли оптическим методом. Концентрацию живых микробных клеток – методом десятикратных разведений с последующим посевом на среду МРС – IV и Блаурокка.
Результаты и обсуждение
Периодический процесс глубинного культивирования микроорганизмов играет важную роль в производстве пробиотических препаратов. В процессе роста микроорганизмов в жидкой питательной среде можно выделить несколько фаз, которые характеризуются определенной морфологией и физиологическим состоянием клеток [4].
На рисунках 1, 2 представлены полученные данные оптического метода и кондуктометрического, представляющие классические кривые роста Стокса с характерными фазами роста микробных клеток в процессе культивирования лактобактерий (рис. 1) и бифидобактерий (рис. 2).
Как видно из рисунка 1, первая фаза (лаг-фаза) характеризуется замедленным ростом популяции и продолжается 2 ч. Следующий период – экспоненциальная (логарифмическая) фаза (отрезок кривой от 3 до 11 ч). Эта фаза начинается после того, как клетки полностью адаптировались к заданным условиям и рост культуры не ограничивается ни недостатком питательных веществ, ни избытком продуктов обмена – скорость размножения клеток постоянна и максимальна. Процесс кислотообразо-вания замедляется к 10 ч культивирования и остается в дальнейшем неизменным. Таким образом, к концу экспоненциальной фазы (11 ч культивирования) количество клеток достигает своего максимального значения, значение мутности и рН – стабильно и не меняется на протяжении 2–3 после- дних часов культивирования.
Известно [3], что выживаемость лиофилизированных микробных клеток зависит от фазы развития культуры: наибольшей устойчивостью к лиофилизации характеризуются культуры, взятые для сушки в конце экспоненциальной, начале стационарной фаз. На полученных кривых роста (рис. 1, 2) наглядно выражены граница окончания экспоненциальной и начало стационарной фаз. Таким образом, кондуктометрический метод показал высокую чувствительность к фиксированию оконча-
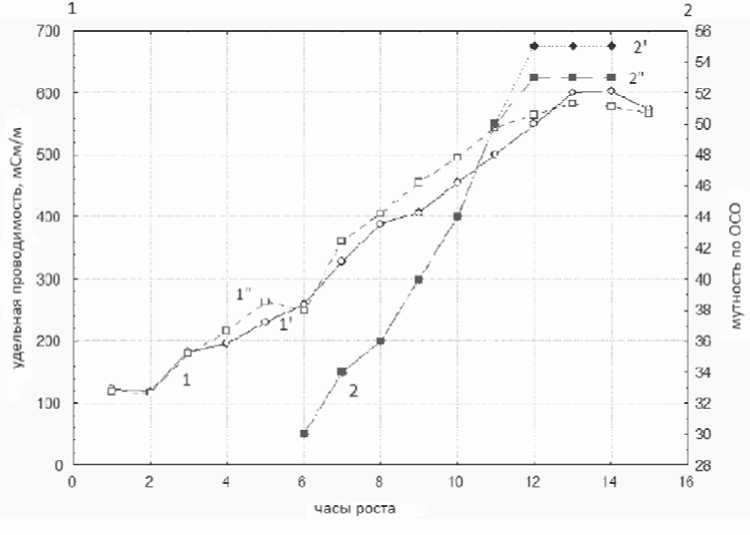
Рис. 1. Изменения удельной проводимости (1) и мутности (2) микробной суспензии лактобактерий штамма L. Plantarum 8Р-А3 в процессе культивирования: ′ – реактор 1, ′′ – реактор 2
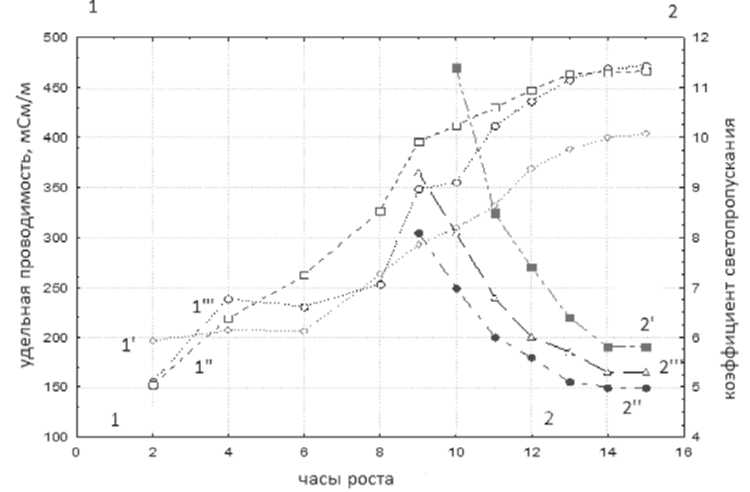
Рис. 2. Изменения удельной проводимости (1) и коэффициента светопропускания (2) микробной суспензии бифидобактерий штамма Bifidobacterium bifidum в процессе культивирования:
′ – реактор 1, ′′ – реактор 2, ′′′ – реактор 3
ния конца экспоненциальной фазы (начала стационарной фазы).
Между технологическими показателями (логарифмом мутности или коэффициента светопропускания) и удельной проводимостью наблюдается хорошая корреляционная зависимость (рис. 3, 4).
Известно, что повышение температуры увеличивает
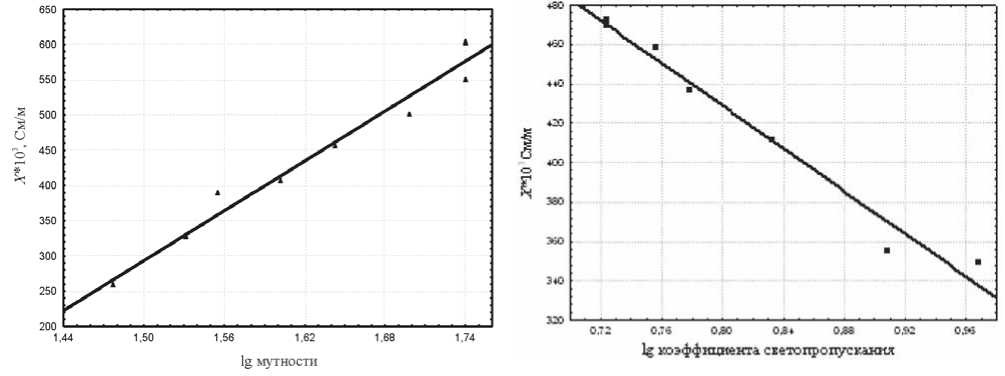
Рис. 4. Корреляционная зависимость логарифма коэффициента светопропускания и удельной проводимости микробной суспензии бифидобактерий Bifidobacterium bifidum (r =–0,9874, p=0,00003)
Рис. 3. Корреляционная зависимость логарифма мутности и удельной проводимости микробной суспензии лактобактерий штамма L. Plantarum 8Р-А3 (r=0,9837, p=0,000002)
удельную электропроводность за счет понижения вязкости раствора, уплотнения гидротированных ионов или увеличения степени диссоциации, в случае эндотермической реакции растворения электролита [2].
Кондуктометрический метод показал чувствительность к сбоям в технологическом процессе культивирования. На рисунке 2 показано, что в первом реакторе (1 ′′′ ) на 4-м ч роста при автоматической подачи аммиака в системе произошел сбой (в термостате увеличилась температура) и началось бурное кислотообразование молочной кислоты лактобактериями.
Заключение
Таким образом, кондуктометрический метод показал чувствительность к изменениям в технологическом процессе культивирования. Обоснована целесообразность применения кондуктометрического метода для контроля стационарной фазы роста микробной биомассы пробиотических микроорганизмов (лакто- и бифидобактерий) в технологическом процессе. Предлагаемый метод позволяет более точно определить технологически важный момент перехода экспоненциональной в стационар- ную фазы кривой роста микробной суспензии.
Работа выполнена при поддержке программы проведение поисковой научно-исследовательской работы в рамках реализации ФЦП “Научные и научно-педагогические кадры инновационной России” на 2009–2013 гг. № 54П и “Научные и научно-педагогические исследования для государственных нужд” на 2009–2013 гг. № 480П.
Список литературы Кондуктометрический метод для контроля прироста микробной биомассы пробиотических микроорганизмов
- Анализатор метаболической активности биокатализаторов: пат. 76340 Рос. Федерация. № 2008114221/22; заявл. 11.04.08; опубл. 20.09.08, Бюл. № 26. -2 с.
- Кутепов А.М. Экспериментальные методы химии растворов: денсиметрия, вискозиметрия, кондуктометрия и другие методы. -М.: Наука, 1997. -351 с.
- Несчисляев В.А., Семченко А.В., Моховикова В.Б. и др. Подготовка бактериальных культур к сублимационному высушиванию//Фундаментальные исследования. -2007. -№ 12. -С. 368-369.
- Петр С.Дж. Основы культивирования микроорганизмов и клеток. -М.: Мир, 1978. -332 с.


