Конроль развития плода у самок черноморской афалины (Tursiops truncatus ponticus Barabash,1940) во второй половине беременности
Автор: Семенов В.А., Родин И.А., Околелова А.И., Винокурова Д.П., Яковец М.Г., Шантыз А.Ю.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 10, 2019 года.
Бесплатный доступ
Цель исследований - выявление беременности у самок черноморской афалины с помощью ультразвуковой диагностики (УЗИ) и изучение динамики линейных размеров головы и грудной клетки плода во второй ее половине, а также показателей крови беременных самок в зависимости от сроков беременности в случаях благополучного и неблагополучного родоразрешения. В период с 2004 по 2017 год проводились исследования в различных дельфинариях на побережье Чёрного моря. Было выявлено 30 случаев беременности черноморских афалин и проведен ряд исследований. На протяжении всего периода исследований имели случаи благополучного и неблагополучного родоразрешения, что послужило причиной формирования двух групп рожденных. В первую группу включили благополучно родившихся детенышей, вовторую группу - мертворожденных или погибших в первый день после рождения. Достоверных отличий между размерами головы и грудной клетки на одном и том же месяце беременности у этих двух групп детенышей не отмечалось. Метод ультразвуковой диагностики присутствия беременности у самок дельфинов в сравнении с другими методами хорошо зарекомендовал себя...
Ультразвуковое исследование, беременность, черноморская афалина, гематологические показатели
Короткий адрес: https://sciup.org/140245587
IDR: 140245587 | УДК: 619:618.2]:639.2:599.537
Текст научной статьи Конроль развития плода у самок черноморской афалины (Tursiops truncatus ponticus Barabash,1940) во второй половине беременности
Введение . Период беременности у афалин длится приблизительно 12 ± 1 месяцев. К примеру, у индийской афалины ( T.t. Aduncus) с известными датами зачатия определяют срок 370 ± 11 дней [1]. Период лактации у афалин может продолжаться до 2 лет и даже более (у диких животных) [2]. Большинство самок впервые производят на свет детенышей в возрасте от 7 до 10 лет [3]. Полный репродуктивный цикл, или промежуток времени между родами, составляет 3–4 года. Продолжительность эстрального цикла у T. truncatus составляет от 21 до 42 дней [4– 6].
Все китообразные являются одноплодными животными, у которых случаи многоплодия очень редки и колеблются от 0,002 % у финвала (Balaenoptera physalus) до 0,5 % у белухи (Delphinapterus leucas). Одноплодность у китообразных связывают с необходимостью высокого уровня развития новорождённых и рассматривают как положительный эволюционно приобретенный признак, а редкие случаи многоплодия относят к атавистическим признакам [7]. По имеющимся данным [8] о многочисленных случаях родов у самок черноморской афалины в неволе, все они завершались рождением одного детеныша. В литературе упоминается всего два случая двуплодной беременности. Ни одна их них не имела благополучного исхода. В одном случае близнецы родились мёртвыми [9]; в другом – у самки произошли преждевременные роды, и спустя четыре месяца после её гибели, при вскрытии, у неё был обнаружен доношенный мацерированный плод [10].
Единственный, хорошо развитый детеныш рождается очень крупным – от 1/4 до 1/2 длины тела матери. Изредка в одной самке находят несколько зародышей. У синего кита однажды обнаружили семь, а у финвала и сейвала – по шесть зародышей. Это свидетельство былого многоплодия предков китообразных. Лишние зародыши обычно рассасываются, и только очень редко могут родиться двойни [11]. Гибель одного из эмбрионов у людей может привести к серьезным нарушениям здоровья второго или даже его гибели. По статистике, в случае смерти одного из эмбрионов в первой трети беременности вероятность нормального развития и рождения второго достигает 90 %. В этом случае происходит полное рассасывание эмбриона или его размягчение. Если смерть одного плода при двойне произошла на более поздних сроках, то у второго может развиться тяжелое поражение центральной нервной системы, внутренних органов или гибель [12].
Действие различных факторов окружающей среды на репродуктивный цикл свидетельствует о том, что процесс размножения находится под контролем нервных стимулов, передающихся в мозг. Основная часть передачи и преобразования этих стимулов, по-видимому, происходит в гипоталамусе и связанных с ним ядрах, нейроны которых секретируют кринотропные гормоны в портальную систему гипофиза [2]. Эти гормоны контролируют переднюю долю гипофиза, или аденогипофиза. К числу таких нейрогормонов относится гонадотропин-рилизинг-гормон (ГнРГ), который имеет первостепенное значение для регуляции эндокринных аспектов размножения млекопитающих. Активация ГнРГ-рецепторов в передней доле гипофиза вызывает секрецию в кровоток лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ). По мере роста и созревания фолликула вырабатывается эстроген за счет паракринного взаимодействия между клетками внутренней оболочки (theca interna) фолликула и зернистого слоя (гранулозы), выстилающего фолликул. Вначале рост синтеза эстрогена ингибирует и ЛГ-, и ФСГ-секрецию в гипофизе. По мере приближения созревающего фолликула к преову-ляционной стадии эстрогены, достигшие максимального уровня секреции, начинают оказывать положительное обратное действие на частоту и амплитуду выбросов ГнРГ, что приводит, в свою очередь, к преовуляторному выбросу ЛГ. ЛГ стимулирует образование в фолликуле низкомолекулярного гликопротеина, так называемого ингибина. Ингибин не только подавляет секрецию ФСГ, но и увеличивает чувствительность клеток theca interna преовуляционного фолликула к ЛГ [13]. Данное сочетание увеличения числа рецепторов к ЛГ и повышения чувствительности к ЛГ обеспечивает соответствующую реакцию на выброс ЛГ и овуляцию.
После овуляции зернистые и обкладочные клетки преобразуются в большие прогестерон-секретирующие и малые лютеиновые клетки соответственно [14]. Прогестерон и в меньшей степени эстроген, продуцируемые желтым телом, подавляют лютеинизирующий и фолликулостимулирующий гормоны, снижая уровень гонадотропин-рилизинг-гормона, высвобождаемого из гипоталамуса.
У содержащихся в Atlantis Marine Park (Западная Австралия) самок афалин использовалось ультразвуковое обследование в В-режиме для диагностики беременности и измерения растущего плода [15]. Обследование проводили примерно с месячным интервалом, используя ультразвуковой аппарат AlokaSSD260 (компании Aloka, Токио, Япония) с линейным датчиком частотой 33-5 МГц (AlokaUST-5021). Преобразователь был заключен в тонкий пластиковый пакет (для защиты от контакта с соленой водой) и снабжен большим количеством геля, чтобы обеспечить хороший контакт с объектом. Проводились замеры поперечного сечения грудной клетки на уровне 2-го или 3-го межреберья, диаметра черепа, ширины ребер и шейных позвонков, а также длины рострума. Из-за непродолжительности процесса визуализации были получены надлежащие изображения грудной клетки и диаметра черепа (затылочно-лобной оси), изображения остальных структур плода не дали надежных результатов. Определение размеров структур плода проводились путем сопоставления их с масштабной шкалой на экране ультразвукового аппарата. В результате исследований выявлена линейная зависимость увеличения параметров развивающегося плода. Сердцебиение плода регулярно визуализировалось и указывало на его жизнеспособность.
Особый интерес представляют исследования динамики роста головы и грудной клетки плода у самок с успешным родоразрешением с одной стороны, и неудачными родами – с другой.
Цель исследований. Выявление беременности у самок черноморской афалины (Tursiops truncatus ponticus Barabash,1940) с помощью ультразвукового исследования и изучение динамики линейных размеров головы и грудной клетки плода во второй половине беременности, а также анализов крови беременных самок, в зависимости от её сроков в случаях благополучного и неблагополучного родоразрешения.
Материалы и методы. Исследования проводились с 2004 по 2017 г. в различных дельфинариях на побережье Чёрного моря. Нами было выявлено 30 случаев беременности черноморских афалин у 15 самок в возрасте от 6,5 до 20 лет и проведено 203 исследования. В связи с отсутствием опыта по проведению ультразвукового обследования черноморских дельфинов на начальных этапах изучения данного вопроса не все исследования оказались корректными и достоверными, поэтому лишь 144 из них вошли в данную работу и подверглись биометрической обработке. Длина животных варьировала от 240 до 275 см, а вес в период отсутствия беременности или в начальной её стадии колебался от 172 до 283 кг.
Беременные животные во время обследования не вынимались из воды, а обследовались у бортика бассейна в боковом лежачем положении, которое позволяло в любой момент приподнять голову над уровнем воды и сделать беспрепятственно акт выдоха-вдоха. Кроме того, дельфины очень хорошо слышат ультразвуки, издаваемые ими же самими в воде, а также их отражения, которые легко проникают через тело этих животных и достигают внутреннего уха [7]. Поэтому требуется некоторое время, возможно, несколько сеансов с пищевым подкреплением, чтобы дельфин привык к ультразвуку, излучаемому датчиком ультразвукового аппарата, и при этом не проявлял бы беспокойства. Данные исследования были сконцентрированы на выявлении беременности с помощью ультразвукового обследования самок и изучении динамики дорсовентральных размеров головы и грудной клетки плода в сагиттальной плоскости во второй половине беременности. Голова измерялась по контурам костей, а грудная клетка – с учётом мягких тканей на уровне сердца. Срок беременности устанавливался ретроспективно от даты родов.
Все 30 случаев беременностей были разделены на две группы:
-
1) закончившиеся удачным родоразрешени-ем;
-
2) закончившиеся неудачным родоразреше-нием, характеризующимся появлением на свет мертворожденных детёнышей или погибших в первый день после рождения.
Биометрическая обработка промеров плода, а также результатов анализов крови самок в течение беременности проводилась как в целом во всех случаях исследований, так и по отдельности в каждой группе. Ультразвуковое обследование беременных самок осуществлялось с помощью аппарата SonoSite180 производства США с глубиной проникновения ультразвуковых волн до 22 см и конвексным преобразователем C60/5 – 2 MHz. Кровь для исследований брали из хвостовых вен – Superficial fluke vv . При этом клинический анализ крови выполнялся на автоматическом анализаторе «Cell-Dyn» (Abbott США) с использованием тест-систем фирмы Abbott США; биохимические исследования проводились на автоматическом анализаторе «ARCHITECT C-8000» (Abbott США) с использованием тест-систем фирмы Abbott США; концентрация прогестерона в крови определялась на автоматическом анализаторе «Architect i2000» (Abbott США) с использованием тест-систем фирмы Abbott США.
Результаты исследований и их обсуждение. Беременность во всех случаях в наших исследованиях завершалась родоразрешением через естественные родовые пути. Уровень плазменного прогестерона в период беременности колебался от 1,70 до 65,1 нг/мл и был в среднем равен 24,54 ± 1,882 нг/мл (число исследований равнялось 66), в то время как в отсутствии беременности он был достоверно ниже (P < 0,001), варьируя от 0 до 17,1 нг/мл, и был в среднем равен 2,14 ± 0,392 нг/мл (число исследований – 74). На протяжении второй половины беременности фиксировалось сердцебиение плода у всех беременных самок от 120 ударов в минуту на 6-м месяце и 117 ударов в минуту на
7-м месяце до 96 ударов в минуту в начале 12-го месяца, а затем до 76 в конце 12-го месяца за 5 дней до рождения.
Начиная с 6 до 9-го месяца беременности включительно размеры головы и грудной клетки плода каждый месяц достоверно (от P <0,05 до P <0,001) увеличивались в сравнении с предыдущим месяцем (табл. 1).
Таблица 1
Динамика изменений дорсовентральных размеров головы и грудной клетки (X ± m, см) плода в период беременности у самок черноморской афалины
|
Месяц беременности |
Дорсовентральные размеры головы (N=15, n=30) |
Дорсовентральные размеры грудной клетки (N=15, n=30) |
||
|
Количество исследований |
X ± m, см |
Количество исследований |
X ± m, см |
|
|
7-й |
10 |
6,5 ± 0,26 ** |
10 |
7,6 ± 0,21 ** |
|
8-й |
11 |
8,7 ± 0,50 * |
12 |
9,9 ± 0,45 *** |
|
9-й |
7 |
10,7 ± 0,12 * |
7 |
11,6 ± 0,29 ** |
|
10-й |
10 |
11,3 ± 0,24 |
10 |
12,9 ± 0,20 ** |
|
11-й |
11 |
12,0 ± 0,21 ** |
11 |
14,5 ±0,12 *** |
|
12-й |
8 |
14,1 ± 0,42 * |
5 |
14,8 ± 0,25 |
|
Итого |
57 |
55 |
||
Примечание. Здесь и далее : X – средняя арифметическая; m – стандартная ошибка для выборочной доли; N – число обследованных особей; n – число исследованных беременностей.
Достоверность различий между данным сроком беременности и предыдущим: * – P <0,05; ** – P <0,01; *** – P < 0,001
На 7-м месяце было выявлено увеличение грудной клетки плода до 7,6± 0,21 см, а головы – до 6,5 ±0,26 см (рис. 1).
На 8-м месяце диаметр грудной клетки увеличился до 9,9±0,45 см, а головы – до 8,7±0,50 см. На 9-м месяце рост грудной клетки достигает в среднем 11,6 ±0,29 см, а головы – 10,7±0,12 см.
На 10-м месяце грудная клетка плода продолжает достоверно (P <0,01) увеличиваться и достигает 12,9±0,20 см, а голова – 11,3±0,24 см.
На 11-м месяце диаметр грудной клетки (рис. 2) и головы также достоверно больше (P <0,001 и P <0,01), чем на 10-м месяце, и в среднем равен соответственно 14,5 ±0,12 и 12,0 ±0,21 см.
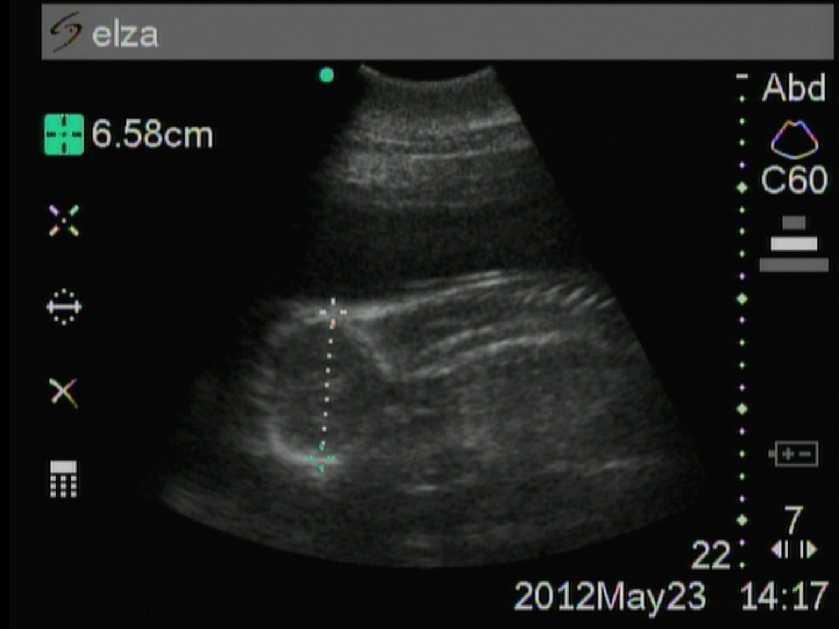
Рис. 1. Седьмой месяц беременности (голова)
Рис. 2. Одиннадцатый месяц беременности (грудная клетка)
Далее на последнем, 12-м месяце беременности (рис. 3 и 4) голова плода достоверно (P <0,01) увеличивалась, что нельзя сказать о грудной клетке. Размер грудной клетки изменился незначительно (14,8 ± 0,25 см), в то время как размер головы увеличивается до 14,1 ± 0,42 см и почти достигает показателей грудной клетки.
Величина диаметра грудной клетки опережает диаметр головы с 5-го и до 12-го месяца. При этом среди достоверных изменений размеров головы плода отмечалось наибольшее их увеличение в течение всего срока беременности на 8-м месяце, а именно на 33,8 % по сравнению с предыдущим, восьмым месяцем.
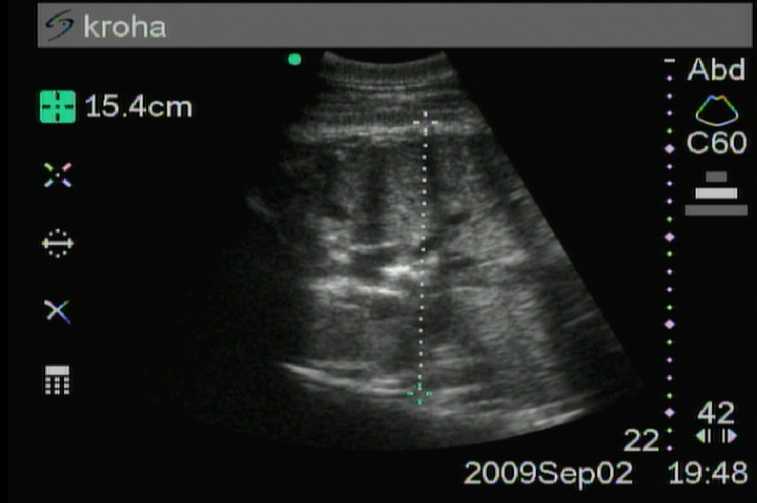
Рис. 3. Двенадцатый месяц беременности (грудная клетка )
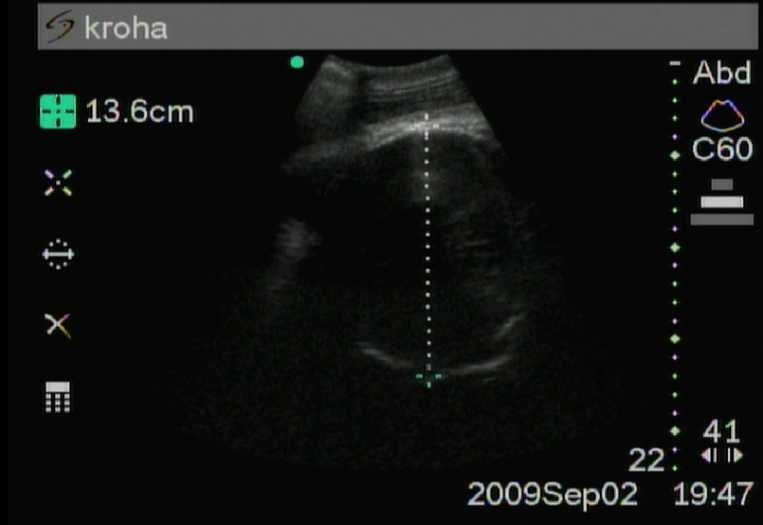
Рис. 4. Двенадцатый месяц беременности (голова)
На протяжении всего периода исследований имели случаи благополучного и неблагополучного родоразрешения, сформировавшие две группы рождённых. Особи первой группы благополучно родились и живут длительное время. Ко второй группе отнесли случаи, когда детёныши рождались мертвыми или погибали в первый день после рождения. Особый интерес составило не только сравнение промеров головы и грудной клетки детёнышей двух групп в пери- од беременности, но и показателей крови их матерей в этот момент жизни. Из таблиц 2 и 3 видно, что достоверные отличия между размерами головы и грудной клетки на одном и том же месяце беременности у этих двух групп детенышей афалины не отмечались.
В то же время, как видно из таблицы 4, различия между определёнными показателями крови беременных самок оказались существенными.
Таблица 2
Динамика изменений дорсовентральных размеров головы (X ± m, см) плода в период беременности у самок черноморской афалины
|
Месяц беремен-ности |
Нормальные родоразре-шения (N=11, n=20) |
Патологические родоразрешения (N=7, n=10) |
Все родоразрешения (N=15, n=30) |
|||
|
Количество исследований |
X ± m, см |
Количество исследований |
X ± m, см |
Количество исследований |
X ± m, см |
|
|
7-й |
9 |
6,5 ± 0,29 |
1 |
6,4 |
10 |
6,5 ± 0,26 |
|
8-й |
8 |
8,1 ± 0,43 |
3 |
10,3 ± 1,01 |
11 |
8,7 ± 0,50 |
|
9-й |
6 |
10,7 ± 0,13 |
1 |
11 |
7 |
10,7 ± 0,12 |
|
10-й |
8 |
11,3 ± 0,30 |
2 |
11,1 ± 0,10 |
10 |
11,3 ± 0,24 |
|
11-й |
6 |
12,1 ± 0,33 |
5 |
12,0 ± 0,27 |
11 |
12,0 ± 0,21 |
|
12-й |
5 |
13,4 ± 0,25 |
3 |
15,3 ± 0,46 |
8 |
14,1 ± 0,42 |
|
Итого |
42 |
15 |
57 |
|||
Таблица 3
Динамика изменений дорсовентральных размеров грудной клетки (X ± m, см) плода в период беременности у самок черноморской афалины
|
Месяц беременности |
Нормальные родоразреше-ния (N=11, n=20) |
Патологические родоразрешения (N=7, n=10) |
Все родоразрешения (N=15, n=30) |
|||
|
Количество исследований |
X ± m, см |
Количество исследований |
X ± m, см |
Количество исследований |
X ± m, см |
|
|
7-й |
9 |
7,9 ± 0,21 |
1 |
6,8 |
10 |
7,6 ± 0,21 |
|
8-й |
8 |
9,6 ± 0,55 |
4 |
10,5 ± 0,75 |
12 |
9,9 ± 0,45 |
|
9-й |
6 |
11,7 ± 0,34 |
1 |
11,3 |
7 |
11,6 ± 0,29 |
|
10-й |
8 |
13,0 ± 0,20 |
2 |
12,3 ± 0,50 |
10 |
12,9 ± 0,20 |
|
11-й |
7 |
14,5 ± 0,14 |
4 |
14,5 ± 0,26 |
11 |
14,5 ± 0,12 |
|
12-й |
4 |
14,8 ± 0,32 |
1 |
15 |
5 |
14,8 ± 0,25 |
|
Итого |
42 |
13 |
55 |
|||
Таблица 4
Гематологические показатели (X ± m, см) в период беременности у самок черноморской афалины
|
Показатель |
Нормальные родоразрешения (N=5, n=14) |
Патологические родораз-решения (N=4, n=7) |
Все родоразрешения (N=15, n=30) |
|||
|
Количество исследований |
X ± m, см |
Количество исследований |
X ± m, см |
Количество исследований |
X ± m, см |
|
|
Возраст, лет |
20 |
16,6 ± 1,20 |
10 |
9,8 ± 0,87 ** |
30 |
14,3 ± 1,03 |
|
Гемоглобин, г/л |
70 |
172,7 ± 1,36 |
33 |
162,3 ± 1,95 ** |
103 |
169,3 ± 1,21 |
|
Эритроциты, х 1012/л |
84 |
3,8 ± 0,05 |
45 |
3,7 ± 0,06 |
129 |
3,8 ± 0,04 |
|
Лейкоциты, х 109/л |
84 |
7,7 ± 0,20 |
45 |
7,3 ± 0,33 |
129 |
7,6 ± 0,17 |
|
Палочкоядерные нейтрофилы, % |
84 |
1,4 ± 0,12 |
45 |
2,2 ± 0,27 * |
129 |
1,7 ± 0,13 |
|
Сегментоядерные нейтрофилы, % |
84 |
54,1 ± 1,34 |
45 |
55,3 ± 1,30 |
129 |
54,5 ± 0.98 |
|
Эозинофилы, % |
84 |
19,3 ± 0,84 |
45 |
17,9 ± 1,21 |
129 |
18,8 ± 0,69 |
|
Лимфоциты, % |
84 |
21,6 ± 1,05 |
45 |
21,9 ± 1,45 |
129 |
21,7 ± 0,85 |
|
Моноциты, % |
84 |
3,3 ± 0,21 |
45 |
3,1 ± 0,33 |
129 |
3,2 ± 0,18 |
|
СОЗ, мм/ч |
75 |
2,9 ± 0,31 |
43 |
3,1 ± 0,57 |
129 |
3,0 ± 0,29 |
|
Прогестерон, нг/мл |
38 |
24,6 ± 2,67 |
28 |
24,4 ± 2,62 |
66 |
24,5 ± 1,88 |
|
Общий белок, г/л |
58 |
70,2 ± 0,89 |
32 |
68,8 ± 1,12 |
90 |
69,7 ± 0,70 |
|
Мочевина, моль/л |
52 |
16,2 ± 0,64 |
30 |
15,7 ± 0,70 |
82 |
16,0 ± 0,48 |
|
Креатинин, мкмоль/л |
58 |
125,4 ± 3,67 |
29 |
125,2 ± 5,44 |
87 |
125,3 ± 3,03 |
|
Глюкоза, моль/л |
58 |
5,02 ± 0,16 |
29 |
4,8 ± 0,24 |
87 |
5,0 ± 0,13 |
|
АЛТ, ед/л |
62 |
61,9 ± 5,77 |
32 |
78,4 ± 12,35 ** |
94 |
67,5 ± 5,69 |
|
АСТ, ед/л |
63 |
312,8 ± 24,17 |
32 |
315,1 ± 51,34 |
95 |
313,6 ± 23,42 |
|
ГГТ, ед/л |
60 |
37,9 ± 2,12 |
30 |
36,5 ± 3,48 |
90 |
37,4 ± 1,82 |
|
ЩФ, ед/л |
52 |
543,9 ± 57,98 |
26 |
809,0 ± 74,09 * |
78 |
632,2 ± 47,76 |
|
Железо, мкмоль/л |
55 |
28,4 ± 1,36 |
33 |
25,1 ± 1,15 |
88 |
27,1 ± 0,96 |
Примечание . Достоверность различий между данным сроком беременности и предыдущим: * – P
< 0,01; ** – P < 0,001.
Из данной таблицы видно, что достоверные различия по гематологическим показателям между группой благополучно родивших самок и неблагополучно родивших отмечаются в первую очередь по концентрации гемоглобина. У благополучно родивших количество гемоглобина в крови оказалось достоверно выше (P <0,001), чем у самок другой группы. В то же время у первых оказался достоверно ниже уровень аланинтрансаминазы (АЛТ) (P <0,001), что указывает на отсутствие токсикоза, целостность гепатоцитов и нормальную функцию печени. При этом относительное содержание палочкоядерных нейтрофилов тоже оказалось достовер- но меньше (P <0,01), чем у неблагополучно родивших афалин, у которых отмечался более выраженный «сдвиг влево» лейкоформулы. Этот факт говорит о большей востребованности у второй группы животных фагоцитоза нейтрофилами тканевых обломков и уничтожения опсонизированных микроорганизмов. В первой группе афалин также отмечался более низкий уровень щелочной фосфотазы (ЩФ) (P <0,01). Однако, если разница по содержанию гемоглобина, АЛТ и палочкоядерных нейтрофилов имеет клиническую ценность, то разница по концентрации ЩФ, уровень которой с возрастом афалин снижается приблизительно от 1300 до
200 ед/л, скорее указывает на относительно молодой возраст неблагополучно родивших самок (9,8 ± 0,87 лет), который оказался достоверно (P < 0,001) ниже возраста нормально родивших (16,6 ± 1,20 лет). Таким образом, данный показатель также имеет важное значение в вопросе благополучного родоразрешения самок дельфинов.
Выводы. В результате проведённых исследований нам удалось определить сроки беременности у самок черноморской афалины во второй половине беременности с помощью их ультразвукового обследования в фетальный период, выявить динамические различия в размерах головы и грудной клетки плода. Использование ультразвука для контроля беременности у китообразных в неволе предоставляет ценные данные о морфологии, развитии и благополучии плода. При этом учет таких параметров, как размеры грудной клетки и головы, могут играть важную роль в установлении сроков беременности. Кроме того, оценка размеров грудной клетки и головы является важной частью обследования плода для контроля его правильного развития.
Помимо этого, выявлены достоверные различия гематологических показателей между группой благополучно родивших самок с одной стороны, и неблагополучно родивших – с другой. Клиническую ценность имели различия по концентрации гемоглобина (P <0,001), аланин-трансаминазы (P <0,001) и относительному содержанию палочкоядерных нейтрофилов (P <0,01). Выявлен относительно молодой возраст (9,8±0,87 лет) неблагополучно родивших самок, который оказался достоверно (P <0,001) ниже возраста (16,6 ± 1,20 лет) благополучно родивших дельфинов.
Таким образом, становится ясно, что использование метода ультразвуковой диагностики актуально для определения беременности у черноморских афалин, её сроков и наблюдения за развитием плода. В то же время гематологические показатели беременных самок дают объективную оценку вероятности физиологически нормального родоразрешения.
Список литературы Конроль развития плода у самок черноморской афалины (Tursiops truncatus ponticus Barabash,1940) во второй половине беременности
- Brook F. The Use of Diagnostic Ultrasound in Assessment of the Reproductive Status of the Bottlenose Dolphin, Tursiops aduncas, in Captivity and Applications in Management of a Controlled Breeding Programme: Ph.D. thesis. - Hong Kong, Hong Kong Polytechnic University, Kowloon, 1997. - 339 p.
- Robeck T.R., Atkinson S.K.C., Brook F. Reproduction. In: Dierauf LA, Gulland FMD. = CRC Handbook of Marine Mammal Medicine. Second Edition. Boca Raton, 2001. - P. 193-226.
- Duffield D.A., Shell D., Dudley M. Demographic analysis of breeding bottlenose dolphins in North American zoological facilities: 1976-1998, in Report from the Bottlenose Dolphin Breeding Workshop, Duffield D.A. and Robeck T.R. (Eds.). - American Zoological Association Marine Mammal Taxon Advisory Group, Silver Spring, MD, 2000. - P. 139-156.
- Sawyer-Steffan J.E., Kirby. V.L. A study of serum steroid hormone levels in captive female bottlenose dolphins, their correlation with reproductive status, and their application to ovulation induction in captivity. - National Technical Information Service, PB80-177199, Springfield, VA, 1980.
- Kirby V.L., Ridgway S.H. Hormonal evidence of spontaneous ovulation in captive dolphins (Tursiops truncatus and Delphinus delphis) // Rep. Int. Whaling Comm. - Spec. Issue 6, 1984. - P. 459-464.
- Schroeder J.P. Reproductive aspects of marine mammal. - In CRC Handbook of Marine Mammal Medicine, Dierauf L.A. (Ed.), CRC Press, Boca Raton, FL, 1990. - P. 353-369.
- Яблоков А.В., Белькович В.М., Борисов В.И. Киты и дельфины. - М.: Наука, 1972. - 472 с.
- Ожаровская Л.В. Морфология репродуктивной системы черноморской афалины // Черноморская афалина Tursiops truncatus ponticus: морфология, физиология, акустика, гидродинамика / под ред. В.Е. Соколова, Е.В. Романенко. - М.: Наука, 1997. - С. 102-113.
- Ridgwey S.H., Benirschke K. Breeding dolphins: Present status, suggestions for the future: Final rep. to US Marine Mammals Comm. - Wash. (D.C.), 1977. - P. 308.
- Gray K.N., Conclin R.H. Multiple births and cardiac anomalies in the bottlenosed dolphin // Wildlife Diseases. - 1974. - Vol. 10. - P. 155-157.
- Томилин А.Г. Китообразные // Звери СССР и прилежащих стран. - М.: АН СССР, 1957. - Т. 9. - С. 756.
- Цивцивадзе Е.Б., Новикова С.В. Многоплодная беременность: современный взгляд на проблему ведения беременности и родов (обзор литературы) // Регулярные выпуски "РМЖ". - 2014. - № 1. - С. 16.
- Baird D.T., Smith K.B. Inhibin and related peptides in the regulation of reproduction, in Oxford Review of Reproductive Biology, Milligan, S.R. (Ed.). - Oxford University Press, Oxford, U.K., 1993. - P. 191-232.
- Hendricks D.M. Biochemistry and physiology of the gonadal hormones, in Reproduction in Domestic Animals, Cupps, P.T. (Ed.). - Academic Press, San Diego, CA, 1991. - P. 81-118.
- Williamson P., Gales N.J., Lister S. Use of real-time B-mode ultrasound for pregnancy diagnosis and measurement of fetal growth rate in captive bottlenose dolphins (Tursiops truncatus) // J. Reprod. Fertil. - 1990. - 88. - P. 543-548.


