Конструирование тест-систем на основе рекомбинантного нуклеокапсидного белка для серодиагностики чумы мелких жвачных
Автор: Середа А.Д., Морозова Д.Ю., Иматдинов А.Р., Лыска В.М., Живодеров С.П., Сливко И.А., Луницин А.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Ветеринарная вирусология, микробиология
Статья в выпуске: 6 т.54, 2019 года.
Бесплатный доступ
Чума мелких жвачных (ЧМЖ, Peste des petits ruminants) - острое лихорадочное вирусное заболевание мелких жвачных животных. В тяжелых случаях ЧМЖ, когда у животных проявляются клинические признаки, в образцах крови и тканей можно обнаружить вирусоспецифические антигены. У субклинически инфицированных животных ЧМЖ может быть диагностирована только путем серологического исследования. По простоте, высокой чувствительности и экономичности наиболее подходящим для диагностики и сероэпидемиологического надзора ЧМЖ считают тест-системы для непрямого и конкурентного иммуноферментного анализа (к-ИФА). Современные средства серодиагностики ЧМЖ разрабатывают на основе рекомбинантного нуклеокапсидного (N) белка (M. Munir с соавт., 2013). Рассматриваются различные варианты создания тест-систем для серодиагностики ЧМЖ, в частности, с использованием поликлональных сывороток к N-белку для к-ИФА или модификаций непрямого ИФА. В настоящем сообщении мы представляем результаты изучения двух модификаций созданных нами на основе рекомбинантного N-белка тест-систем для серодиагностики ЧМЖ в сравнении с коммерческим набором ID Screen® PPR Competition («IDvet», Франция). Целью этой работы было изучить характеристики компонентов экспериментальных тест-систем для диагностики ЧМЖ на основе рекомбинантного N-белка методом непрямого ИФА с пероксидазным конъюгатом протеина А и конкурентного ИФА (к-ИФА) с пероксидазным конъюгатом IgG из поликлональных кроличьих сывороток к нуклеокапсидному белку. В результате иммунизации кроликов очищенным рекомбинантным N-белком получены сыворотки с титрами 1:512-1:1024 при тестировании с помощью к-ИФА. Возможность конструирования тест-системы для диагностики ЧМЖ методом непрямого ИФА, в которой для выявления связавшихся с антигеном ЧМЖ-специфических антител использовали пероксидазный конъюгат протеина А, продемонстрирована в экспериментах с сыворотками от коз-реконвалесцентов, а также кроликов, иммунизированных N-белком. Важно, что пероксидазный конъюгат протеина А реагировал с антителами сывороток коз в составе иммунных комплексов. Показано, что антитела сыворотки крови кролика, иммунизированного очищенным рекомбинантным N-белком, реагируют с теми же антигенными детерминантами, что и антитела положительной сыворотки козы. Для конструирования тест-системы для серодиагностики ЧМЖ методом к-ИФА был изготовлен пероксидазный конъюгат на основе IgG, выделенных из специфичной к N-белку сыворотки кролика. Сыворотки свиней, иммунизированных очищенным вирусом ЧМЖ, и вакцинированных против ЧМЖ коз с титрами в реакции нейтрализации от 1:64 и выше были положительными при исследовании методом к-ИФА с применением компонентов экспериментальной тест-системы. Полученные результаты позволяют положительно оценивать перспективу разрабатываемых тест-систем для применения в диагностике ЧМЖ.
Чума мелких жвачных, серодиагностика, иммуноферментный анализ, рекомбинантный нуклеокапсидный белок
Короткий адрес: https://sciup.org/142226282
IDR: 142226282 | УДК: 636.3:619:616.98:578:577.2 | DOI: 10.15389/agrobiology.2019.6.1225rus
Текст научной статьи Конструирование тест-систем на основе рекомбинантного нуклеокапсидного белка для серодиагностики чумы мелких жвачных
Чума мелких жвачных (ЧМЖ, Peste des petits ruminants) — это острая, заразная и экономически значимая вирусная инфекция мелких жвачных животных (козы, овцы, газели, ориксы, белохвостые олени) с заболеваемостью и смертностью соответственно 100 и 90 % (1). Клинически заболевание напоминает чуму крупного рогатого скота и характеризуется тяжелой гипертермией, некротическим и эрозивным стоматитом, энтеритом и пневмонией (2). Передача вируса осуществляется при тесном контакте восприимчивых животных через секреты и экскреты больных особей. Крупный рогатый скот, буйволы и свиньи могут быть заражены вирусом ЧМЖ естественным образом или экспериментально, но они становятся тупиковыми хозяевами, поскольку вирус от них не передается другим
Работа выполнена при поддержке субсидии Министерства науки и высшего образования Российской Федерации ¹ 0451-2019-0005.
животным (3, 4). Иммунная защита молодняка сроком до 4 месяцев приобретается с молозивом (5).
Вирус ЧМЖ (Peste-des-petits-ruminants virus, PPRV) относится к роду Morbillivirus семейства Paramyxoviridae (6-8). Из четырех известных линий вируса ЧМЖ распространение одной (линия 4) ограничено Азией, а другие распространены в Африке (9).
В лабораторной диагностике болезни для обнаружения вирусоспецифических антигенов и антител применяют реакции нейтрализации вируса (РН) (10), диффузионной преципитации (11), встречного иммуно-электроосмофореза, непрямой иммунофлуоресценции (12, 13), прямой и непрямой варианты иммуноферментного анализа (ИФА) (14), а также конкурентный ИФА (к-ИФА) на основе моноклональных антител (15-18).
В тяжелых случаях ЧМЖ, когда у животных проявляются клинические признаки, в образцах крови и тканей обнаруживаются вирусные антигены. У субклинически инфицированных животных ЧМЖ может быть диагностирована только при серологическом исследовании. Реакция нейтрализации для выявления антител к вирусу ЧМЖ трудоемка и затратна, требует использования инфекционного вируса, предполагает работу с культурами клеток и наличие квалифицированного персонала. По этим причинам для крупномасштабных рутинных исследований применение РН затруднительно. Альтернативу РН составляют быстрые, недорогие и чувствительные серологические тесты на основе различных вариантов ИФА, которые успешно применяются в диагностике многих заболеваний.
По простоте, высокой чувствительности и экономичности наиболее подходящим для диагностики и сероэпидемиологического надзора ЧМЖ считают тест-системы для непрямого и конкурентного ИФА. Они могут быть ориентированы на выявление присутствия гемагглютинина (H) (15, 16, 19) или нуклеокапсидного (N) белка (20-25).
Следует отметить, что у большинства одноцепочечных РНК-вирусов, включая вирус ЧМЖ, N-белок является высоко консервативным и наиболее иммуногенным белком. Это объясняется тем, что ген N-белка расположен близко к 3’-концу генома вируса и, поэтому, транслируется в количествах, превышающих любые другие структурные белки вируса ЧМЖ (26). Образующиеся против N-белка антитела не защищают животных от болезни, но, с учетом его иммуногенности и высокого уровня продукции, N-белок считают наиболее приемлемым антигеном для разработки средств диагностики ЧМЖ (27). Кроме того, N-белок, по-видимому, имеет как типоспецифичные, так и перекрестно-реактивные эпитопы, которые сохраняются в вирусе ЧМЖ из линий, происходящих из различных географических регионов. С учетом вышесказанного, современные средства серодиагностики ЧМЖ разрабатывают на основе рекомбинантного N-белка (28). Пероксидазные конъюгаты для тест-систем на основе различных вариантов ИФА готовят с использованием IgG антивидовых сывороток или моноклональных антител (МАТ) к иммуноглобулинам животных, а также МАТ к N-белку. Однако случайная потеря продуцирующих МАТ гибридных клонов из-за лабораторной аварии или ненадлежащих условий хранения может создать проблемы в производстве тест-систем (29). Поэтому прорабатываются различные варианты создания тест-систем для серодиагностики ЧМЖ, в частности с использованием поликлональных сывороток к N-белку для к-ИФА или модификаций непрямого ИФА.
В настоящей работе мы представляем результаты изучения двух модификаций созданных нами на основе рекомбинантного N-белка тест-систем для серодиагностики ЧМЖ в сравнении с коммерческим набором 1226
ID Screen® PPR Competition («IDvet», Франция). Результаты проверки полученных компонентов этих тест-систем для непрямого и конкурентного ИФА на ЧМЖ-положительных антисыворотках коз и свиней позволяют положительно оценивать перспективу применения предлагаемых нами тест-систем для серодиагностики ЧМЖ.
Целью этого исследования было конструирование тест-систем для диагностики ЧМЖ на основе рекомбинантного N-белка в непрямом ИФА с пероксидазным конъюгатом протеина А и в конкурентном ИФА с пероксидазным конъюгатом IgG поликлональных кроличьих сывороток к нуклеокапсидному белку.
Методика. Животных (козы, свиньи, кролики) получали из сектора подготовки животных (ФИЦВиМ), содержали в стандартных условиях и использовали в соответствии с требованиями ГОСТ Р от 02.12.2009 534342009 «Принципы надлежащей лабораторной практики (GLP)». В период акклиматизации и эксперимента животных размещали в индивидуальных станках и клетках в соответствии с требованиями GLP (30). Брикетированные комбикорма и очищенную воду животным давали ad libitum в кормушки и поилки.
Коз прививали Вирусвакциной против чумы мелких жвачных сухая культуральная (ФГБНУ ФИЦВиМ) согласно инструкции по применению.
Вакцинный штамм 45G37/35-К вируса ЧМЖ получили из Государственной коллекции микроорганизмов ФИЦВиМ. Накопление вируса ЧМЖ и определение его инфекционной активности осуществляли соответственно в полистироловых матрасах и 48-луночных планшетах («Costar», Франция). Использовали культуру клеток Vero (коллекци я Федерального исследовательского центра вирусологии и микробиологии) в поддерживающей среде Игла МЕМ («ПанЭко», Россия) с 2,5 % сыворотки крови плода крупного рогатого скота. При титровании вируссодержащий материал последовательно разводили 10-кратно в 4 повторностях. Зараженную и контрольную культуры клеток Vero выдерживали при температуре 37 °С в воздушной атмосфере с 5 % СО2, заменяя поддерживающую среду каждые 2-3 сут. Результаты учитывали по цитопатическому действию в течение 10 сут. Титр вируса рассчитывали по Б.А. Керберу в модификации И.П. Ашмарина и выражали в lg ТЦД50/см3 (31).
Двух коз (¹¹ 1, 2) породы русская белая в возрасте 1 года прививали 1-кратно подкожно . У козленка (¹ 3), рожденного от вакцинированной козы ¹ 1, в возрасте 1 мес брали кровь. У взрослых коз кровь для исследования брали на 28-е сут после вакцинации.
Четырех свиней (¹¹ 1-4) породы крупная белая массой 25-30 кг иммунизировали 1-кратно очищенным концентрированным вирусом ЧМЖ (штамм 45G37/35-К), вводя его внутримышечно и интраназально по 2,5 см3 с титром 105 ТЦД50/см3. Вирионы очищали методом дифференциального центрифугирования. Для этого культуральную суспензию вируса с титром 105 ТЦД50/см3 объемом 30 см3 центрифугировали при 5000 g 40 мин (J68, «Beckman Coulter», США) для удаления клеточного дебриса, надосадок повторно центрифугировали через сахарозную подушку (20 %, масса/объем) при 45000 g в течение 4,5 ч (Avanti JXN-30, «Beckman Coulter», США). По окончании надосадок декантировали, а осадок ресуспендировали в 20 см3 фосфатного буферного раствора (ФБР, рН 7,2). Из крови, взятой у свиней на 0-е и 28-е сут, получали образцы сыворотки.
Четырех кроликов (¹¹ 1-4) породы Шиншилла массой 1,5-2,0 кг иммунизировали очищенным рекомбинантным N-белком по следующей схеме: ¹ 1 — 200 мкг N-белка с полным адъювантом Фрейнда (ПАФ) на
0-е сут внутрикожно в подушечки стоп всех четырех конечностей и повторно на 25-е сут внутримышечно в верхнюю часть бедра, после чего на 50-е и 57-е сут по 200 мкг N-белка без адъюванта внутривенно в ухо; ¹ 2 — аналогично ¹ 1, но по 40 мкг N-белка, ¹ 3 — аналогично ¹ 1, но с неполным адъювантом Фрейнда (НАФ), ¹ 4 — аналогично ¹ 2, но с НАФ. На 64-е сут кроликов обескровливали post mortem. IgG из антисывороток очищали согласно описанию (32). Рекомбинантный N-белок вируса ЧМЖ из лизатов клеток полученного ранее нами клона E. coli pET32а/N/10 очищали методом металл-хелатной хроматографии (Ni Sepharose HIS-Select Nickel Affinity Gel, «Sigma-Aldrich», США) в нативных условиях. Белок элюировали ступенчато водными растворами имидазола (50, 100, 250 и 500 мМ). Во фракции элюата с 500 мМ имидазолом конечную концентрацию рекомбинантного N-белка после диализа против ФБР доводили до 2 мг/см3.
Реакцию нейтрализации (РН) проводили со штаммом 45G37/35-К вируса ЧМЖ в соответствии с рекомендацией OIE (World Organisation for Animal Health), 2016 (2).
Конъюгаты пероксидазы хрена («Sigmа», США) с IgG или с протеином А («Sigma», США) для разработанных тест-систем на основе ИФА изготавливали согласно описанию (33).
Для конкурентного или непрямого ИФА на стрипы («Eppendorf», ФРГ) иммобилизовали очищенный рекомбинантный N-белок в концентрации 0,25 мкг/см3 в карбонат-бикарбонатном буфере (pH 9,6) (по 50 мкл на лунку в течение 16 ч при 4 °С; 96-луночные планшеты, «Corning», США). Затем трижды по 1,0 мин промывали лунки 300 мкл ФБР с 0,1 % Tween 20 (ФБР-т), далее активные сайты полистирола блокировали ФБР-т с 1 % казеина (блокирующий раствор, по 100 мкл в каждую лунку) в течение 1 ч при 37 °С. Затем лунки отмывали один раз ФБР-т и удаляли влагу. Исследуемые сыворотки, разведенные в блокирующем растворе, вносили в лунки (по 50 мкл на лунку) и оставляли на 2 ч при 37 °С. Далее после 3-кратной отмывки ФБР-т в лунки вносили конъюгат из коммерческого набора или исследуемые конъюгаты, разведенные в блокирующем растворе, и инкубировали 1,5 ч при 22 °С, после чего лунки 3-кратно промывали ФСБ-т и вносили по 100 мкл хромогенного субстратного раствора АБТС — 2,2'-азино-бис-(3-этилбензтиозолин-6-сульфокислоты) диаммониевая соль, («Thermo Scientific», США) с добавлением H2O2. Спустя 15-20 мин инкубации в темноте при температуре 22 °С результаты реакций считывали на спектрофотометре Sunrise («Tecan», Австрия) при X = 405 нм (OD405).
В качестве контрольной тест-системы в работе использовали коммерческий набор ID Screen® PPR Competition («IDvet», Франция), предназначенный для выявления в сыворотке или плазме крови овец и коз антител к нуклеопротеину вируса ЧМЖ. Конъюгат в этом наборе представляет собой меченные пероксидазой моноклональные мышиные антитела к рекомбинантному N-белку вируса ЧМЖ.
Статистическую обработку полученных данных проводили при помощи пакета программ Microsoft Excel 2010. Определяли средние значения ( M ), стандартные ошибки среднего (±SEM). Средние значения показателей сравнивали по t -критерию Стьюдента. Различия считали статистически значимыми при р < 0,05.
Результаты. Первоначально с целью получения кроличьих поликлональных антител к нуклеокапсидному белку вируса ЧМЖ были испытаны четыре схемы иммунизации, различающиеся по дозе вводимого животному N-белка (40 и 200 мкг) и типу адъюванта (полный или неполный адъюванты Фрейнда). Активность антител к N-белку в полученных сыворотках 1228
крови кроликов исследовали методом к-ИФА с использованием коммерческого набора ID Screen® PPR Competition (рис. 1). Все исследованные сыворотки имели титры 1:512-1:1024. При этих разведениях значения OD405 были более чем в 2,5 раз ниже, чем при крайнем разведении 1:8192 или с контрольными сыворотками, полученными до иммунизации. Наиболее предпочтительной оказалась сыворотка, полученная в результате иммунизации кролика ¹ 1 N-белком в дозе 200 мкг с полным адъювантом Фрейнда. При ее разведении 1:1024 OD405 = 0,2, тогда как аналогичная оптическая плотность по результатам интерполяции достигается с сыворотками ¹ 2 при разведении 1:172, ¹ 3 — 1:768 и ¹ 4 — 1:256.
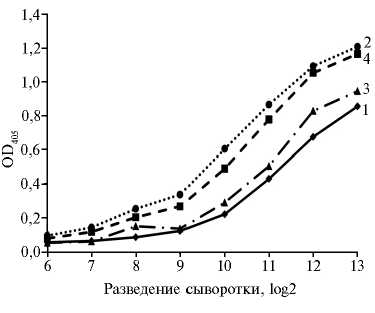
Рис. 1. Активность антител к N-белку в сыворотках крови кроликов ¹¹ 1-4 ( 1-4) , иммунизированных очищенным рекомбинантным нук-леокапсидным белком вируса чумы мелких жвачных (лабораторное заражение).
Разведение конъюгата
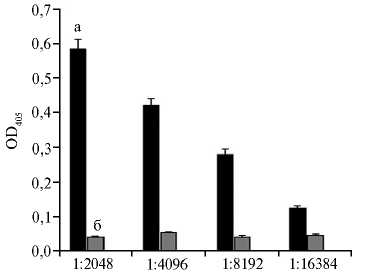
Рис. 2. Результаты титрования пероксидазного конъюгата протеина А на экспериментальных стрипах с отрицательной (а), положительной (б) сыворотками крови кролика ¹ 1 в разведении 1:1024 (непрямой вариант ИФА, М ±SEM, n = 4, лабораторное заражение).
В модельном эксперименте в лунки с иммобилизованным очищенным рекомбинантным N-белком вносили положительную и отрицательную сыворотки крови кролика ¹ 1 в разных разведениях, после инкубирования и отмывки вносили пероксидазный конъюгат протеина А в разведении 1:500. Результаты, представленные на рисунке 2, подтверждают, что пероксидазный конъюгат протеина А напрямую не взаимодействует с N-белком и выявляет положительные к N-белку антитела кролика до разведения сыворотки 1:16384, что свидетельствует о высокой аналитической чувствительности этого варианта непрямого ИФА. Самое высокое соотношение OD405 для положительной и отрицательной сыворотки кролика ¹ 1 было при их разведениях 1:2048 (см. рис. 2).
Для выявления антител к вирусу ЧМЖ у коз стрипы сенсибилизировали очищенным рекомбинантным N-белком. Затем в лунки вносили отдельно отрицательные и положительные сыворотки коз из коммерческого набора или кролика ¹ 1 в разведении 1:2048. После инкубирования с пероксидазным конъюгатом протеина А по результатам учета реакции соотношения значений ОD405 с положительной и отрицательной козьими сыворотками составило 5,54, с сыворотками кролика ¹ 1 — 7,99. Важно, что пероксидазный конъюгат протеина А в наших экспериментах реагировал с антителами козьих сывороток в составе иммунных комплексов. Таким образом, полученные результаты свидетельствуют о возможности применить пероксидазного конъюгата протеина А в тест-системах для диагностики ЧМЖ методом непрямого ИФА (см. рис. 2).
При разработке к-ИФА необходимо было ответить на вопрос о со- ответствии антигенных детерминант на N-белке, с которыми взаимодействуют антитела из козьих сывороток и антитела из сыворотки иммунизированного N-белком кролика ¹ 1. Мы выяснили, блокируют ли антитела положительной сыворотки коз из коммерческого набора взаимодействие антител положительной сыворотки кролика ¹ 1 с антигенными детерминантами рекомбинантного N-белка. Для этого в одни лунки стрипов с иммобилизованным N-белком отдельно добавляли отрицательные или положительные козьи сыворотки, а в другие — сначала вносили отрицательную или положительную сыворотку коз из коммерческого набора, а затем (после инкубирования в течение 2 ч и 3-кратной отмывки) — отрицательную или положительную сыворотку кролика ¹ 1 в разведении 1:2048. После отмывки во все лунки добавляли пероксидазный конъюгат протеина А в разведении 1:2000. Результаты представлены на рисунке 3.
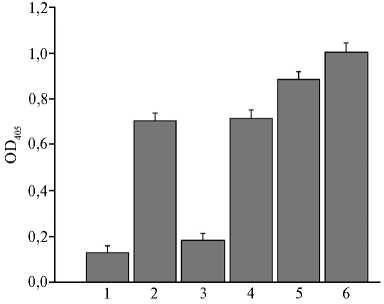
Рис. 3. Результаты непрямого ИФА с использованием иммобилизованного рекомбинантного N-белка, пероксидазного конъюгата протеина А и разных сывороток: 1 и 2 — соответственно отрицательная и положительная козьи сыворотки из коммерческого набора ID Screen® PPR Competition («IDvet», Франция); 3 — последовательное использование отрицательной сыворотки козы из коммерческого набора и отрицательной сыворотки кролика ¹ 1; 4 — последовательное использование положительной сывороткой козы из коммерческого набора и отрицательной сывороткой кролика ¹ 1; 5 — последовательное использование отрицательной сывороткой козы из коммерческого набора и положительной сывороткой кролика ¹ 1; 6 — последовательное использование положительной сывороткой козы из коммерческого набора и положительной сывороткой кролика ¹ 1 (М±SEM, n = 4, лабораторное заражение).
Предварительное инкубирование иммобилизованного N-белка с отрицательной или положительной сывороткой коз из коммерческого набора и последующее — с отрицательной сывороткой крови кролика ¹ 1 приводит к недостоверному изменению (р > 0,05) показателей OD405. Последовательное инкубирование положительной козьей сыворотки и положительной сыворотки кролика ¹ 1 привело к увеличению OD405 с 0,70 до 1,00 (р < 0,05) (см. рис. 3). Из этого следует, что у кролика, иммунизированного очищенным рекомбинантным N-белком, антитела реагируют в основном с теми же антигенными детерминантами, что и антитела из положительной сыворотки козы. Вместе с тем существует вероятность того, что антитела из сыворотки кролика ¹ 1 реагируют с антигенными детерминантами, недоступными антителам из ЧМЖ-положительной сыворотки крови коз.
Для конструирования тест-системы для серодиагностики ЧМЖ в к-ИФА был изготовлен пероксидазный конъюгат на основе IgG, выделенных из положительной сыворотки кролика ¹ 1. Приготовленный конъюгат титровали на экспериментальных стрипах с иммобилизованным в лунках очищенным рекомбинантным N-белком в дозе 0,0125 мкг на лунку и с использованием отрицательной и положительной сывороток кролика ¹ 1 в разведении 1:1024 (рис. 4). По результатам к-ИФА соотношение OD405 с отрицательной и положительной сыворотками кролика ¹ 1 с конъюгатом, взятым в разведении 1:500, составляло 2,66, 1:1000 — 3,60, 1:2000 — 3,38, 1:4000 — 4,25, 1:8000 — 1,59. Разведение конъюгата 1:4000 приняли в каче-1230
стве рабочего. Конъюгат не вступал в реакцию с контрольным антигеном, приготовленным из нетрансформированной 16-часовой культуры E. coli
Rosetta 2(DE3)pLysS.
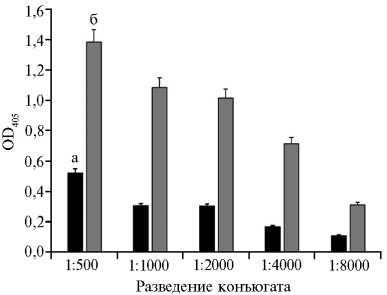
Рис. 4. Результаты титрования пероксидазного конъюгата, полученного на основе IgG кролика, на экспериментальных стрипах с отрицательной (а) и положительной (б) сыворотками кролика ¹ 1 в разведении 1:1024 (конкурентный ИФА, М ±SEM n = 4, лабораторное заражение).
Далее в к-ИФА на экспериментальных стрипах с использованием или изготовленного нами, или коммерческого конъюгата сравнили коммерческие сыворотки коз с сыворотками кролика ¹ 1 (табл. 1). С обоими конъюгатами получили положительные результаты, но соотношение значений OD405 для отрицательной и положительной козьих сывороток с коммерческим конъюгатом было выше, чем с пероксидазным конъюгатом IgG кролика ¹ 1.
-
1. Исследование отрицательных и положительных козьих сывороток из коммерческого набора ID Screen® PPR Competition («IDvet», Франция) и сывороток кролика ¹ 1 (конкурентный ИФА, M ±SEM, n = 3, лабораторное заражение)
Сыворотка
Экспериментальный конъюгат, 1:4000
Коммерческий конъюгат
сыворотка
кролика ¹ 1
коммерческая сыворотка коз
сыворотка
кролика ¹ 1
коммерческая сыворотка коз
Отрицательная ( - )
0,63±0,04
0,46±0,03
0,56±0,05
0,59±0,03
Положительная (+)
0,08±0,01
0,17±0,01
0,07±0,01
0,10±0,00
- /+
7,9
2,7
8,0
5,9
-
2. Исследование сывороток крови вакцинированных коз и инокулированных очищенным вирусом чумы мелких жвачных свиней в реакции нейтрализации и методом конкурентного иммуноферментного анализа с использованием экспериментальной тест-системы ( M ±SEM, n = 3, лабораторное заражение)
Номер животного
|
Сыворотка |
свиньи |
козы |
|||||
|
¹ 1 |
¹ 2 |
¹ 3 |
¹ 4 |
¹ 1 |
¹2 |
¹3 |
|
|
Реакция нейтрализации |
|||||||
|
Титр |
1:64 |
1:128 |
1:64 |
1:128 |
1:32 |
1:128 |
1:4 |
|
Конкуре |
нтный |
иммуноферментный анализ |
|||||
|
Отрицательная ( - ) |
1,21±0,13 |
1,17±0,09 |
0,89±0,07 |
0,90±0,08 |
0,30±0,02 |
0,32±0,02 |
0,33±0,04 |
|
Положительная (+) |
0,33±0,05 |
0,32±0,02 |
0,30±0.02 |
0,33±0,01 |
0,18±0,01 |
0,10±0,01 |
0,17±0,01 |
|
- /+ |
3,7 |
3,6 |
3,0 |
2,7 |
1,7 |
3,2 |
1,9 |
С использованием компонентов экспериментальной тест-системы, включающей стрипы с иммобилизованным очищенным рекомбинантным N-белком и пероксидазный конъюгат IgG сыворотки кролика ¹ 1, иммунизированного N-белком, были исследованы сыворотки у четырех свиней, которых инокулировали очищенным вакцинным вирусом ЧМЖ (¹¹ 14), а также двух вакцинированных коз (¹¹ 1, 2) и 1-месячного козленка (¹ 3), рожденного от вакцинированной козы (¹ 1) (табл. 2). Все сыворотки свиней, инокулированных очищенным вирусом ЧМЖ, оказались положительными в к-ИФА, поскольку соотношение значений OD405 для отрицательных и положительных сывороток было больше 2,5. Из двух вакцинированных коз положительной оказалась антисыворотка у животного ¹ 2. По данным РН, все исследованные сыворотки были положительными, однако титр вируснейтрализующих антител у козы ¹ 2 был выше, чем у козы ¹ 1. Полученные данные свидетельствуют, что в конкурентном варианте ИФА для диагностики ЧМЖ можно использовать пероксидазные конъюгаты, полученные на основе IgG кроликов, иммунизированных очищенным рекомбинантным N-белком вируса ЧМЖ.
Преимущество серологического анализа при ЧМЖ в том, что антитела к вирусу ЧМЖ можно выявлять у животных-реконвалесцентов (34). Мы сопоставили результаты непрямого ИФА, полученные с разработанной нами системой и тест-системой индийских специалистов, в которой использовали в качестве антигена очищенные вирионы аттенуированного вируса ЧМЖ, выращенного в клеточной культуре Vero, и пероксидазный конъюгат кроличьих IgG против IgG коз (17). Тест-система включала стандартные контроли (конъюгат, сыворотки коз и овец отрицательные, с высокими и низкими значениями титров антител). Средние значения OD405 у коз в случае отрицательных сывороток и сывороток с высокими и низкими значениями титров антител составляли соответственно 0,19±0,07; 1,13±0,09 и 0,75±0,08. Однако OD405 с образцами контрольной панели сывороток овец имели значения 0,15±0,05; 0,95±0,08 и 0,49±0,07. По мнению авторов работы, это связано с неполной перекрестной реактивностью антикозьего конъюгата с овечьими антителами. Средние значения OD405 для «пустой» контрольной реакции (реакция между реконвалесцентными козьими антителами к вирусу ЧМЖ и конъюгатом в отсутствие антигена) и контроля конъюгата без антител были соответственно 0,14±0,05 и 0,12±0,02 (17). В наших исследованиях с экспериментальной тест-системой для непрямого ИФА с отрицательной и положительной сыворотками коз из коммерческого набора значение OD405 составило 0,13 и 0,70, а с отрицательной и положительной сыворотками кролика ¹ 1 в разведении 1:1024 — 0,09 и 0,74. Известно, что иммуноглобулины коз слабо связываются с протеином А (35). Также сообщалось, что связывание антигена Fab-фрагментами увеличивает аффинность между Fc-фрагментом IgG и белком А (36). Это расширяет возможность использования белка А в ИФА, позволяя применять IgG животных, слабо взаимодействующие с ним. Так, козьи и овечьи IgG, связанные с антигеном, в 100 раз сильнее взаимодействуют с белком А, чем без антигена. Важно отметить, что в наших экспериментах пероксидазный конъюгат протеина А реагировал с антителами козьих сывороток. Таким образом, полученные результаты свидетельствуют о возможности использования пероксидазного конъюгата протеина А в тест-системах для диагностики ЧМЖ методом непрямого ИФА.
Для замены реакции нейтрализации при массовом исследовании крови животных ранее была предложена тест-система к-ИФА, в которой в качестве антигена использовали лизат культуры клеток, зараженной аттенуированным штаммом вируса ЧМЖ, и моноклональные антитела, полученные на нейтрализующий эпитоп Н-белка (37). Преимущества теста, по мнению авторов цитируемой публикации, заключаются в простоте, быстром получении результата, меньшей зависимость от качества образцов сывороток, удобстве при исследовании большого числа образцов. Относительно РН его чувствительность составила 92,2 %, специфичность — 98,4 %. Авторы отмечают, что обычно в крови титры антител в к-ИФА были на 1-3 log2 ниже, чем в РН. Как правило, титры антител в РН после вакцинации, особенно у овец, составляли от 1:8 до 1:16. Сыворотки с низкими значениями титров антител в РН были отрицательными в к-ИФА. Поэтому для выявления положительных проб предложено выбирать низкое отсечение (среднее отрицательное значение +2 стандартных отклонения) (38).
Таким образом, установлено, что у кроликов, иммунизированных очищенным рекомбинантным N-белком вируса чумы мелких жвачных (ЧМЖ), вырабатываются антитела, которые реагируют в основном с теми же антигенными детерминантами этого белка, что и антитела ЧМЖ-поло-жительной сыворотки коз. Нами сконструирована и апробирована экспериментальная тест-система для серодиагностики чумы мелких жвачных методом конкурентного ИФА (к-ИФА) на основе рекомбинантного N-белка и пероксидазного конъюгата, изготовленного на основе IgG, выделенных из специфической к N-белку кроличьей сыворотки. С использованием предложенной тест-системы показано, что сыворотки животных с титрами антител к вирусу ЧМЖ в реакции нейтрализации 1:64 и выше в к-ИФА были положительными. По соотношению значений OD405 для отрицательной и положительной сывороток коз результаты с коммерческой тест-системой ID Screen® PPR Competition («IDvet», Франция) были в 2 раза выше, чем с экспериментальной. Полученные результаты позволяют положительно оценивать перспективу применения сконструио-ванных нами тест-систем для непрямого и конкурентного вариантов ИФА для серодиагностики ЧМЖ.
Список литературы Конструирование тест-систем на основе рекомбинантного нуклеокапсидного белка для серодиагностики чумы мелких жвачных
- Banyard A.C., Parida S., Batten C., Oura C., Kwiatek O., Libeau G. Global distribution of peste des petits ruminants virus and prospects for improved diagnosis and control. Journal of General Virology, 2010, 91(12): 2885-2897 ( ). DOI: 10.1099/vir.0.025841-0
- World Organization for Animal Health (OIE). Peste des petits ruminants (infection with Peste des petits ruminants virus). Chapter 2.7.10. In: Manual of diagnostic tests and vaccines for terrestrial animals. Cambridge, 2016.
- Baron M.D., Diop B., Njeumi F., Willett B.J., Bailey D. Future research to underpin successful peste des petits ruminants virus (PPRV) eradication. Journal of General Virology, 2017, 98(11): 2635-2644 ( ). DOI: 10.1099/jgv.0.000944
- Schulz C., Fast C., Schlottau K., Hoffmann B., Beer M. Neglected hosts of small ruminant morbillivirus. Emerging Infectious Diseases, 2018, 24(12): 2334-2337 ( ). DOI: 10.3201/eid2412.180507
- Mariner J.C., Jones B.A., Rich K.M., Thevasagayam S., Anderson J., Jeggo M., Cai Y., Andrew R., Peters A.R., Roeder P.L. The opportunity to eradicate Peste des petits ruminants. The Journal of Immunology, 2016, 196(9): 3498-3506 ( ). DOI: 10.4049/jimmunol.1502625
- Amarasinghe G.K., Aréchiga N.G., Ashley C., Christopher C.B. Taxonomy of the order Mononegavirales: update 2018. Archives of Virology, 2018, 163(8): 2283-2294 ( ).
- DOI: 10.1007/s00705-018-3814-x
- Virus taxonomy: classification and nomenclature of viruses. Ninth report of the International Committee on Taxonomy of Viruses /A.M.Q. King, M.J. Adams, E.B. Carstens, E.J. Lefkowitz (eds.). Elsevier, 2012.
- Libeau G., Diallo A., Parida S. Evolutionary genetics underlying the spread of Peste des petits ruminants virus. Animal Frontiers, 2014, 4(1): 14-20 ( ).
- DOI: 10.2527/af.2014-0003
- Dhar P., Sreenivasa B.P., Barrett T., Corteyn M., Singh R.P., Bandyopadhyay S.K. Recent epidemiology of Peste-des-petits-ruminants virus (PPRV). Veterinary Microbiology, 2002, 88(2): 153-159 (
- DOI: 10.1016/S0378-1135(02)00102-5)
- Liu F., Wu X., Zou Y., Li L., Wang Z. Peste des petits ruminants virus-like particles induce both complete virus-specific antibodies and virus neutralizing antibodies in mice. Journal of Virological Methods, 2015, 213: 45-49 ( ).
- DOI: 10.1016/j.jviromet.2014.11.018
- Durojaiye O.A. Precipitating antibody in sera of goats naturally affected with Peste des petits ruminants. Tropical Animal Health and Production, 1982, 14(2): 98-100 ( ).
- DOI: 10.1007/BF02282591
- Kozat S., Sepehrizadeh E. Peste des petit ruminants. Journal of Istanbul Veterinary Sciences, 2017, 1(2): 47-56 ( ).
- DOI: 10.30704/http-www-jivs-net.319937
- Durojaiye O.A., Taylor W.P. Application of countercurrent immuno-electro-osmophoresis to the serology of Peste des petits ruminants. Revue d'élevage et de médecine vétérinaire des pays tropicaux, 1984, 37(3): 272-276 ( ).
- DOI: 10.19182/remvt.8396
- Obi T.U., McCullough K.C., Taylor W.P. The production of Peste des petits ruminants hyperimmune sera in rabbits and their application in virus diagnosis. Journal of Veterinary Medicine, Series B, 1990, 37(1-10): 345-352 ( ).
- DOI: 10.1111/j.1439-0450.1990.tb01068.x
- Anderson J., Mckay J.A., Butcher R.N. The use of monoclonal antibodies in competition ELISA for detection of antibodies to rinderpest and peste des petits ruminants viruses. In: Final research co-ordination meeting on the sero-monitoring of rinderpest throughout Africa, Bingerville (Cote d'Ivoire), 19-23 Nov 1990. International Atomic Energy Agency (IAEA), Vienna, 1991: 43-53.
- Abubakar M., Mahapatra M., Muniraju M., Arshed M.J., Khan E.A., Banyard A.C., Ali Q., Parida S. Serological detection of antibodies to Peste des petits ruminants virus in large ruminants. Transboundary and Emerging Diseases, 2017, 64(2): 513-519 ( ).
- DOI: 10.1111/tbed.12392
- Balamurugan V., Singh R.P., Saravanan P., Sen A., Sarkar J., Sahay B., Rasool T.J., Singh R.K. Development of an indirect ELISA for the detection of antibodies against Peste-des-petits-ruminants virus in small ruminants. Veterinary Research Communications, 2007, 31(3): 355-364 ( ).
- DOI: 10.1007/s11259-006-3442-x
- Singh R.P., Sreenivasa B.P., Dhar P., Shah L.C., Bandyopadhyay S.K. Development of a monoclonal antibody based competitive ELISA for detection and titration of antibodies to peste des petits ruminants (PPR) virus. Veterinary Microbiology, 2004, 98(1): 3-15 ( ).
- DOI: 10.1016/j.vetmic.2003.07.007
- Singh R.P., Screenivasa B.P., Dhar P., Roy R.N., Brandyopadhyay S.K. Development and evaluation of a monoclonal antibody based competitive enzyme-linked immunosorbent assay for the detection of rinderpest virus antibodies. Revue Scientifique et Technique, 2000, 19(3): 754-763 ( ).
- DOI: 10.20506/rst.19.3.1243
- Choi K.S., Nah J.J., Choi C.U., Ko Y.J., Sohn H.J., Libeau G., Kang S.Y., Joo Y.S. Monoclonal antibody-based competitive ELISA for simultaneous detection of rinderpest virus and peste des petits ruminants virus antibodies. Veterinary Microbiology, 2003, 96(1): 1-16 (
- DOI: 10.1016/S0378-1135(03)00201-3)
- Basagoudanavar S.H., Hosamani M., Muthuchelvan D., Singh R.P., Santhamani R., Sreenivasa B.P., Saravanan P., Pandey A.B., Singh R.K., Venkataramanan R. Baculovirus expression and purification of peste-des-petits-ruminants virus nucleocapsid protein and its application in diagnostic assay. Biologicals, 2018, 55: 38-42 ( ).
- DOI: 10.1016/j.biologicals.2018.07.003
- Liu F., Wu X., Li L., Liu Z., Wang Z. Use of baculovirus expression system for generation of virus-like particles: successes and challenges. Protein Expression and Purification, 2013, 90(2): 104-116 ( ).
- DOI: 10.1016/j.pep.2013.05.009
- Liu F., Wu X., Li L., Liu Z., Wang Z. Formation of peste des petits ruminants spikeless virus-like particles by co-expression of M and N proteins in insect cells. Research in Veterinary Science, 2014, 96(1): 213-216 ( ).
- DOI: 10.1016/j.rvsc.2013.10.012
- Berguido F.J., Bodjo S.C., Loitsch A., Diallo A. Specific detection of peste des petits ruminants virus antibodies in sheep and goat sera by the luciferase immunoprecipitation system. Journal of Virological Methods, 2016, 227: 40-46 ( ).
- DOI: 10.1016/j.jviromet.2015.10.008
- Bodjo S.C., Baziki J.D., Nwankpa N., Chitsungo E., Koffi Y.M., Couacy-Hymann E., Diop M., Gizaw D., Tajelser I.B.A., Lelenta M., Diallo A., Tounkara K. Development and validation of an epitope-blocking ELISA using an anti-haemagglutinin monoclonal antibody for specific detection of antibodies in sheep and goat sera directed against peste des petits ruminants virus. Archives of Virology, 2018, 163(7): 1745-1756 ( ).
- DOI: 10.1007/s00705-018-3782-1
- Lefevre P.C., Diallo A., Schenkel F., Hussein S., Staak G. Serological evidence of Peste des petits ruminants in Jordan. Veterinary Record, 1991, 128(5): 110 ( ).
- DOI: 10.1136/vr.128.5.110
- Cosby S.L., Weir L. Measles vaccination: threat from related veterinary viruses and need for continued vaccination post measles eradication. Human Vaccines & Immunotherapeutics, 2018, 14(1): 229-233 ( ).
- DOI: 10.1080/21645515.2017.1403677
- Munir M., Zohari S., Berg M. Current advances in molecular diagnosis and vaccines for peste des petits ruminants. In: Molecular Biology and Pathogenesis of Peste des Petits Ruminants Virus. SpringerBriefs in Animal Sciences. Springer, Berlin, Heidelberg, 2013: 105-133 ( ).
- DOI: 10.1007/978-3-642-31451-3_6
- Getachew B., Upmanyu V., Haq A.A., Santhamani R., Rajak K.K., Muthuchelvan D., Gupta S.K., Yousuf R.W., Mahapatra M., Parida S., Sharma B., Singh R.P. Monoclonal antibody resistant mutant of Peste des petits ruminants vaccine virus. VirusDisease, 2018, 29(4): 520-530 ( ).
- DOI: 10.1007/s13337-018-0483-z
- Clark J.D., Gebhart G.F., Gonder J.C., Keeling M.E., Kohn D.F. The 1996 guide for the care and use of laboratory animals. ILAR Journal, 1997, 38(1): 41-48 ( ).
- DOI: 10.1093/ilar.38.1.41
- Ашмарин И.П., Васильев Н.Н., Амбросов В.А. Быстрые методы статистической обработки и планирование экспериментов. Л., 1974.
- Берзина А.Г., Гамалея Н.Б., Капанадзе Г.Д. Методические подходы к получению антивидовых антисывороток с целью их использования в иммунофармакологических исследованиях. Биомедицина, 2013, 2: 95-102.
- Berg E.A., Fishman J.B. Conjugation of antibodies to horseradish peroxidase. Cold Spring Harbor Protocols, 2019, 9: pdb.prot099309 ( ).
- DOI: 10.1101/pdb.prot099309
- Wohlsein P., Singh R.P. Peste des petits ruminants in unusual hosts: epidemiology, disease, and impact on eradication. In: Peste des Petits Ruminants Virus /M. Munir (ed.). Springer, Berlin, Heidelberg, 2015: 95-118 ( ).
- DOI: 10.1007/978-3-662-45165-6_6
- Antibodies: a laboratory manual /E.A. Greenfield (ed.). Cold Spring Harbor Laboratory Press, 2013.
- Вербов В.Н. Принципы твердофазного иммуноферментного анализа. Труды института имени Пастера, 1998, 64: 3-27.
- Mapaco L., Monjane I., Fafetine J., Arone D., Caron A., Chilundo A., Quembo C., Carrilho M.D.C., Nhabomba V., Zohari S., Achá S. Peste des petits ruminants virus surveillance in domestic small ruminants, Mozambique (2015 and 2017). Frontiers in Veterenary Science, 2019, 6: 370 ( ).
- DOI: 10.3389/fvets.2019.00370
- Sreenivasa B. P., Dhar P., Singh R.P., Bandyopadhyay S.K. Development of peste des petits ruminants (PPR) challenge virus from a field isolate. In: XIV annual conference and national seminar on management of viral diseases with emphasis on global trade and WTO regime of Indian Virological Society. Pantnagar, India, 2002.


