Контроль производства генно-инженерного инсулина человека с помощью тандема "микроколоночный жидкостный хроматограф- масс-спектрометр" в режиме прямого ввода образца
Автор: Новиков А.В., Назимов И.В., Русанов В.А., Веренчиков А.Н., Краснов Н.В.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Масс-спектрометрия для биотехнологии
Статья в выпуске: 2 т.14, 2004 года.
Бесплатный доступ
Проведены хроматографическое разделение и МС-анализ компонентов сложных смесей полипептидов в режиме "on-line" путем стыковки высокоэффективного жидкостного микроколоночного хроматографа МилиХром А-02 и времяпролетного масс-спектрометра с ортогональным источником и электрораспылением ионов МХ5303. Возможности тандема показаны на примере контроля содержания целевых и побочных продуктов на отдельных стадиях промышленного биотехнологического процесса получения генно-инженерного инсулина человека.
Короткий адрес: https://sciup.org/14264332
IDR: 14264332 | УДК: 543.544+
Текст научной статьи Контроль производства генно-инженерного инсулина человека с помощью тандема "микроколоночный жидкостный хроматограф- масс-спектрометр" в режиме прямого ввода образца
Использование масс-спектрометрии (МС) с мягкими методами ионизации позволяет интенсифицировать исследования в различных областях органической, биологической, геологической химии, агрохимии, медицины, биотехнологии и т.д. [1–4]. Тем не менее, при использовании даже современных МС-методов, например ESI-MS (Electrospray Ionization Mass Spectrometry), работа с компонентами сложных смесей, полученных в режиме "off-line", является трудоемкой задачей, которая быстрее решается при использовании тандема "высокоэффективный жидкостный хроматограф—масс-спектрометр" (ВЭЖХ-МС) [3–4]. Такой тандем, первый элемент которого осуществляет микроколоночную высокоэффективную жидкостную хроматографию (микро-ВЭЖХ) или капиллярный электрофорез (КЭФ), позволяет проводить изучение состава и структуры компонентов сложных смесей органических веществ без предварительного выделения компонентов, что значительно упрощает идентификацию их при сохранении возможности количественного определения исследуемых веществ [4]. В последнее время такой подход особенно актуален в протеомных исследованиях, где приходится иметь дело с разделением чрезвычайно сложных по составу смесей пептидов (включающих тысячи, а иногда и десятки тысяч пептидов — фрагментов белков) с последующим определением химической структуры целевых пептидов.
Целью нашей работы была стыковка отечественного ВЭЖХ МилиХром А-02 с времяпролет-ным масс-спектрометром с ортогональным вводом и ионизацией электрораспылением (модель МХ5303). Возможности этого тандема показаны на примере анализа продуктов ферментативного гидролиза гибридного белка (ГБ), являющегося предшественником инсулина человека.
Инсулин является полипептидным гормоном, который повышает скорость синтеза гликогена и тем самым снижает содержание глюкозы и ряда других сахаров в крови. Прекращение синтеза инсулина организмом человека приводит к развитию сахарного диабета [5].
Первоначально инсулин для терапевтических целей получали из природных источников (островков Лангерганса поджелудочной железы крупного рогатого скота и свиней). В 20-х годах прошлого века было установлено, что бычий и свиной инсулины (которые являются наиболее близкими к инсулину человека) проявляют в организме активность, сравнимую с инсулином человека. Поэтому долгое время для лечения сахарного диабета применяли инсулины быка или свиньи. Однако через некоторое время было показано, что в ряде случаев в организме начинают накапливаться антитела к бычьему и свиному инсулинам, тем самым сводя на нет их действие. Инсулин человека теоретически можно получать из поджелудочной железы человека, но использование такого источника практически нереально для массового получения инсулина человека в терапевтических целях.
Выходом из этой ситуации стало получение человеческого инсулина генно-инженерным способом (ГИИЧ) путем встраивания гена инсулина человека в генетический аппарат бактерии ( E.сoli ) или дрожжей ( Sacharomyces сerevisae ) [5–7].
Основные стадии производства ГИИЧ
Методы анализа
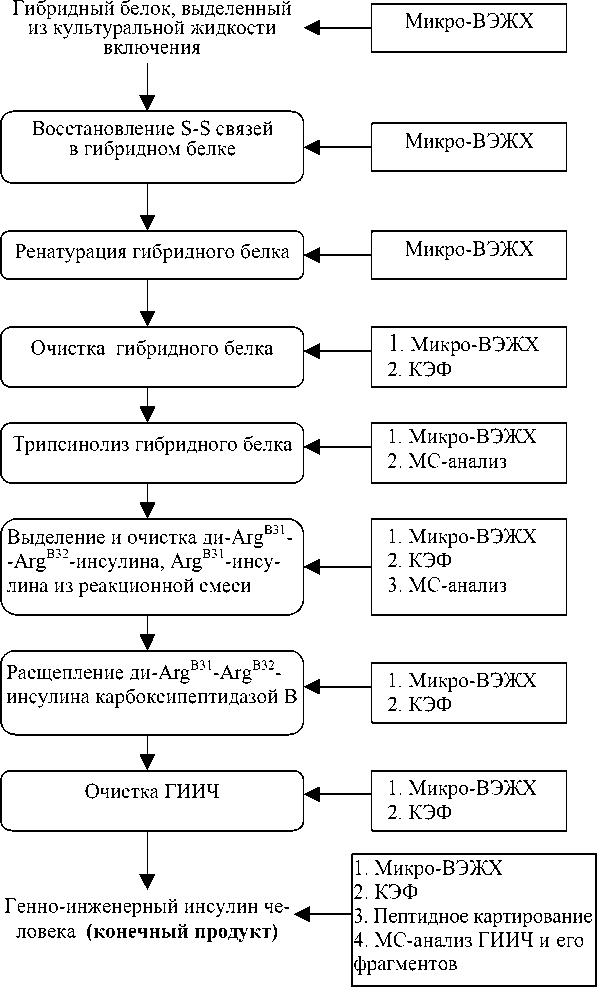
Рис. 1. Блок-схема получения ГИИЧ с разделением стадий трипсинолиза и действия карбоксипептидазы В
В процессе культивирования бактерии (дрожжи) синтезируют ГБ-предшественник, включающий инсулин человека. ГБ ферментативно расщепляют трипсином и карбоксипептидазой В с последующим выделением активной формы гормона (рис. 1).
Ферментативное расщепление ГБ может проводиться либо в несколько последовательных отдельных стадий (трипсинолиз → очистка → гидролиз карбоксипептидазой В →очистка), что довольно долго, либо в одну стадию, совместив действие трипсина и карбоксипетидазы В (что значительно быстрее). При этом необходимо учитывать, что все эти стадии (рис. 1) требуют контроля состояния как исходного ГБ, так и продуктов гидролиза. В связи с этим разработка надежного и экономически целесообразного метода контроля процесса получения инсулина является актуальной задачей [6–7].
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Расщепление ГБ трипсином представляет собой сложный многоступенчатый и многопараметрический кинетический процесс. Поэтому первым этапом нашей работы была оптимизация процесса триптического гидролиза с целью получения максимального количества диаргинилинсулина (из которого далее при обработке карбоксипептидазой В получали инсулин) при минимальном образовании побочных (зачастую токсичных) продуктов расщепления ГБ. В частности, необходимо было минимизировать разрыв пептидных связей между Lys29 и Тhr30 и образование дезтрионилинсулина (дез-ThrB30-инсулин).
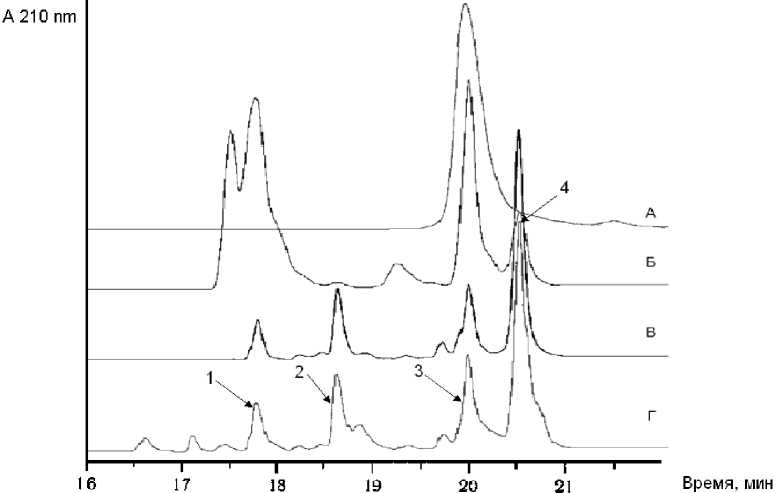
Рис. 2. Микро-ВЭЖХ триптического гидролизата (гибридного белка, ГБ), полученного при 37 °С.
А — исходный ГБ; Б — 4 часа, В — 8 часов, Г — 24 часа гидролиза
|
соответственно. Колонка: |
PRONTOSIL AQ С 18 (2 × 75 мм). |
|
Подвижная фаза: |
А — 0.1% трифторуксусная кислота ( ТФУ), Б — СН 3 CN. |
|
Градиент: |
10–40 % Б за 23 мин. |
|
Скорость потока: |
100 мкл/мин. |
|
Температура колонки: |
40 оС. |
Пик 1 — продукт протеолиза ЛФ с m / z = 7025.4 Да, пик 2 — ди-Arg-инсулин, пик 3 — моно-Arg-инсулин, пик 4 — дезтрионилинсулин (дез-ThrB30-инсулин)
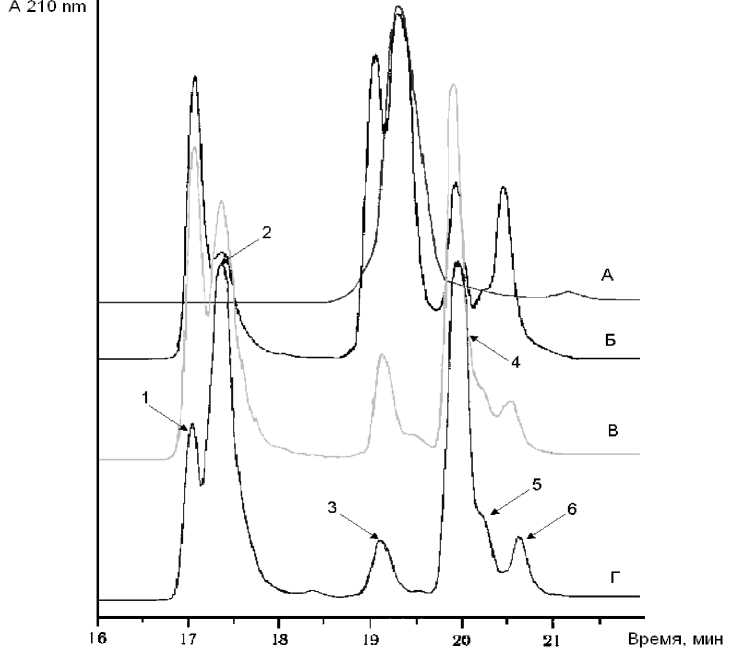
Рис. 3. Микро-ВЭЖХ триптического гидролизата (гибридного белка, ГБ), полученного при 10 °С.
А — исходный ГБ; Б — 2 часа, В — 8 часов, Г — 22 часа гидролиза соответственно.
Колонка: PRONTOSIL AQ С 18 (2 × 75 мм).
Подвижная фаза: А — 0.1% трифторуксусная кислота ( ТФУ), Б — СН 3 CN.
Градиент: 10–40 % Б за 23 мин.
Скорость потока: 100 мкл/мин.
Температура колонки: 40 оС.
Пик 1 — расщепление по связи Glu107-Arg 139 (С-КR);
пик 2 — продукт протеолиза ЛФ с m / z = 7025.4 Да;
пик 3 — ди-Arg-инсулин;
пик 4 — моно-Arg-инсулин;
пик 5 — расщепление по связи Met1-Arg74 (ЛФ-1);
пик 6 — дез-ThrB30-инсулин
Для этого была отработана методика расщепления ГБ трипсином и последующего хроматографического и МС-анализа трипсинового гидролизата off-line. При этом гидролизат предварительно разделяли хроматографически, затем отобранные фракции лиофильно высушивали и исследовали масс-спектрометрически.
Было определено, что снижение температуры расщепления белка трипсином (рис. 2, 3) позволяет существенно снизить выход дез-Thr-инсулина.
Была проведена масс-спектрометрическая идентификация всех хроматографических пиков (рис. 4). Были определены все пептиды, образую- щиеся в результате трипсинолиза. Так как раздельная обработка гибридного белка трипсином и карбоксипептидазой В занимает много времени, была проведена работа по оптимизации условий совместного гидролиза (рис. 5). После хроматографического разделения продуктов триптического гидролиза проводился масс-спектрометри чес-кий анализ отобранных фракций.
Методика анализа продуктов гидролиза off-line занимает много времени и, несмотря на свою надежность, весьма трудоемка и потому малопригодна для серийного анализа. Для того чтобы сократить время анализа продуктов гидролиза, была
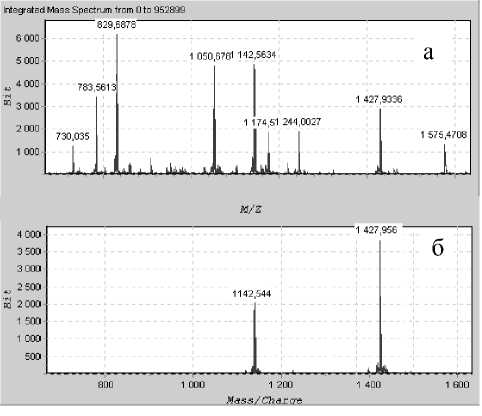
Рис. 4. Масс-спектры продуктов трипсинолиза гибридного белка:
а — суммарный масс-спектр гидролизата;
б — масс-спектр дез-ThrB30-инсулин (фракция получена после хроматографического разделения)

Рис. 6. Тандем: жидкостной хроматограф МилиХром А-02 с времяпролетным масс-спектрометром с орто-ганальным вводом и ионизацией электрораспылением (МХ5303)
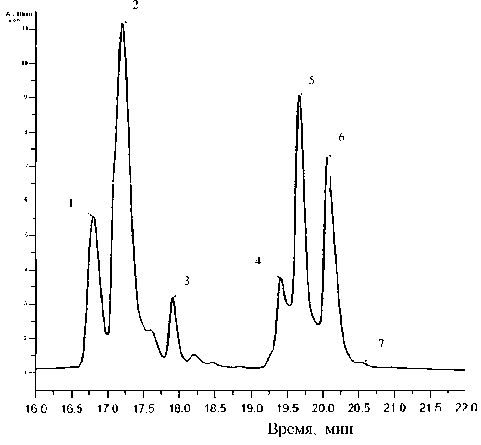
Рис. 5. Микро-ВЭЖХ триптического гидролиза гибридного белка совместно с действием карбоксипептидазы В при 4 °С через 22 часа.
Колонка: PRONTOSIL AQ С 18 (2 × 75 мм).
Температура: 40 оС.
Пик 1 — расщепление по связи Glu107-Lys 138 (С-К);
пик 2 — продукт протеолиза ЛФ с m / z = 7024.0 Да;
пик 3 — ди-Arg-инсулин;
пик 4 — фрагмент совместного триптического гидролиза с m / z = 5984.3 Да;
пик 5 — моно-Arg-инсулин;
пик 6 — инсулин;
B30
пик 7 — дез-Thr -инсулин
осуществлена стыковка ВЭЖХ МилиХром А-02 и масс-спектрометра МХ5303 в единый тандем (рис. 6).
Важной задачей при стыковке являлся подбор условий, позволяющих добиться максимального разделения компонентов реакционной смеси на хроматографической колонке при условии получения максимального МС-сигнала. Первоначально в качестве одного из элюентов использовали 0.1% трифторуксусную кислоту (ТФУ). Однако использование этого элюента показало, что из-за чрезвычайно низкой чувствительности детектирования масс-спектрометрический анализ пептидов невозможен.
Использование 1% раствора уксусной кислоты позволяет добиться высокой чувствительности МС-детектирования, но не позволяет получить удовлетворительное разделение пептидов и приводит к размытым зонам, содержащим смеси пептидов (рис. 7).
Наилучшие результаты были достигнуты при использовании в качестве элюента 0.5% раствора муравьиной кислоты, который создает оптимальный рН раствора (рис. 8).
Таким образом, в результате проделанной работы были осуществлены хроматографическое разделение и МС-анализ компонентов сложных смесей полипептидов в режиме "on-line" путем стыковки ВЭЖХ (МилиХром А-02) и времяпро-летного масс-спектрометра (МХ5303) с ортогональным источником ионов и электрораспылением (ESI-o-TOF). При этом реализован полностью автоматизированный режим работы "on-line", включающий забор пробы, хроматографическое разделение и МС-анализ с записью масс-спектров в диапазоне от 100 Да до 17 кДа с разрешением 10 000. Время разделения даже сложных смесей пептидов с близкими хроматографическими свойствами не превышало 20–25 мин при чувстви- 10 пикомоль каждого компонента.
тельности МС-идентификации пептидов не более
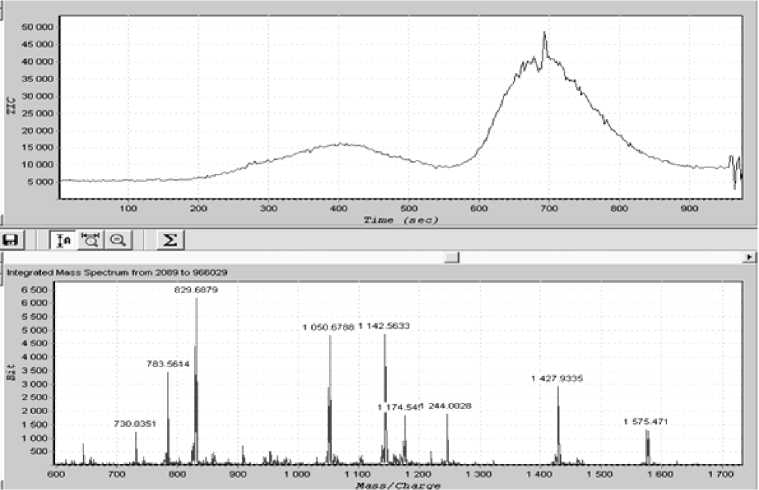
Рис. 7. Пример неполного разделения гидролизата при использовании в качестве элюента 1 % уксусной кислоты
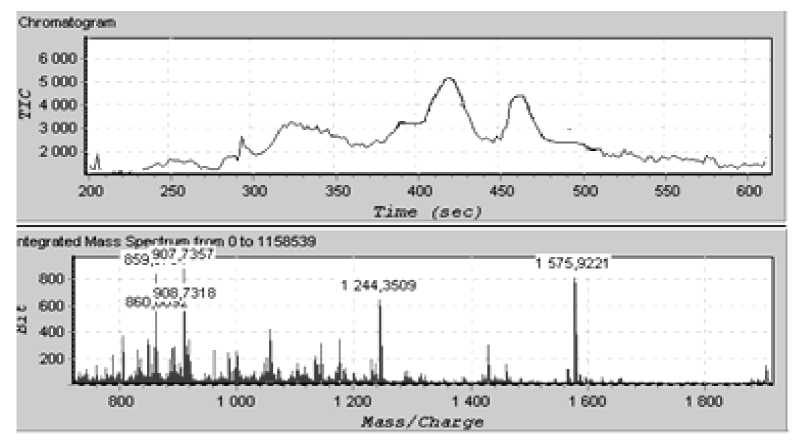
Рис. 8. Пример разделения гидролизата гибридного белка при использовании в качестве элюента 0.5 % муравьиной кислоты
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали гибридный белок, инсулин человека (Институт биоорганической химии РАН, Москва), трифторуксусную кислоту, уксусную кислоту, муравьиную кислоту производства фирмы "Merck" (ФРГ), ацетонитрил ("Криохром", Санкт-Петербург). Использовали ферменты: карбоксипептидазу В, трипсин ("Serva", ФРГ).
Хроматографию проводили на микроколоноч-ном жидкостном хроматографе МилиХром А-02 ("Эконова", Новосибирск). Хроматографическая колонка размером 2 × 75 мм заполнена сорбентом Prontosil AQC18 ("Bishof", ФРГ).
Масс-спектрометрический анализ проводили на приборе МХ 5303, оборудованном электрораспы-лительным источником ионизации (electrospray ionization, ESI) и времяпролетным масс-анали-затором (TOF), разработанным в Лаборатории экологической и биомедицинской масс-спектрометрии ИАнП РАН. Все спектры получены в режиме съемки положительных ионов. Объем анализируемой пробы 10 мкл. Скорость подачи раствора образца 1–2 мкл/мин.
Пептиды растворяли в 50 % ацетонитриле в присутствии 1 % уксусной кислоты в концентрации 0.5–1.0 пмоль/мкл.
Элюцию осуществляли градиентом концентрации ацетонитрила от 10 до 50 % (по объему) в растворах 0.1 % трифторуксусной кислоты, 0.5 % муравьиной кислоты, 1 % уксусной кислоты в зависимости от эксперимента со скоростью 100 мкл/мин.
Список литературы Контроль производства генно-инженерного инсулина человека с помощью тандема "микроколоночный жидкостный хроматограф- масс-спектрометр" в режиме прямого ввода образца
- Chhabil Dass. Principles and practice of biological mass spectrometry. Wiley-interscience, NY., USA, 2001. 416 p.
- Chapman J.R. Practical organic Mass Spectrometry. John Wiley & Sons, Chichester, 1995. 338 p.
- Mann Matthias, Hendrickson Ronald C., and Pandey Akhilesh. Analysis of proteins and proteomes by mass spectrometry//Annu. Rev. Biochem. 2001. V. 70. P. 437-473.
- Willoughby Ross, Ed Sheehan & Sam Mitrovich A Global View of LC/MS, How to Solve Your Most Challenging Analytical Problems. Global View Publishing, 2002. 2nd edition. 554 p.
- Степанов В.М. Молекулярная биология. Структура и функции белков. М.: Высшая школа, 1996. 335 c.
- Миргородская О.А., Казанина Г.А., Миргородская Е.П. и др. Протеолиз проинсулина человека, катализируемый нативным, модифицированным и иммобилизованным трипсином//Биоорганическая химия. 1997. т. 23, № 2. с. 91-97.
- Клюшниченко В.Е., Якимов С.А., Мальцев К.В. и др. Генно-инженерный инсулин человека. ВЭЖХ в анализе продуктов основных стадий производства//Биоорганическая химия. 1992. Т. 18, № 12. С. 1478-1486.


