Конверсионная лекарственная терапия в лечении гепатоцеллюлярной карциномы. Клиническое наблюдение
Автор: Валишин В.А., Меньшиков К.В., Султанбаев А.В., Абдеев Р.Р., Уразин Р.Р., Мусин Ш.И., Валишина Л.А., Згоников В.И., Аюпов Р.Т., Старцев-Светличный И.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 4 т.24, 2025 года.
Бесплатный доступ
Введение. В настоящее время комбинация препаратов атезолизумаба и бевацизумаба рекомендована для первой линии терапии распространенной гепатоцеллюлярной карциномы (ГЦК). Накопленный мировой и отечественный опыт применения данного метода лечения позволяет утверждать, что он значительно улучшает общий прогноз заболевания. Обсуждается возможность применения комбинации атезолизумаб + бевацизумаб в качестве конверсионной терапии при исходно распространенной или функционально нерезектабельной ГЦК. Цель исследования – оценить возможность применения комбинации атезолизумаб + бевацизумаб в качестве конверсионной лекарственной терапии ГЦК. Описание клинического случая. Представлен клинический случай конверсионной лекарственной терапии функционально нерезектабельной ГЦК правой доли печени. В связи c недостаточным объемом остающейся паренхимы печени (менее 25 %) выполнение правосторонней гемигепатэктомии признано нецелесообразным. На начальном этапе лечения проведено 20 курсов конверсионной лекарственной терапии по схеме атезолизумаб + бевацизумаб, которая сопровождалась минимальным количеством нежелательных явлений. В дальнейшем с учетом частичного ответа опухоли на противоопухолевую терапию выполнено радикальное оперативное вмешательство в объеме резекции s7–8. При гистологическом исследовании операционного материала констатирован полный патоморфологический ответ. Заключение. Приведенное клиническое наблюдение демонстрирует эффективность комбинации атезолизумаб + бевацизумаб в качестве конверсионной терапии при ГЦК, которая обеспечила выполнение радикальной резекции печени и полный патоморфологический ответ. Полученный опыт подчеркивает необходимость дальнейших исследований в данном направлении.
Гепатоцеллюлярная карцинома, атезолизумаб + бевацизумаб, конверсионная терапия, радикальное хирургическое лечение, полный патоморфологический ответ
Короткий адрес: https://sciup.org/140312283
IDR: 140312283 | УДК: 616.36-006.6-08 | DOI: 10.21294/1814-4861-2025-24-4-170-177
Текст научной статьи Конверсионная лекарственная терапия в лечении гепатоцеллюлярной карциномы. Клиническое наблюдение
COnVeRsiOn tHeRaPY FOR HePatOCellulaR CaRCinOMa: a Case RePORt
V.a. Valishin1, K.V. Menshikov1, a.V. sultanbaev1, R.R. abdeev1,R.R. urazin1, sh.i. Musin1, l.a. Valishina2, V.i. Zgonikov3, R.t. ayupov1, i.n. startsev-svetlichny1
1Republican Clinical Oncology Center, Ministry of Health of the Republic of Bashkortostan 73/1, Oktyabrya Ave., Ufa, 450054, Russia
2Clinical and diagnostic center “MEDSI-ProMedicine”
-
18 , Aurora St., Ufa, 450092, Russia
-
3I .M. Sechenov First Moscow State Medical University, Ministry of Health of Russia
8/2, Trubetskaya St., Moscow, 119048, Russia
Currently, the combination of atezolizumab and bevacizumab is recommended for first-line therapy of advanced hepatocellular carcinoma (HCC). The accumulated world experience of using this treatment modality allows us to state that it significantly improves the overall prognosis of the disease. the aim of the study was to evaluate the feasibility of using the combination of atezolizumab + bevacizumab as a conversion therapy for HCC. Case presentation. We report a case of conversion therapy for initially unresectable right-lobe HCC. Due to the insufficient volume of the remaining liver parenchyma (less than 25 %), right-sided hemihepatectomy was considered inappropriate. At the initial stage of treatment, 20 courses of conversion therapy with the atezolizumab + bevacizumab regimen were administered, which was accompanied by a minimum number of adverse events. Subsequently, taking into account the partial response of the tumor to antitumor therapy, radical surgery involving the resection of liver segment S7–8 was performed. Histological examination of the surgical specimen revealed a complete pathological response. Conclusion. This case report demonstrates the efficacy of atezolizumab + bevacizumab combination as a conversion therapy for HCC, resulting in complete pathological response. The experience gained emphasizes the need for further research in this area.
Гепатоцеллюлярная карцинома (ГЦК) является одним из самых агрессивных видов злокачественных новообразований (ЗНО). Она занимает 7-е место по распространенности среди всех видов ЗНО и является одной из основных причин смертности от онкологических заболеваний. Высокий уровень смертности связан с поздней диагностикой и агрессивным течением заболевания. Часто ГЦК развивается на фоне цирроза или хронического заболевания печени [1].
Гепатоцеллюлярная карцинома часто проявляет резистентность к такой системной терапии, как химиотерапия, что делает сложным ее лечение. Многочисленные клинические исследования подчеркивают высокую агрессивность ГЦК и низкую неэффективность традиционных методов лечения. Основным методом лечения ГЦК является радикальная операция, к сожалению, в большинстве случаев пациенты не могут рассчитывать на радикальное хирургическое лечение ввиду местного распространения опухоли, нарушения функции печени или сопутствующей патологии. Эта группа пациентов может рассчитывать на такие методы лечения, как локорегионарная терапия (например, трансартериальная химиоэмболизация, чрескожная абляция) и/ или системная терапия, отдаленная эффективность которых остается достаточно низкой [2].
Конверсионная лекарственная терапия позволяет улучшить показатели резектабельности и отдаленные результаты при таких ЗНО, как колоректальный рак, рак молочной железы, легкого. Однако в стандарты лечения ГЦК проведение неоадъювантной терапии не входит. Сорафениб, ингибитор тирозинкиназы, является первым препаратом для системной терапии ГЦК, он оставался единственной опцией для лечения распространенной ГЦК более десятилетия, пока исследование REFLECT не продемонстрировало эффективность другого ингибитора тирозинкиназы – ленватиниба [3–5]. Однако при использовании сорафениба или ленватиниба медиана общей выживаемости (ОВ) не превышает 12–14 мес.
Ингибиторы иммунных контрольных точек (ИКТ) доказали свою эффективность при многих солидных опухолях. Благодаря взаимодействию в иммунных контрольных точках опухолевые клетки могут ингибировать Т-клетки и уклоняться от иммунной системы, ИКТ блокируют это взаимодействие и восстанавливают нормальную функцию Т-клеток [6, 7]. Применение ИКТ открыло новую эру в лечении распространенной ГЦК. В исследовании IMbrave150 у пациентов с распространенной ГЦК показано улучшение ОВ при терапии комбинацией атезолизумаб (ингибитор PD-L1) + бевацизумаб (ингибитор рецептора фактора роста эндотелия сосудов, VEGFR) в сравнении с сорафенибом [8]. Эта комбинация зарегистрирована в качестве терапии первой линии при распространенной ГЦК [9]. Исследование HIMALAYA продемонстрировало эффективность тремелимумаба и дурвалумаба для пациентов с распространенной ГЦК, эта комбинация также одобрена в качестве терапии первой линии [10].
Учитывая полученные результаты в исследованиях ИКТ при распространенной ГКЦ, рассматриваются возможности применения данных препаратов при неоадъювантной и адъювантной терапии [11, 12]. A.O. Kaseb et al. [13] провели открытое исследование фазы II, сравнивающее периоперационные режимы ниволумаб (анти-PD-1) и комбинацию ниволумаба и ипилимумаба (анти-CTLA-4) у пациентов с резектабельной ГЦК. Из 27 пролеченных пациентов 20 перенесли резекцию печени. Следует отметить, что отказы от хирургического вмешательства не были вызваны токсичностью, больные не оперировались в связи с прогрессированием заболевания (n=4), невозможностью проведения резекции печени (n=2) и наличием спаечной болезни (n=1). Частота патологического ответа при комбинированной терапии составила 27 % против 33 % – при монотерапии ниволумабом. Однако отдаленные результаты были лучше в группе комбинированной терапии по сравнению с монотерапией ниволумабом, медиана ВБП составила – 19,4 и 9,4 мес соответственно [13]. Данное исследование продолжается, результаты промежуточного анализа были представлены ASCO в 2022 г. Среди 15 пациентов у 1 (7 %) было нежелательное явление III степени, связанное с лечением. Среди 13 пациентов, у которых были таргетные очаги по RECIST, частота объективного ответа составила 23 %, частота контроля заболевания – 92 %. В 9 случаях исследован па-томорфологический ответ, в 7 (78 %) наблюдениях подтверждена частичная регрессия, полный ответ был у 2 (22 %) пациентов.
Недавно опубликован метаанализ применения ИКТ в неоадъювантном режиме при ГЦК [14], который включал результаты 4 опубликованных исследований, а также 5 исследований, которые были доступны только в виде тезисов конференций [15–17]. По данным метаанализа, применение ИКТ в качестве неоадъювантной терапии ГЦК давало выигрыш в безрецидивной выживаемости и частоте патоморфологических ответов.
Таким образом, в литературе активно обсуждается возможность применения ИКТ в качестве конверсионной терапии при ГЦК. Мы приводим клиническое наблюдение конверсионной лекарственной терапии в режиме атезолизумаб + бевацизумаб у пациента с ГЦК с последующим хирургическим лечением.
Описание клинического случая
У пациента Б., 69 лет, в ноябре 2022 г. во время диспансеризации при КТ органов грудной и брюшной полости выявлено объемное образование в правой доле печени. Пациент дообследован в условиях Республиканского клинического онкологического диспансера, где по данным КТ с контрастированием (20.01.23) описывалось гиперваскулярное образование в правой доле печени (рис. 1).
Функциональный статус по ECOG на момент обследования – 1 балл, уровень АФП – 2,07 МЕ/мл. По данным ФГДС (10.03.23): хронический атрофический гастрит, варикозного расширения вен пищевода не выявлено. В лабораторных показателях клинически значимых изменений не выявлено. Также не отмечено неконтролируемой артериальной гипертензии и аутоиммунных заболеваний. С целью верификации диагноза 31.03.23 проведена биопсия печени под КТ-контролем. Гистологическое заключение: гепатоцеллюлярная карцинома (рис. 2).
Таким образом, установлен диагноз: Гепатоцеллюлярный рак, IIIA (сT3N0M0) стадия. Стадия по BCLC – В. Класс по Child–Turcott–Pugh А. На момент исследования опухоль являлась нерезекта-бельной, поскольку при планировании правосторонней гемигепатэктомии оставшийся объем печени был менее 25 % от первоначального, что является критическим показателем для поддержания жизнеспособности печени в послеоперационном периоде. На онкологическом консилиуме решено начать лечение с системной противоопухолевой терапии комбинацией: атезолизумаб, в дозе 1200 мг, и бевацизумаб, в дозе 15 мг/кг.
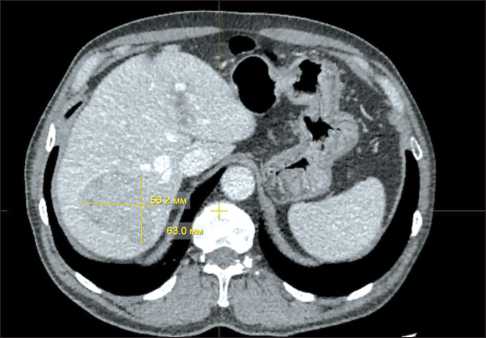
Рис. 1. КТ органов брюшной полости. В S7 печени определяется гиперваскулярное образование с нечеткими неровными контурами, размерами 63×56×49 мм, с наличием псевдокапсулы в отсроченную фазу, плотность +40 – + 47 HU, контраст накапливает неоднородно до +94 HU.
Примечание: рисунок выполнен авторами
Fig. 1. CT of the abdomen. In segment 7 of the liver, a hypervas-cular lesion, measuring 63×56×49 mm, with indistinct irregular contours, is visualized. There is a pseudocapsule with delayed, heterogeneous, positive contrast enhancement (density +40 to +47 HU, with accumulations up to +94 HU).
Note: created by the authors
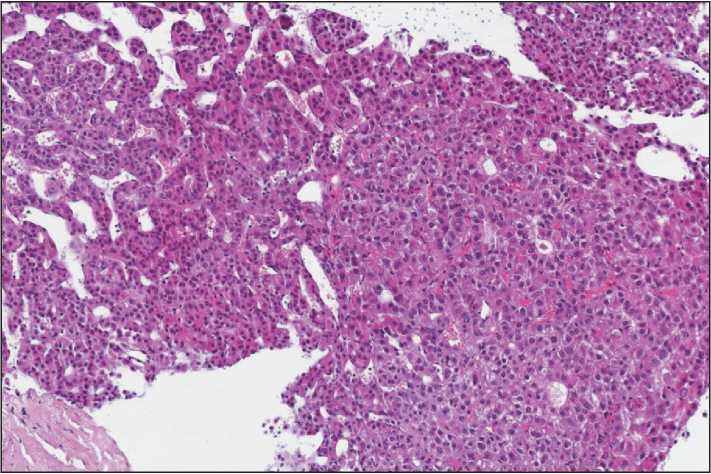
Рис. 2. Микрофото. Опухоль трабекулярного строения представлена клетками с обильной эозинофильной цитоплазмой, расположенными в 2–3 слоя. Ядра крупные с ядрышками, единичные фигуры митоза.
Окраска гематоксилином и эозином, ×100. Примечание: рисунок выполнен авторами Fig. 2. Microphoto. The tumor has a trabecular structure consisting of cells with abundant eosinophilic cytoplasm arranged in 2–3 layers. Nuclei are large with nucleoli, individual mitotic figures are present. Hematoxylin-eosin staining, ×100.
Note: created by the authors
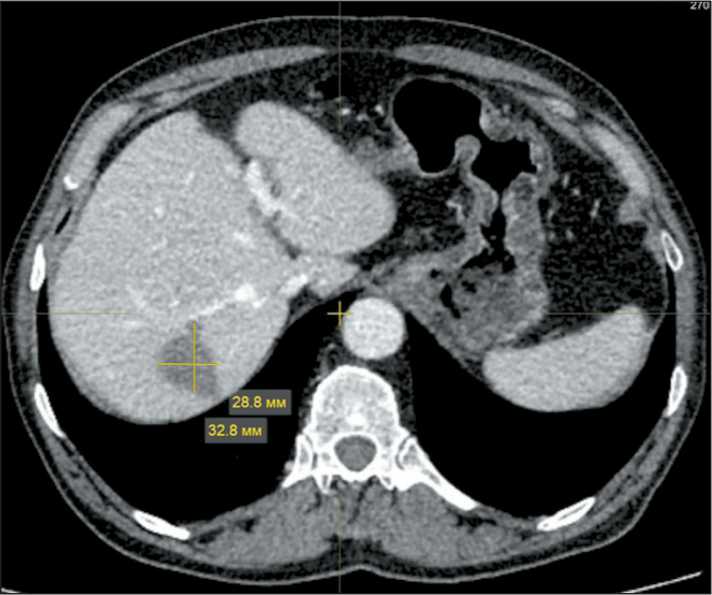
Рис. 3. КТ от 27.05.24. В S7 печени определяется образование с нечеткими неровными контурами, размерами 28,8×32,8 мм. Частичный ответ. Примечание: рисунок выполнен авторами
Fig. 3. CT scan (May 27, 2024). In segment 7 of the liver, an ill-defined mass is detected with dimensions of 28.8×32.8 mm.
A partial response. Note: created by the authors
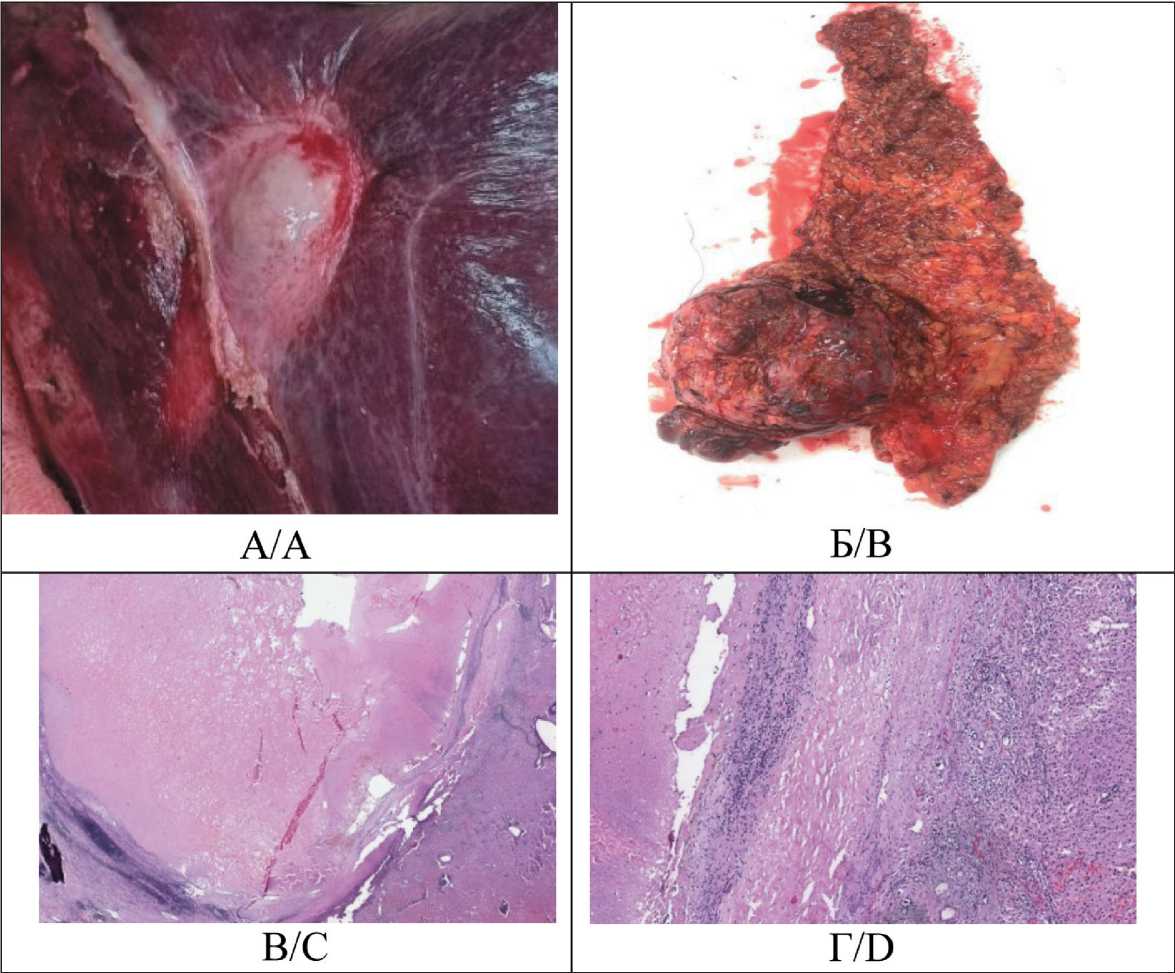
Рис. 4. А. Поверхность печени с кистозной опухолью. Б. Макропрепарат. Резецированные S7–8 правой доли печени. В. Микрофото. Обширный очаг некроза опухоли в печени. Окраска гематоксилином и эозином, ×40.
Г. Микрофото. Зона некроза опухоли и сохранной печеночной ткани, разделенные зоной фиброза с демаркационным лимфолейкоцитарным воспалительным инфильтратом. Окраска гематоксилином и эозином, ×100.
Примечание: рисунок выполнен авторами
Fig. 4. A. Surface of the liver with cystic tumor. B. Macrospecimen. Resected S7–8 of the right lobe of the liver. C. Microphoto. Extensive necrosis in the liver tumor. Hematoxylin-eosin stain, ×40. D. Microphoto. Areas of tumor necrosis and preserved hepatic tissue separated by fibrotic zones with demarcating lympho-leukocytic inflammatory infiltrate. Hematoxylin-eosin stain, magnification ×100.
Note: created by the authors
В период с 11.04.23 по 5.05.24 проведено 20 курсов комбинированной терапии в указанном режиме. После первых 4 курсов зарегистрирован частичный ответ (уменьшение размера очага с 63 мм до 41 мм). На фоне терапии отмечен гипотиреоз I степени, который купирован заместительной терапией L-тироксином. При оценке эффективности лечения после 20 курсов по данным КТ от 27.05.24 зарегистрирована частичная регрессия опухоли (рис. 3). С учетом полученных данных решено провести оперативнвный этап комбинированного лечения.
30.07.24 выполнено радикальное оперативное вмешательство в объеме: лапаротомия, резекция печени S7–8, лимфаденэктомия гепатодуодельной связки (рис. 4 А, Б). Послеоперационный период по шкале Clavien–Dindo соответствовал I классу. Отмечалось повышение уровней АЛТ, АСТ до 3 верхних границ нормы.
По данным гистологического исследования послеоперационного материала – киста печени с некрозами. В лимфатических узлах – реактивная гиперплазия. Таким образом, констатирован полный патоморфологический ответ (рис. 4 В, Г). С учетом полученных данных терапию комбинацией атезо-лизумаб + бевацизумаб решено не продолжать. Пациент направлен на динамическое наблюдение.
Обсуждение
Достижения в области методов диагностики увеличили количество пациентов с ГЦК, у которых диагноз устанавливается на ранних стадиях, что позволяет провести радикальное лечение [18, 19]. Резекция печени, трансплантация и абляция являются методами, позволяющими излечить пациентов с ГЦК [19–21]. Однако риск прогрессирования после радикального лечения остается высоким, показатели 5-летней безрецидивной выживаемости составляют от 40 до 70 % [21].
В представленном клиническом наблюдении у пациента диагностирована локализованная форма ГЦК, при которой показано хирургическое лечение, но противопоказанием для правосторонней гемигепатэктомии явился недостаточной объем остающейся паренхимы печени. Мы не рассматривали вопрос о неоадъювантной ТАХЭ для пациентов с ГЦК, которым запланирована резекция или трансплантация печени, т.к. роль данного метода неоднозначна. В ретроспективном исследовании K.T. Lee et al. [22] оценивались результаты неоадъювантной ТАХЭ. Частота рецидивов была выше в группе ТАХЭ с последующей резекцией, чем в группе без ТАХЭ (35,90 vs 29,36 %, p=0,955), ОВ была также ниже в группе ТАХЭ (47,05 vs 52,46 %, p=0,025) и отмечалась более высокая частота повторной госпитализации в течение 6 мес после операции (33,3 vs 20,8 %, p=0,011).
В настоящее время при различных солидных ЗНО широкое распространение получила нео- и адъювантная терапия, рассматриваются возможности применения данных методов лечения и при ГЦК. Так, W.J. Ho et al. [23] провели одногрупповое исследование 1b фазы по оценке эффективности комбинации ниволумаба и кабозантиниба в качестве неоадъювантной терапии при местнораспространенной нерезектабельной ГЦК. Пациенты получали 40 мг кабозантиниба ежедневно в течение 8 нед и 240 мг ниволумаба 1 раз каждые 2 нед, со 2-й нед после начала приема кабозантиниба, всего 4 курса. Оценка эффективности проводилась через 2 нед после окончания терапии. Из 15 пациентов, включенных в исследование, 14 – завершили терапию, а 12 больным проведено хирургическое лечение. Причем до операции стабилизация, согласно критериям RECIST 1.1, была отмечена у 13, частичный ответ – у 1 пациента. В 5 случаях из 12 по данным послеоперационного морфологического исследования отмечен полный или значительный (≥90 % некроза опухоли) патоморфологический ответ. Таким образом, данное исследование достигло своей первичной конечной точки.
В представленном случае пациенту с функционально нерезектабельной ГЦК предложен вариант конверсионной лекарственной терапии комбинацией атезолизумаб + бевацизумаб. Принимая решение о назначении данной комбинации, мы рассчитывали на ЧОО, что описано при данном методе лечения в исследовании IMbrave150. В данном исследовании подтвержденные объективные ответы наблюдались у 97 (30 %) из 326 пациентов (95 % ДИ 25–35), получавших атезолизумаб + бевацизумаб, и у 18 (11 %) из 159 пациентов (95 % ДИ 7–17), получавших сорафениб [24]. В исследовании REFLECT, посвященном ленватинибу в монотерапии ГЦК, также получены хорошие результаты. Частота объективного ответа по критериям mRECIST составила 40,6 % [5]. В представленном клиническом наблюдении частичный ответ был зарегистрирован на первом контрольном исследовании через 3 мес терапии. Всего проведено 20 курсов терапии комбинацией атезолизумаб + бевацизумаб при минимальном количестве нежелательных явлений, отмечался лишь субклинический гипотиреоз. В дальнейшем удалось выполнить радикальную операцию.
Заключение
Представленный клинический случай демонстрирует возможность применения комбинации атезолизумаб + бевацизумаб в качестве конверсионной лекарственной терапии при функционально нерезектабельной ГЦК. Достигнутый полный пато-морфологический ответ свидетельствует об эффективности данного подхода. Необходимы большие рандомизированные клинические исследования для изучения эффективности неадъювантной терапии у больных с гепатоцеллюлярной карциномой.


