Коррекция аномалии полового члена при эписпадии и экстрофии мочевого пузыря (обзор литературы)
Автор: Рудин Ю.Э., Марухненко Д.В., Алиев Д.К.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Детская урология
Статья в выпуске: 1, 2016 года.
Бесплатный доступ
Экстрофия-эписпадия комплекс представляет собой спектр урогенитальных пороков развития, варьирующий по тяжести от эписпадии до классической экстрофии мочевого пузыря и экстрофии клоаки. Описание и изучение экстрофии и эписпадии началось с VII в. н.э., успешные результаты, обеспечивающие оптимальное качество жизни, были достигнуты лишь к началу ХХ века. Комплекс экстрофия-эписпадия -одна из самых сложных для лечения патологий в практике детского уролога. В настоящее время частота встречаемости в среднем 1 на 100 000 новорожденных. Доля мальчиков среди таких больных выше в 1,5-6 раз чем девочек. Клинически данная аномалия характеризуется видимым дефектом нижних мочевыводящих путей, в сочетании либо с эвагинированной стенкой мочевого пузыря (классическая экстрофия мочевого пузыря), либо с расщепленной уретрой (при эписпадии). Анатомические изменения полового члена при эписпадии проявляются расщеплением уретры, вплоть до наружного отверстия мочеиспускательного канала, расположение которого варьирует в зависимости от формы эписпадии. Головка полового члена уплощена, крайняя плоть покрывает лишь ее вентральную поверхность. Также, вследствие расхождения лонных костей и гипоплазии белочной оболочки по дорсальной поверхности половой член укорочен, имеет дорсальную деформацию различной степени. Кроме того, большинство мальчиков с тотальной эписпадией имеют недержание мочи. Цель коррекции комплекса экстрофия-эписпадия состоит в достижении удержания мочи с сохранением верхних мочевых путей и реконструкции функционально и косметически приемлемого полового члена. До сих пор нет единого мнения о выборе тактики лечения таких пациентов.
Детская урология, экстрофия мочевого пузыря, эписпадия, недержание мочи, уретропластика
Короткий адрес: https://sciup.org/142188077
IDR: 142188077
Текст обзорной статьи Коррекция аномалии полового члена при эписпадии и экстрофии мочевого пузыря (обзор литературы)
Exstrophy-epispadias complex is a range of urogenital malformations vary in severity from epispadias to classic bladder exstrophy and cloacal exstrophy. Description and study of exstrophy epispadias complex began with the VII century. Only in the beginning of the twentieth century successful results, ensuring optimal quality of life, were achieved. Exstrophyepispadias complex - one of the most difficult for treat pathologies in the practice of pediatric urology. Currently, the frequency rate is 1 for 100,000 live births. The proportion of boys among those patients with higher 1.5-6 times than girls. Clinically, this anomaly is characterized by a visible defect in the lower urinary tract as evaginated combination with either the bladder wall (classical schistocystis) or digested with urethra (with epispadias). Anatomical changes in penile urethra occur when epispadias splitting up to the meatus, the location of which varies depending on the form of epispadias.
The head of the penis flattened, the foreskin covers only its ventral surface. Also, due to differences pubic bones and hypoplasia tunica on the dorsal surface of the penis is shortened, a dorsal varying degrees of deformation. Furthermore, most boys with epispadias have total incontinence. The aim of exstrophy-epispadias complex correction is to achieve continence with preservation of the upper urinary tract and functional and cosmetically reconstruction of the penis. There is still no consensus on the choice of steps of treatment of such patients.
Ю.Э. Рудин, Д.В. Марухненко, Д.К. Алиев
НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал
ФГБУ «НМИРЦ» Минздрава России
кстрофия-эписпадия комплекс представляет собой спектр урогенитальных пороков развития, варьирующий по тяжести от эписпа-дии до классической экстрофии мочевого пузыря и экстрофии клоаки. Комплекс экс-трофия-эписпадия характеризуется видимым дефектом нижней части брюшной стенки, в сочетании либо с эвагинированной стенкой мочевого пузыря (классическая экстрофия мочевого пузыря), либо с расщепленной уретрой (при эписпа-дии). Данное заболевание встречается в среднем у 1 на 100 000 новорожденных. В отечественной литературе эписпадия и экстрофия рассматриваются как отдельные нозологические единицы, однако, в мировой практике – только как единый комплекс. Анатомические изменения полового члена при эписпа-дии выражены: 1) Уретра расщеплена вплоть до наружного отверстия мочеиспускательного канала, которое в зависимости от формы эписпадии может располагаться на головке при головчатой форме, средней и проксимальной части ствола – при стволовой и в пено-пубикаль-ном углу – при тотальной форме эписпадии. 2) Головка полового члена уплощена, крайняя плоть покрывает лишь ее вентральную поверхность. 3) Вследствие расхождения лонных костей и гипоплазии белочной оболочки по дорсальной поверхности половой член укорочен, имеет дорсальную деформацию различной степени. Кроме того, большинство мальчиков с тотальной эписпадией имеют недержание мочи. Таким образом, основными задачами коррекции аномалий развития полового члена при комплексе эписпадия-экстрофия являются достижение удержания мочи, создание уретры, выпрямление и удлинение полового члена до достаточных для нормального полового акта размеров.
В данной работе проведен анализ различных методов коррекции недержания мочи и аномалии полового члена при комплексе эктро-фия-эписпадия.
ОПРЕДЕЛЕНИЕ
Комплекс экстрофия-эписпа-дия (КЭЭ) является наиболее серьезной формой аномалии развития передней брюшной стенки. При КЭЭ имеются характерные дефекты мочевыделительной системы, опорно-двигательного аппарата, таза, тазового дна, брюшной стенки, гениталий, а иногда даже позвоночника и ануса [1]. Существует много теорий эмбриогенеза экстрофии, однако, наиболее значимой причиной развития экстрофии мочевого пузыря (ЭМП) является давление хвоста эмбриона на область урогенитальной диафрагмы (место, где происходит соединение зачатков мочевого пузыря, уретры и полового члена) в период закладки органов на 3-4 неделе внутриутробного развития F.D. Stephens, J.M. Hutson [2].
КЭЭ может иметь различный уровень тяжести, начиная с легкой формы эписпадии (Э), с нижним и верхним расщеплением, заканчивая экспериментальная и клиническая урология № 1 2 0 16 полной картиной классической ЭМП (КЭМП), и экстрофией клоаки (ЭК) – эта аномалия также встречается в составе комплекса OEIS (омфало-целе, экстрофия клоаки, атрезия ануса, пороки развития крестца). КЭЭ можно подразделить на "классические" или "типичные" формы КЭЭ (Э, КЭМП, и ЭК) и «нетипичные» формы КЭЭ (экстрофия добавочного мочевого пузыря, прикрытая экстрофия и псевдо-экстрофия).
ИСТОРИЯ
Первые упоминания об экстрофии мочевого пузыря датируются 2000 г. до н.э., их можно обнаружить на Ассирийских клинописных дощечках. В то время врожденные аномалии у людей и животных тщательно записывались на дощечки из-за их важности в качестве примет и использовались предсказателями для гадания. M. Feneley и J.P. Gearhart исследовали ассиро-вавилонские описания врожденных аномалий из клинописных текстов в Британском музее в Лондоне. Хотя ссылки на аномалии наружных половых органов были частыми (например, гермафродитизм, отсутствие наружных половых органов, односторонний и двусторонний крипторхизм), информации об аномалиях почек и мочевого пузыря было мало и их было трудно интерпретировать с медицинской точки зрения. Удвоение и латеральность аномалий описывались подробно, благодаря их отчетливой выраженности, однако сочетанные пороки развития описаны не были. На основе этих исследований, проведенных с видным ассириологом, наличие точного описания экстрофии мочевого пузыря или клоаки не было подтверждено [1].
Первый зарегистрированный случай описания эписпадии приписывают византийскому императору Ираклию (610 - 641 г. н.э.). Первое же подробное описание экстрофии как врожденного порока за авторством J. Schenck von Grafenberg было датировано в 1595 г. (M. Feneley, J.P.
Gearhart, 2000) [1]. Сам термин «экстрофия» впервые был использован F. Chaussier в 1780 г. [3]. С тех пор хирурги трудились над улучшением результатов лечения данной мальформации, однако прогресс стал намечаться лишь с конца XIX в.
C. Triersch в 1869 году описал закрытие обнаженного мочевого пузыря латеральными лоскутами, что позволило достичь емкости мочевого пузыря около 100 мл. В 1894 г. K. Maydl описал более успешный метод отведения мочи с трансплантацией треугольника Льето в прямую кишку. R.C. Coffey, R.M. Nesbit и W.F. Leadbetter усовершенствовали технику для предотвращения рефлюкса из сигмовидной кишки в мочеточник [4, 5, 7]. F.von Trendelenburg в 1906 году сообщил о выполненной двусторонней крестцово-подвздошной остеотомии и применении тазовой петли для защиты закрытой передней стенки мочевого пузыря [6]. В 1942 году Н.Н.Young доложил о первом случае удержания мочи после закрытия эктрофии мочевого пузыря. В 1948 г. L.Michon опубликовал случай успешного лечения пациента, которому была выполнена полная реконструкция. H. Lepor и R.D. Jeffs в 1983 г., Н-G. Mesrobian, P.P. Kelalis и S.A. Kramer в 1988 г., а также P.G.Ransley в 1991г. 75-80% пациентов получили результат удержания мочи после этапной реконструкции с усовершенствованием уретропластики и аугментации мочевого пузыря [8-15].
Первую успешную уретропла-стику при эписпадии выполнил F.V.Cantwell в 1895 г.: произведена полная мобилизация уретральной площадки, создана тубулязирован-ная уретра, которая перемещена под предварительно ротированые в дорсальном направлении и соединенные в средней трети уретры кавернозные тела [16].
ЭПИДЕМИОЛОГИЯ
Опубликованы различные данные о частоте встречаемости КЭЭ, особенно в отношении различных подтипов, в различных этнических группах, а также относительно гендерного соотношения. В общей сложности, в сочетании заболеваемости всего КЭЭ можно оценить как 1 на 10 000 рождений. Заболеваемость в соотношении мужского и женского пола по данным различных авторов варьирует от 1,5:1 до 6,0:1 [17-20].
Международный информационный центр мониторинга врожденных дефектов оценивает среднюю заболеваемость эписпадией как 2,4 на 100 000 [18]. Среди включенных 148 случаев, только четыре были у пациенток женского пола [18]. Тем не менее, вполне вероятно, что доля женщин, страдающих недержанием мочи с эписпадией по-прежнему не диагностируется [17]. Принимая это во внимание, в последнее время сообщалось что соотношение мужчин к женщинам в заболеваемости эписпадией равна 1,4: 1. В Европе диапазон заболеваемости эписпадией составляет от 0,6 на 100000 во Франции до 4,7 на 100000 в Дании . Наибольшая встречаемость эписпадией – 8,1 на 100 000 новорожденных – отмечена у американских индейцев, в то время как заболеваемость среди американцев азиатского происхождения составила 1 на 100 000 [19].
Зарегистрированная заболеваемость КЭМП варьирует от 2,1 до 4,0 на 100 000 живорожденных [17,18]. Складывается впечатление, что КЭМП встречается чаще среди младенцев белой расы, и заболеваемость варьирует в зависимости от географического положения и социальноэкономического статуса [20]. Хотя C.P. Nelson и соавт. [20] обнаружили почти равное отношение мужчин к женщинам при КЭМП, обобщение сведений многочисленных исследований показывают гендерное соотношении как 2,4:1 [18, 20]. Сообщения о высоких соотношениях заболеваемости мужчин и женщин, как 5: 1 или 6: 1, очень редки. Частота ЭК, колеблется в диапазоне от 0,5 до 1 на 200 000 рождений [17,18,20]. В основном,
ЭК чаще страдают девочки. По данным L. Gambhir и соавт. соотношение полов равно 2,0:1 [19].
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
Все составные элементы КЭЭ проявляются специфически и определяются при осмотре сразу после рождения педиатрами и акушерами. При эписпадии анатомические изменения полового члена выражены: уретра расщеплена вплоть до наружного отверстия мочеиспускательного канала, которое в зависимости от формы Э может располагаться на головке (рис. 1), средней и проксимальной части ствола полового члена (рис. 2), в пено-пуби-кальном углу (рис. 3).
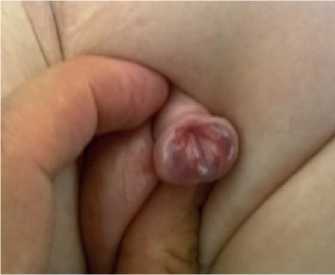
Рис. 1. Головчатая форма эписпадии
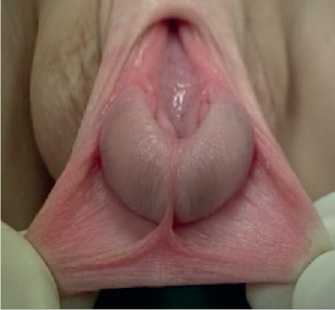
Рис.2. Стволовая форма эписпадии

Рис. 3. Тотальная эписпадия
При тотальной эписпадии передняя стенка мочеиспускательного канала отсутствует на всем протяжении. Головка полового члена уплощена, крайняя плоть покрывает лишь ее вентральную поверхность. Оба пещеристых тела расположены под уретральной площадкой. Внимательный осмотр позволяет определить семенной бугорок и семенные протоки. Вследствие расхождения лонных костей и прямых мышц живота, половой член укорочен, имеет дорсальную деформацию. У большинства пациентов-мальчиков (около 70%) отмечается тотальная эписпадия с недержанием мочи [21].
Классическая экстрофия в дополнение к проявлениям тотальной эписпадии характеризуется отсутствием части передней брюшной стенки и мочевого пузыря, при этом задняя стенка мочевого пузыря замещает собой отсутствующую часть передней брюшной стенки (рис. 4). Видимая слизистая мочевого пузыря выглядит красноватой при рождении, на поверхности могут быть слизистые полипы. Пупок располагается ниже обычного, ниже него отмечается расхождение прямых мышц живота и определяемые пальпаторно пупочные грыжи. Лобковые кости могут прощупываться с обеих сторон эвагинированной стенки мочевого пузыря. Яички обычно нормальных размеров, расположены в мошонке.
Часто пороки развития составляющие КЭЭ сочетаются с другими мальформациями.
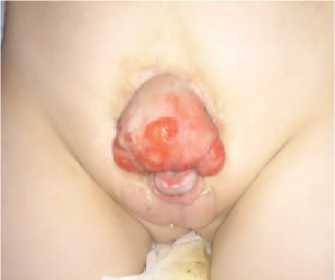
Рис. 4. Мальчик 3 лет с экстрофией мочевого пузыря
Аномалии, связанные с эпис-падией обычно ограничиваются деформациями наружных половых органов, диастазом лобкового симфиза и недостаточностью удерживающего механизма мочевого пузыря. В обзоре, опубликованном S. Arap и соавт. в 1988 году, описан один случай агенезии почки и один случай эктопии почки в группе из 38 пациентов [21]. Функция уретерове-зикального соустья при тотальной эписпадии зачастую недостаточна, в различных исследованиях описываются от 30% до 40% встречаемости пузырно-мочеточникового рефлюкса [11, 22].
В среднем у одной трети всех пациентов с ЭМП, особенно у больных с клоакальной экстрофией, наблюдаются такие урологические аномалии как обструкция лоханочно-мочеточникового сегмента, тазовая эктопия почки, подковообразная почка, гипо- или агенезия почки, мегауретер, эктопия мочеточника, уретероцеле и удвоение чашечно-лоханочной системы [1]. Тем не менее, у 100 % детей с ЭМП отмечается наличие двухстороннего пузырно-мочеточникового рефлюкса (ПМР) вследствие нарушения развития пузырно-мочеточникового соустья. В обзоре, опубликованном J. Ben-Chaim с соавт. среди мальчиков с тотальной эписпадией ПМР встречается реже, чем у пациентов с ЭМП (82% против 100%, соответственно) [23].
МЕТОДЫ ЛЕЧЕНИЯ
Цель коррекции тотальной эписпадии состоит в достижении удержания мочи с сохранением верхних мочевых путей и реконструкцию косметически приемлемого полового члена. Хирургическое лечение недержания мочи практически идентично тому, что выполняется при закрытии экстрофии мочевого пузыря.
Роль остеотомии при реконструктивных операциях у пациентов с экстрофией сводится к сбли- экспериментальная и клиническая урология № 1 2 0 16 жению костей симфиза, что обеспечивает снижение натяжения мышц и надежное закрытие брюшной стенки, а также перемещение закрываемого мочевого пузыря глубже в таз. Эти меры напрямую влияют на улучшение удержания мочи и снижение риска рецидива ЭМП. С точки зрения реконструкции полового члена, сведение лонных костей обеспечивает его удлинение [1]. За счет расхождения симфиза происходит растяжение ножек кавернозных тел, что является одним из факторов укорочения полового члена у пациентов с ЭМП до 50% [24].
В настоящее время в мировой практике используются различные формы остеотомии. Наиболее часто используются задняя сагиттальная подвздошная остеотомия, поперечная подвздошная остеотомия, диагональная средне-подвздошная остеотомия, комбинированная вертикальная и горизонтальная тазовая остеотомия, передняя лобковая остеотомия (рамотомия).
H.H. Young сообщил о первом эффективном лечении недержания мочи у пациента мужского пола с тотальной эписпадией в 1922 г. [3]. С этого времени результаты лечения тотальной эписпадии постепенно улучшаются [11, 21, 25, 26].
У пациентов с тотальной эпис-падией и большой емкостью мочевого пузыря, реконструкция эпи-спадии и шейки мочевого пузыря может быть выполнена одномоментно. Тем не менее, результаты лечения небольшого мочевого пузыря в сочетании с экстрофией и небольшого мочевого пузыря в сочетании с эписпадией привели к практике выполнения уретропла-стики и удлинения полового члена до реконструкции шейки мочевого пузыря [22, 26].
Небольшой, инконтинентный мочевого пузырь при наличии ПМР едва ли является идеальным случаем для реконструкции шейки мочевого пузыря и реимплантации мочеточников.
Исходная емкость мочевого пузыря является наиболее доминирующим показателем прогноза удержания мочи. В исследовании S. Arap с соавт. отмечен гораздо более высокий уровень удержания мочи у тех пациентов, которые имели адекватную емкость мочевого пузыря до реконструкции шейки мочевого пузыря, чем у пациентов с неадекватной емкостью последнего (71% против 20% соответственно) [21]. Пластика шейки мочевого пузыря по Young-Dees-Leadbetter, уретропек-сия по Marshall-Marchetti-Krantz и реимплантация мочеточника выполняются, когда емкость мочевого пузыря достигает приблизительно 80-85 мл, что обычно соответствует возрасту 4-5 лет.
Достижение удержания мочи после коррекции эписпадии по данным различных авторов отражены в таблице 1 [11, 21, 23, 25]. Большинству из этих пациентов пластика шейки мочевого пузыря выплнена по Young-Dees-Leadbetter. Удержание мочи получено у 82% пациентов мужского пола (Ben-Chaim и соавт.) [23]. Коррекция эписпадии, выполняемая перед реконструкцией шейки мочевого пузыря, способствует повышению сопротивления току мочи на выходе из мочевого пузыря, и возможному увеличению емкости мочевого пузыря. Хотя у пациентов и с Э и с ЭМП достигается несколько большая емкость мочевого пузыря после коррекции эписпадии, большее увеличение объема мочевого пузыря отмечено чаще у пациентов с тотальной эпис-падией. Увеличение емкости мочевого пузыря может способствовать повышению качества удержания мочи в этой группе, по сравнению с группой пациентов с классической ЭМП. Клинически мочевые пузыри при тотальной эписпадии более гибкие, их легче мобилизовать и выполнить реконструкцию шейки мочевого пузыря чем при ЭМП.
Реконструктивные операции на половом члене при эписпадии и экстрофии одинаковы.
Основными задачами реконструкции полового члена являются:
-
• коррекция искривления кавернозных тел, их расправление;
-
• формирование уретры;
-
• реконструкция головки;
-
• закрытие дефекта кожи полового члена.
Предложено много различных способов реконструкции уретры при тотальной эписпадии. G. Monfort предложил использовать поперечный перемещенный лоскут [27]. Располагать реконструированную уретру между и под кавернозными телами предлагали многие авторы (F.V. Cantwell; P.G. Ransley c соавт.; J.Р. Gearhart c соавт.) [22, 31, 32]. M.I. Mitchell и D.J. Bagley предложили методику полной разборки полового члена [28]. Позже другие авторы сообщили о многоцентровом опыте работы с этой техникой – 17 пациентах из четырех учреждений (M. Zaontz и соавт.)[29].
Таблица 1. Процент достижения удержания мочи после коррекции эписпадии у мальчиков
|
Показатель |
Ben-Chaim и соавт. (1995) [23] |
Kramer, Kelalis (1982) [11] |
Arap и соавт. (1988) [22] |
Burkholder, Williams (1965) [25] |
|
Кол-во наблюдений |
15 |
53 |
38 |
27 |
|
Проведено реконструкций шейки мочевого пузыря |
11 |
32 |
21 |
17 |
|
Успешная коррекция недержания мочи |
9 |
22 |
15 |
8 |
|
Процент успешной коррекции |
82% |
69% |
71% |
47% |
Искривление полового члена было скорректировано, эректильная функция при этом была сохранена, наружное отверстие уретры было, в конечном счете, расположено на головке полового члена. При этом пациенты были удовлетворены косметическими результатами данной операции. Характерной особенностью операции Mitchell является полное разделение кавернозных тел и рассечение головки на две отдельные половинки, с диссекцией уретральной площадки от кавернозных тел (рис. 5). Авторы считали, что полное рассечение кавернозных тел и головки на две отдельные половинки необходимо для упрощения выполнения медиальной ротации кавернозных тел, с тщательной вен-трализацией тубуляризированной уретральной площадки [28]. Ротация кавернозных тел приводит к удовлетворительной коррекции дорсального искривления. Однако, 77% пациентов в последующем требуются дополнительные операции по коррекции гипоспадии, поскольку во время «разборки полового члена» и распрямления кавернозных
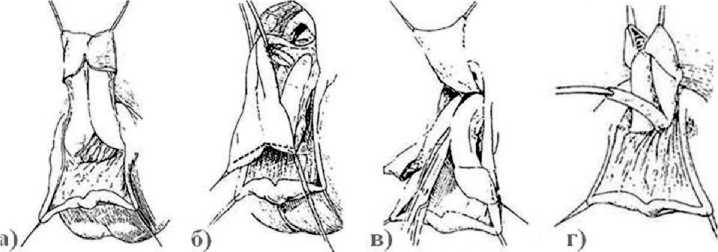
Рис. 5. Этапы уретропластики по методике Mitchell-Bagley: а) выделение кавернозных тел; б) мобилизация уретральной площадки; в) рассечение головки и разделение кавернозных тел; г) этап формирования уретры и сшивания кавернозных тел
тел длины уретральной площадки оказывается недостаточно для достижения до верхушки головки полового члена (A.T. Hafez и соавт.) [30].
В более крупном исследовании, выполненном P.G. Ransley и I. Surer с соавт., были получены положительные результаты лечения по модифицированной методике Cantwell-Ransley [31,32]. Для выпрямления изогнутогополового члена при эпис-падии P. Ransley представил концепцию иссечения дорсальной хорды и сохранения дорсомедиального анастомоза пещеристых тел над уретрой [33]. Эта техника подразумевает мобилизацию уретральной площадки от подлежащих тканей, с от-сепаровкой кавернозных тел друг от друга. Дистальная часть уретральной площадки, кавернозных тел и головка остаются неиссеченными для обеспечения хорошего кровоснабжения и предотвращения укорочения формируемой уретры (рис. 6). Уретральная площадка тубуляризиру-ется и помещается вентральнее под кавернозные тела. Мобилизованные кавернозные тела ротиру-ются ме- диально и фиксируются посредством наложения кавернозо-кавер-нозостомии, обеспечивая эффективное расправление кавернозных тел (рис. 7). Однако в послеоперационном периоде у больных пубертатного возраста с выраженной дисплазией белочной оболочки по дорсальной поверхности кавернозных тел наблюдается ее значительное укорочение по сравнению с длиной белочной оболочки вентральной поверхности. В таких наблюдениях ротации и кавернозо-кавернозного анастомоза может быть недостаточно. Могут наблюдаться S-образные искривления дистальной части кавернозных тел (по типу кобры).
Преимуществами техники Cant-well-Ransley и Mitchell-Bagley являются анатомически правильная реконструкция с лишь незначительной степенью остаточной девиации кавернозных тел, низкий уровень образования свищей благодаря укрытию неоуретры кавернозными телами на всем протяжении. Если мобилизация уретральной площадки от кавернозных тел достаточно радикальная, то кавернозные тела наиболее вероятно могут быть соединены без натяжения, без необходимости выполнения корпоро-томии и полной мобилизации нейроваскулярных пучков. Тем не менее, рубцы и укороченность сосудисто-нервных пучков впоследствии могут привести к серьезным, часто неисправимым искривлениям полового члена. Одним из основных требований для этих операций является аккуратная и тщательная моби-
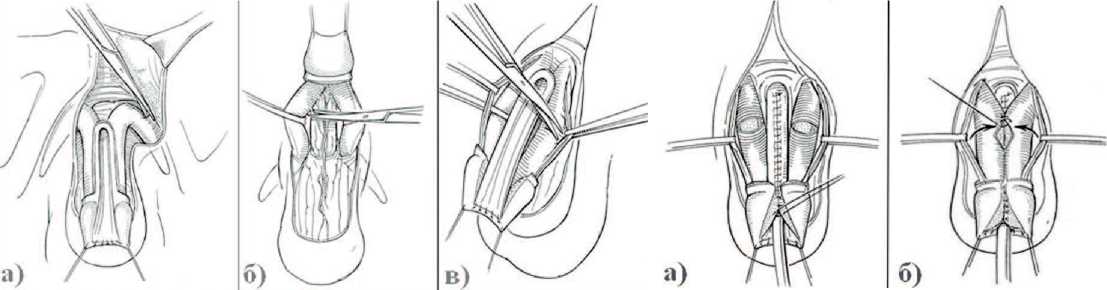
Рис. 7. Схема уретропластики по методике Cantwell-Ransley: а) этап формирования уретры; б) этап ротации и сшивания кавернозных тел над уретрой
Рис. 6. Схема уретропластики по методике Cantwell-Ransley: а) этап мобилизации ножек кавернозных тел; б) мобилизация уретральной площадки; в) этап выделения сосудистонервных пучков экспериментальная и клиническая урология № 1 2 0 16 лизация сосудисто-нервного пучка (с использованием микрохирургической оптики), что способствует поддержанию достаточного кровоснабжения и иннервации, сохранению эрекции и, самое главное, – профилактике ишемии головки полового члена.
ЗАКЛЮЧЕНИЕ
Комплекс экстрофия-эписпа-дия является одним из самых тяжелых заболеваний в клинической практике детских урологов. С каждым годом число новорожденных с данной патологией увеличивается. Доля мальчиков среди таких боль- ных выше в 1,5-6 раз.
Несмотря на то, что описание и изучение экстрофии и эписпадии началось с VII в. н.э. успешные результаты, обеспечивающие оптимальное качество жизни, были достигнуты лишь к началу ХХ века.
В настоящее время продолжается усовершенствование методик оперативного лечения недержания мочи и реконструкции полового члена при эписпадии и экстрофии. Это комплексная проблема, требующая активного участия различных специалистов: детских урологов-андрологов, хирургов, травматологов-ортопедов и неонатологов. К сожалению, нет точных руководств по ве- дению таких пациентов, и каждая методика лечения имеет свои положительные и отрицательные стороны. Методом выбора при лечении недержания мочи у пациентов с аномалиями КЭЭ является пластика шейки мочевого пузыря в сочетании с остеотомией. Золотым же стандартом реконструкции полового члена, по нашему мнению, можно считать уретропластику с разборкой полового члена на составляющие, иссечение хорды, мобилизацию кавернозных тел и их расправление, а также формирование уретры и погружение ее под кавернозные тела. При этом выбор техники операции остается за хирургом.
Резюме:
Список литературы Коррекция аномалии полового члена при эписпадии и экстрофии мочевого пузыря (обзор литературы)
- Gearhart JP. The bladder exstrophy-epispadias-doacal exstrophy complex.//In Pediatric Urology. Volume Chapter Edited by: Gearhart JP, Rink RC, Mouriquand PDE. Philadelphia: W B. Saunders Co. 2001. P. 511-546.
- Ашкрафт К.У., Холдер Т.М. Детская хирургия, Руководство СПб., ООО «Раритет-М», 1999, с.19-20
- Murphy LJT. The history of urology. // Charles C Thomas Publishers, Springfield, 1972. P.288-333.
- Thierch C. Ueber die entstchungsweiseund operative behandlung der Epispadie, Arch Heilbundle, 1869. №10. P.20
- Leadbetter W-F. Considerations of the problems incident to the performance of ureteroenterostomy: report of a technique. // J Urol, 1955. Vol.73, P 67.
- Trendelenburg F. De la cure operatoire de l’ exstrophie vesicale et de l’ epispadias.//Arch Klin Chir, 1892. №.43. P.394.
- Gambhir L, Holler T, Müller M, Schott G, Vogt H, Detlefsen B, Ebert AK, Fisch M, Beaudoin S, Stein R, Boyadjiev S, Rösch W, Utsch B, Boemers TM, Reutter H, Ludwig M. Epidemiological survey of 214 European families with Bladder Exstrophy-Epispadias Complex (BEEC).//J Urol, 2008. Vol.179. P.1539-1543.
- Mesrobian H-GJ, Kelalis PP, Kramer SA. Long-term follow-up of 103 patients with bladder exstrophy. // J Urol, 1988. Vol. 139. P.719-722.
- Michon L. Conservative operations for exstrophy of the bladder with particular reference to urinary incontinence.//Br J Urol, 1948. Vol. 20. P.167.
- Marshall VF, Muecke EC. // Functional closure of typical exstrophy of the bladder. // J Urol 1970. Vol. 104. P. 205.
- Kramer SA, Kelalis P. Assessment of urinary continence in epispadias: review of 94 patients.//J Urol, 1982. Vol.128. P.290
- Williams DI, Keaton J. Vesical exstrophy: twenty years’ experience.//Br J Surg, 1973. N 60. Р. 203.
- Lepor H, Jeffs RD: Primary bladder closure and bladder neck reconstruction in classical bladder exstrophy.//J Urol, 1983. Vol. 130. Р.1142-1145.
- Hollowell JG, Ransley PG. Surgical management of incontinence in bladder exstrophy.//Br J U rol, 1991. Vol. 68. P.543
- James A.O’ Neill, Jr, Marc I. Rowe, Jay L.Grosfeld, Eric W Fonkalsrud, Arnold G. Coran. Pediatric Surgery, 1998. 5th edition. Vol. 2. p.1709-1759.
- Cantwell F.V Operative Treatment of Epispadias by Transplantation of the Urethra.//Ann Surg, 1895. Vol. 22, N. 6. P. 689-701.
- Boyadjiev SA, Dodson JL, Radford CL, Ashrafi GH, Beaty TH, Mathews RI, Broman KW, Gearhart JP. Clinical and molecular characterization of the bladder exstrophy-epispadias complex: analysis of 232 families.//BJU Int, 2004. N 94. P. 1337-1343.
- Anonymous: Epidemiology of bladder exstrophy and epispadias: a communication from the International Clearinghouse for Birth Defects Monitoring Systems. Teratology 1987. N 36. Р. 221-227.
- Bennet AH. Exstrophy of the bladder treated by ureterosigmoidostomies, long term evaluation.//Urology 1973, Vot 2. P. 165-168.
- Nelson CP, Dunn RL, Wei JT. Contemporary epidemiology of bladder exstrophy in the United States.//J Urol. 2005. Vol. 173. P.1728-1731.
- Campbell MF. Epispadias; a report of 15 cases.//J. Urol. (Baltimore) 1952, Vol.67. P. 988
- Arap S, Nahas WC, Giron AM. Continent epispadias: Surgical treatment of 38 cases.//J Urol 1988. Vol. 140. P. 577.
- Ben-Chaim J, Peppas DS, Jeffs RD, Gearhart JP. Complete male epispadias: Genital reconstruction achieving continence.//J Urol 1995b; Vol.153. P. 1665.
- Silver RI, Yang A, Ben-Chaim J, Jeffs R, Gearhart JP. Penile length in adulthood after exstrophy reconstruction.//J Urol 1997, Vol. 157. N 3. P. 999-1003.
- Burkholder GV, Williams DI. Epispadias and incontinence: Surgical treatment in 27 children.//J Urol 1965. Vol.94. P. 674.
- Peters CA, Gearhart JP, Jeffs RD. Epispadias and incontinence: The child with a small bladder.//J Urol 1988. Vol. 140. P. 1199.
- Monfort G, Morisson-Lacombe GM, Guys JM, Coguel M. Transverse island flap and double flap procedure in the treatment of congenital epispadias in 32 patients.//J Urol 1987. Vol. 138. P. 1069.
- Mitchell MI, Bagley DJ. Complete penile disassembly for epispadias repair: The Mitchell technique.//J Urol 1996. Vol. 155. P. 300.
- Zaontz M, Steckler RE, Shortliffe LM. Multicenter experience with the Mitchell technique for epispadias repair.//J Urol 1998; Vol.160. P. 1972
- Hafez AT, El-Sherbiny MT, Shorrab AA. Complete primary repair of bladder exstrophy in children presenting late and those with failed initial closure: single center experience.//J Urol. 2005. Vol. 174. P. 1549-1552.
- Kajbafzadeh AN, Duffy PG, Ransley PG. The evolution of penile reconstruction and epispadias repair: A report of 180 cases.//J Urol 1995. Vot 154. P. 858.
- Surer I, Baker LA, Jeffs RD, Gearhart JP. The modified Cantwell-Ransley repair in exstrophy and epispadias: 10 year experience.//J Urol 2001. Vol.164. P.1040.
- Ransley PG, Duffy PG, Wollin M: Bladder exstrophy closure and epispadias repair. In Paediatric Surgery. 4th edition. // Edited by: Spitz l, Nixon HH. London: Butterworths. 1988. P. 620-632.


