Коррекция аортальных пороков в сочетании с расширением восходящей аорты у взрослых пациентов: сравнение процедуры Росса и операции Бенталла-Де Боно
Автор: Караськов Александр Михайлович, Шарифулин Равиль Махарамович, Богачев-Прокофьев Александр Владимирович, Демин Игорь Иванович, Железнев Сергей Иванович, Опен Александр Борисович
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Приобретенные пороки сердца
Статья в выпуске: 3 т.19, 2015 года.
Бесплатный доступ
Цель Сравнение результатов процедуры Росса и операции Бенталла-Де Боно лечения пациентов с аортальными пороками и сопутствующим расширением восходящего отдела аорты. Материал и методы В исследование включили пациентов с пороками аортального клапана и расширением восходящей аорты >45 мм, которым выполнили операции Росса (76 пациентов) и Бенталла-Де Боно (47). С помощью методики propensity score matching сформировали две группы по 42 пациента: I группа - процедура Росса, II - операция Бенталла-Де Боно. Проведен сравнительный анализ результатов оперативного лечения с оценкой качества жизни. Медиана срока наблюдения для I группы - 24 (12; 35) мес., для II - 21 (14; 25) мес. (p = 0,27). Результаты Не получено статистически значимых различий по показателям ранней и отдаленной летальности, а также по характеру осложнений в раннем послеоперационном периоде. Свобода от протез-зависимых осложнений для I группы составила 95,1±3,4%, для II - 76,2±8,2% (p = 0,08). Свобода от дисфункции протезов для I и II групп - 91,0±5,0 и 97,4±2,6% (p = 0,3). качество жизни пациентов в первой группе было выше, статистически значимые различия получены для показателя физического функционирования (I группа - 85 (72,5; 90), II - 80 (65; 85), p = 0,02) и психического здоровья (I группа - 80 (70; 84), II - 68 (64; 76), p = 0,02) опросника SF-36. Выводы Процедура Росса - безопасная методика лечения пациентов с аортальными пороками и сопутствующим расширением восходящей аорты. качество жизни после процедуры Росса выше, чем после операции Бенталла-Де Боно.
Аортальный порок, аневризма восходящей аорты, процедура росса, операция бенталла-де боно, качество жизни
Короткий адрес: https://sciup.org/142140685
IDR: 142140685 | УДК: 616.132.13-089.168.1
Текст научной статьи Коррекция аортальных пороков в сочетании с расширением восходящей аорты у взрослых пациентов: сравнение процедуры Росса и операции Бенталла-Де Боно
Таблица 1 Общая характеристика пациентов
|
Характеристика |
Средние значения |
|||
|
I группа, n = 113 |
II группа, n = 121 |
p |
Критерий |
|
|
Возраст, лет, n |
53,2±1,3 |
49,6±1,2 |
0,04 |
F |
|
Возраст >70 лет, n (%) |
10 (9,1±2,7) |
6 (5,0±2,0) |
0,3 |
Fe |
|
Пол, мужской, n (%) |
75 (68,2±4,5) |
90 (75,0±4,0) |
0,3 |
Fe |
|
Площадь поверхности тела, м2 |
1,86±0,02 |
1,84±0,02 |
0,41 |
F |
|
III–IV ФК ХСН, n (%) |
99 (90,0±2,8) |
108 (90,0±2,8) |
0,99 |
Fe |
|
ФП, n (%) |
19 (17,3±3,7) |
13 (10,8± 2,8) |
0,18 |
Fe |
|
АГ, n (%) |
43 (39,1±4,7) |
29 (24,2±3,9) |
0,02 |
Fe |
|
Периферический атеросклероз, n (%) |
18 (16,4±3,5) |
7 (5,8±2,1) |
0,01 |
Fe |
|
СД, n (%) |
10 (9,1±2,7) |
3 (2,5± 1,4) |
0,04 |
Fe |
|
ОНМК, n (%) |
7 (6,4±2,3) |
4 (3,3± 1,6) |
0,36 |
Fe |
|
ХОБЛ + БА, n (%) |
12 (10,9) |
12 (10,0) |
0,83 |
Fe |
|
III–IV степень ХПН, n (%) |
5 (4,6) |
6 (5,0) |
0,99 |
Fe |
|
АоСт, n (%) |
54 (49,1±4,8) |
45 (37,5±4,4) |
0,08 |
Fe |
|
ЛП, см |
5,4±0,06 |
5,5±0,07 |
0,40 |
F |
|
КДО, мл |
200,9±6,8 |
212,3±6,7 |
0,24 |
F |
|
КСО, мл |
91,6±4,3 |
99,4±4,4 |
0,21 |
F |
|
МЖП, см |
1,62±0,03 |
1,50 ± 0,03 |
0,005 |
F |
|
ЗС ЛЖ, см |
1,48±0,03 |
1,41 ± 0,03 |
0,09 |
F |
|
ФВ ЛЖ, % |
55,8±1,2 |
54,3±1,2 |
0,37 |
F |
|
ФВ ЛЖ <50%, n (%) |
36 (33,0±4,5) |
39 (32,5±4,3) |
0,99 |
Fe |
|
Средний градиент АоК, torr |
49 (21–62) |
33 (14–62) |
0,42 |
U |
|
ЛГ ≥ 40 torr, n (%) |
31 (28,2±4,3) |
58 (48,3±4,6) |
0,002 |
Fe |
F – статистика Фишера для равенства дисперсий; L – статистика Левена для равенства дисперсий; Fe – точный критерий Фишера для равенства долей; U – статистика Манна – Уитни для порядковых величин; ФК – функциональный класс; ХСН – хроническая сердечная недостаточность; ФП – фибрилляция предсердий; АГ – артериальная гипертензия; СД – сахарный диабет 2-го типа; ОМНК – острое нарушение мозгового кровообращения; ХОБЛ – хроническая обструктивная болезнь легких; БА – бронхиальная астма; ХПН – хроническая почечная недостаточность; АоСт – аортальный стеноз; ЛП – левое предсердие; КДО – конечный диастолический объем; КСО – конечный систолический объем; МЖП – межжелудочковая перегородка; ЗС ЛЖ – задняя стенка левого желудочка; ФВ – фракция выброса; ЛГ – легочная гипертензия приводит к нечетким представлениям о тактике ведения данных пациентов и зачастую субъективным решениям оперирующего хирурга о вмешательстве на митральном клапане (МК). В рекомендациях Европейской ассоциации кардиоторакальных хирургов (EACTS) по лечению пациентов с заболеваниями клапанов сердца от 2012 г. в главе о вторичной МН внимание уделено МН ишемической этиологии, а тактика ведения при вторичной МН неишемического генеза освещена недостаточно [9].
Цель – оценить отдаленные результаты хирургического лечения выраженного аортального порока, сочетающегося с умеренной вторичной МН с одновременной коррекцией МР и без нее. Выявить предикторы летальности и рекуррентной МР в отдаленные сроки.
Материал и методы
С января 2003 г. по декабрь 2011 г. в ННИИПК им. акад. Е.Н. Мешалкина выполнили протезирование АоК у 1 574 пациентов, в 463 случаях аортальный порок сочетался с умеренной МН. Мы провели ретроспективное когортное исследование оперативного лечения пациентов с выраженным аортальным пороком в сочетании с вторичной митральной недостаточностью.
Критерии исключения: сопутствующая ишемическая болезнь сердца (гемодинамически значимое поражение коронарного русла, перенесенные инфаркты миокарда в анамнезе, вмешательства на коронарных артериях), активный инфекционный эндокардит, органическое поражение створок и ранее протезированный МК. Таким образом, отобрали 234 пациента.
Таблица 2 Периоперационные данные
|
Характеристика |
I группа |
II группа |
p |
Критерий |
|
Искусственное кровообращение, мин |
115,5 (98–165) |
152 (126–196) |
<0,0001 |
U |
|
Окклюзия аорты, мин |
90 (76–124) |
125 (100–149) |
<0,0001 |
U |
|
Длительность госпитального периода, дни |
20,5 (16–26) |
19,5 (15–24) |
0,35 |
U |
|
Резидуальная МН, абс. ч./общ. число (%) |
9/105 (8,6±2,8) |
3/113 (2,7±1,7) |
0,1 |
Fe |
|
Госпитальная летальность, абс. ч (%) |
5 (4,6±2,0) |
7 (5,8±2,1) |
0,77 |
Fe |
Первичной конечной точкой выбрали смерть от любой причины и повторное хирургическое вмешательство по поводу прогрессирования МН (впоследствии ставшая комбинированной в связи с малым количеством наблюдений после повторной хирургической коррекцией МР); вторичными конечными точками выбрали возобновление МН в отдаленном периоде, ФК ХСН и ФВ ЛЖ. Общая продолжительность наблюдения составила 976 пациенто-лет (от 1 до 10,8 года), средний период наблюдения – 4,35 года. Отдаленные результаты получили у 95,4% пациентов.
Пациентов разделили в зависимости от наличия коррекции МК на две группы: I группа – изолированное протезирование аортального клапана без коррекции умеренной МН (113 пациентов) и II группа – протезирование АоК в сочетании с пластической коррекцией сопутствующей умеренной МН (121 пациент).
Как видно из табл. 1, пациенты обеих групп не имели различий по полу, ФК ХСН, типу гемодинамического порока АоК, наличию ФП, размерам полостей сердца и сократительной способности левого желудочка.
Возраст пациентов группы с коррекцией МН был меньше (53,2 против 49,6; р = 0,04), но количество пациентов старше 70 лет было сопоставимым (р = 0,30). В группе без вмешательства на МК чаще встречалась сопутствующая патология: артериальная гипертония (р = 0,02), периферический атеросклероз (р = 0,01), сахарный диабет (р = 0,04). По ЭхоКГ-критериям, в группе без коррекции была более выраженная гипертрофия ЛЖ (р = 0,005), а в группе с коррекцией МН чаще регистрировали легочную гипертензию (р = 0,002).
Согласно рекомендациям Американского общества эхокардиографии [10, 11], для оценки выраженности МН у пациентов использовались качественные и по-луколичественные методы с учетом принятого протокола. К умеренной МН относилось распространение струи регургитации не менее II степени (до устьев легочных вен) при условии, что цветное пятно регургитации занимало от 20 до 40% площади левого предсердия (ЛП).
Митральная недостаточность считалась резидуальной, если ее регистрировали в пределах умеренной степени при выписке. В отдаленном периоде проанализировали 362 протокола ЭхоКГ, что составило 70,9% данных на момент окончания исследования. Если к выписке регургитация на клапане была незначительной или отсутствовала и появилась при ЭхоКГ в отдаленном периоде, то это считалось рецидивом митральной недостаточности.
Протезирование аортального клапана выполнялось по принятой в клинике методике в условиях умеренной гипотермии 28–30 °С, защита миокарда – антеградная фармакохолодовая кристаллоидная кардиоплегия в корень аорты или в устья коронарных артерий при наличии аортальной недостаточности.
Таблица 3 Послеоперационные осложнения
|
Осложнения, n (%) |
I группа, n = 113 |
II группа, n = 121 |
p |
Критерий |
|
Периоперационный острый инфаркт миокарда |
5 (4,4) |
2 (1,7) |
0,26 |
Fe |
|
Сердечная недостаточность |
7 (6,2) |
11 (9,0) |
0,47 |
Fe |
|
Нарушения ритма сердца |
9 (8,0) |
26 (21,5) |
0,005 |
Fe |
|
Инфекционные осложнения |
2 (1,8) |
4 (3,3) |
0,68 |
Fe |
|
Синдром полиорганной недостаточности |
4 (3,8) |
9 (7,4) |
0,26 |
Fe |
|
Рестернотомия-гемостаз |
4 (3,8) |
5 (4,1) |
0,99 |
Fe |
Пациенты с риском
|
I группа |
113 |
81 |
62 |
27 |
14 |
3 |
|
II группа |
121 |
86 |
63 |
33 |
12 |
4 |
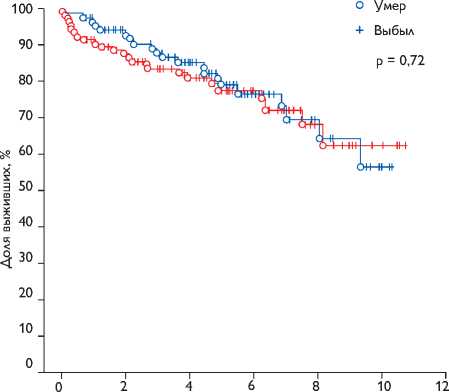
После операции, лет
Рис. 1. Первичная комбинированная точка (смерть от любых причин + повторное вмешательство по поводу прогрессирующей МН). Log-rank тест: test statistic = 0,357; p = 0,72. Различия достоверно не значимы
Доступ к АоК – поперечная аортотомия, к МК – через ЛП позади межпредсердной борозды.
В I группе для коррекции аортального порока в 62,8% (82) случаев использовали механические протезы, доля биопротезирования – 37,2% (42). Средний диаметр аортального протеза – 23,93±0,74. Одиннадцати пациентам выполнили дополнительные вмешательства на аорте, пяти – аортоаннулопластику по Manougian для имплантации протеза расчетного диаметра. Помимо вмешательств на аорте, 15 респондентам сделали аннулопластическую коррекцию трикуспидального клапана и 2 – его протезирование. В одном случае провели радиочастотную фрагментацию ЛП по поводу фибрилляции предсердий.
Во II группе для коррекции аортального порока в 75,8% (97) выполнили протезирование механическим протезом, доля биопротезирования – 24,2% (31). Средний диаметр протеза в аортальной позиции – 23,95±1,62. Для коррекции МН выполнили 37 (30,6%) пациентам шовную аннулопластику по задней полуокружности фиброзного кольца МК, 84 (69,4%) – аннуло-пластику опорным полужестким кольцом (ЗАО НПП «МедИнж», Пенза, РФ). Размеры имплантируемых опорных колец были от 26 до 32, в среднем 28,3. Дополнительно в этой группе выполнили 5 вмешательств на восходящей аорте, 11 аортоаннулопластик по Manougian и 1 миомэктомию выходного отдела ЛЖ по Morrow. Также выполнили 28 аннулопластик и 4 протезирования трикуспидального клапана. Основные операционные данные представлены в табл. 2.
В группе без вмешательства на МК длительность окклюзии аорты и искусственного кровообращения была достоверно меньше, однако это не повлияло на длительность пребывания в стационаре, госпитальную смертность и частоту рецидива МН.
В группе с коррекцией МН достоверно чаще наблюдали предсердные нарушения ритма (по типу ФП, трепетания предсердий, узловой ритм, брадисисто-лию, требующую временный электрокардиостимулятор), по другим видам осложнений группы были сопоставимы (табл. 3).
Статистический анализ
Объем выборки рассчитывался на основании сравнения долей пациентов с возвратом МН в отдаленном периоде (р = 0,045) в исследовании Gon g alo F., Coutinho и соавт. и составил 108 человек для каждой группы [10].
Величины, измеренные в интервальной шкале, приводятся в виде среднее ± стандартная ошибка среднего и сравниваются тестом Стьюдента или Фишера, крите-
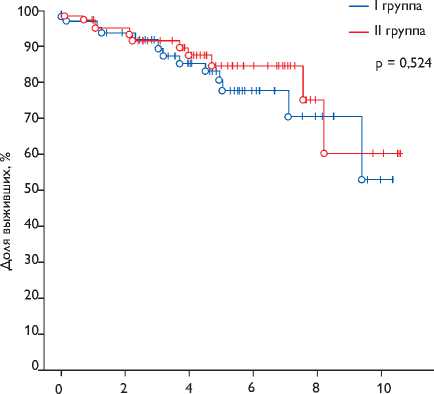
После операции, лет
Пациенты с риском
|
I группа |
59 |
50 |
40 |
15 |
7 |
1 |
|
II группа |
59 |
53 |
40 |
19 |
5 |
3 |
Рис. 2. Первичная комбинированная точка (смерть от любых причин + повторное вмешательство по поводу прогрессирующей МН) после matching. Log-rank тест: test statistic = –0,64; p = 0,524. Различия достоверно не значимы рий χ2. Выживаемость и свобода от событий оценивались методом Каплана – Майера и сравнивались в двух группах по лог-ранговому критерию. Многомерный статистический анализ факторов, влияющих на выживаемость, выполнялся в рамках модели регрессии Кокса. Статистическая значимость – α = 0,05. Большинство расчетов выполнено с помощью пакета программ Statistica 8.0 (StatSoft, Inc.).
Результаты
Выживаемость через 1, 5 и 10 лет в группе без коррекции МН составила 95±6, 76±10, 58±20%, в группе с коррекцией МР 90±6, 77±10, 62±24% соответственно. Так как в отдаленном периоде всего 2 пациента подверглись повторной операции по поводу прогрессирующей МН, первичную точку пришлось скомбинировать. Статистических различий по первичной комбинированной точки в обеих группах не выявлено (р = 0,72) (рис. 1).
При применении метода соответствия propensity score matching различия были также достоверно не значимы (p = 0,524) (рис. 2).
Соответствие групп выполнялось по возрасту (р = 0,04), толщине межжелудочковой перегородки (р = 0,005), наличию артериальной гипертонии (р = 0,02), периферического атеросклероза (р = 0,01), сахарного диабета (р = 0,04) и легочной гипертензии (р = 0,002).
С помощью многомерного статистического анализа определили предикторы госпитальной летальности, такие как длительное время искусственного кровообращения более 200 мин (р = 0,00003; ОШ 0,03), наличие периферического атеросклероза (р = 0,002; ОШ 3,84) и увеличенный конечный диастолический размер правого желудочка более 2,9 см (р = 0,011; ОШ 2,74), факторы распределены в порядке убывания значимости.
По модели регрессии Кокса для кривой выживаемости, предикторами отдаленной летальности являются наличие в послеоперационном периоде синдрома поли-органной недостаточности (р = 0,038; ОШ 0,91) и увеличенная индексированная масса миокарда ЛЖ более 275г/м2 (р = 0,029; ОШ 0,74).
Учитывая наличие у всех пациентов искусственного клапана в аортальной позиции, для определения влияния на группы сравнения оценивали свободу от клапан-зависимых осложнений (MAVE), таких как кардиоэмболический инсульт, транзиторная ишемическая атака, дисфункция искусственного клапана сердца и серьезные кровотечения на фоне передозировки антикоагулянтной терапии. При сравнении групп достоверной разницы не выявлено (р = 0,49). При использо-
Таблица 4 Показатели ЭхоКГ после операции
|
Характеристика |
I группа |
II группа |
||||
|
Эффект |
95% ДИ |
р |
Эффект |
95% ДИ |
р |
|
|
ЛП, мм |
–3,9 |
–5,0… –2,8 |
<0,0001 |
–5,6 |
–6,9… –4,3 |
<0,0001 |
|
КДР, мм |
–7,6 |
–9,1… –6,1 |
<0,0001 |
–8,6 |
–9,8… –7,4 |
<0,0001 |
|
МЖП, мм |
–3,0 |
–1,8… 1,2 |
0,64 |
0,3 |
–8,0… 8,0 |
0,94 |
|
Пиковый градиент АоК |
–40,6 |
–48,4… –32,8 |
<0,0001 |
–30,2 |
–37,7… –22,7 |
<0,0001 |
|
ФВ ЛЖ, % |
0,5 |
–2,0… 2,0 |
0,67 |
–0,78 |
–2,0… 2,0 |
0,50 |
|
КДО, мл |
–56,1 |
–66,5… –45,7 |
<0,0001 |
–59,8 |
–69,5… –50,1 |
<0,0001 |
|
КСО, мл |
–24,9 |
–31,3… –18,5 |
<0,0001 |
–26,5 |
–32,1… –20,9 |
<0,0001 |
КДР – конечный систолический размер
вании анализа соответствия (matching) различий также не выявлено (р = 0,879), а свобода от клапан-зависимых осложнений через 1, 5 и 10 лет в группе без вмешательства на МК составила 98, 80 и 48%, в группе с пластикой МК – 96, 79 и 71% соответственно.
После коррекции порока наблюдали обратное ремоделирование сердца в обеих группах. Уменьшились размеры камер сердца, трансаортальный градиент, однако сократительная способность ЛЖ и толщина межжелудочковой перегородки остались прежними или изменились незначительно. В группе без коррекции МН процессы обратного ремоделирования были менее выраженными по сравнению со II группой (табл. 4).
Отмечена динамика ФК ХСН: до вмешательства преобладали пациенты с III–IV ФК ХСН, а в отдаленные сроки большинство пациентов принадлежат I и II ФК в обеих группах (70,3 против 78,5%) (рис. 3).
Подавляющее большинство пациентов с IV ФК в отдаленном периоде имели низкую контрактильную функцию ЛЖ (ср. ФВ = 30,4%), что и определяло в сущности их морбидный профиль. В сравниваемых группах количество пациентов со сниженной ФВ ЛЖ (менее 50%) было сопоставимо при выписке (32 против 37%, р = 0,55) и существенно не различалось в отдаленном периоде (20 против 15%, р = 0,86). Исходная ФВ ЛЖ ниже 50% не влияла на отдаленную выживаемость (р = 0,76).
После операции в обеих группах регистрировали МР у незначительного числа пациентов, однако в отдаленном периоде различия были более существенными (табл. 5). При сравнении пациентов в зависимости от наличия МН в отдаленном периоде выявили более тяжелые проявления ХСН среди пациентов с рецидивом МР. В группе без рецидива МН 90% пациентов принадлежало к I–II ФК, а в группе с рецидивом – 48% (р =
0,001) (рис. 4). С помощью многофакторного регрессионного анализа выявили предикторы возврата МН в отдаленном периоде (табл. 6).
Обсуждение
Часто сопутствующая умеренная МН при протезировании АоК не корригируется, в результате восстановления нормальной гемодинамики через АоК и обратного ремоделирования ЛЖ уменьшается воздействие на митральный клапан, и регургитация регрессирует. Согласно полученным данным, у незначительной части пациентов сохраняется МН при выписке. Однако в отдаленном периоде отмечается возврат МН у большого количества пациентов.
В результате исследования определили, что у большинства пациентов после изолированной коррекции аортального порока МН регрессирует до незначительной в раннем послеоперационном периоде (при выписке) и сохраняется в отдаленном периоде у 64% пациентов.
В исследовании 2008 г., проведенном Calvin K.N. Wan с соавт. на 190 пациентах, которые были прооперированы по поводу аортального порока, имевших умеренную МН и наблюдаемых в сроки до 10 лет, в отдаленном периоде обнаружили МН в 33% случаев, из них в 3% – утяжеление регургитации. В группу сравнения включили 90 пациентов со схожими характеристиками (по полу, возрасту и соматическим заболеваниям), но не имевших МН во время протезирования АоК. В исследовании был ряд особенностей: средний возраст пациентов – 74 года, 83% имели аортальный стеноз, выживаемость через 10 лет составила 43 и 48%. При этом умеренная функциональная МР не оказывала влияния на 5-летнюю выживаемость независимо от функции ЛЖ, а через 10 лет снижение ФВ было независимым предиктором летальности [1].
До После
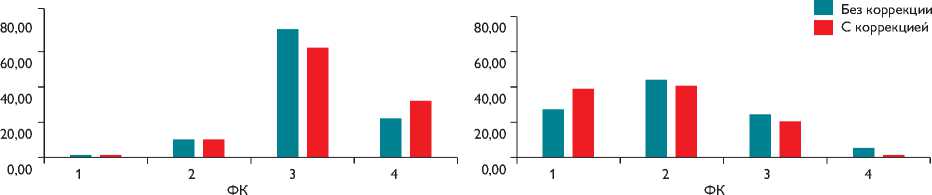
Рис. 3. Распределение пациентов по ФК ХСН до вмешательства и в отдаленные сроки после операции, различия достоверно не значимы
В 2010 г. Takeda K. опубликовал данные исследования на когорте из 193 пациентов. По его мнению, исходная умеренная (mild-to-moderate) МР явилась независимым фактором ухудшения отдаленных результатов, несмотря на значительное уменьшение после изолированного протезирования АоК, а сопутствующая хирургия МК оправдана, особенно у пациентов со сниженной функцией ЛЖ. Особенности исследования: средний возраст – 67 лет, выживаемость через 10 лет составила 88%, однако свобода от повторных вмешательств составила 23% в течение того же срока. Автор отмечает, что органической и функциональной недостаточности МК было 60 и 40% соответственно [8]. Несомненно, у этого исследования было немало недостатков, таких как объединение МР различной этиологии (ишемическая, миксоматоз, ревматизм и функциональная), совместное рассмотрение выраженной и умеренной МР при противопоставлении ее незначительной МР. Однако большая выборка свидетельствует о существенности сделанных выводов.
В тот же период Сливнева И.В. с соавт. опубликовали исследование, проведенное на базе ФГБУ « НЦССХ им. А.Н. Бакулева » , 84 пациентов с выраженным аортальным пороком и МН II и III степени. Средний возраст – 50,5 года, половина пациентов получила различные типы коррекции МР, летальность через 8 лет составила 15%. Исследователи получили корреляционную связь между умеренной МН и отдаленной летальностью при исходной аортальной недостаточности. Анализ проведен на небольшой когорте, имел много групп (по наличию митральной коррекции и гемодинамическому типу аортального порока) [11].
В 2013 г. Coutinho F. опубликовал результаты исследования, посвященного вторичной МН при протезировании аортальных пороков, где он сравнил группы с симультанным вмешательством на МК и без него, не учитывая гемодинамический тип аортального протезирования (n = 255, средний возраст 67 лет, 37% с конко-митантной коррекцией МР). Автор не получил достоверное улучшение выживаемости в группе пациентов с коррекцией МК (76 против 67%), хотя в группе с коррекцией выживаемость была несколько больше. Одним из основных выводов было то, что сохраняющаяся МН при выписке является независимым предиктором смертности в отдаленном периоде, которую прогнозировали расширение корня аорты, острая сердечная недостаточность, невмешательство на МК и наличие исходной фибрилляции предсердий [10].
В нашем исследовании предикторами госпитальной летальности являются длительное время искусственного кровообращения, наличие периферического атеросклероза и увеличенный конечный диастолический размер правого желудочка в порядке убывания значимости. Дилатация правого желудочка, как предиктор госпитальной летальности, свидетельствует о развивающейся правожелудочковой недостаточности и глубине патологического ремоделирования сердца на фоне измененной гемодинамики. Вероятно, наличие периферического атеросклероза приводит к редуцированному кровотоку во внутренних органах, что усугубляется искусственным кровообращением и приводит к более раннему гипоксическому повреждению.
В данном исследовании, несмотря на достаточно небольшой возраст, отдаленная выживаемость была значительно ниже (58–62% через 10 лет), чем у представленных выше авторов, однако эти цифры коррелируют с данными Kirklin/Barrat-Boyes[12].
Предикторы летальности в отдаленном периоде – осложненный послеоперационный период с синдромом полиорганной недостаточности и выраженная
Таблица 5 Динамика МН в раннем (при выписке) и отдаленном периодах
При выписке МР выше незначительной степени регистрировали всего в 5% случаев, а в отдаленные сроки МН II–III степени – у четверти пациентов с преобладанием в группе без вмешательства на МК (64 против 84%), что коррелирует с данными литературы [1, 8, 10]. Отследив пациентов с резидуальной МН при выписке, мы не получили достоверной разницы в смертности в отдаленном периоде (p = 0,654). Наличие исходной ФП также не является предиктором сохранения МН в раннем периоде (р = 0,073) и ее рецидива в отдаленном периоде (р = 0,244). Вероятно, это связано с небольшим возрастом пациентов, так как частота ФП прогрессирует в пожилом и старческом возрасте.
Предикторы рецидива МР в отдаленном периоде: отсутствие коррекции МР (р = 0,013), МР при выписке (р = 0,001), наличие трикуспидальной недостаточности II степени и более (р = 0,017), ревматическая этиология аортального порока. Первые два фактора закономерны, согласно данным литературы, вторичная трикуспидаль- ная недостаточность на фоне митральных пороков развивается опосредовано через легочную гипертензию и является маркером правожелудочковой недостаточности, а также ухудшает отдаленные результаты [13]. Исходная трикуспидальная недостаточность II степени и выше не выявлена как фактор риска смерти (р = 0,479), что, вероятно, связано с тем, что в подавляющем большинстве случаев она подвергалась коррекции.
Профессор Дземешкевич С.Л., рассуждая о ревматических и атеросклеротических аортальных пороках, утверждает, что эти группы пациентов, одинаковые с точки зрения хирургической техники, неоднородны по состоянию миокарда и прогнозу. Также он отмечает, что при развитии кардиальной формы ревматизма всегда обнаруживают поражение миокарда в виде ревматического миокардита, наряду с ревматическим вальвулитом клапана [14]. Несомненно, перенесенный миокардит дает меньшую вероятность полного обратного ремоделирования после коррекции порока, что подтверждено нашим исследованием.
На момент окончания исследования среди выживших пациентов выявлены более выраженные проявления ХСН среди пациентов с рецидивом МН. При сравнении групп с коррекцией и без коррекции МР по ФК ХСН была получена не достоверная разница, а лишь тенденция. Следовательно, нет необходимости в случаях со вторичной МР выполнять ее коррекцию, следует подходить к этому вопросу дифференцировано.
Ограничения исследования
Выбор вмешательства или невмешательства на МК зачастую был случайным, зависел от решения оперирующей бригады и не регламентировался какими-то конкретными рекомендациями. Мы использовали поправки на достоверные отличия не для всех дооперационных характеристик, а лишь для признаков, имеющих разли-
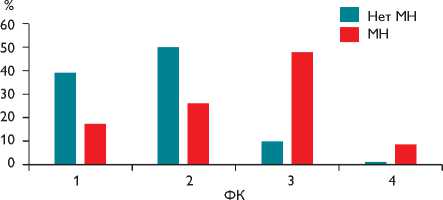
Рис. 4. Распределение пациентов по ФК ХСН в отдаленные сроки в зависимости от наличия МН, различия достоверно значимы, р = 0,001
Таблица 6 Предикторы отдаленной МН (в общей группе)
|
Показатель |
Оценка |
СОШ |
Wald |
p |
|
Отсутствие коррекции МР |
1,03005 |
0,417550 |
6,08555 |
0,013629 |
|
Трикуспидальная недостаточность ≥ 2 ст. |
1,38997 |
0,582985 |
5,68453 |
0,017115 |
|
МН при выписке |
3,75303 |
1,152938 |
10,59626 |
0,001133 |
|
Ревматическая этиология аортального протезирования |
0,93492 |
0,399488 |
5,47697 |
0,019269 |
чия между сравниваемыми группами по критерию Фишера р<0,05. Тем не менее полученные данные коррелируют с результатами других исследований.
Выводы
У подавляющего большинства пациентов после изолированной коррекции аортального порока МН регрессирует до незначительной в раннем послеоперационном периоде (при выписке) и сохраняется в отдаленном периоде у 64% пациентов.
Пациенты с умеренной вторичной МН при аортальном протезировании могут подвергаться конкоми-тантной митральной аннулопластике с высокой долей эффективности, что не влияет на смертность и заболеваемость как в раннем, так и в отдаленном периоде.
Пациенты с вмешательством на МК имели схожую выживаемость, что и пациенты без митральной коррекции, даже после оценки соответствия разница в выживаемости была достоверно незначимой. Пациенты без митральной коррекции были более симп-томными, и процессы ремоделирования сердца менее выраженными.
Предикторами возврата МН являлось наличие исходной трикуспидальной недостаточности II степени, а также ревматическая этиология аортального порока.
Список литературы Коррекция аортальных пороков в сочетании с расширением восходящей аорты у взрослых пациентов: сравнение процедуры Росса и операции Бенталла-Де Боно
- Leyh R.G., Hagl С., Kofidis T., Haverich A. Impact of ascending aorta replacement combined with a Ross procedure on autograft root distensibility and function in patients with combined pathology of the aortic valve and ascending aorta//Interact. Cardiovasc. Thorac. Surg. 2003. Vol. 2. P. 116-119.
- Elkins R.C., Lane M.M., McCue C. Ross procedure for ascending aortic replacement//Ann. Thorac. Surg. 1999. Vol. 67. P. 1843-1845.
- Michelena H.I., Desjardins V.A., Avierinos J.F., et al. Natural history of asymptomatic patients with normally functioning or minimally dysfunctional bicuspid aortic valve in the community//Circulation. 2008. Vol. 117. P. 2776-2784.
- Erbel R., Aboyans V., Boileau C., et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases//Eur. Heart J. 2014. Vol. 35. P. 2873-2926.
- Luciani G.B., Favaro A., Casali G., et al. Ross operation in the young: a ten-year experience//Ann. Thorac. Surg. 2005. Vol. 80. P. 2271-2277.
- Литасова Е.Е., Назаров В.М., Железнев С.И. и др. Первый опыт выполнения операции Росса в качестве повторной клапанной коррекции//Патология кровообращения и кардиохирургия. 2009. № 4. С. 9-13.
- Караськов А.М., Железнев С.И., Богачев А.В. и др. Процедура Росса как этап сочетанного вмешательства при комбинированной патологии сердца//Кардиология и сердечно-сосудистая хирургия. 2010. № 3. С. 64-67.
- Караськов А.М., Железнев С.И., Богачев А.В. и др. Процедура Росса у пациентов с выраженной систолической дисфункцией левого желудочка//Патология кровообращения и кардиохирургия. 2013. № 1. С. 5-11.
- Караськов А.М., Демин И.И., Шарифулин Р.М. и др. Различные типы кондуитов для реконструкции пути оттока из правого желудочка при процедуре Росса у взрослых: сравнительный анализ//Патология кровообращения и кардиохирургия. 2013. № 2. С. 23-27.
- Караськов А.М., Демин И.И., Шарифулин Р.М. и др. Факторы риска развития дисфункции легочного аутографта после процедуры Росса//кардиология и сердечно-сосудистая хирургия. 2015. Т. 19. № 2. С. 54-68.
- Vink R., Kraaijenhagen R.A., Hutten B.A., et al. The optimal intensity of vitamin k antagonists in patients with mechanical heart valves: a meta-analysis//J. Am. Coll. Cardiol. 2003. Vol. 42. P. 2042-2048.
- Takkenberg J.J., Puvimanasinghe J.P., van Herwerden L.A. Optimal target international normalized ratio for patients with mechanical heart valves//J. Am. Coll. Cardiol. 2004. Vol. 44. P. 1142-1143.
- David T.E., David C., Woo A., et al. The Ross procedure: outcomes at 20 years//J. Thorac. Cardiovasc. Surg. 2014. Vol. 147. P. 85-94.
- Elkins R.C., Thompson D.M., Lane M.M., et al. Ross operation: 16-year experience//J. Thorac. Cardiovasc. Surg. 2008. Vol. 136. P. 623-630.
- Klieverik L.M., Noorlander M., Takkenberg J.J., et al. Outcome after aortic valve replacement in young adults:is patient profile more important than prosthesis type?//J. Heart Valve Dis. 2006. Vol. 15. № 4. P. 479-487.
- Andreas M., Wiedemann D., Seebacher G., et al. The Ross procedure offers excellent survival compared with mechanical aortic valve replacement in a real-world setting//Eur. J. Cardiothorac. Surg. 2014. Vol. 46. № 3. P. 409-413.
- Charitos E.I., Takkenberg J.J., Hanke T., et al. Reoperations on the pulmonary autograft and pulmonary homograft after the Ross procedure: an update on the German Dutch Ross registry//J. Thorac. Cardiovasc. Surg. 2012. Vol. 144. № 4. P. 813-823.
- Brown J.W., Fehrenbacher J.W., Ruzmetov M., et al. Ross root dilation in adult patients: is preoperative aortic insufficiency associated with increased late autograft reoperation?//Ann. Thorac. Surg. 2011. Vol. 92. P. 74-81.
- Aicher D., Holz A., Feldner S., Kollner V., Schafers H.J. Quality of life after aortic valve surgery: replacement versus reconstruction//J. Thorac. Cardiovasc. Surg. 2011. Vol. 142. P. 19-24.
- Nötzold A., Hüppe M., Schmidtke C., et al. Quality of life in aortic valve replacement: pulmonary autografts versus mechanical prostheses//J. Am. Coll. Cardiol. 2001. Vol. 37. P. 1963-1966.
- Schmidtke C., Hüppe M., Berndt S., Nötzold A., Sievers H.H. Quality of life after aortic valve replacement. Self-management or conventional anticoagulation therapy after mechanical valve replacement plus pulmonary autograft//Z Kardiol. 2001. Vol. 90. № 11. P. 860-866.
- Akhyari P., Bara C., Kofidis T., et al. Aortic root and ascending aortic replacement: Bentall or Ross procedure?//Int Heart J. 2009. Vol. 50. № 1. P. 47-57.


