Коррекция иммунологических нарушений у больных со злокачественными опухолями уровня краниовертебрального отдела позвоночника
Автор: Бажанов С.П., Ульянов В.Ю., Норкин И.А., Гуляев Д.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Онкология
Статья в выпуске: 2 т.9, 2013 года.
Бесплатный доступ
Цель: изучение показателей клеточного и гуморального звеньев иммунитета у больных со злокачественными опухолями уровня верхнешейного отдела позвоночника. Материал и методы. Объектом исследования стали 22 больных со злокачественными опухолями области краниовертебрального перехода и верхнешейного отдела позвоночника. Для оценки функционирования иммунной системы применялись методы иммунофено-типирования популяционной и субпопуляционной принадлежности лимфоцитов периферической крови. Параметры цитокинового статуса и функциональная (цитотоксическая) активность NK-клеток исследовались с помощью иммуноферментных методов. Все показатели в целях большей объективизации данных представлялись в абсолютных и относительных величинах. Во всех случаях проводилась адъювантная терапия. Результаты. Применение средств для коррекции клеточного звена иммунитета ведет к увеличению содержания CD3+ (Т-лимфоцитов) и CD3+CD8+ (Т-киллеров). Уровень цитокинов в изучаемых группах в динамике достоверно не изменяется. Динамика показателя цитотоксической (функциональной) активности NK-клеток в первой группе после проведения комплексного лечения более высокая, чем до лечения. Показатель цитотоксической (функциональной) активности NK-клеток во второй изучаемой группе после проведения комплексного лечения ниже, чем до лечения. Заключение. Применение иммунотропной терапии на фоне комплексного лечения позволяет позитивно влиять на показатели иммунного статуса.
Злокачественные новообразования, иммунитет, позвоночник
Короткий адрес: https://sciup.org/14917724
IDR: 14917724
Текст научной статьи Коррекция иммунологических нарушений у больных со злокачественными опухолями уровня краниовертебрального отдела позвоночника
следние годы как среди общественности, так и среди ученых глубокое разочарование, нередко переходящее в чрезмерный пессимизм и даже отчаяние…» — эти слова выдающегося ученого Джона Хиггинсона, директора «Международного агентства по изучению рака», произнесенные в 1968 г., сегодня звучат так же правдиво, как и более сорока лет назад. Несмотря на значительный прогресс медицины, на земном шаре ежегодно от злокачественных опухолей умирают около 7 млн человек и регистрируется свыше 10 млн новых случаев рака [1, 2]. В промышленно развитых странах онкологические заболевания среди причин смерти прочно удерживают второе место, уступая только сердечно-сосудистой патологии [3, 4].
Несмотря на полярность мнений о происхождении злокачественных новообразований, все исследователи сходятся в том, что одним из основных факторов, приводящих к развитию опухолей, является то или иное нарушение со стороны иммунной системы [5–7]. В связи с этим при комплексной терапии неопластических процессов большое внимание уделяется коррекции структурно-функциональных нарушений иммунитета и специфической активации противоопухолевых механизмов [8–11].
Ведущую роль в осуществлении противоопухолевой защиты играют реакции клеточного иммунитета, опосредуемые естественными киллерными клетками (врожденный иммунитет) и антигенспецифическими цитотоксическими Т-лимфоцитами (приобретенный иммунитет) [12, 13]. Источниками естественных кил-лерных клеток могут быть натуральные киллерные клетки, а также CD4+ и CD8+ Т-лимфоциты, которые после активации интерлейкином-2 или цитокинами (ИЛ-1, ИФН-γ, ГМ-КСФ) приобретают способность лизировать опухолевые клетки. Действие естественных киллерных клеток неспецифично и не требует предшествующей сенсибилизации [14]. Многими исследователями установлено, что у больных со злокачественными опухолями отмечается снижение субпопуляциий CD3+, CD4+, CD16+, CD3+CD8+ лимфоцитов, при этом не выявлено какой-либо корреляции между степенью анаплазии опухоли и параметрами иммунологического статуса [15]. У онкологических больных в целом снижена реактивность иммунной системы, причем неадекватность и неэффективность опухоль-специфического иммунного ответа развивается на фоне субкомпенсированного состояния иммунной системы, преимущественно за счет Т-клеточного иммунодефицита, который, возможно, является вторичным, так как опухолевые клетки непосредственно обладают иммунодепрессивным действием [16]. Кроме этого, лимфоциты периферической крови проявляют дефекты в экспрессии IL-2 и рецептора IL-2, что обнаруживается после стимуляции in vitro [10, 17]. Следовательно, при злокачественных опухолях происходит значительное, по сравнению с доброкачественными опухолями, угнетение количественного состава Т-клеточных субпопуляций Т-лимфоцитов и угнетение процессов активации. Снижение естественной киллерной активности связано не только с уменьшением количества этих клеток в крови, но и со снижением их способности распознавать и связываться с опухолевыми клетками. Снижение функциональной активности NK-клеток имеет место в послеоперационном периоде, а также при продолженном росте опухоли [18].
Рядом авторов показано, что безуспешность саногенетических механизмов у больных со злокачественными опухолями определяется недостаточностью клеточного и гуморального звеньев иммунитета, а также нарушением иммунологического надзора против онкогенных вирусов или аномальных клеток. На этой основе определена стратегия лечения рака, заключающаяся в методе «комплементарной онкотерапии», который подразумевает взаи- моусиливающее лечебное действие существующих традиционных и иммунологических методов с учетом этиопатогенетической значимости каждого метода [2, 19]. Применение Левамизола, Т-активина, Зимозана в клинике на фоне химиотерапии продемонстрировало положительный эффект при использовании их между курсами полихимиотерапии. Указанные методы неспецифической противоопухолевой иммунотерапии удлиняли сроки ремиссии больных со злокачественными опухолями центральной нервной системы [20, 21]. В последние два десятилетия в качестве неспецифической активной иммунотерапии начали широко применять интерфероны (ИФН) для лечения онкологических больных [22, 23]. Показано, что ИФН, помимо своего прямого противоопухолевого действия, обладает направленным воздействием на иммунную систему, что позволяет отнести его к методам активной иммунотерапии. Уже через сутки после введения альфа-ИФН снижалось содержание супрессорных СD8+ лимфоцитов и повышалось количество CD4+ клеток. Помимо этого, интерфероны обладают противовирусным, антипролиферативным, иммуномодулирующим действием; последнее, как известно, реализуется за счет стимуляции функциональной активности NK-клеток, макрофагов; усиления экспрессии антигенов главного комплекса гистосовместимости на лимфоидных клетках; усиления синтеза провоспалительных цитокинов [24, 25].
Таким образом, применение иммунотерапии у больных со злокачественными опухолями является чрезвычайно актуальным вопросом современной онкологии, его решение позволит улучшить ближайшие и отдаленные результаты комплексного лечения.
Цель: изучить показатели клеточного и гуморального звеньев иммунитета у больных со злокачественными опухолями уровня краниовертебрального перехода и верхнешейного отдела позвоночника на фоне применения неспецифической противоопухолевой иммунотерапии.
Материал и методы. Объектом исследования послужили 22 больных со злокачественными опухолями области краниовертебрального перехода и верхнешейного отдела позвоночника, находившиеся на стационарном лечении в нейрохирургическом отделении ФГБУ «СарНИИТО» Минздравсоцразвития России и в отделении хирургии опухолей головного и спинного мозга ФГБУ «РНХИ им. проф. А. Л. Поленова» Минздравсоцразвития России в период с 2010 по 2012 г.
Критерии включения пациентов в исследование: возраст больного старше 17 лет; степень компенсации общего состояния пациента по шкале Karnofsky не менее 40 баллов; пациенту в указанный срок наблюдения выполняли хирургическое лечение; диагноз подтвержден гистологически; всем пациентам проводили адъювантную терапию; отсутствие у пациента синхронных и метахронных опухолей, а также отдаленных органных метастазов; отсутствие соматической патологии в стадии выраженной клинической декомпенсации, а также психических дисфункций, препятствующих адекватной оценке общего состояния больного.
Возраст больных находился в границах от 21 года до 76 лет. Средний возраст составил 50 лет (М±1,96). В пределах выборки отмечается некоторое увеличение доли больных старшего возраста (коэффициент аппроксимации R²=0), что связано как с улучшением диагностики данной патологии из-за рутинного использования средств нейровизуализации, так и с увеличением среднего возраста в общей популяции.
Всем больным выполняли хирургические вмешательства, основанные на концепциях единого нейро-ортопедического и мультидисциплинарного подходов. Гистологический диагноз верифицировали при биопсийном исследовании операционного материала, в ряде случае с дополнительным применением иммуногистохимических методов. Распределение больных по гистологическому строению опухолей представлено следующим образом: хордома — 6, хондросаркома — 4, плазмоцитома — 2, гигантоклеточная опухоль — 2, метастазы рака — 8. Следует отметить, что в случаях метастатического поражения уровня краниовертебрального перехода и верхнешейного отдела позвоночника первичный очаг был верифицирован только у 5 пациентов. Репрезентативность групп обеспечивалась сопоставимостью обследованных лиц по полу и возрасту, уровню и структуре анамнестической заболеваемости, сходностью клинической картины основного заболевания, исходными параметрами лабораторных данных, сопоставимостью по гистологическому диагнозу. Численность выборки обследованных лиц позволяла получить статистически достоверные результаты.
Оценку первичного иммунного статуса проводили перед хирургическим вмешательством (за 2–3 дня) и в динамике на 10–12-й день после курса иммунотерапии на фоне применения других адъювантных методов лечения (химиотерапии либо радиотерапии). Гематологические исследования выполняли с использованием автоматических гематологических анализаторов «BECMAN — COULTER ACT diff» (Германия), «ABACUS» (Англия), «ARCUS» (Австрия) и включали количественное определение клеток, их морфологические характеристики. Аппаратное исследование крови дополняли визуальным определением количества лейкоцитов с помощью светового микроскопа в счетной камере Горяева. Морфологическое исследование лейкоцитов проводили в мазках крови, окрашенных по Романовскому — Гимзе с подсчетом лейкоцитарной формулы.
Для оценки функционирования иммунной системы применяли методы выявления популяционной и субпопуляционной принадлежности лимфоцитов периферической крови, которые определяли методом иммунофенотипирования (микролимфоцитотоксиче-ского теста). Все показатели в целях большей объективизации данных представлялись в абсолютных и относительных величинах. В исследовании определены как количественные, так и качественные параметры клеточных механизмов иммунной защиты: количество лимфоцитов и их субпопуляций: общее содержание лимфоцитов, CD3+ (Т-лимфоциты), CD3+ CD16+CD56+ (TNK-клетки), CD4+ (хелперы), CD3+CD8+ (киллеры), CD3– CD8+ (активированные NK-клетки), соотношение CD4/CD8, CD3– CD16+ (NK-клетки), СD19+ (В-лимфоциты), CD25+ (рецептор ИЛ-2), HLA-DR+, СD95+ (Fas-рецептор).
Параметры цитокинового статуса (интерферон-а, интерферон-g) и функциональную (цитотоксическая) активность NK-клеток исследовали с помощью имму-ноферментных методов с использованием стандартных наборов фирмы «TRINITY» (Ирландия) и микрофотоэлектроколориметра EL-400 («LABSYSTEM», Финляндия) в соответствии с протоколом фирмы-производителя.
Во всех случаях проводили адъювантную терапию, осуществляемую в онкологических стаци- онарах, которая включала цитотоксическую химиотерапию, лучевую терапию, неспецифическую иммунотерапию. Показания к проведению химиотерапии либо лучевой терапии определялись онкологами и зависели от вида опухоли и ее «биологического поведения», а также патоморфологической характеристики. Неспецифическая противоопухолевая иммунотерапия в структуре комплексного лечения была проведена 11 больным и включала препараты для коррекции клеточного (Тактивин и Зимозан) и гуморального звена иммунитета (Альфаферон и Ингарон). Курс иммунотерапии проводился в течение 14 дней с чередованием через день препаратов для коррекции иммунологических нарушений (первый день: Тактивин и Альфаферон, второй день: Зимозан и Ингарон и т.д.). Использование иммунотропной терапии (дозы, способы и кратность введения) осуществлялось в соответствии с инструкцией к применению указанных средств лечения, при этом приоритет отдавали парентеральным формам введения.
Доверительные интервалы для частотных показателей рассчитывались с использованием точного метода Фишера. Критерием статистической достоверности получаемых выводов считали общепринятую в медицине величину (p<0,05).
Результаты. В целях объективности исследования при оценке иммунологических параметров мы сочли целесообразным разделить больных на две группы, в зависимости от проводимой схемы адъювантной терапии:
группа 1 — больные (n=11), получившие комплексное лечение, включающее хирургию, химиотерапию либо лучевую терапию, неспецифическую противоопухолевую иммунотерапию;
группа 2 — больные (n=11), получившие комплексное лечение, включающее хирургию, химиотерапию либо лучевую терапию. Неспецифическая противоопухолевая иммунотерапия в этой группе не проводилась.
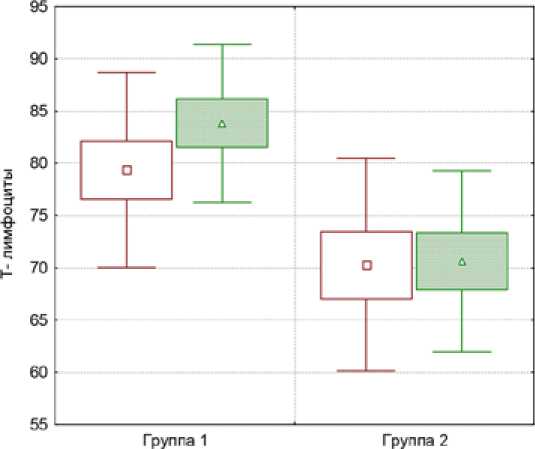
Средние значения показателей (и их динамика) клеточного звена иммунитета в первой и второй изучаемых группах представлена в виде диаграмм размаха на рис. 1 и 2.
Из рис. 1 следует, что при оценке показателей клеточного звена иммунитета у больных в первой изучаемой группе отмечено достоверное (p<0,05) увеличение CD3+ (T-лимфоцитов). У больных во второй изучаемой группе уровень CD3+ (T-лимфоцитов) достоверно не изменяется.
Из рис. 2 следует, что у больных в первой изучаемой группе также отмечено увеличение СD3+СD8+
о До лечения л После лечения
Рис. 1. Динамика уровня CD3+ (Т-лимфоцитов) в процессе комплексного лечения в первой и второй группах больных
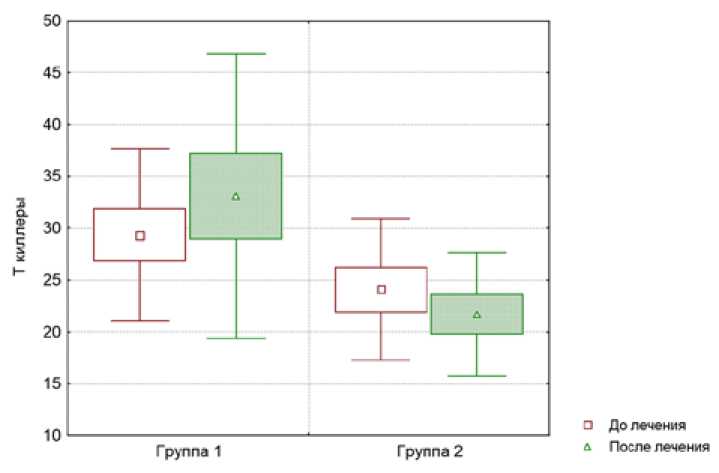
Рис. 2. Динамика уровня CD3+CD8+ (Т-киллеров) в процессе комплексного лечения в первой и второй группах больных
(Т-киллеров) после проведения лечения, а уровень СD3+СD8+ (Т-киллеров) после проведения лечения достоверно (p<0,05) уменьшается.
Таким образом, применение средств для коррекции клеточного звена иммунитета (Тактивин и Зимозан) приводит в достоверному увеличению CD3+ (T-лимфоцитов) и CD3+CD8+ (Т-киллеров). Остальные показатели клеточного звена иммунитета, а именно: общее содержание лимфоцитов, CD3+CD16+CD56+ (TNK-клетки), CD4+ (Т-хелперы), CD3 — CD8+ (активированные NK-клетки), соотношение CD4/CD8, CD3– CD16+ (NK-клетки), СD19+CD 25+ (рецептор ИЛ-2), HLADR+, СD95+; достоверно не изменялись в двух изучаемых группах.
В первой и второй группах пациентов со злокачественными опухолями уровня краниовертебрального перехода и верхнешейного отдела позвоноч- ника определены параметры цитокинового статуса, а именно спонтанная и индуцированная продукция интерферона-альфа и интерферона-гамма в сыворотке крови. Данные динамики параметров цитоки-нового звена иммунитета представлены в табл. 1 и 2.
Из табл. 1 и 2 следует, что уровень цитокинов в первой и второй изучаемых группах находился в пределах физиологически допустимых границ нормы и в динамике достоверно не изменялся, однако в первой изучаемой группе уровень цитокинов после проведенного лечения был выше, чем у больных во второй группе. Динамика показателя цитотоксической (функциональной) активности NK-клеток у пациентов в первой изучаемой группе после проведения комплексного лечения было достоверно выше (р<0,01), чем до лечения (табл. 3). Показатель цитотоксической (функциональной) активности NK-клеток
Динамика параметров цитокинового статуса в процессе комплексного лечения в первой группе (n=11)
Таблица 1
|
Параметры цитокинового звена иммунитета |
M ± m (до лечения) |
M ± m (после лечения) |
|
Спонтанная продукция ИФН-альфа (пг/мл) |
14,18 ± 4, 16 |
23,1 ± 3,75 |
|
Индуцированная продукция ИФН-альфа (пг/мл) |
59,82 ± 10,35 |
90,45 ± 24,67 |
|
Спонтанная продукция ИФН-гамма (пг/мл) |
102,72 ± 34,23 |
119,45 ± 42,74 |
|
Индуцированная продукция ИФН-гамма (пг/мл) |
361,91 ± 46,75 |
1017,2 ± 398,33 |
П р и м еч а н и е : М — среднее значение показателя, m — ошибка среднего значения показателя.
Динамика параметров цитокинового звена иммунитета в процессе комплексного лечения во второй группе (n=10)
Таблица 2
|
Параметры цитокинового звена иммунитета |
M ± m (до лечения) |
M ± m (после лечения) |
|
Спонтанная продукция ИФН-альфа (пг/мл) |
6 ± 2,37 |
7,8 ± 3,81 |
|
Индуцированная продукция ИФН-альфа (пг/мл) |
35,9 ± 9,86 |
49,2 ± 7,21 |
|
Спонтанная продукция ИФН-гамма (пг/мл) |
95 ± 26,3 |
112,3 ± 73,97 |
|
Индуцированная продукция ИФН-гамма (пг/мл) |
445,4 ± 176,85 |
503,27 ± 124,42 |
П р и м еч а н и е : М — среднее значение показателя, m — ошибка среднего значения показателя
Динамика показателя цитотоксической (функциональной) активности NK-клеток у больных в первой группе
Таблица 3
|
Группа 1 |
N |
M ± m |
min ÷ max |
Me (LQ;UQ) |
|
Цитотоксическая активность NK-клеток (%) до проведения комплексного лечения |
11 |
25,82 ±1,68 |
20 ÷ 40 |
29 (25;30) |
|
Цитотоксическая активность NK-клеток (%) после проведения комплексного лечения |
11 |
35,09 ± 1,9 |
20 ÷ 42 |
29 (27;33) |
|
Динамика показателя цитотоксической активности в процессе комплексного лечения |
11 |
1,27 ± 1,2 |
–10 ÷ 5 |
2 (1;3) |
П р и м еч а н и е : N — число больных; М — среднее значение показателя, m — ошибка среднего значения показателя; min ÷ max — минимальное и максимальное значение показателя; Me (LQ;UQ) — медиана, квартили.
Динамика показателя цитотоксической (функциональной) активности NK-клеток у больных во второй группе
Таблица 4
|
Группа 2 |
N |
M ± m |
min ÷ max |
Me (LQ;UQ) |
|
Цитотоксическая активность NK-клеток (%) до проведения комплексного лечения |
10 |
32,9 ±1,88 |
26 ÷ 44 |
34,5 (29;39) |
|
Цитотоксическая активность NK-клеток (%) после проведения комплексного лечения |
10 |
21,3 ±2,48 |
10 ÷ 36 |
21 (20;26) |
|
Динамика показателя цитотоксической активности в процессе комплексного лечения |
10 |
-10,61,85 |
–20 ÷ –4 |
–8,5 (-16; –7) |
П р и м еч а н и е : N — число больных; М — среднее значение показателя, m — ошибка среднего значения показателя; min ÷ max — минимальное и максимальное значение показателя; Me (LQ;UQ) — медиана, квартили.
у пациентов во второй изучаемой группе после проведения комплексного лечения был достоверно ниже (р<0,01), чем до лечения (табл. 4).
Обсуждение. В послеоперационном периоде наиболее значимым фактором, определяющим способность организма противостоять опухолевому процессу, оказывается состояние иммунной системы. При этом основной задачей любого онколога является сохранение, поддержание и укрепление иммунного гомеостаза. Представленный материал свидетельствует, что включение в схему комплексного лечения средств неспецифической противоопухоле- вой иммунотерапии у больных со злокачественными опухолями уровня краниовертебрального перехода и верхнешейного отдела позвоночника позволяет сохранить или повысить потенциал клеточных механизмов иммунной защиты, играющих ведущую роль в распознавании мутировавших клеток, а также дезинтеграции и элиминации генетически чужеродного материала. Подобная динамика у пациентов с неопластическими процессами, безусловно, должна расцениваться как позитивная, в связи с тем что в процессе дезинтеграции и элиминации новообразований ведущая роль принадлежит активации клеточ- ных механизмов иммунного ответа с формированием активированных клонов иммунокомпетентных клеток, способных активно воздействовать на новообразования, а эффекторные механизмы нейтрализации генетически чужеродных агентов, реализуемые путем синтеза антител различной специфичности и аффинности, при этом играют второстепенную роль [3, 5, 7, 11].
Определение уровня синтеза различных классов интерферонов для пациентов с пролиферативными процессами является наиболее информативным, так как любое лечебное воздействие, направленное на усиление эндогенного интерфероногенеза, также может расцениваться как позитивное. В нашем исследовании спонтанная и индуцированная продукция цитокинов в динамике заболевания у больных в первой и второй изучаемых группах находилась в пределах физиологически допустимых границ и не имела достоверных математических отличий по сравнению с результатами первичного обследования. Однако следует учитывать, что у пациентов первой группы на фоне проводимого иммунотропного лечения уровень интерферонов был несколько выше, чем у больных второй группы, что может являться дополнительным фактором, способствующим улучшению отдаленных результатов лечения этой категории больных [4, 17, 21].
Заключение. Комплексное лечение злокачественных опухолей вследствие применения таких «жестких» методов, как химиотерапия и лучевая терапия, часто способствует выраженному угнетению иммунной защиты. Данное исследование показывает, что применение иммунотерапии наряду с другими методами послеоперационного лечения пациентов с опухолевыми процессами приводит к сохранению структурно-количественных и функциональных параметров большинства элементов иммунной системы. Резюмируя изложенное, можно отметить, что включение в комплексную терапию пациентов со злокачественными новообразованиями верхнешейного отдела позвоночника и уровня краниовертебрального перехода средств неспецифической иммунотропной терапии позволяет демпфировать негативные влияния на иммунную систему химиотерапии и лучевой терапии и тем самым сохранять на достаточно высоком уровне активность клеточных механизмов противоопухолевой защиты.
Список литературы Коррекция иммунологических нарушений у больных со злокачественными опухолями уровня краниовертебрального отдела позвоночника
- Дикун П. П. Канцерогенные свойства индивидуальных соединений и комплекса веществ, класса полициклических ароматических углеводородов с конденсированными кольцами//Вредные химические вещества. Углеводороды. Галоген-производные углеводороды/под ред. В. А. Филова. Л., 1990. С. 251-268
- Трапезников Н.Н., Аксель Е.М., Бармина Н.М. Состояние онкологической помощи населению стран СНГ в 1998 году//М.: РОНЦ им. Н.Н. Блохина РАМН, 1998. 192 с.
- Ионова Т. И., Новик А. А., Сухонос Ю.А. Понятие качества онкологического профиля жизни больных//Онкология. 2000. №1/2. С. 25-28
- Walker А. Е. Epidemiology of brain tumours: the national survey of intracranial neoplasms//Neurology. 1985. № 2. P. 219-226
- Барышников А. Ю. Принципы и практика вакцинотерапии рака//Вестн. Рос. АМН. 2004. № 12. С. 6-10
- Потебня Г. П., Лисовенко Г. Е., Северова З.Д. Противоопухолевые вакцины: перспективы применения в клинической онкологии//Онкология. 2004. № 3. С. 165-174
- Основы медицинской иммунологии/А. Рабсон, А., Ройт, П., Делвз. М.: Мир, 2006. 320 с.
- Добрица В. П., Ботерашвили Н.М., Добрица Е.В. Современные иммуномодуляторы для клинического применения. СПб: Политехника, 2001. 249 с.
- Дранник Г. Н. Клиническая иммунология и аллергология. М.: МИА, 2003. 603 с.
- Козлов В. К., Смирнов М.Н., Егорова В.Н. Коррекция иммунореактивности рекомбинатным IL-2: пособие для врачей. СПб., 2001. 24 с.
- Хавинсон В. X. Иммунокорригирующая терапия при заболеваниях и травмах: автореф. дис.... д-ра мед. наук. Л., 1987.50 с.
- Lillehei К. О. Immunotherapy//Neuro-Oncology Essentials/ed. by S. Mark Bernstein & Mitchel. Berger: Thieme Medical Publishers, Inc. New York, 2000. P. 264-272
- Whiteside T. L. Human tumor antigen-specific T-lymphocytes and interleukin-2-activated natural killer cells: comparisons of antitumor effects in vitro and in vivo//Clin. cancer res. 1998. №4. P. 1135-1145
- Cooper M.A., Fehniger T.A., Caligiuri M.A. The biology of human natural killer-cell subsets//Trends immunol. 2001. № 11. P. 633-640
- Качков И. А., Биктимиров P. Г., Захаров А. В. Гли-альные опухоли головного мозга: классификация, иммуно-патогенез и иммунодиагностика//Вестн. РАМН. 2005. № 6. С. 36-41
- Гранов A.M., Молчанов О.Е. Канцерогенез и иммунология опухоли: фундаментальные и клинические аспекты//Вопр. онкол. 2008. № 4. С. 401-409
- Лисяный И. И., Семенова В.М., Любич Л. Д. Достижения и проблемы применения интерферонов в нейроонко-логии//Укр. нейрохир. журн. 2004. № 3. С. 29-39
- Маркова О. В. Состояние естественной киллер-ной активности лимфоцитов периферической крови у больных с опухолями головного мозга: дис.... канд. мед. наук/О. В. Маркова. Киев, 1998. 196 с.
- Хаитов P.M., Игнатьева ГА., Сидорович И. Г. Иммунология: учебник 2е изд., перераб. и доп. М.: Медицина, 2002. 536 с.
- Примушко Л. И. Состояние иммунной системы у больных со злокачественными глиомами головного мозга на этапах комбинированного лечения: дис.... канд. мед. наук. Киев, 1988. 176 с.
- Mahaley M.S. J., Mettlin О, Mahaley С. Analysis of patterns of care of brain tumor patients in the United States: a study of the Brain Tumor Section of the AANS and CNS and the commission Cancer of the American Cancer Sosiety//Clin. Neurosurg. 1990. № 36. P. 347-352
- Воронцова А.Л. Интерферон как важный элемент оптимизации лечения онкологических больных//Онкология. 2000. №1/2. С. 16-20
- Кадагидзе 3. Г. Цитокины//Практ онкол. 2003. № 3. С. 131-139
- Петленко С. В., Ельцин С. С. «Тимоген» как средство этиотропной терапии и профилактики инфекционных осложнений у оперированных больных с неопластическими прޑƐՑQPАܐؠбрюшной полости//XII национальный конгресс «Человек и лекарство». М., 2005. С. 230-231
- Бажанов С. П., Ульянов В.Ю. Оценка параметров клеточного иммунитета у больных с анапластическими ме-нингиомами верхнешейного отдела позвоночника и уровня краниовертебрального перехода//Новые медицинские технологии. URL: http://econf.rae.ru/article/6560 (дата обращения: 09.07.2012).


