Коррекция структурных повреждений, связанных с диабетической кардиомиопатией, производным ГАМК
Автор: Смирнов А.В., Тюренков И.Н., Бакулин Д.А., Великородная Ю.И., Паньшин Н.Г., Чернышев А.В., Пустынников В.Э., Болохов Н.С., Похлебин А.А., Самусев Р.П., Замараев В.С., Гуров Д.Ю., Краюшкин А.И., Быхалов Л.С.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Статьи
Статья в выпуске: 1 т.22, 2025 года.
Бесплатный доступ
Сахарный диабет (СД) в настоящее время рассматривают как серьезную эпидемию во всем мире. Он является ведущей причиной сердечно-сосудистых заболеваний и смертности пациентов. Диабетическая кардиомиопатия (ДКМП) в отсутствии ИБС, пороков сердца, артериальной гипертонии и др. является многофакторным заболеванием, приводящим к гипертрофии желудочков, интерстициальным фиброзным изменениям сердца и сердечной недостаточности.
Сердце, сахарный диабет, сукцикард, фиброз, гипертрофия
Короткий адрес: https://sciup.org/142245444
IDR: 142245444 | УДК: 616-091.814 | DOI: 10.19163/2658-4514-2025-22-1-40-46
Текст научной статьи Коррекция структурных повреждений, связанных с диабетической кардиомиопатией, производным ГАМК
doi:
ORIGINAL ARTICLE doi:
Сахарный диабет (СД) в настоящее время все чаще начинают рассматривать как серьезную мировую эпидемию.
Всемирная организация здравоохранения (ВОЗ) постановила, что к 2040 г. распространенность СД может достичь 10,4 % мирового населения, что составит около 642 млн человек [1].
Риск осложнений сахарного диабета особенно велик у пожилых больных. Среди осложнений СД важная роль отдается нарушениям глюкозного и липидного видов обмена, развивающимся на фоне инсулинорезистентности [2, 3], что способствует инициации и прогрессии повреждения эндотелия и увеличению сосудистой проницаемости. Также оксидативный стресс, нитрозатив-ный стресс и воспаление, являющиеся предикторами развития СД, могут стимулировать развитие диабетической кардиомиопатии (ДКМП) [4, 5].
На более поздних стадиях ДКМП наблюдаются выраженные изменения в структуре и функции сердца.
Одними из ключевых морфологических проявлений являются гипертрофия и фиброзирование левого желудочка (ЛЖ), которые развиваются в ответ на хроническую перегрузку сердца метаболическими факторами и сопровождаются прогрессирующей диастолической и систолической дисфункцией, что приводит к снижению фракции выброса, уменьшению насосной функции сердца и, в конечном итоге, к развитию хронической сердечной недостаточности (ХСН) [6].
Осложнения СД, связанные с сердечной мышцей, сильно повышают риск развития инфаркта миокарда, что требует применения эффективных терапевтических подходов, направленных не только на контроль уровня глюкозы, но и на защиту сердечно-сосудистой системы. Существующие сахароснижающие методы лечения не направлены на снижение смертности от сердечно-сосудистых заболеваний при сахарном диабете, а в некоторых случаях могут даже ухудшать течение сердечной недостаточности [7].
ГАМК-ергическая система является перспективной мишенью для поиска препаратов с комплексной поливалентной активностью, направленных на предупреждение развития осложнений СД. Разработанные комбинированные производные гамма-аминомасляной кислоты (ГАМК), например сукцикард (4-фенилпирацетам в комбинации с янтарной кислотой, 2 : 1), обладающий цитопротек-торными свойствами, что позволяет рассматривать данное вещество в качестве кандидата для лечения сахарного диабета [8].
ЦЕЛЬ РАБОТЫ
Охарактеризовать структурные повреждения в миокарде, развитие фиброза, гипертрофии кардиомиоцитов на модели экспериментального сахарного диабета 2-го типа у стареющих животных с учетом фармакологической коррекции производным ГАМК.
МЕТОДИКА ИССЛЕДОВАНИЯ
Исследование выполнено на 18 беспородных крысах в возрасте 12 месяцев на начало эксперимента, полученных из питомника лабораторных животных (ФГУП питомник лабораторных животных «Рапполово», Ленинградская обл.).
Грызуны содержались в специализированных пластиковых клетках (545 × 395 × 200 мм). В качестве подстила использовались древесные гранулы (пеллеты), которые после введения стрептозотоцина и развития полиурии менялись ежедневно. Животные получали круглосуточный доступ к пище и воде. Световой режим составлял 12/12 часов день-ночь. Дизайн исследования был одобрен этическим комитетом ВолгГМУ, протокол № 2022/116 от 04.03.2022 г.
Эксперимент произведен на белых беспородных крысах, которых в возрасте 12 месяцев подвергали моделированию сахарного диабета в течение 6 месяцев путем введения стрептозо-тоцина [60 мг/кг, Cat No. 14653, Sisco Research Laboratories Pvt. Ltd. (SRL), Индия] через 15 минут после введения никотинамида (230 мг/кг, Sigma-Aldrich, США). Производили контроль уровня глюкозы в крови через 3 суток и через 6 месяцев, при наличии гипергликемии в течение 6 месяцев (от 10 до 18 ммоль/л) включали в исследование [9].
После наблюдения за животными в течение 6 месяцев от моделирования патологии животных разделяли на группы. Первую группу животных ( n = 6) составляли интактные крысы в возрасте 19 месяцев. Вторую группу животных составляли крысы в возрасте 19 месяцев с экспериментальным сахарным диабетом, получавшие 0,9%-й раствор NaCl. Третью группу животных составляли крысы в возрасте 19 месяцев с экспериментальным сахарным диабетом, получавшие в качестве терапии аминалон в дозе 1000 мг/кг.
Четвертую группу животных составляли крысы в возрасте 19 месяцев с экспериментальным сахарным диабетом, получавшие в качестве терапии исследуемое производное ГАМК – сукци-кард (4-фенилпирацетам в сочетании с янтарной кислотой, 2 : 1) в дозе 50 мг/кг.
Соединения вводили на протяжении 4 недель каждый день по одному разу внутрижелудочно.
Эвтаназию проводили декапитацией при нар-котизировании хлоралгидратом в дозе 400 мг/кг, внутрибрюшинно. Образцы тканей сердца фиксировали в растворе забуференного формалина. Изготавливали парафиновые срезы толщиной 4– 5 мкм. Производили их окрашивание гематоксилином и трихромом по Массону.
Фотодокументирование препаратов производили с использованием видео/фотокамеры AxioCam 305 color (Carl Zeiss Microscopy GmbH, Германия), установленной на световом микроскопе AxioImager A2 (Carl Zeiss Microscopy GmbH, Германия) с использованием объективов ×10, ×20, ×40. При морфометрическом исследовании использовали программу Zeiss Zen Pro 2.3 2021 (Carl Zeiss Microscopy GmbH, Германия), определяли диаметр кардиомиоцитов левого желудочка. Фиброз оценивали полуколичественным методом в субэпикардиальной, интрамуральной и эпикардиальной областях миокарда левого желудочка.
Статистическую обработку данных проводили с использованием пакета программы «Statistica 10.0» (USA). При проверки выборки на нормальность проводили тест Колмогорова – Смирнова. Сравнение независимых выборок проводили непараметрическим методом (критерий Краскела – Уоллиса с посттестом Данна). Гипоте- зу о существовании различий между выборками принимали при уровне р < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
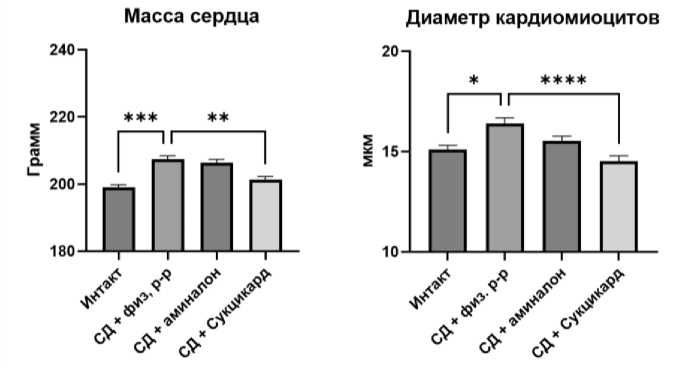
При исследовании сердца крыс интактной группы престарческого возраста (19 мес.) выявлено, что средняя масса сердца составила (199 ± 1,53) г, обнаружены явления интерстициального фиброза у части животных в миокарде левого желудочка. Отмечались явления слабовыражен-ного периваскулярного фиброза в субэпикардиальных областях миокарда, что отражает увеличение степени фиброзирования с возрастом. По всей видимости, это основано на увеличении действия хронического воспаления и окислительного стресса на фоне старения (рис. 1 а).
Морфометрическое исследование диаметра кардиомиоцитов левого желудочка у интактных крыс выявило средний диаметр кардиомиоцитов – (14,95 ± 0,22) мкм (рис. 2 б).
При изучении миокарда животных с сахарным диабетом средняя масса сердца составила (207,33 ± 1,98) г, что на 4 % меньше, чем у животных интактной группы. Отмечены наиболее выраженные признаки умеренно выраженного мелкоочагового интерстициального фиброза в интрамуральных отделах миокарда левого желудочка. Кроме того, в единичных случаях обнаружен слабо выраженный фиброз в субэпикардиальных областях. В субэндокардиальных областях у большинства экспериментальных животных были отмечены явления интерстициального фиброза, при чем в единичные случаях – в папиллярных мышцах (рис. 1 б). Диаметр кардиомиоцитов левого желудочка составил (16,40 ± 0,29) мкм, увеличение размеров кардиомиоцитов – 8,9 % (при p < 0,001) (рис. 2 б).
У крыс третьей группы (сахарный диабет, лечение миналоном) средняя масса сердца составила (206,33 ± 1,93) г, что на 0,48 % меньше, чем у животных с экспериментальным СД. В миокарде левого желудочка выявлялась умеренная гипертрофия в сочетании с участками, в которых наблюдались атрофические изменения в кардиомиоцитах (рис. 1 в). Отмечены явления периваскулярного и интерстициального фиброза в интрамуральных областях миокарда. Средний диаметр кардиомиоцитов левого желудочка у животных 3-й группы снижался на 5,43 % ( p > 0,05), по сравнению с группой животных с СД без лечения, и составил (15,52 ± 0,22) мкм (рис. 2 б).
Средняя масса сердца животных с СД, получавших в качестве терапии сукцикард (4-я группа), составила (201 ± 1,63) г, что на 2,89 % меньше, чем у животных 2-й группы с СД. В миокарде левого желудочка отмечено преобладание участков с умеренной гипертрофией, сочетавшихся с участками атрофических изменений (рис. 1 г).
Были выявлены единичные явления периваскулярного и интерстициального фиброза в субэпикардиальных областях миокарда. Кардиомиоциты левого желудочка животных этой группы в диаметре были меньше на 13,12 % (при p < 0,0001) по сравнению со 2-й группой животных с СД [(14,254 ± 0,27) мкм] (рис. 2 б).
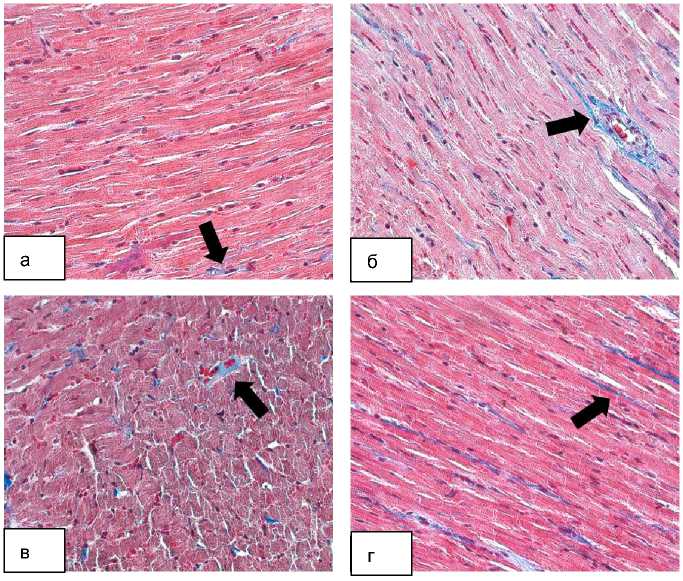
Рис. 1. Структурные изменения миокарда левого желудочка:
а – 1-я группа, миокард крысы в возрасте 19 мес.; б – 2-я группа, миокард крысы в возрасте 19 мес.
с экспериментальным сахарным диабетом; в – 3-я группа, миокард крысы в возрасте 19 мес. с экспериментальным сахарным диабетом, получавшей аминалон; г – 4-я группа, миокард крысы в возрасте 19 мес.
с экспериментальным сахарным диабетом, получавшей сукцикард.
Окраска по Массону. ×400. Черные стрелки – соединительная ткань, участки фиброзирования
б
а
Рис. 2. Результаты измерения массы сердца (а); результаты морфометрии кардиомиоцитов миокарда (б);
* - p < 0,05 * - p < 0,01, *** - p < 0,001, **** - p < 0,0001
Обнаруженные нами данные указывают на значимое повышение диаметра кардиомиоцитов у животных с сахарным диабетом. Это говорит о развившейся гипертрофии миокарда. Так как в кардиомиоцитах хорошо видна поперечная ис-черченность, формирующаяся за счет миофибрилл, можно подтвердить сохранность миофибрилл и отмести отек кардиомиоцитов. Подтверждает все это увеличение средней массы сердца животных с сахарным диабетом.
Было отмечено развитие мелкоочагового интерстициального фиброза в интрамуральных отделах миокарда у животных со стрептозото-цин-никотинамид-индуцированным СД (модель СД 2-го типа). Подобные изменения были обнаружены ранее при стрептозотоцин-индуцируемом СД (модель СД 1-го типа) [10], что свидетельствует о метаболических нарушениях кардиомиоцитов при СД, характерных для ДКМП. На модели СД 2-го типа показано, что сукцикард способствует снижению массы сердца, уровня фиброза в левом желудочке, уменьшению выраженности гипертрофии кардиомиоцитов левого желудочка у крыс, что подтверждается значимым снижением диаметра кардиомиоцитов. Стоит отметить, что в проведенном эксперименте использовались крысы престарческого возраста (19 мес.), у которых уже наблюдалось развитие фиброза, связанного с воз- растными изменениями в сердце, на фоне которых развивались патологические изменения в результате моделирования сахарного диабета, усугубляющие метаболические нарушения в миокарде.
ЗАКЛЮЧЕНИЕ
Результаты исследования демонстрируют, что у крыс престарелого возраста развитие диабетической кардиомиопатии сопровождается значительными морфологическими изменениями в миокарде, включая гипертрофию кардиомиоцитов и фиброз. Возрастные изменения, такие как старческие изменения миокарда, усиливают патологические эффекты сахарного диабета, что подчеркивает важность учета коморбидных состояний при моделировании патологии.
Применение сукцикарда при СД показало выраженное кардиопротективное влияние, выражающееся в уменьшении гипертрофии кардиомиоцитов и снижении степени фиброза, что может быть обусловлено мембрано- и цитопротектив-ным действием производного ГАМК – сукцикарда (4-фенилпирацетам в комбинации с янтарной кислотой, 2 : 1). Это подчеркивает перспективность дальнейших исследований использования сукцикарда в коррекции морфологических нарушений, развивающихся при диабетической кардиомиопатии, особенно в условиях старения.


