Корреляция параметров искусственного кровообращения и гемодинамики во время кардиохирургических операций и структурно-функционального состояния сетчатки
Автор: Дьякова М.Л., Подоксенов Ю.К., Шипулин В.М., Шишнева Е.В., Каменщиков Н.О., Кривошеина О.И., Дениско М.С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.35, 2020 года.
Бесплатный доступ
Цель исследования: изучить изменения структурно-функционального состояния сетчатки у кардиохирургических больных, развившиеся в результате воздействия искусственного кровообращения (ИК), а также выявить факторы, влияющие на характер и степень данных изменений.Материал и методы. Обследованы 10 пациентов, перенесших кардиохирургическую операцию с использованием ИК. Офтальмологическое обследование выполняли перед кардиохирургическим вмешательством и на 10-14-е сут после операции.Результаты. На 10-14-е сут после кардиохирургического вмешательства максимально корригированная острота зрения, показатели периметрии, уровень внутриглазного давления, структуры переднего отрезка глазных яблок статистически значимо не изменились. При офтальмоскопии в 30% случаев на глазном дне по ходу артерий 1-го и 2-го порядка обнаруживались очаги ишемического отека. У одного пациента (10%) уменьшилась толщина ганглионарного слоя и слоя нервных волокон, что может быть связано с интраоперационной ишемией ветвей глазничной артерии, питающей зрительный нерв. Выявленные изменения имели прямую взаимосвязь с уровнем максимально среднего артериального давления (САД) во время ИК и колебанием абсолютных значений САД во время ИК: САД ≥ 90 мм рт. ст. во время ИК в 100% случаев ассоциировалось с появлением очагов ишемического отека сетчатки. Если разница между максимальным и минимальным уровнем САД во время ИК составляла >20 мм рт. ст., то изменения сетчатки развивались чаще (p = 0,0350) по сравнению с больными, у которых колебания САД во время ИК были 90 мм рт. ст.).
Искусственное кровообращение, нарушения микроциркуляции, осложнения, среднее артериальное давление, сетчатка
Короткий адрес: https://sciup.org/149126176
IDR: 149126176 | УДК: 616.12-089.8-78:612.13]-06:617.735-008.6 | DOI: 10.29001/2073-8552-2020-35-2-149-156
Текст научной статьи Корреляция параметров искусственного кровообращения и гемодинамики во время кардиохирургических операций и структурно-функционального состояния сетчатки
–156
Подавляющее большинство кардиохирургических операций выполняется с использованием искусственного кровообращения (ИК). ИК применяют для обеспечения кардиохирургических операций более 60 лет, в настоящее время число операций с ИК в год в мире превышает 1 млн [1].
Сама процедура ИК вызывает целый каскад различных патофизиологических процессов в организме. Они, в свою очередь, вызваны в большей степени активацией системного воспалительного ответа как результата прохождения крови через поверхности физиологического контура ИК [1, 2].
Интегральной современной концепцией патофизиологии ИК считается положение о системной активации под его влиянием компонентов крови и эндотелия сосудов, приводящей к воспалительной реакции всего организма [1].
ИК активирует 5 плазменных белковых систем: контактную, внутренний и внешний пути свертывания, систему комплемента и фибринолитическую систему. Физиологические контуры систем ИК, покрытые гепариноподобными соединениями, изменяют характер реакции адсорбции, но не снижают риск тромбообразова-ния [3, 4].
Кровотечения и тромбоэмболические осложнения, вызванные ИК, связаны с активацией тромбоцитов и белков плазмы, а также с использованием гепарина и протаминасульфата [5].
Массивный выход жидкости из сосудистого русла в интерстиций является результатом повышения системного венозного давления, объемной нагрузки пациента жидкостью, снижения концентрации протеинов плазмы крови (как результат дилюции и адсорбции), а также системного воспалительного ответа, который повышает проницаемость стенок капилляров [1, 2].
Изменения белков в крови больного, происходящие под влиянием ее контакта с инородными поверхностями биологического контура ИК, вызывают активацию комплемента, изменения кининовой системы, фибринолиз и изменения коагуляции. Этим же процессам способствует травма клеточных элементов крови, в особенности тромбоцитов и нейтрофилов. Травма клеточных элементов крови в контуре ИК приводит к их адгезии и образованию микроагрегатов, вызывающих возникновение микротромбов в капиллярном русле различных органов [6, 7].
В настоящее время известно, что «залповое» поступление микроэмболов в церебральный кровоток регистрируется во многих случаях при хирургических манипуляциях на сердце и аорте (канюлирование и деканюлирование аорты, наложение и снятие аортальных зажимов, подключение аппарата ИК, возврат к естественному кровообращению). При операциях на открытом сердце значительное количество воздушных микроэмболов поступает также из камер сердца и просвета крупных сосудов в момент возобновления сердечной деятельности. Известно, что ни один из современных аппаратов ИК не способен удалить все воздушные эмболы, поступающие в венозную магистраль. Жировая микроэмболия также неминуемо сопутствует всем хирургическим вмешательствам с обширной травматизацией подкожной жировой клетчатки и/или костных структур, в частности, вследствие стернотомии при кардиохирургических операциях [6].
Таким образом, после проведения операций с ИК можно ожидать развития ряда побочных эффектов, таких как кровотечение, системный воспалительный ответ, неврологические и нейрокогнитивные нарушения, почечная, легочная, сердечная и полиорганная дисфункции.
Учитывая сложные изменения в организме на фоне проведения операций с ИК и высокую чувствительность ретинальных сосудов к изменениям реологии крови, уровню среднего артериального давления (САД), можно предположить вероятность развития изменений на уровне сосудов микроциркуляторного русла сетчатки у пациентов, перенесших операции с ИК, поскольку сетчатка глаза – это «зеркало мозгового кровообращения». Таким образом, выявив нарушения микроциркуляции на уровне сетчатки глаза, можно ожидать появления подобных расстройств и на уровне головного мозга, вну- тренних органов. В связи с этим важным представляется диагностика патологических изменений сетчатки и анализ факторов, которые могут повлиять на их появление. Несмотря на большой опыт выполнения операций с ИК, на данный момент этот вопрос остается еще мало исследованным.
Цель исследования: изучить изменения в структурно-функциональном состоянии сетчатки у кардиохирургических больных, перенесших оперативное вмешательство в условиях ИК, а также выявить факторы, влияющие на характер и степень данных изменений.
Материал и методы
В исследование включены 10 пациентов, перенесших кардиохирургическую операцию – аортокоронарное шунтирование (АКШ) с использованием ИК. Клинико-демографическая характеристика пациентов представлена в таблице 1.
Таблица 1. Клинико-демографическая характеристика пациентов
Table 1. Clinical and demographic characteristics of patients
|
Показатели |
n = 10 |
|
Indicators |
|
|
Пол: мужчины, n (%) Gender: men, n (%) |
10 (100) |
|
Возраст, лет, Мe [25;75] Age, years, Мe [25;75] |
59,2 [56; 64] |
|
Индекс массы тела, кг/м2, Мe [25;75] Body mass index, kg/m2, Мe [25;75] |
30,75 [27; 34,2] |
|
Основное заболевание Underlying disease Ишемическая болезнь сердца, n (%) Coronary artery disease, n (%) |
10 (100) |
|
Сопутствующие заболевания Concomitant diseases Гипертоническая болезнь, n (%) Hypertonic disease, n (%) |
10 (100) |
|
Сахарный диабет, n (%) |
4 (40) |
|
Diabetes, n (%) Ожирение, n (%) Obesity, n (%) |
6 (60) |
|
Хроническая болезнь почек, n (%) Chronic kidney disease, n (%) |
2 (20) |
|
Курение в анамнезе, n (%) Smokers, n (%) |
4 (40) |
Все больные прооперированы в условиях ИК, фармакохолодовой кардиоплегии раствором «Кустодиол» (Koehler Chemi, Alsbach-Haenlien, Германия). Во время операции использовали унифицированную хирургическую и анестезиологическую тактику. Анестезиологическое обеспечение выполняли в виде комбинированной анестезии на основе эндотрахеального наркоза (сево-флюран) и аналгезии фентанилом. Искусственную вентиляцию легких проводили аппаратом Primus (Dräger, Германия) по полузакрытому контуру в режиме Controlled Mandatory Ventilation с управлением по объему с положительным давлением конца выдоха 5 см Н2О, дыхательным объемом 6–8 мл/кг идеальной массы тела, с частотой дыхательных движений и FiO2, адекватными для обеспечения целевой оксигенации и вентиляции.
Во время ИК использовали тотальную внутривенную анестезию (пропофол, фентанил). ИК выполняли с при- менением аппарата фирмы Strockert (Strockert, Германия) с одноразовыми мембранными оксигенаторами. ИК проводили в условиях нормотермии, кровообращение обеспечивали непульсирующим кровотоком с объемной скоростью 2,4–2,8 л/мин/м2, содержание в крови гемоглобина не менее 80 г/л, уровень гематокрита – 0,24–0,26. Начальная доза гепарина составила 300 ЕД/кг. После окончания ИК выполняли инактивацию гепарина протамина сульфатом из расчета 1 : 1. Контроль гепаринизации и нейтрализации гепарина осуществляли по времени активированного свертывания. По окончании оперативного вмешательства пациентов транспортировали в отделение реанимации. Особенности течения интраоперационного периода представлены в таблице 2.
Таблица 2. Особенности течения интраоперационного периода, Мe [25; 75]
Table 2. Features of a current intra-operative period, Мe [25; 75]
|
Показатели Indicators |
n = 10 |
|
Длительность ИК, мин Duration of cardiopulmonary bypass, min |
69,9 [60; 130] |
|
Время пережатия аорты, мин Aortic clamping time, min |
59,9 [35; 58] |
|
Min. САД во время ИК, мм рт. ст. Minimum MBP during CPB, mmHg |
58,4 [52; 61] |
|
Max. САД во время ИК, мм рт. ст. Max MBP during cardiopulmonary bypass, mmHg |
76,8 [70; 86] |
|
Колебания САД во время ИК, мм рт. ст. The difference in MBP during CPB, mmHg |
18,3 [15; 23] |
|
Объемная скорость перфузии, мл/кг/ч Perfusion volumetric speed, mL/kg/h |
4,7 [4,1; 5,0] |
|
Сатурация в артериальной крови, % Arterial saturation, % |
99 [98; 99,9] |
Примечание: Min. САД во время ИК – минимальные значения CАД во время ИК, Max. САД во время ИК – максимальные значения среднего АД во время ИК, колебание САД во время ИК рассчитывалось как разница между максимальным и минимальным уровнем САД во время ИК.
Note: CPB – cardiopulmonary bypass; MBP – mean blood pressure. The difference in MBP during CPB was calculated as the difference between the maximum and minimum levels.
Офтальмологическое обследование выполняли перед кардиохирургическим вмешательством и на 10– 14-е сут после операции. Все пациенты подписывали информированное согласие на проведение обследования.
В ходе офтальмологического обследования всем пациентам проводили визометрию, периметрию, бесконтактную тонометрию (бесконтактный тонометр FT-1000, Tomey, Япония), биомикроскопию переднего отрезка глаза, обратную бинокулярную офтальмоскопию, оптическую когерентную томографию (ОКТ) сетчатки – макулярной области и диска зрительного нерва (ДЗН) с подсчетом ганглионарных клеток и слоя нервных волокон (оптический когерентный томограф 3D OCT-2000, Topcon Corporation, Япония), фоторегистрацию глазного дна (оптический когерентный томограф 3D OCT-2000, Topcon Corporation, Япония).
Статистический анализ данных проводили в программе STATISTICA 10 StatSoft. Inc. 1984–2011 (USA). Количественные значения выражали как медиану и квартили Ме [25; 75]. Для оценки корреляции использовали коэффициент Спирмена. Для сравнения количественных характеристик применяли U-критерий Манна – Уитни (неза- висимые выборки) и W-критерий Вилкоксона (зависимые выборки). Для сравнения качественных характеристик использовали точный критерий Фишера. Различия считали статистически значимыми при p < 0,05.
Результаты
При проведении офтальмологического исследования у пациентов накануне оперативного вмешательства были выявлены следующие особенности: максимально корригированная острота зрения у всех пациентов (10 человек, 20 глаз) составляла 0,85 [0,3; 2,0]. Показатель периметрии (сумма показателей поля зрения по восьми меридианам) составляла 467 [450,0; 480,0] градусов.
Уровень внутриглазного давления в 100% случаев находился в пределах референсных значений – 15,5 [13,0; 18,0] мм рт. ст.
По данным биомикроскопии переднего отрезка глазных яблок обследованных пациентов в 100% случаев в хрусталиках обнаруживались начальные признаки катаракты в виде явлений оводнения и единичных спицеобразных помутнений в корковых отделах, обусловивших незначительное (до 0,9) снижение максимально корригированной остроты зрения. Каких-либо других патологических изменений со стороны переднего отрезка глазных яблок у пациентов (10 человек, 20 глаз) не выявлено.
На глазном дне в ходе офтальмоскопии у всех пациентов (10 человек, 20 глаз) перед кардиохирургическим вмешательством выявлялись признаки гипертензивного артериолосклероза сетчатки: изменение артерио-венозного соотношения 1 : 3 – у 80% пациентов (8 человек, 16 глаз), 1 : 4 – у 20% пациентов (2 человека, 4 глаза), наличие артерио-венозных перекрестов 2–3-й степени, симптом «серебряной проволоки» – у 100% пациентов. Состояние сосудов микроциркуляторного русла сетчатки соответствовало степени тяжести основного заболевания.
По данным ОКТ сетчатки, перед операцией толщина сетчатки в области центральной ямки желтого пятна в 100% случаев составляла 231,5 [227,0; 235,0] мкм, что соответствовало нормальному уровню.
На 10–14-е сут после кардиохирургического вмешательства максимально корригированная острота зрения у всех пациентов (10 человек, 20 глаз) соответствовала исходному уровню. При сравнении показателей периметрии в 100% случаев не выявлено статистически значимой разницы с первоначальным значением. Уровень внутриглазного давления также соответствовал исходному уровню. Со стороны переднего отрезка глазных яблок у обследованных пациентов (10 человек, 20 глаз) ни в одном случае в послеоперационном периоде не зарегистрировано развитие каких-либо патологических изменений или прогрессирование помутнений в хрусталиках.
При осмотре глазного дна в 70% случаев (7 пациентов, 14 глаз) сохранялись признаки гипертензивного арте-риолосклероза сетчатки, что соответствовало исходной офтальмоскопической картине.
В 30% случаев ( n = 3) в ходе офтальмоскопии на глазном дне по ходу артерий 1-го и 2-го порядка обнаруживались очаги ишемического отека беловатого цвета, почти округлой формы, с нечеткими границами, величиной до 1/4–1/6 диаметра ДЗН, располагающиеся по ходу указанных сосудов (рис. 1).
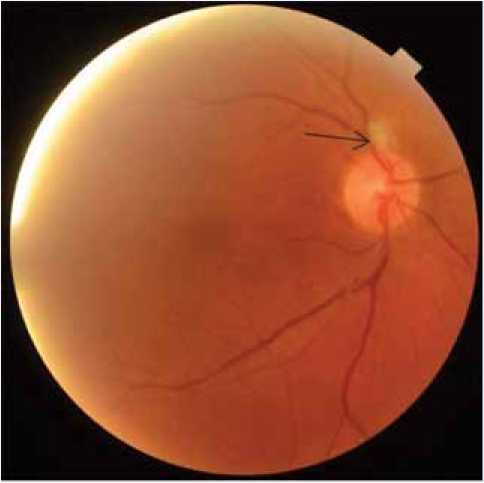
Рис. 1. Фотография глазного дна правого глаза пациента на 14-е сут после оперативного вмешательства. Стрелкой указан ишемический фокус на сетчатке вблизи диска зрительного нерва по ходу верхневисочной артерии
Fig. 1. The photograph of right eye fundus in the patient on day 14 after surgery. The arrow indicates the ischemic focus at the retina near the optic disc along the superior temporal artery
Появление участков ишемического отека в ткани сетчатки, отличающейся высокой чувствительностью к уровню кислорода в крови, свидетельствовало о кратковременном нарушении кровотока в ретинальных артериях 1–2-го порядка в интра- или раннем послеоперационном периодах.
По данным ОКТ сетчатки, в проекции очагов ишемического отека отмечалось увеличение толщины ретинальной ткани в 1,6 раза (до 428 [419,0; 435,0] мкм) по сравнению с исходным значением (258,0 [254,0; 265,0]) ( р ˂ 0,05), рисунок 2.
Согласно результатам ОКТ ДЗН, у одного пациента (10%) в раннем (10–14-е сут) послеоперационном периоде наблюдалось снижение толщины ганглионарного слоя и слоя нервных волокон сетчатки вокруг ДЗН.
При изучении факторов, которые могли оказать влияние на формирование патологических изменений в сетчатке во время операции, нами были проанализированы параметры САД во время ИК, длительность ИК, время пережатия аорты, объемная скорость перфузии.
Проведен корреляционный анализ Спирмена (табл. 3). Выявлено, что изменения глазного дна имеют прямую взаимосвязь с уровнем максимального САД во время ИК и колебанием абсолютных значений САД во время ИК. Так, повышение уровня САД до 90 мм рт. ст. и более ( n = 2) во время ИК в 100% случаев было связано с появлением очагов ишемического отека сетчатки. При этом среди пациентов, у которых разница между максимальным уровнем САД и минимальным уровнем САД во время ИК составила более 20 мм рт. ст. ( n = 6), такие изменения встречались чаще ( p = 0,0350) – в 67% случаев (у 4 пациентов из 6), по сравнению с больными, у которых колебания САД во время ИК были менее 20 мм рт. ст.
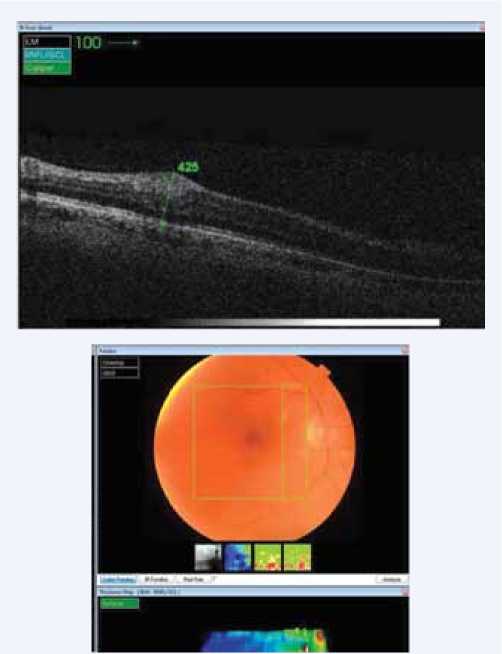
Рис. 2. ОКТ-томограмма в проекции ишемического фокуса на сетчатке пациента на 14-е сут после оперативного вмешательства
Fig. 2. Optical coherence tomography in the projection of ischemic focus in the patient’s retina on day 14 after surgery
Таблица 3. Корреляция между параметрами ИК и изменениями сетчатки (очаги ишемического отека) после операции
Table 3. Correlation between CPB parameters and retinal changes (foci of ischemic edema) after surgery
|
Показатели Indicators |
Коэффициент корреляции Спирмена Spearman’s correlation coefficient |
|
Длительность ИК CPB duration |
0,106925 |
|
Min. САД во время ИК Minimum MBP during CPB |
0,356416 |
|
Max. САД во время ИК Maximum MBP during CPB |
0,712832* |
|
Колебание САД во время ИК The difference in MBP during CPB |
0,748474* |
|
Время пережатия аорты Aortic clamping time |
–0,071067 |
|
Объемная скорость перфузии Volumetric perfusion rate |
0,320775 |
Примечание: Min. САД во время ИК – минимальные значения CАД во время ИК, max. САД во время ИК – максимальные значения среднего АД во время ИК, колебание САД во время ИК рассчитывалось как разница между максимальным и минимальным уровнем САД во время ИК, ОСП – объемная скорость перфузии, * – p < 0,05.
Note: CPB – cardiopulmonary bypass; MBP – mean blood pressure. The difference in MBP during CPB was calculated as the difference between the maximum and minimum levels. * – p < 0.05.
Обсуждение
Хотя абсолютное большинство пациентов переносят ИК без существенных проблем, субклинические и клинические доказательства побочных эффектов ИК отмечаются достаточно часто. Нами были изучены патологические изменения сетчатки, развившиеся у пациентов после проведения операций с ИК.
Обращало на себя внимание то, что у 40% больных отмечено появление выраженных изменений в сетчатке глаза и структуре ганглионарных волокон: в 30% случаев появились очаги ишемического отека на сетчатке глаза, у 10% – уменьшение толщины ганглионарных волокон. По нашему мнению, данные изменения могут быть связаны с интраоперационной ишемией ветвей глазничной артерии, в частности, центральной артерии сетчатки, а также ветвей, кровоснабжающих зрительный нерв. Как уже упоминалось, сосуды микроциркуляторного русла сетчатки весьма чувствительны к колебаниям САД и степени оксигенации крови.
Учитывая эти особенности, нами были проанализированы параметры гемодинамики во время процедуры ИК.
Так как цель ИК – адекватная доставка кислорода тканям, то одними из главных показателей являются САД во время перфузии и объемная скорость перфузии (ОСП, л/мин), которая рассчитывается на основании площади поверхности тела и необходимого перфузионного индекса (ПИ) – аналога сердечного индекса при естественном кровообращении. ОСП или ПИ зависят от режима гипотермии и возраста больного [8].
Целевое АД во время ИК остается одним из фундаментальных вопросов в кардиоанестезиологии. Большинство исследований ограничены из-за гетерогенности пациентов или иных изъянов в дизайне и статистической силе [9].
Уровень САД во время ИК, необходимый для обеспечения адекватной перфузии органов и тканей, не определен. В особенности не ясна нижняя граница безопасного САД: часть исследователей защищают низкое (50–60 мм рт. ст.), часть – высокое (70–80 мм рт. ст. и выше) САД во время ИК. Во многих центрах САД поддерживают на уровне 50–60 мм рт. ст. у большинства взрослых пациентов во время ИК. Эти цифры основываются на данных, что 50 мм рт. ст. являются нижним пределом церебральной ауторегуляции [1].
Неопределенность целевого уровня САД еще более усугубляется имеющейся у многих пациентов исходной артериальной гипертензией. Предлагается использовать более высокое САД у пациентов с гипертензией, основываясь на предположении, что у таких пациентов имеется сдвиг кривой ауторегуляции мозгового кровообращения вправо [10]. Однако степень этого сдвига, если он есть, остается неясной. Как результат, на практике анестезиологи не могут достоверно определить, когда АД становится слишком низким у данного конкретного пациента. В то же время низкое САД во время ИК может иметь некоторые преимущества (меньшая травма форменных элементов крови, уменьшение некоронарного коллатерального кровотока в сердце).
Другие исследователи поддерживают более высокое САД (>70 мм рт. ст.) во время ИК [11–13], опираясь на данные, что нижний лимит ауторегуляции кровотока может быть гораздо выше 50 мм рт. ст. Сторонники более высокого САД во время ИК отмечают, что многие пациенты в кардиохирургии являются лицами пожилого возрас- та, страдают артериальной гипертонией и рядом сопутствующих цереброваскулярных заболеваний.
Теоретически перфузионное давление выше 70 мм рт. ст. может уменьшить риск гипоперфузии мозга в группе пациентов высокого риска и усилить коллатеральный кровоток в случае эмболии [10].
Согласно результатам наших исследований, повышение уровня САД во время ИК более 90 мм рт. ст. в 100% случаев сопровождается значительным изменением трансмурального (разница давления внутри и снаружи сосуда) давления и, вследствие включения механизма миогенной ауторегуляции кровотока, приводит к полному перекрыванию кровотока в ретинальных артериях с появлением ишемических очагов на сетчатке. Полученные данные согласуются с мнением, что высокое перфузионное давление (>90 мм рт. ст. у взрослых) негативно влияет на организм пациента в целом и повышает риск развития таких серьезных осложнений, как расслоение аорты и геморрагический инсульт, поэтому его необходимо своевременно снижать [1, 14].
Считается, что перфузионное давление у взрослых пациентов не должно быть ниже 50–60 мм рт. ст. Повышенное внимание к его нижней границе связано с тем, что основное число кардиохирургических больных – это пациенты среднего и старшего возраста, главными факторами повреждения головного мозга у которых являются выраженный цереброваскулярный стеноз и нарушения миогенной ауторегуляции мозгового кровотока, связанные с артериальной гипертензией и сахарным диабетом. У данной категории больных рекомендуется поддерживать САД на уровне 70–80 мм рт. ст. Искусственное повышение АД оправданно только для пациентов высокого риска. В остальных случаях применение вазопрессоров только усугубляет расстройства микроциркуляции, характерные для ИК [10].
В ходе проведенного нами исследования у всех пациентов уровень САД во время ИК не опускался ниже 50 мм рт. ст. При проведении корреляционного анализа не выявлено статистически значимых данных о взаимосвязи между минимальным уровнем САД во время ИК и появлением патологических изменений со стороны сетчатки. Таким образом, полученные данные позволяют рассматривать значение САД во время ИК, равное 50 мм рт. ст., как допустимый уровень минимального САД, не оказывающий негативного влияния на состояние ретинального кровотока.
Необходимо отметить, что в ряде ранее проведенных проспективных обсервационных исследованиях оценивалось влияние артериальной гипотонии на ИК (обычно определяемой как САД < 50 мм рт. ст.) и риск развития побочных эффектов. Первичной точкой, определяемой в указанных исследованиях, как правило, являлась неврологическая дисфункция (определяемая весьма вариативно). Было установлено, что у пациентов с артериальной гипотонией во время ИК неврологические или нейропсихологические функции ухудшались [15] либо оставались неизменными [10].
Кроме абсолютных значений минимально и максимально допустимых уровней САД во время ИК необходимо контролировать и колебания САД (разница в уровне максимального и минимального САД во время ИК). Как показало наше исследование, данный показатель имеет столь же важное значение, как и уровень наибольшего САД во время ИК. Уровень САД не должен изменяться во время ИК более чем на 20 мм рт. ст., поскольку превышение данной величины приводит к нарушению кровотока на уровне микроциркуляторного русла сетчатки в 67% случаев.
Заключение
Наиболее значимые изменения в органах зрения у больных, перенесших кардиохирургические операции с ИК, происходят в сетчатке глаз.
Повышение уровня САД до 90 мм рт. ст. и более во время ИК в ходе кардиохирургического вмешательства в 100% случаев сопровождается нарушением ретинального кровотока с появлением очагов ишемического отека. Колебания САД во время ИК, достигающие значений 20 мм рт. ст. и более, в 67% случаев ассоциированы с патологическими изменениями сетчатки в виде очагов ишемического отека и уменьшения толщины слоя ганглионарных волокон ретинальной ткани.
Список литературы Корреляция параметров искусственного кровообращения и гемодинамики во время кардиохирургических операций и структурно-функционального состояния сетчатки
- Корнилов И.А., Пономарев Д.Н., Шмырев В.А., Скопец А.А., Синельников Ю.С., Ломиворотов В.В. Физиологические параметры искусственного кровообращения с точки зрения доказательной медицины. Часть I. Вестник анестезиологии и реаниматологии. 2016;13(2):57-69. DOI: 10.21292/2078-5658-2016-13-2-57-69.
- Бунятян A.A., Мизиков В.М. Анестезиология: национальное руководство. М.: ГЭОТАР-Медиа; 2011:1104.
- Радивилко А.С. Профилактика осложнений после операций с искусственным кровообращением (дайджест публикаций). Комплексные проблемы сердечно-сосудистых заболеваний. 2016;(3):117-123. DOI: 10.17802/2306-1278-2016-3-117-123.
- Ranucci M., Conti D., Castelvecchio S., Menicanti L., Frigiola A., Ballotta A. et al. Hematocrit on cardiopulmonary bypass and outcome after coronary surgery in nontransfused patients. Ann. Thorac. Surg. 2010;89(1):11-17. DOI: 10.1016/j.athoracsur.2009.07.078.
- Бабаев М.А., Еременко А.А., Винницкий Л.И., Бунятян К.А. Причины возникновения полиорганной недостаточности при кардиохирургических операциях в условиях искусственного кровообращения. Общая реаниматология. 2010;6(3):76. DOI: 10.15360/1813-9779-2010-3-76.
- Бокерия Л.А., Голухова Е.З., Ваничкин А.В., Полунина А.Г., Лефте-рова Н.П., Казановская С.Н. Эхокардиографические корреляты при когнитивной дисфункции после кардиохирургических операций. Креативная кардиология. 2015;(4):13-25. DOI: 10.15275/ kreatkard.2015.04.02.
- Козлов Б.Н., Панфилов Д.С., Кузнецов М.С., Пономаренко И.В., На-срашвили Г.Г., Шипулин В.М. Антеградная унилатеральная перфузия головного мозга через брахиоцефальный ствол при операциях на дуге аорты. Ангиология и сосудистая хирургия. 2016;22(1):195-198.
- Murphy G.S., Hessel E.A., Groom R.C. Optimal perfusion during car diopulmonary bypass: an evidence-based approach. Anesth. Analg. 2009;108(5):1394-1417. DOI: 10.1213/ane.0b013e3181875e2e.
- Hessel E.A. What's new in cardiopulmonary bypass. J. Cardiothorac. Vasc. Anesth. 2019;33(8):2296-2326. DOI: 10.1053/j.jvca.2019.01.039.
- Корнилов И.А., Пономарев Д.Н., Шмырев В.А., Скопец А.А., Синельников Ю.С., Ломиворотов В.В. Физиологические параметры искусственного кровообращения с точки зрения доказательной медицины (часть 2). Вестник анестезиологии и реаниматологии. 2016;13(3):29-42. DOI: 10.21292/2078-5658-2016-13-3-29-42.
- Joshi B., Ono M., Brown C., Brady K., Easley R.B., Yenokyan G. et al. Predicting the limits of cerebral autoregulation during cardiopulmonary bypass. Anesth. Analg. 2012;114(3):503-510. DOI: 10.1213/ane.0b013e-31823d292a.
- Лысенко А.В., Белов Ю.В., Комаров Р.Н., Стоногин А.В. Мониторинг церебральной гемодинамики во время коронарного шунтирования без искусственного кровообращения. Кардиология и сердечнососудистая хирургия. 2015;8(6):4-7. DOI: 10.17116/kardio2015864-7.
- Vedel A.G., Holmgaard F., RasmussenL. S., Langkilde A., Paulson O.B., Lange T. et al. High-Target Versus Low-Target Blood Pressure Management During Cardiopulmonary Bypass to Prevent Cerebral Injury in Cardiac Surgery Patients: A Randomized Controlled Trial. Circulation. 2018;137(17):1770-1778. DOI: 10.1161/circulationaha.117.030308.
- Ono M., Brady K., Easley R.B., Brown C., Kraut M., Gottesman R.F. et al. Duration and magnitude of blood pressure below cerebral autoregulation threshold during cardiopulmonary bypass is associated with major morbidity and operative mortality. J. Thorac. Cardiovasc. Surg. 2014;147(1):483-489. DOI: 10.1016/j.jtcvs.2013.07.069.
- Sun L.Y., Chung A.M., Farkouh M.E., van Diepen S., Weinberger J., Bourke M. et al. Defining an intraoperative hypotension threshold in association with stroke in cardiac surgery. Anesthesiology. 2018;129(3):440-447. DOI: 10.1097/aln.0000000000002298.


