Коррозия стали СТ3 в технологических водных растворах нитрата кальция
Автор: Нифталиев С.И., Козадеров О.А., Козадерова О.А., Клоков Г.В.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Фундаментальная и прикладная химия, химическая технология
Статья в выпуске: 1 (55), 2013 года.
Бесплатный доступ
Методом вольтамперометрии изучено коррозионное поведение конструкционной малоуглеродистой нелегированной стали Ст3 в водных растворах нитрата кальция. Выявлено влияние аммонизации раствора и введения добавок моноэтаноламина и бихромата калия на основные параметры коррозионного процесса.
Аммонизированный раствор нитрата кальция, сталь ст3, коррозия, моноэтаноламин, бихромат калия
Короткий адрес: https://sciup.org/14039955
IDR: 14039955 | УДК: 620.193
Текст научной статьи Коррозия стали СТ3 в технологических водных растворах нитрата кальция
температурный диапазон использования, а также высокая коррозионная активность заметно ограничивают возможности использования концентрированных солевых растворов в качестве охлаждающих жидкостей и теплоносителей.
Распространенным методом защиты от коррозии, особенно в нейтральных или близких к ним средах, где коррозия протекает преимущественно с кислородной деполяризацией, является введение в агрессивную среду специально подобранных соединений – ингибиторов [4,5].
Целью настоящей работы является изучение коррозионной активности модельного раствора нитрата кальция (РНК) и аммонизированного раствора нитрата кальция (АРНК) с неорганическими и органическими добавками в отношении конструкционной малоуглеродистой нелегированной стали Ст3, представленной в системах охлаждения ДВС.
Исследование коррозионной активности водных растворов нитрата кальция (модельного (45 % масс. Ca(NO3)2) и аммонизированного (45 % масс. Ca(NO3)2, 6 % масс. NH4NO3)) проводили при комнатной температуре вольтамперометрическим методом на стали Ст3 в отсутствие добавок и в присутствии бихромата калия и моноэтаноламина (1 % масс.). Использовали трехэлектродную электрохимическую ячейку с хлоридсеребряным электродом сравнения и платиновым вспомогательным электродом. Поляризационные кривые снимали при помощи потенциостата IPC-Compact, изменяя потенциал рабочего стального электрода из катодной в анодную область со скоростью 10 мВ/с. Потенциалы в работе приведены по шкале стандартного водородного электрода, токи отнесены к геометрической площади исследуемого электрода.
Для определения базовых параметров коррозионного процесса (таблица 1) экстраполировали линейные участки анодной и катодной кривых (рисунок 1) до взаимного пересечения в точке с координатами Екорр (потенциал коррозии) и lgiкорр (iкорр – скорость коррозии в токовых единицах) [6]. Значения тафелевых наклонов линейных участков поляризационных кривых приведены в табл. 2.
Таблица 1
Основные параметры коррозионного процесса на стали Ст3 в РНК (числитель) и АРНК (знаменатель)
|
Параметр |
Добавка |
||
|
отсутствует |
K 2 Cr 2 O 7 |
моноэтаноламин |
|
|
рН раствора |
5,6 7,9 |
4,5 7,7 |
11,2 9,7 |
|
Потенциал коррозии Е корр , мВ |
- 546 - 331 |
- 351 - 443 |
- 458 - 376 |
|
Ток коррозии i корр , мкА/см2 |
28 72 |
30 36 |
8 76 |
|
Скорость коррозии K , г/(м2ч) |
0,28 0,72 |
0,30 0,36 |
0,08 0,76 |
|
Проницаемость П , мм/год |
0,31 0,80 |
0,33 0,40 |
0,09 0,84 |
|
Степень защиты Z , % |
— |
0 50 |
71 - 5,5 |
|
Коэффициент торможения Y |
– |
1,0 2,0 |
3,3 0,95 |
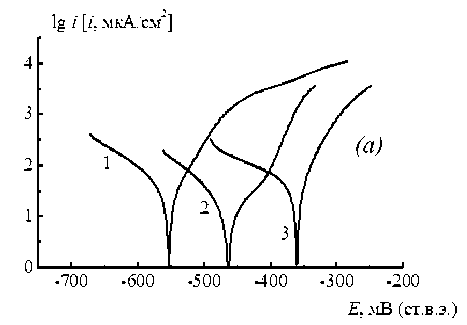
Рис. 1. Поляризационные кривые, полученные на стали Ст3 в модельном (а) и аммонизированном (б) растворах нитрата кальция без ингибитора (1) и с добавкой моноэтаноламина (2) и K 2 Cr 2 O 7 (3)
Анализ поляризационных кривых в модельном растворе (рис. 1а) показывает, что бестоковый потенциал коррозии при введении добавок смещается в положительную сторону, а ток анодного процесса при Е = const уменьшается. Эффекты облагораживания коррозионного потенциала и замедления перехода металла в раствор более ярко выражены с добав- кой бихромата калия, чем с моноэтанолами-ном. Влияние на катодный процесс обратное: скорость реакции восстановления на стали при введении ингибиторов в нитратную коррозионную среду не падает, а возрастает. Аммонизация нитратного раствора заметно изменяет электрохимическое поведение системы (рис. 1б). Так, бестоковый потенциал в аммонизированном растворе значительно более положительный, чем в модельном, и при введении добавок, напротив, разблагораживается.
Значения параметров уравнения Тафеля (табл. 2), найденных по линейным участкам E , lg i -кривых на стали в модельном нитратном электролите с разными добавками, свидетельствуют, что коррозия, видимо, протекает с водородной деполяризацией. Действительно, наклон линейного участка катодной полулогарифмической поляризационной кривой составляет (-120 мВ) (исключением является раствор с добавкой моноэтаноламина), что свидетельствует о замедленной стадии разряда
Таблица2
Параметры уравнения Тафеля E = a i + b i •lg i (мВ) для анодного ( aa и Ь а ) и катодного ( ак и Ьк ) парциальных процессов на стали Ст3 в РНК (числитель) и АРНК (знаменатель)
Скорость коррозионного процесса К , найденная из i корр по закону Фарадея, в модельном растворе нитрата кальция ниже, чем в аммонизированном (табл. 1), однако в обоих случаях сталь Ст3 по шкале коррозионной стойкости [7,8] следует отнести к пониженно стойким материалам.
Эффективность добавок в отношении коррозионного процесса оценивали по стандартным параметрам [4]: проницаемости П = 1,11 К ; степени ингибиторной защиты:
Z = K 1 K 2 . юо% _ i корр,1 i корр,2 . 100%
K 1 i корр,1
водорода с переносом одного электрона [4]. Добавление моноэтаноламина, а также аммонизация раствора нитрата кальция снижает кислотность среды (таблица 1), что, вероятно, способствует реализации иного механизма многостадийного катодного процесса, осложненного кислородной деполяризацией.
Аналогичный эффект наблюдается и в анодном поведении стального электрода: если в модельных растворах без ингибитора и с бихроматом калия наклон прямолинейной зависимости потенциала от логарифма анодного тока равен в среднем 40 мВ (табл. 2), что служит признаком электрохимической реакции растворения металла до двухзарядных ионов по двухстадийному механизму с замедленной стадией отщепления второго электрона [4], то введение моноэтаноламина и переход к аммонизированному раствору заметно затрудняют анодный процесс: наклон соответствующего участка Е, lg i- зависимости увеличивается до 60 - 121 мВ (табл. 2).
Y = K 1 _ i корр,1 К “ i , , 2 корр,2
где К 1 ( i корр,1 ) и K 2 ( i ко РР ,2 ) — скорость (плотность тока) саморастворения металла в среде без добавки и с добавкой, соответственно.
Эти параметры, найденные по пересечению линейных участков полулогарифмических поляризационных кривых, отвечающих проте канию парциальных процессов на стали в исследуемых средах, приведены в табл.1.
Введение добавки бихромата калия в модельный раствор заметно снижает скорость анодного растворения стали, однако существенно увеличивает скорость катодной реакции (рис. 1а). Как результат, несмотря на сдвиг коррозионного потенциала в положительную сторону, скорость коррозии практически не изменяется в сравнении с исходным нитратным раствором. В случае моноэтаноламина скорость анодной реакции снижается значительнее, чем катодной, а потому уменьшается и скорость коррозионного процесса в целом. В аммонизированном растворе нитрата кальция моноэтаноламин также снижает скорость анодного растворения стали, однако скорость катодной реакции увеличивается, несмотря на сдвиг коррозионного потенциала в положительную сторону, в результате скорость коррозии практически не изменяется по сравнению с модельным раствором. При применении бихромата калия в качестве ингибитора скорость коррозионного процесса стали Ст3 заметно снижается.
В соответствии со шкалой коррозионной стойкости [7,8] сталь Ст3 в базовом растворе нитрата кальция и с добавкой бихромата калия следует отнести к пониженно стойким материалам; органическая добавка моноэтаноламина к РНК позволяет перевести сталь Ст3 в группу стойких к коррозии материалов. В аммонизированном растворе Ca(NO3)2, как и с добавкой моноэтаноламина, сталь Ст3 можно считать стойким материалом, в то время как введение бихромата калия в АРНК позволяет отнести сталь Ст3 к весьма стойким к коррозии материалам.


