Костеобразование при использовании электромагнитного излучения высокой частоты в условиях гнойной инфекции (экспериментальное исследование)
Автор: Ерофеев С.А., Притыкин А.В., Городилов Р.В.
Журнал: Гений ортопедии @geniy-ortopedii
Статья в выпуске: 4, 2009 года.
Бесплатный доступ
Оценено влияние переменного электромагнитного поля высокой частоты генерируемого аппаратом «ОРЕОЛ-2» на процессы репаративной регенерации костной ткани в условиях гнойной инфекции. Экспериментальное исследование проводили на 96 кроликах, животные были разбиты на 4 группы по 24 кролика в каждой. У всех животных с соблюдением правил асептики создавали стандартный дефект костной ткани диафиза лучевой кости левой грудной конечности. Кроликам 3-й и 4-й групп в область дефекта вводили суспензии культур st. aureus. В опытных группах (2-й и 4-й) эксперимента на оперированную конечность проводилось воздействие аппаратом стимуляции репаративных процессов «Ореол-2». Результаты опыта оценивались по рентгенологическим и морфологическим данным. Из анализа данных исследования сделан вывод о положительном влиянии аппарата «Ореол-2» на процессы регенерации костной ткани, микроциркуляции и мобилизации резервных возможностей организма.
Кролики, золотистый стафилококк, рентгенология, гистология, регенерация, электромагнитное поле высокой частоты
Короткий адрес: https://sciup.org/142121252
IDR: 142121252 | УДК: 616.71-002.1:615.849.11:616.71-007.235
Текст научной статьи Костеобразование при использовании электромагнитного излучения высокой частоты в условиях гнойной инфекции (экспериментальное исследование)
Раневая инфекция является одним из наиболее распространенных факторов, обусловливающих осложненное течение и удлиняющих сроки лечения больных с открытой травмой [3]. Множество способов и приемов борьбы с раневой инфекцией, значительная частота гнойных осложнений стимулирует поиск новых методик воздействия на костную и мягкотканную раны, позволяющих не только профилактировать инфекционные осложнения или воздействовать на уже развившийся инфекционный процесс, но и в последующем влиять на регенерацию костной ткани. Наибольшую трудность для лечения представляют открытые переломы костей, при которых кроме наличия тяжелого повреждения мягких тканей имеются оскольчатые переломы диафизов костей, сопровождающиеся потерей костного вещества во время травмы или после хирургической обработки. Возникающие разного рода дефекты и неконгруэнтность костных отломков резко тормозят, а порой и останавливают процессы регенерации костной ткани, вызывая развитие несращений, ложных суставов, дефектов и рефрактур, частота которых достигает при консервативном лечении 70 %, а при оперативном – 58 % [13]. Повреждение мягких тканей при открытых переломах зачастую продолжает прогрессировать и в раннем посттравматическом периоде, что, с одной стороны, вызывает возникновение вторично открытых переломов и создает дополнительные возможности для инфицирования костной раны [14], а с другой стороны, тормозит процессы регенерации костной ткани в зоне перелома.
Из многообразия оперативных методов лечения переломов, осложненных гнойной инфекцией, признанным в настоящее время большинством травматологов является метод управляемого чре-скостного остеосинтеза по Илизарову [1, 12], однако проблема регенерации костной ткани и разработка вопросов оптимизирующего или даже стимулирующего воздействия на её процесс остаются актуальными [2, 5]. Об этом свидетельствуют многочисленные публикации, отражающие экспериментальные и клинические результаты применения в качестве стимулирующих факторов медикаментозных лекарственных средств, игло-рефлексотерапии, приемов активной иммунизации, биостимуляторов и механического воздействия на область перелома [9, 11]. Появились исследования, свидетельствующие о стимулирующем воздействии низкочастотного пульсирующего ультразвука, электрического и постоянного магнитного полей [4], а также переменного магнитного и электромагнитного полей при лечении диафизарных переломов и замещении пострезекционных дефектов [6, 10].
Однако все методы стимуляции репаративной регенерации костной ткани имеют большой недостаток, а именно невозможность применения метода стимуляции репаративных процессов в острый период развития инфекционного процесса.
Цель работы оценить влияние переменного электромагнитного поля высокой частоты, генерируемого аппаратом «ОРЕОЛ-2», на процессы репаративной регенерации костной ткани в условиях гнойной инфекции.
МАТЕРИАЛЫ И МЕТОДЫ
Для поставленной цели применялся разработанный аппарат стимуляции репаративных процессов (АРСП) «Ореол-2» [7] (заключение Комитета по новой медицинской техники МЗ РФ протокол № 6 от 27.06.2001 г.). Действие прибора достигается путем многократного воздействия на область перелома или костного дефекта электромагнитного поля, образованного синусоидальным сигналом с несущей частотой в диапазоне частот 300 кГц – 1 МГц амплитудно-модулированным низкочастотным сигналом в диапазоне частот 101000 Гц.
Экспериментальное исследование проводили на 96 здоровых беспородных половозрелых кроликах, подобранных по принципу аналогов: вес – 1,5-2,0 кг, возраст – 4-5 месяцев. Исследования выполнялись с соблюдением принципов гуманности, изложенных в директивах Европейского сообщества (86/609/ЕЕС) и Хельсинкской декларации.
Животные были разбиты на 4 группы по 24 кролика в каждой. У всех животных с соблюдением правил асептики создавали стандартный дефект костной ткани диафиза лучевой кости левой грудной конечности. Перед операцией животных выдерживали на 12-часовой голодной диете. После обездвиживания 2 % раствором рометара в дозе 0,2 мл/кг живой массы животных фиксировали в боковом положении на операционном столе Виноградова. По месту разреза проводили инфильтрационную анестезию 0,5 % раствором новокаина. Оперативный доступ к диафизу лучевой кости определяли с краниомедиальной стороны предплечья. Разрез кожи и фасции осуществляли между передним краем круглого пронатора и задним краем лучевого разгибателя запястья. Отпре-паровав лучевую кость создавали стандартный дефект длиной 5 мм с помощью разработанных «щипцов хирургических для создания дефекта на лучевой кости у животных в эксперименте» [8]. В область дефекта животным 3-й и 4-й групп вводили по 0,5 мл, полученные путем приготовления соответствующих разведений, используя стандарт мутности бактериальной взвеси по Мак-Фарленду, суспензии выделенных от больных культур st. aureus в концентрации 10–4 КОЕ/мл. Был использован комплект БАК-5 (паспорт СОГ №1-98 ООО «Ормет») с оптической плотностью, имитирующих бактериальную взвесь для st. aureus 5,5×10–9 КОЕ/мл. Полученные взвеси путем десятикратной раститровки доводили до 10–4 КОЕ/мл.
Оперированную рану зашивали, дренировали резиновым выпускником, накладывали асептическую повязку. Внешней иммобилизации конечности не проводилось. После операции кроликам второй (опытной) группы производилось воздействие прибором АСРП на оперированную конечность два раза в день в течение 15 суток, длительность процедуры составляла 30 минут (методика В.К. Носкова) [6]. Кроликам 4-й (опытной) группы курс процедур повторяли на 28-е сутки. У кроликов 1-ой и 3-й (контрольных) групп заживление дефекта происходило в естественных условиях.
С целью наблюдения за формированием костной мозоли в зоне дефекта лучевой кости всем животным проводилось рентгенологическое исследование с помощью стационарного рентгеновского аппарата «Рентген 30» на 1-е, 7-е, 14-е, 28-е, 50-е и 80-е сутки после операции.
Для гистологических исследований проводили отбор проб формирующейся костной мозоли. Животных выводили из опыта на 14-е, 28-е, 50-е и 80-е сутки после операции путем внутримышечного введения летальных доз 2 % раствора листе-нона. После декальцинации в 7 % растворе азотной кислоты и парафиновой заливки из кусочков костной ткани на микротоме были приготовлены срезы толщиной 10-12 микрон, которые затем окрашивали гематоксилином и эозином.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рентгенограммах у животных всех групп после операции отмечался дефект средней трети диафиза лучевой кости протяженностью 0,5 мм с ровным четким контуром краев фрагментов кости.
У животных 1-й группы первые признаки появления регенерации костной ткани были выявлены на 28-е сутки эксперимента. Отмечали замещение дефекта лучевой кости регенератом на 1/4 поперечника кости. Процесс репаративной реакции еще больше увеличивался к 50-м суткам и захватывал 4/5 поперечника кости. В области наружного кортикального слоя проксимального края костного дефекта отмечалась периостальная реакция. Локальная периостальная реакция на наружном контуре проксимального фрагмента лучевой кости сохраняла свои размеры и структуру, как при исследовании на 28-е сутки, и выглядела в виде полуовального образования однородной слабой интенсивности (рис. 1). На 80-е сутки исследования в области резекционного дефекта новообразованная костная ткань практически полностью заполняла дефект без дифференцировки на кортикальный слой и костномозговое пространство.
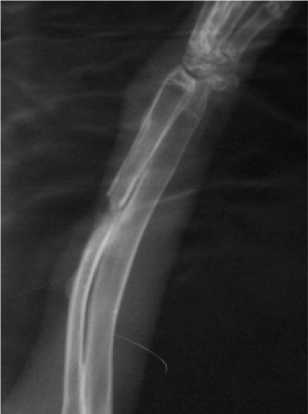
Рис. 1. Рентгенограмма предплечья кролика 1 -й группы на 50-е сутки после резекции лучевой кости
Во 2-й (опытной) группе первые признаки репаративной регенерации отмечали на 14-е сутки в виде костного мостика, перекидывающегося с одного края дефекта до другого, толщиной до 1/2 диаметра кости с наличием поперечной полосы просветления в формирующейся костной ткани. На 28-е сутки исследования костный дефект был полностью заполнен костной тканью. К 50-м суткам плотность костной мозоли по сравнению с исследованием на 28-е сутки увеличилась, произошла ассимиляция периостальных наслоений, формировалась корти- кальная пластинка диафиза кости (рис. 2). На 80-е сутки область создаваемого дефекта не прослеживалась, поля регенерата выступали за пределы кортикального слоя лучевой кости.
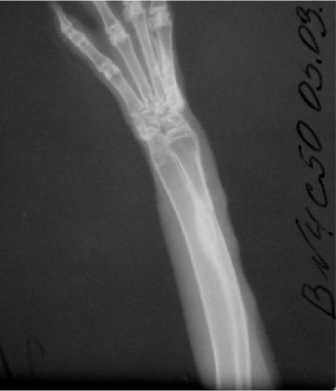
Рис. 2. Рентгенограмма предплечья кролика 2-й группы на 50-е сутки после резекции лучевой кости
У животных 3-й (контрольной) группы вследствие выраженного воспалительного процесса в области послеоперационной раны первые признаки костной регенерации появились на 50-е сутки. На 80-е сутки отмечали формирование ложного сустава с закруглением краев и наличием тонкой замыкательной пластинки по контуру краев дефекта (рис. 3).
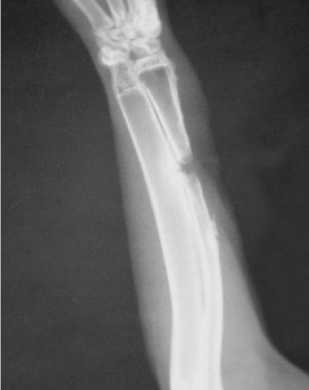
Рис. 3. Рентгенограмма предплечья кролика 3 -й группы на 80-е сутки после резекции лучевой кости
На рентгенограммах в 4-й (опытной) группе на 28-е сутки исследования в области костного дефекта отмечали широкую полосу новообразованной костной ткани толщиной в половину поперечника кости с наличием со стороны внутреннего кортикального слоя периостальных наслоений. К 50-м суткам костный дефект за- полнялся тенями новообразованной костной ткани до 3/4 поперечника кости. На 80-е сутки исследования костный дефект был полностью заполнен костным регенератом с выраженной репаративной периостальной реакцией (рис. 4).
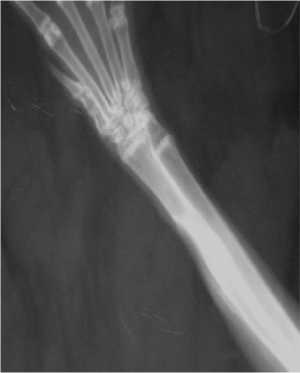
Рис. 4. Рентгенограмма предплечья кролика 4-й группы на 80-е сутки после резекции лучевой кости
При гистологическом исследовании дефекта лучевой кости кроликов 1-й группы к 14-м суткам эксперимента между проксимальным и дистальным краями дефекта обнаруживали участки грануляционной ткани. На 28-е сутки в дефекте определялись формирующиеся костные трабекулы, окруженные пролиферирующими остеобластами (рис. 5). Периостальная костная мозоль характеризовалась выраженной пролиферацией хондроцитов с участками формирования костных балок. К 50-м суткам эксперимента дефект замещался костной тканью компактного и губчатого строения, в которой обнаруживалось нарушение гистиоархи-тектоники базофильных линий склеивания. Такие изменения отражают процессы ремодулирования костной ткани и свидетельствуют об адаптации костного органа к функциональным линиям силовой нагрузки. На 80-е сутки зона дефекта замещалась полноценной костью с присущей ей микроскопической картиной строения.
Во 2-й группе на 14-е сутки в дефекте на фоне сформировавшейся грануляционной ткани с обилием сосудов (рис. 6) обращало внимание образование как эндостальной, так и периостальной костной мозоли, состоящей из остеобластов, расположенных на поверхности формирующихся костных трабекул непрерывным слоем или с формированием скоплений («остеобластические пролифе-раты»). В дефекте местами прослеживались участки оссификации хрящевой ткани. К 28-м суткам обнаруживалась компактная кость, состоящая из пластинчатой костной ткани. Остеоны были отграничены друг от друга базофильными линиями склеивания, построенными из аморфного основного вещества. Отмечалось увеличение числа базофильных линий. Среди участков компактной кости обнаруживались фокусы грубоволокнистой соединительной ткани с признаками остеобласти-ческой реакции в виде активного костеобразования. К 50-м суткам завершалось моделирование губчатой костной ткани. В новообразованной губчатой и компактной кости из области дефекта базофильные линии располагались упорядоченно, с одинаковыми промежутками между ними, что отражает направленность и силу механических нагрузок (рис. 7). Аналогичная картина в области дефекта обнаруживалась и к 80-м суткам эксперимента.
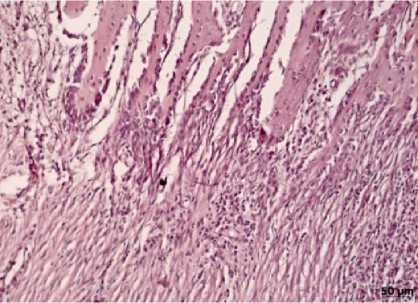
Рис. 5. Врастание костных балок в грануляционную ткань в области дефекта трубчатой кости. 28-е сутки эксперимента (1-я группа). Окраска гематоксилином и эозином, ув. х200
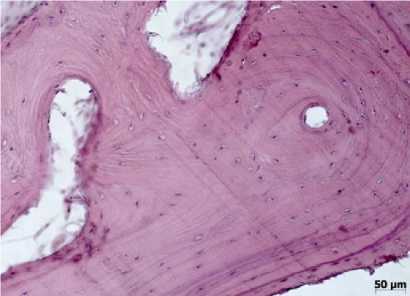
Рис. 7. Сформировавшаяся губчатая костная ткань с характерным для нее распределением базофильных линий. 50-е сутки эксперимента (2-я группа). Окраска гематоксилином и эозином, ув. х200
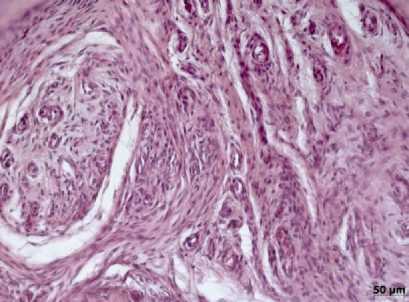
Рис. 6. Грануляционная ткань. Обилие сосудов артериолярного типа. 14-е сутки эксперимента (2-я группа).
Окраска гематоксилином и эозином, ув. х200
У животных 3-й группы на 14-е сутки наблюдения в срезах из области дефекта кости обнаруживались признаки гнойно-гранулирующего воспаления. По периферии очагов грануляционной ткани с признаками гнойного воспаления отмечалось разрастание соединительной ткани. На 28-е сутки у торцов костных отломков определялись новообразованные трабекулы губчатой костной ткани. Обращало внимание наличие в межтрабекулярных пространствах нейтрофильных лейкоцитов и макрофагов. В отдельных участках костная мозоль подвергалась некрозу. К 50-м суткам на фоне воспалительных изменений в костнохрящевой мозоли выявлялись очаговые лимфоги-стиоцитарные воспалительные инфильтраты. На 80-е сутки эксперимента восстановления целостности кости не происходило. Проксимальные и дистальные отломки кости были окружены гиалиновым хрящом (рис. 8). Между ними располагалась грубоволокнистая соединительная ткань с наличием мелкоочаговых скоплений нейтрофильных лейкоцитов.
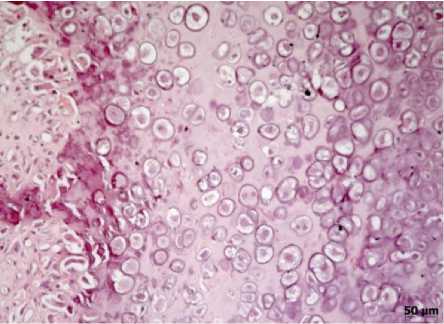
Рис. 8. Пролиферирующий гиалиновый хрящ в области формирования ложного сустава. 80-е сутки эксперимента (3-я группа). Окраска гематоксилином и эозином, х200
В 4-й группе к 14-м суткам между отломками обнаруживалась богатая сосудами грануляционная ткань. Среди пролиферирующих сосудов капиллярного типа отмечались очаги скопления нейтрофильных лейкоцитов. К 28-м суткам гнойный процесс в грануляционной ткани носил очаговый характер, увеличивалось количество фибробластов, продуцирующих коллагеновые волокна (рис. 9). Здесь же среди полей фиброза обнаруживались очаги оссификации. Со стороны эндоста и периоста выявлялись поля хрящевой ткани, в которой формировались костные балки примитивного строения. На 50-е сутки в грануляционной ткани исчезали нейтрофильные лейкоциты, обращали внимание редукция микроциркуляторного русла и доминирование процессов организации. Формировались участки десмопластического и энходраль-ного костеобразования. На 80-е сутки дефект замещался костной тканью губчатого строения с явлениями нарушенной гистиоархитектоники и дистрофическими изменениями в остеоцитах. Разнонаправленное расположение базофильных линий склеивания отражает нарушение репаративного процесса (рис. 10).
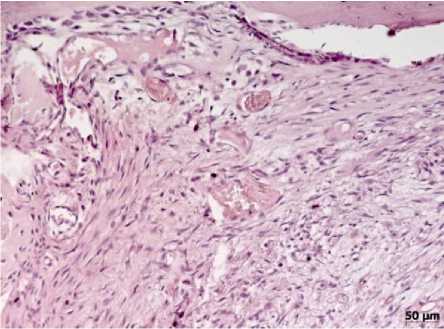
Рис. 9. Процессы организации грануляционной ткани с наличием скудных мононуклеарных воспалительных инфильтратов. 28-е сутки эксперимента (4-я группа). Окраска гематоксилином и эозином, х200
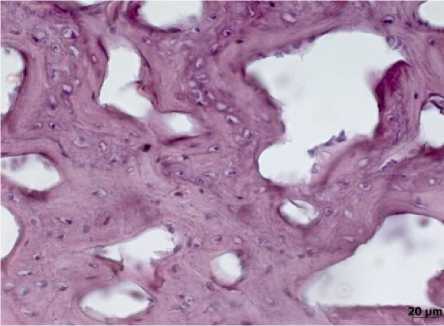
Рис. 10. Сформировавшаяся губчатая костная ткань с явлениями нарушения гистиоархитектоники базофильных линий склеивания. 80-е сутки эксперимента (4-я группа). Окраска гематоксилином и эозином, х400
При сравнительном анализе репаративной реакции кости между первыми двумя группами обращает на себя внимание более интенсивное костеобразование в опытной группе с выраженной периостальной реакцией с полным замещением дефекта костной тканью к 50-м суткам эксперимента. В контрольной группе сращение наступало на 80-е сутки. Морфологически в опытной группе выявлена типичная картина репарации костного дефекта, которая характеризовалась ранним созреванием костной мозоли и быстрой консолидацией процесса, уже к 28-м суткам дефект заполнялся костной тканью, что, возможно, связано с проводимым курсом электромагнитного излучения.
В 3-й и 4-й группах отмечено нарушение сроков репарации кости, что вызвано в первую очередь формированием у них в эксперименте гнойного процесса. Начало костеобразования в опытной группе отмечается на 28-е сутки, а в контрольной на 50-е сутки и завершается формированием ложного сустава. В 4-й группе процесс завершается на 80-е сутки полным сращением с замещением дефекта пластинчатой костью. Морфологически отмечалось сохранение нейтрофильной инфильтрации до 50-х суток в контрольной группе и до 28-х суток в опытной группе. Вероятно, с этим связаны осложнения в костно-хрящевой мозоли вплоть до некроза, которые мы обнаруживали в эксперименте, а также удлинение сроков репарации. На фоне проведения лечения при осложненном течении репаративного процесса доминировала соединительнотканная костная мозоль, а не костнохрящевая, как в других исследованных группах.
Таким образом, анализ полученных экспериментальных данных доказал, что электромагнитное поле высокой частоты положительно влияет на процессы регенерации костной ткани, микроциркуляции и мобилизации резервных возможностей организма, в том числе в условиях острой гнойной инфекции.


