Краниопластика с применением аутотрансплантата и костнопластического материала: клинический пример
Автор: Офицеров А.А., Боровкова Н.В., Талыпов А.Э., Макаров М.С., Титова Г.П., Кудряшова Н.Е., Лещинская О.В., Муслимов Р.Ш., Пономарев И.Н.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 3 т.13, 2023 года.
Бесплатный доступ
Проведено клиническое исследование эффективности отсроченной краниопластики аутологичным костным лоскутом с использованием аллогенного костнопластического материала. Аутотрансплантат консервировали, насыщали коллагеном человека 1-го типа, лиофилизировали и стерилизовали. Костнопластический материал использовался для заполнения диастазов. Пациент проходил наблюдение в послеоперационном периоде в течение 24-х месяцев. Не было зарегистрировано клинических осложнений. Рентгенологический и радиоизотопный анализ показал нормальную фиксацию аутотрансплантата через 6, 12 и 24 месяца. Анализ биоптата через 12 месяцев показал наличие регенеративных процессов при отсутствии воспаления. Клинический результат был оценен как успешный.
Краниопластика, аутотрансплантат, костно-пластический материал, компьютерная томография, сцинтиграфия
Короткий адрес: https://sciup.org/143180364
IDR: 143180364 | УДК: 616.714/.715-089.843/.844-77 | DOI: 10.20340/vmi-rvz.2023.3.CLIN7
Текст научной статьи Краниопластика с применением аутотрансплантата и костнопластического материала: клинический пример
Одной из основных причин неблагоприятных исходов у пострадавших с тяжёлой черепно-мозговой травмой (ЧМТ) и нетравматическими внутричерепными гематомами является дислокационный синдром, представляющий собой смещение больших полушарий мозга или полушарий мозжечка в горизонтальном и/или аксиальном направлениях, сопровождающееся быстро нарастающей компрессией ствола мозга [1]. Методом хирургического лечения дислокационного синдрома и внутричерепной гипертензии является проведение декомпрессивной трепанации черепа (ДТЧ), основной целью которой является увеличение внутричерепного объёма, благодаря чему снижается внутричерепное давление (ВЧД) и уменьшается компрессия ствола мозга. В ряде случаев у пациентов с внутричерепной гематомой, тяжёлой внутричерепной гипертензией и другими заболеваниями, сопровождающимися отёком мозга, после трепанации черепа провести краниопластику в рамках одной операции не представляется возможным [2, 3]. Пластику послеоперационного дефекта свода черепа проводят отсрочено с использованием титановой пластины, синтетических имплантов или криоконсервиро-ванного аутологичного костного фрагмента свода черепа [4]. При этом предпочтение отдают металлическим и синтетическим имплантам, несмотря на их негативные эффекты. Одной из причин этого является высокая частота осложнений, развивающихся после краниопластики аутологичным криоконсервированным лоскутом. Так, по данным разных авторов, преждевременный лизис аутотрансплантата развивается в 24–40 % случаев [5, 6]. Также после криоконсервации уменьшаются остеокондуктивные и остеоиндуктивные свойства костной ткани, что способствует замедлению процессов восстановления структурной целостности костей свода черепа. Таким образом, актуальной задачей является разработка не только способа сохранения аутологичного костного фрагмента для отсроченной краниопластики, но и увеличение его остеокондук-тивных и остеоиндуктивных свойств.
Известно, что потенцировать указанные биологические свойства можно путём дополнительного насыщения трансплантата костной ткани коллагеном и/или факторами роста. Одновременно с краниопластикой диастаз между краем дефекта и аутологичным трансплантатом целесообразно заполнить костно-пластическим материалом, который, помимо стабилизации костного фрагмента, позволит обеспечить миграцию в него клеток. В свою очередь демонстрация безопасности использования для краниопластики аутотрансплантата, дополнительно насыщенного коллагеном, в сочетании с костнопластическим материалом и аутологичной богатой тромбоцитами плазмой даст стимул к дальнейшим исследованиям по повышению эффективности лечения с их применением.
Цель исследования – на клиническом примере продемонстрировать безопасность и эффективность краниопластики с использованием аутотрансплантата, дополнительно насыщенного коллагеном, в сочетании с костнопластическим материалом и аутологичной богатой тромбоцитами плазмой.
Материалы и методы
Работа проводилась в рамках исследования эффективности краниопластики аутологичным трансплантатом в ГБУЗ НИИ скорой помощи им. Н.В. Склифосовского ДЗМ при проведении ограниченных клинических испытаний в соответствии с НИР института на основании информированного добровольного согласия пациента и одобрения локального комитета по биомедицинской этике (выписка из протокола № 3–19 от 19.08.2019 года).
Пациент Д., мужчина, 61 год, в мае 2020 года впервые поступил в 1-е нейрохирургическое отделение НИИ СП им. Н.В. Склифосовского с диагнозом «Открытая черепно-мозговая травма». У пациента по данным компьютерной томографии (КТ) был диагностирован ушиб головного мозга тяжёлой степени, острая внутримозговая гематома правой височно-затылочной области (объём 30 см3), субдуральная гематома правой лобно-височной области, внутрижелудочковое кровоизлияние (рис. 1, А).
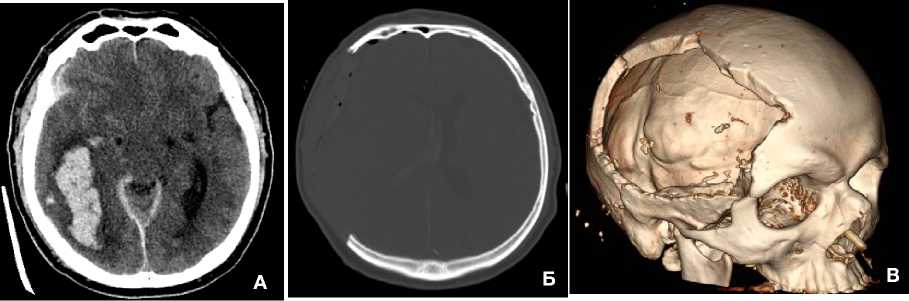
Рисунок 1. Компьютерная томограмма головы: А – травматическая внутримозговая гематома правой височно-затылочной области; Б – состояние после декомпрессивной трепанации черепа, удаление внутримозговой и субдуральной гематомы; В – трёхмерная реконструкция черепа. Визуализируется обширный дефект черепа укрытый кожно-мышечным лоскутом
Figure 1. Computed tomogram of the head: A – traumatic intracerebral hematoma of the right temporo-occipital region; B – condition after decompressive cranial trepanation, removal of intracerebral and subdural hematoma; C – three-dimensional reconstruction of the skull. An extensive skull defect covered by a musculocutaneous flap is visualized
В экстренном порядке выполнена декомпрессивная трепанация черепа в правой лобно-височно-теменнозатылочной области с иссечением фрагмента свода черепа площадью 110 см2 (рис. 1, Б и В). Эвакуированы внутримозговая и субдуральные гематомы (с помощью видеоэн-доскопической ассистенции и УЗИ-навигации), проведена тривентрикулостомия.
В связи с клинической ситуацией трепанационный дефект укрыт кожно-мышечным лоскутом. Эксплантирован-ный костный фрагмент свода черепа герметично упакован последовательно в два стерильных специализированных полиэтиленовых пакета и направлен на карантинизацию до решения вопроса об отсроченной краниопластике аутологичным трансплантатом.
Послеоперационный период протекал без особенностей. За время госпитализации у пациента получено добровольное информированное согласие (предварительное) на использование аутологичного фрагмента костей свода черепа, аллогенного костнопластического материала и аутологичной богатой тромбоцитами плазмы при отсроченной краниопластике. Через 21 день после операции пациент выписан из стационара в удовлетворительном состоянии без неврологического дефицита.
Подготовка аутотрансплантата. Костный фрагмент свода черепа доставлен в специализированное отделение консервирования тканей и производства трансплантатов института, где был зарегистрирован, заморожен до -40 °C и помещён на карантин до получения результатов анализов на гемотрансмиссивные инфекции. После подтверждения инфекционной безопасности костный лоскут помещён в криохранилище. В рамках подготовки для клинического применения в трансплантате сформировали отверстия диаметром 2 мм с плотностью 5-7 отверстий на 6 см в шахматном порядке. Затем его депротеинизировали 3 % раствором перекиси водорода, обезжирили в смеси 95 % спирта и диэтилового эфира (соотношение
1:1), пассивно высушили. Для повышения биокондуктив-ных свойств костный лоскут дополнительно насытили 0,6-0,8 % аллогенным раствором коллагена 1 -го типа человека [2], полученным методом кислотной экстракции из сухожилий. Затем фрагмент свода черепа, насыщенный коллагеном, заморозили до -40 °C и лиофилизировали в камере с разрежённой атмосферой. Готовый аутологичный краниотрансплантат (рис. 2, А) стерилизован ионизирующим излучением 2,5 кГр.
Изготовление костно-пластического материала (КПМ). В 100 мл 0,6-0,8 % раствора коллагена 1 -го типа человека внесли 6 грамм аллогенной костной крошки (размером 600-630 мкм). Затем компоненты перемешали до гомогенного состояния. Смесь равномерно распределили в чашке Петри размером 10x10 см, заморозили, азатем лиофилизировали в камере с разрежённой атмосферой. Готовый костнопластический материал (рис. 2, Б) стерилизован ионизирующим излучением 2,5 кГр [7].
Получение аутологичной богатой тромбоцитами плазмы. У пациента непосредственно перед краниопластикой из локтевой вены с сохранением стерильности забрали 40 мл венозной крови в вакуумные пробирки с антикоагулянтом ЭДТА. Затем кровь разделили на компоненты центрифугированием с ускорением 300 g в течение 5 минут. Фракцию плазмы с тромбоцитами, сохраняя её стерильность, перенесли в новые центрифужные пробирки (тип Falcon). Для концентрации тромбоцитов пробирки Falcon центрифугировали ещё раз с ускорением 700 g в течение 17 минут, получали осадок тромбоцитов и супернатант в виде бедной тромбоцитами плазмы. Из пробирки удаляли 3/4 объёма бедной тромбоцитами плазмы, в оставшемся объёме ресуспендировали осадок тромбоцитов [8]. В результате из 40 мл крови получали 4 мл богатой тромбоцитами плазмы с концентрацией клеток 1020x109/л.
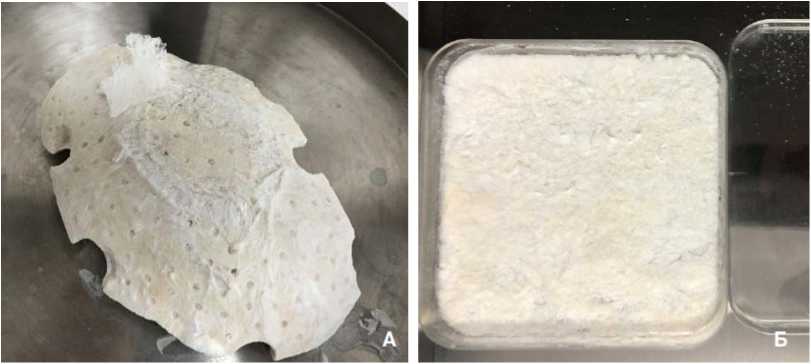
Рисунок 2. Подготовка аутотрансплантата и костнопластического материала для операции: А - аутологичный костный лоскут свода черепа после насыщения коллагеном 1 -го типа и лиофилизации; Б - костнопластический материал после лиофилизации
Figure 2. Preparation of autograft and osteoplastic material for the operation: A - autologous bone flap of the cranial roof after saturation with type 1 collagen aid lyophilization; В - osteoplastic material after lyophilization
Оценку состояния аутотрансплантата после краниопластики проводили в динамике методом трёхфазной сцинтиграфии черепа с 99mТс-пирфотехом (в/в 590 МБк; л/н 3,3 мЗв) с однофотонной эмиссионной компьютерной томографией, совмещённой с компьютерной томографией (ОФЭКТ/КТ). Накопление остеотропного радиофармпрепарата (РФП) 99mТс-пирфотех в кристаллах гидроксиапатита и незрелом коллагене только при наличии кровоснабжения костной ткани, а любые костные повреждения, сопровождающиеся повышенным метаболизмом и репарацией, регистрируются в виде участков повышенного включения РФП. Для зон костной резорбции и остеолизиса характерны дефекты накопления РФП.
Клиническое наблюдение
Через 5 месяцем после ДТЧ (ноябрь 2020 года) в связи с наличием гигантского посттрепанационного дефекта пациент госпитализирован в плановом порядке для проведения аутокраниопластики.
При визуальном осмотре был выявлен посттрепанационный дефект в правой лобно-височно-теменнозатылочной области. Кожный лоскут западает, передаёт пульсацию мозга. Послеоперационный рубец состоятельный, без признаков воспаления. Неврологический статус: сознание ясное, в пространстве, времени и собственной личности ориентирован. Шкала комы Глазго (ШКГ) 15 баллов. Менингеальных симптомов нет. Симметрия зрачков: D = S. Диаметр зрачка 3 мм. Фотореакция живые. Поля зрения не изменены. Речь не нарушена. Лицо симметричное. Сухожильные рефлексы: D = S. Парезов мышц нет. Чувствительность не нарушена. Функции тазовых органов не нарушены.
При КТ головного мозга до краниопластики: трепанационный дефект 15x12 см справа в височно-лобно-теменной области, прикрытый кожно-мышечным лоскутом, руб- цово-кистозные изменения в височной и затылочной долях справа. Пролабирование вещества мозга не выявлено, срединные структуры не смещены (рис. 3).
Исходя из добровольного информированного согласие на закрытие дефекта аутотрансплантатом в сочетании с костнопластическим материалом и аутологичной богатой тромбоцитами плазмой принято решение о проведении операции с их использованием и титановыми минипластинами и винтами.
Операция. Под эндотрахеальным наркозом выполнен доступ к дефекту костей свода черепа. Мозг не выступает (рис. 4, А). Края костного дефекта обработаны бором до появления «кровяной росы». В дефект уложен костный аутотрансплантат (рис. 4, Б), а в диастаз между аутотрансплантатом и ложем помещён КПМ в объёме 40 см3. Краниотрансплантат фиксирован по периметру к костям черепа с помощью 6-ти титановых мини-пластин, 30-ти микровинтов, а КПМ насыщен аутологичной богатой тромбоцитами плазмой (4 мл). Проведён тщательный гемостаз. Рана ушита послойно.
Стоит отметить, что из-за дополнительного скусыва-ния костной ткани кусачками Люэра уже после выпиливания фрагмента свода черепа краниотомом (при первой операции), изготовленный из него аутотрансплантат был несколько меньше самого дефекта. В связи с этим для замещения дефицита костной ткани в височной области и по периметру костного дефекта применили КПМ, который заполнил все костные пустоты.
Послеоперационный период. Первые сутки после операции пациент находился под наблюдением врача-анестезиолога реаниматолога , неврологический статус пациента не нарушался. На вторые сутки переведён в нейрохирургическое отделение. Пациенту проведена комплексная медикаментозная терапия (антибактериальная, обезболивающая гастропротективная, противоотечная), физиотерапевтическое лечение и курс сеансов гипербарической оксигенации с положительным результатом.
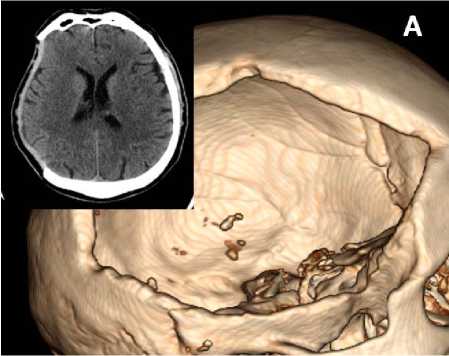
Рисунок 3. Компьютерная томограмма головы (аксиальные срезы и трёхмерные реконструкции): А – перед краниопластикой; Б – после краниопластики
Figure 3. Computer tomogram of the head (axial slices and three-dimensional reconstructions): A – before cranioplasty; B – after cranioplasty
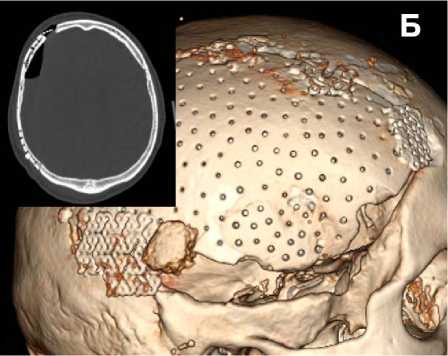
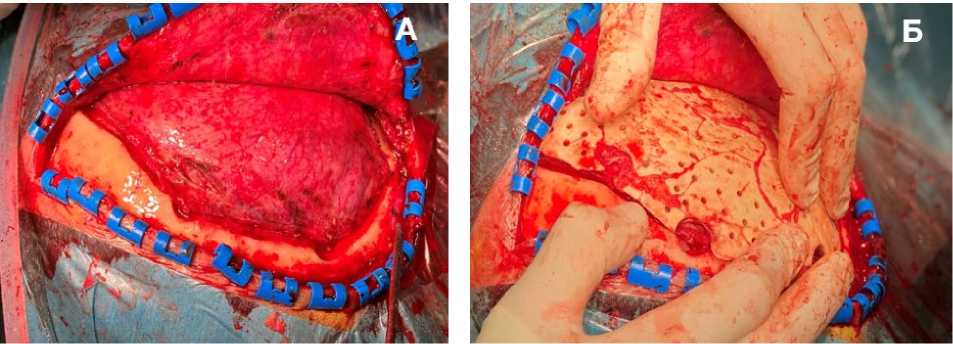
Рисунок 4. Интраоперационные фотографии: А – дефект свода черепа; Б – фиксация аутологичного костного лоскута в области дефекта
Figure 4. Intraoperative photos: A – defect of the cranial vault; B – fixation of the autologous bone flap in the area of the defect
На 7-е сутки после краниопластики форма головы в области правой лобно-височно-теменно-затылочной области соответствует аналогичной области на противоположной стороне, швы зажили первичным натяжением, кожа в зоне послеоперационной без признаков воспаления. При пальпации аутотрансплантат стабилен, без крепитации. Пациент в удовлетворительном состоянии выписан на 7-е сутки после операции (9-е сутки госпитализации).
В мае 2021 года пациент начал отмечать западение мягких тканей в правой лобно-височной области. В связи с этим в ноябре 2021 года (через 1 год после краниопластики) было принято решение о проведении операции по реконструкции дефекта черепа титановой пластиной. При осмотре в правой лобно-височной области мягкие ткани западают. При пальпации области ранее проведённой краниопластики аутотрансплантат стабилен. В связи с наличием дефекта в лобновисочной области принято решение в проведении операции по реконструкции титановой пластиной.
Операция. Под эндотрахеальным наркозом острым и тупым способами выполнен доступ и визуализирован костный дефект в лобно-височной области размерами 4x6 см. Края дефекта скелетированы. Затем он укрыт титановой пластиной, которая зафиксирована 6-ю микровинтами. Выделена и подшита к апоневрозу височная мышца. Проведён тщательный гемостаз. Рана ушита послойно.
Биопсия аутотрансплантата. Биопсийный материал фиксировали в 10 % растворе нейтрального формалина, затем по стандартной методике изготавливали гистологические препараты, окрашенные гематоксилином-эозином [9]. В проходящем свете оценивали общую топографию трансплантата и костнопластического материала, наличие клеток и сосудов. Дополнительно оценивали уровень автофлуоресценции коллагеновых волокон в составе трансплантата. Автофлуоресценция позволяет оценить плотность коллагеновых волокон, их топографию, наличие дефектов. В работе использовали конфокальный микроскоп «Nikon Eclipse 80i», совмещённый с флуоресцентной лампой «Nikon Intesilight
C-HGFi» (Nikon Corporation, Япония). Для оценки автофлуоресценции коллагена в гистологических препаратах использовали зеленый светофильтр (А возбуждения - 510-560 нм, λ эмиссии – от 575 нм, время экспозиции – 1 с).
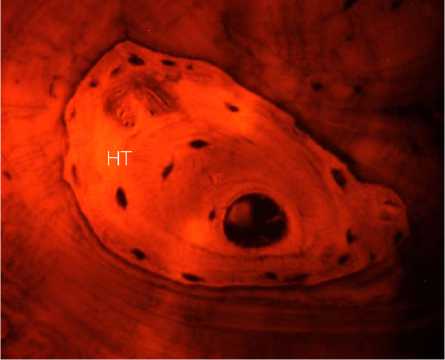
В связи с наличием прямого доступа к аутотрансплантату с целью исследования его микроструктуры при операции из краевых его отделов взята биопсия. При гистологическом анализе биопсийного материала следует, что через 12 месяцев после имплантации общая топография костной ткани в составе аутотрансплантата значимо не отличалась от здоровой ткани. Просветы костномозговых каналов выполнены рыхлой соединительной тканью с активно пролиферирующими фибробластами (рис. 5, А), новообразованными капиллярами разной степени полнокровия (рис. 5, Б) при отсутствии воспаления. Стоит особо отметить, что уровень автофлуоресценции коллагена в зоне костного лоскута был в 2,1–2,3 раза ниже по сравнению с аналогичными значениями в здоровой кости. Анализ автофлуоресценции показал, что коллагеновые волокна краниотрансплантата имели более диффузный вид, что указывает на их декомпактизацию и нарушение исходной топографии. С другой стороны, волокна с резко увеличенной яркостью (признак химической деградации коллагена) выявлялись только в зоне врастания сосудов в аутотрансплантат. Таким образом, в зоне костного лоскута отмечено снижение плотности коллагеновых волокон на фоне сохранения общей структуры трансплантата. Необходимо отметить гистологически в краевых отделах костных балок наличие узких прослоек новообразованной костной ткани с хорошо различимыми остеоцитами (рис. 5, В). В зоне контакта костного лоскута с остальной частью кости черепа происходит формирование васкуляризированной зрелой малоклеточной соединительной ткани с микроструктурами костных фрагментов в ней, что подтверждает замещение костнопластического материала (рис. 5, Г). Таким образом, через 12 месяцев после операции продолжаются процессы ремоделирования костной ткани в области дефекта.
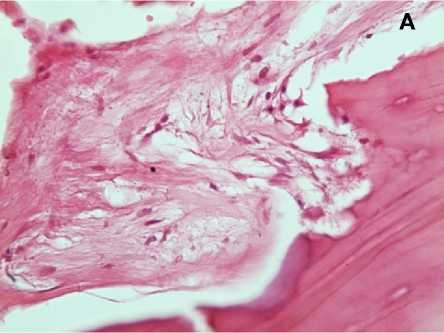
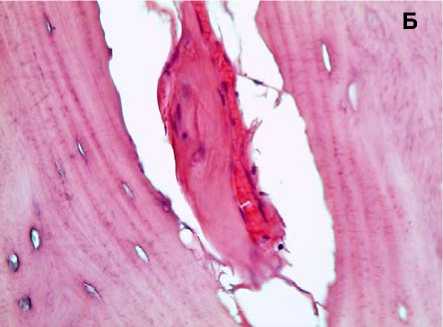
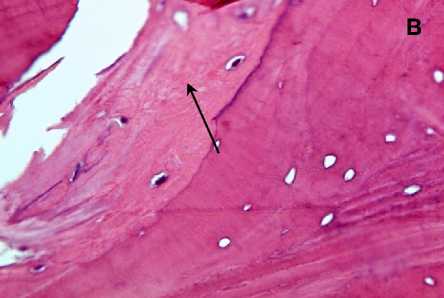
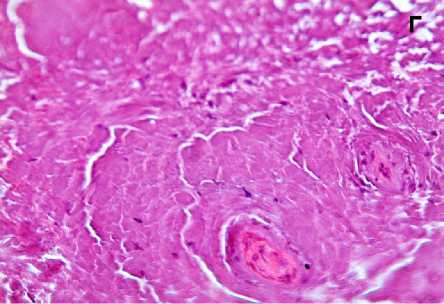
Рисунок 5. Гистологическая картина аутологичного краниотрансплантата через 12 месяцев после операции: в просвете костномозгового канала рыхлая соединительная ткань с фибробластами (А), полнокровные капилляры (Б), в крае трабекулы новообразованная костная ткань с различными остеоцитами (В стрелка), замещение зрелой соединительной тканью костнопластического материала (Г). Окраска гематоксилином и эозином. Увеличение х 400
Figure 5. Histological picture of autologous craniotransplant 12 months after the operation: in the lumen of the medullary canal loose connective tissue with fibroblasts (А), full blood capillaries (B), in the trabecula edge newly formed bone tissue with various osteocytes (C arrow), replacement of the mature connective tissue by bone-plastic material (D). Hematoxylin and eosin staining. Magnification x 400
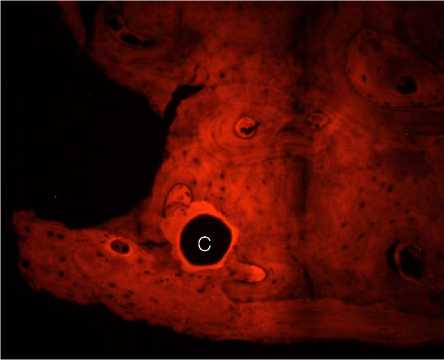
Рисунок 6. Автофлуоресценция коллагена в составе аутологичного краниотрансплантата через 12 месяцев после операции. Слева – увеличение x ioo, справа - увеличение x 2oo. Условные обозначения: С - сосуд, НТ - новообразованная костная ткань
Figure 6. Autofluorescence of collagen in autologous craniotransplant 12 months after surgery. On the left, magnification x ioo; on the right, magnification x 200. Legend: C - vessel, NT - newly formed bone tissue
Послеоперационный период протекал без особенностей. Пациент выписан из стационара на 7-е сутки.
Через 1 года и 9 месяцев после первой краниопластики (август 2022 года) при осмотре форма головы в области правой лобно-височно-теменно-затылочной соответствовала аналогичной области на противоположной стороне. При пальпации аутотрансплантат был стабилен, без крепитации.
Динамика состояние краниотрансплантата по данным аппаратных методов исследования. Через 1 год и 3 месяца после трепанации, 9 месяцев после краниопластики (август 2021 года), пациенту впервые выполнили трёхфазную (сосудистая, тканевая и костная фазы) сцинтиграфию черепа с 99mТс-пирфотехом (в/в 590 МБк; л/н 3,3 мЗв) и ОФЭКТ/КТ для оценки состояния трансплантата.
По данным сцинтиграфии костный аутотрансплантат правой лобно-теменно-височной области был жизнеспособен, кровоток сохранялся и усиливался в тканевой и кост- ной фазах (преимущественно по периметру костного лоскута) с превышением накопления по сравнению с интактной костной тканью на 17 % и 50 % соответственно (рис. 7).
Через 2 года пациенту при контрольном посещении была повторно выполнена трёхфазная сцинтиграфия с 99mТс-пирфотехом, дополненная гибридным исследованием ОФЭКТ/КТ. Было отмечено относительно симметричное накопление и распределение радиоиндикатора в костях черепа, за исключением очагового превышения включения в теменно-височной области на 20 % (преимущественно по краю костного лоскута в теменной области). По данным сцинтиграфии костный трансплантат правой лобно-теменно-височной области сохранял жизнеспособность. По сравнению с предыдущим исследованием (через 1 год после операции) наблюдалось более равномерное распределение радиоиндикатора, что свидетельствовало о положительной динамике (рис. 8).
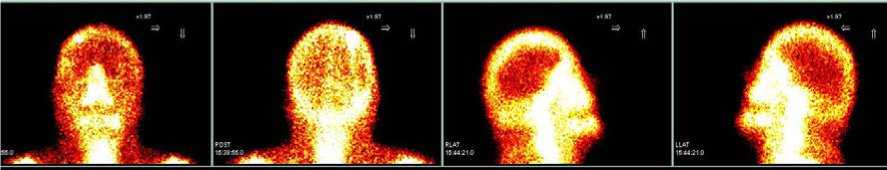
а б в г
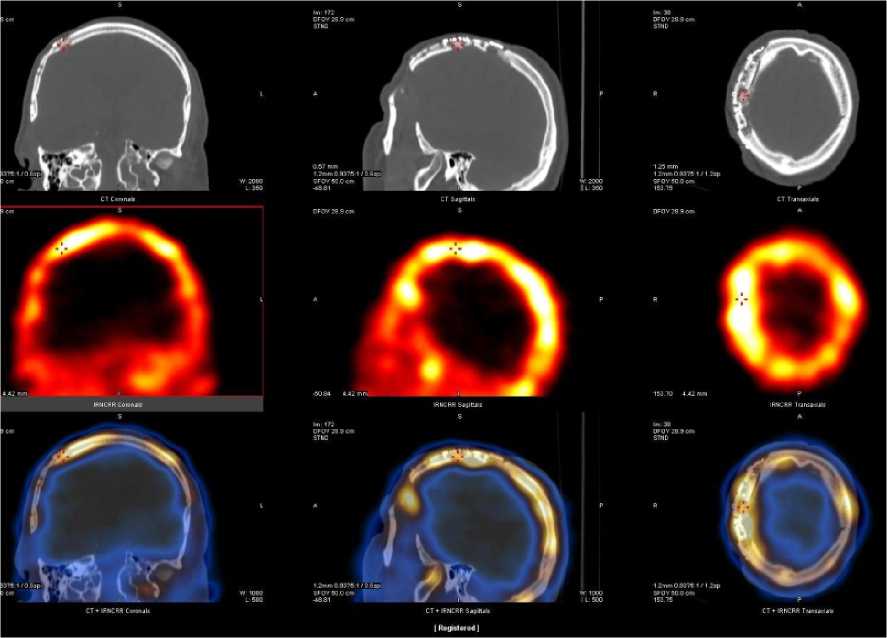
Рисунок 7. Сцинтиграфия (а – передняя, б – задняя, в – правая боковая, г – левая боковая проекции) и ОФЭКТ/КТ через 1 год после краниопластики: регистрируется накопление 99mТс-пирфотеха в проекции костного аутотрансплантата, свидетельствующее о его жизнеспособности, с превышением включения в теменно-височной области на 50 % по сравнению с контрлатеральной зоной в костной фазе Figure 7. Scintigraphy (a – anterior, b – posterior, c – right lateral, d – left lateral projections) and SPECT/CT 1 year after cranioplasty: 99mTc-pirfotech accumulation is recorded in the projection of the bone autograft, indicating its viability, with an excess inclusion in the parieto- temporal area by 50% compared to the contralateral zone in the bone phase

а б
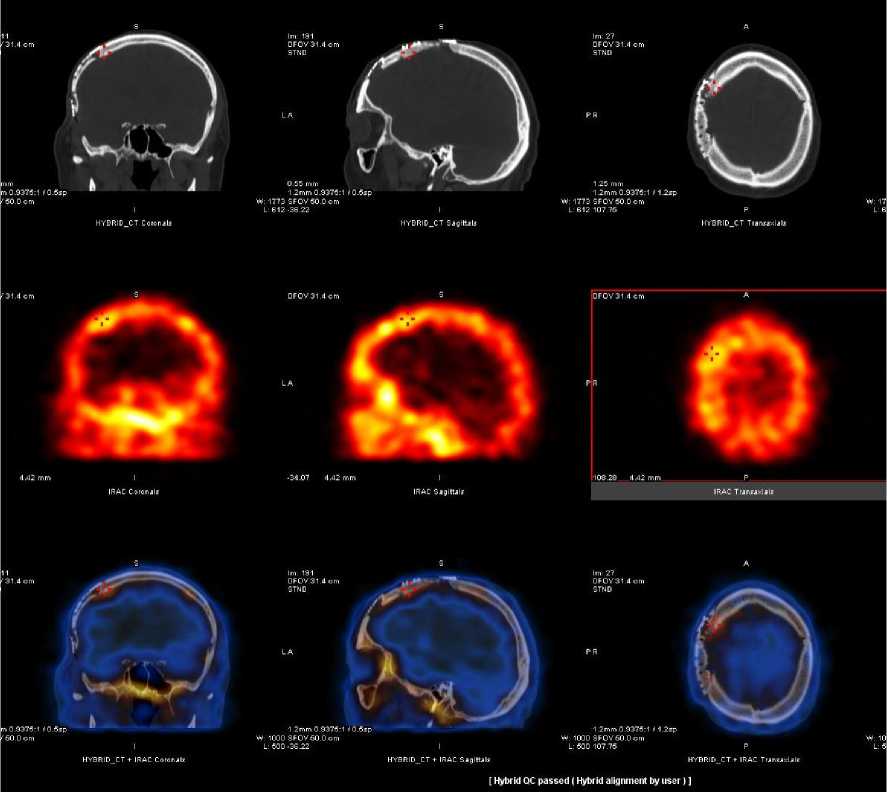
Рисунок 8. Сцинтиграфия (а – передняя, б – задняя проекции) и ОФЭКТ/КТ через 2 года после краниопластики: регистрируется накопление 99mТс-пирфотеха в проекции костного аллотрансплантата, свидетельствующее о его жизнеспособности, с превышением включения в височно-теменной области на 20 % по сравнению с контрлатеральной зоной в костной фазе (в норме 0 %). Положительная динамика в сравнении с предыдущим исследованием
Figure 8. Scintigraphy (a – anterior, b – posterior projections) and SPECT/CT 2 years after cranioplasty: accumulation of 99mTc-pyrfotech in the projection of the bone allograft is registered, indicating its viability, with an excess inclusion in the temporoparietal area by 20 % compared with the contralateral area in the bone phase (0 % is normal). Positive dynamics compared to the previous study
При КТ костей черепа (в составе гибридного исследования) при VRT-реконструкции в правой лобно-теменно-височной области (рис. 9) определялся перфорированный костный лоскут, закреплённый винтами и минипластинами (слева – исследование через год, справа – через 2 года после краниопластики): отсутствовали признаки остеолизиса или деструкции лоскута; при КТ черепа через 2 года визуализировалась дополнительная пластина, установленная в передних отделах костного дефекта, наложенная для пластики жевательной мышцы. КТ-исследование показало, что аутологичный краниотрансплантат сохранял свою форму и положение, явные признаки деформации трансплантата не выявлялись (рис. 10).
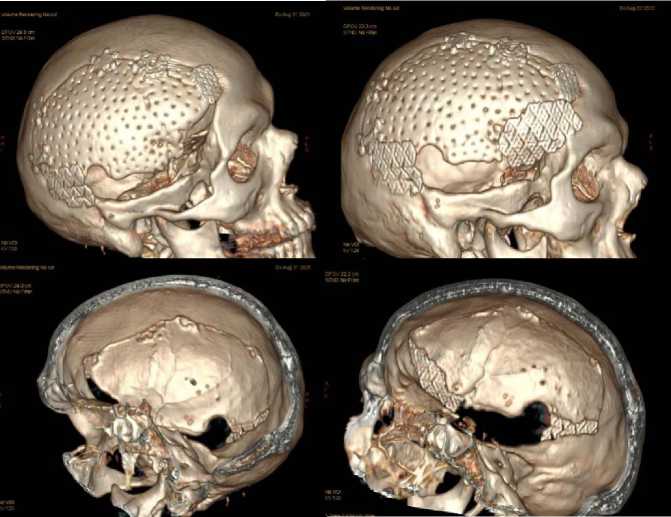
Рисунок 9. Компьютерные томограммы костей черепа, трёхмерные реконструкции (VRT): в правой лобно-теменно-височной области определяется перфорированный костный лоскут, закреплённый винтами и мини-пластинами (слева – исследование 31.08.2021, справа – от 22.08.2022): отсутствуют признаки остеолизиса, либо деструкции лоскута, при КТ 22.08.2022 визуализируется дополнительная пластина, установленная в передних отделах костного дефекта
Figure 9. Computed tomograms of the skull bones, three-dimensional reconstructions (VRT): there is a perforated bone flap in the right frontal-parietal area, secured with screws and mini plates (left – study of 08.31.2021, right – from 08.22.2022): no signs of osteolysis or destruction of the flap, CT scan of 08.22.2022 shows additional plates, installed in the anterior bone defect
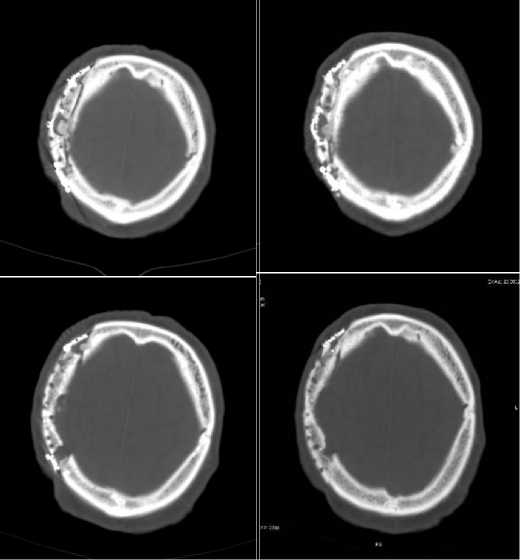
Рисунок 10. Компьютерные томограммы, аксиальные срезы (слева – исследование от 31.08.2021, справа – 22.08.2022): по краю костного лоскута и на уровне фрезевых отверстий. Между лоскутом и краем костного дефекта и частичное заполнение фрезевых отверстий костной тканью – признаки репаративных процессов и формирующейся консолидации
Figure 10. Computer tomograms, axial slices (on the left – the study of 31.08.2021, on the right – 22.08.2022): at the edge of the bone flap and at the level of milling holes. Between the flap and the edge of the bone defect and partial filling of the milling holes with bone tissue – signs of reparative processes and consolidation in progress
Заключение
Продемонстрированный клинический пример показал безопасность применения аутотрансплантата кости свода черепа в комплексе с аллогенным костнопластическим материалом и аутологичной богатой тромбоцитами плазмой при лечении посттрепанационного дефекта. Аллогенный костнопластический материал не вызывал выраженных воспалительных и иммунологических реакций. Методика консервирования и стерилизации тканевых трансплантатов позволяет сохранить общую структуру аутологичного костного лоскута. Для полного завершения ремоделирования кости требуется более длительное время.
Выводы
-
1. Использование аутотрансплантата, дополнительно насыщенного коллагеном, в сочетании с костнопластическим материалом и аутологичной богатой тромбоцитами плазмой для краниопластики безопасно для пациента, позволяет выполнить пластику посттрепанационного дефекта костей свода черепа с хорошим функциональным исходом.
-
2. Через 12 месяцев после операции наблюдается заселение краниотрансплантата аутологичными клетками, формирование сосудов без видимого нарушения гистологической картины краниотрансплантата.
-
3. Замещение значительного дефицита костной ткани костно-пластическим материалом дает временный эффект.
Список литературы Краниопластика с применением аутотрансплантата и костнопластического материала: клинический пример
- Hutchinson P.J., Kolias A.G., Tajsic T., Adeleye A., Aklilu A.T., Apriawan T. et al. Consensus statement from the International Consensus Meeting on the Role of Decompressive Craniectomy in the Management of Traumatic Brain Injury: consensus statement. Acta Neurochir (Wien). 2019;161:1261-1274.
- Qiu S., You W., Wang H., Zhou X., Yang X. Allergic epidural effusion following polyetheretherketone cranioplasty. J Craniofac Surg. 2019;30:E241-E243.
- Jost J.N. Primary decompressive craniectomy after traumatic brain injury: a literature review. Cureus. 2022;14(10):e29894.
- Офицеров А.А., Боровкова Н.В., Талыпов А.Э., Пономарев И.Н. Современные материалы для реконструкции костей свода черепа. Трансплантология. 2019;11(3):234-243.
- Sahoo N.K., Tomar K., Thakral A., Rangan N.M. Complications of cranioplasty. J Craniofac Surg. 2018;29:1344-1348.
- Zhou W., Wang Z., Zhu H., Xie Z., Zhao Y., Li C. et al. Effects of cranioplasty on contralateral subdural effusion after decompressive craniectomy: A Literature Review. World Neurosurg. 2022;165:147-153.
- Методические рекомендации "Потенцирование кондуктивных и индуктивных свойств трансплантатов костной ткани". М.: ГБУЗ "НИИ СП им. Н.В. Склифосовского ДЗМ". 2022:24.
- Боровкова Н.В., Макаров М.С., Андреев Ю.В., Сторожева М.В., Пономарев И.Н. Оценка цитокинового состава сыворотки крови и препаратов на основе тромбоцитов человека. Молекулярная медицина. 2021;19(3):51-57.
- Осипов В.А., Пастухов А.Н., Курбатов О.И., Потехина Ю.П. Гистологическое исследование синхондрозов черепа, функционально значимых в краниальной остеопатической концепции. Российский остеопатический журнал. 2021;4(55):29-38.
- Макаров М.С., Сторожева М.В., Боровкова Н.В. Значение автофлюоресценции коллагеновых волокон для оценки биологических свойств тканевых трансплантатов. Современные технологии в медицине. 2017; 9(2):83-90.


