Кселода в неоадъювантном лечении операбельного рака молочной железы
Автор: Слонимская Е.М., Тарабановская Н.А., Дорошенко А.В., Гарбуков Е.Ю., Кокорина Ю.Л.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 (31), 2009 года.
Бесплатный доступ
В работе изучена переносимость, токсичность и непосредственная эффективность неоадъювантной полихимиотерапии с включением кселоды (САХ, СМХ) у больных операбельным раком молочной железы. Результаты исследования показали, что включение кселоды в схемы НАХТ позволило получить более высокие показатели непосредственной эффективности, по сравнению со стандартными режимами FAC и CMF при сопоставимой токсичности проводимой терапии. Это дало возможность увеличить количество выполняемых органосохранных оперативных вмешательств у пациенток исследуемых групп в достоверно большем числе случаев, по сравнению с контролем.
Рак молочной железы, неоадъювантная химиотерапия, кселода
Короткий адрес: https://sciup.org/14055109
IDR: 14055109 | УДК: :
Текст научной статьи Кселода в неоадъювантном лечении операбельного рака молочной железы
Одним из важнейших составляющих компонентов комплексного лечения рака молочной железы является неоадъювантная полихимиотерапия, основные задачи которой состоят в уменьшении объема первичного очага с целью улучшения условий для выполнения органосохранных оперативных вмешательств, в определении чувствительности опухоли in vivo и планировании адъювантной терапии на основании выраженности терапевтического патоморфоза [12]. Результатами рандомизированных исследований показано, что эффект лечения коррелирует с продолжительностью безрецидивного периода, а достоверное улучшение показателей общей выживаемости наблюдается только при достижении полной морфологической регрессии [5].
Современная цитостатическая терапия рака молочной железы (РМЖ) насчитывает в своем арсенале большое количество противоопухолевых препаратов различного механизма действия. «Золотым стандартом» на настоящее время считаются антрациклины и таксаны, однако ре- зультаты лечения не всегда удовлетворительны, в связи с чем поиск новых, более эффективных препаратов и создание схем на их основе представляются актуальными [1, 2].
Низкая селективность большинства цитостатиков нередко является причиной их достаточно выраженной токсичности. Поэтому все больше внимания уделяется препаратам направленного противоопухолевого действия, что наряду с повышением эффективности лечения позволяет уменьшить нежелательные побочные проявления терапии. Большой интерес в этом отношении представляет кселода (капецитабин). Являясь предшественником 5-фторурацила, капецитабин путем ферментного каскада трансформируется в активный цитостатик непосредственно в опухоли под воздействием ангиогенного фактора – тимидинфосфорилазы (ТФ), концентрация которой в пораженной ткани значительно выше, чем в нормальных клетках [6]. Избирательность действия кселоды обусловливает уменьшение негативного влияния на неизмененные окружающие ткани и снижает токсическое влияние цитостатической терапии. Кроме этого, во время приема капецитабина создается эффект длительной инфузии 5-фторурацила, что позволяет оказывать фазоспецифичное действие на максимальное количество опухолевых клеток.
Удовлетворительные результаты клинических исследований в лечении метастатического рака молочной железы, а также при прогрессировании процесса на фоне терапии антрацикли-нами и таксанами послужили основанием для изучения эффективности полихимиотерапии с включением кселоды и в неоадъювантном режиме [1, 3, 4, 7, 9]. Применение капецитабина в монорежиме в качестве 2-й линии индукционной терапии местно-распространенных форм рака молочной железы продемонстрировало высокие результаты непосредственной эффективности. По данным T. Saeki [9], общая эффективность лечения составила 45,5 %. В исследовании N. Tagaya et al. [11] сочетание кселоды с таксотером и эпирубицином позволило увеличить частоту объективных ответов до 77,8 %. M. Mansutti et al. [7] в 3-й фазе рандомизированных исследований, посвященных неоадъювантной химиотерапии (НАХТ) местно-распространенного РМЖ, при сравнении режимов, включающих таксаны, антрациклины и кселоду, показали, что общая эффективность схем с использованием капецитабина оказалась выше по сравнению со стандартными: TEХ – 70 %, ЕТ – 62 %.
В последние годы стали появляться работы по изучению эффективности НАХТ с применением капецитабина при операбельных формах РМЖ. Немногочисленные данные зарубежных исследований демонстрируют обнадеживающие результаты. Так, сочетание таксотера и кселоды позволило достичь общей эффективности в 84 % наблюдений, что превысило аналогичный показатель по сравнению с общепринятой схемой АС – 67 %. При этом полные морфологические регрессии как первичной опухоли, так и метастатических аксиллярных лимфатических узлов отмечались чаще у больных, получавших кселоду [13].
Цель исследования – изучение переносимости, токсичности и непосредственной эффективности неоадъювантной химиотерапии с включением кселоды у больных операбельным раком молочной железы.
Материал и методы исследования
В исследование включено 190 больных операбельным раком молочной железы II–III стадии (T2–4N0–2M0) в возрасте от 29 до 68 лет. Критериями включения пациенток в исследование являлись: удовлетворительный объективный статус по шкале ECOG (0–1), гистологически верифицированный рак молочной железы, отсутствие отдаленных метастазов. Все больные получили комбинированное лечение (рис. 1).
В зависимости от используемой схемы лечения пациентки были разделены на 4 группы. Больные исследуемых групп получали НАХТ по схемам САХ (n=45): кселода 2000 мг/м2 с 1-го по 14-й дни per os; циклофосфан 200 мг/м2 с 1-го по 14-й дни в/м; адриамицин 30 мг/м2 в 1-й и 8-й дни в/в с интервалом между курсами 4 нед (патент РФ на изобретение № 2288710 от 10.12.06) и СМХ (n=45): кселода 2000 мг/м2 с 1-го по 14-й дни per os; циклофосфан 200 мг/м2 с 1-го по 14-й дни в/м; метотрексат 40 мг/м2 в 1-й и 8-й дни в/в; интервал между курсами 2 нед (патент РФ на изобретение № 235914 от 15.06.06). В контрольных группах проводилась полихимиотерапия по стандартным схемам FAC и СMF. Анализируемые группы были сопоставимы по основным клинико-морфологическим критериям (возраст, состояние менструальной функции, стадия опухолевого процесса, объем проводимого лечения).
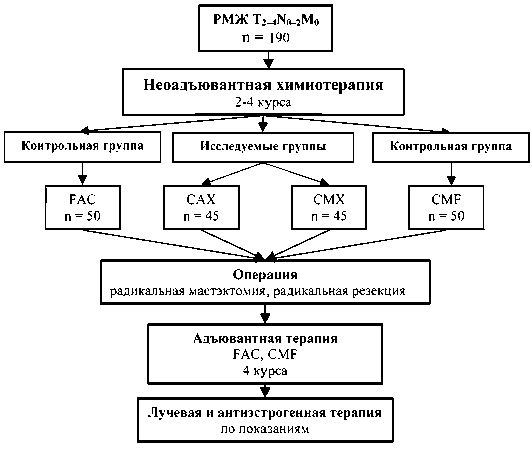
Рис. 1. Дизайн исследования
Таблица 1
|
Вид токсических осложнений |
Количество курсов НАХТ, абс. (%) |
|||
|
САХ n=130 |
FAC n=156 |
СМХ n=112 |
CMF n=109 |
|
|
Желудочно-кишечный тракт |
||||
|
Тошнота/рвота I–II ст. |
70 (53,8) |
98 (62,8) |
57 (50,8) |
54 (49,5) |
|
Рвота III ст. |
2 (1,5) |
8 (5,1) |
- |
- |
|
Обострение ЯБЖ |
9 (6,9) |
16 (10,2) |
- |
- |
|
Стоматит I–II ст. |
30 (23) * |
19 (12,1) |
20 (17,8) * |
- |
|
Гематологические осложнения |
||||
|
Лейкопения I–II ст. |
58 (44,6) |
70 (44,8) |
50 (44,6) |
37 (33,9) |
|
Лейкопения III ст. |
10 (7,6) |
22 (14,1) |
6 (5,3) |
- |
|
Осложнения со стороны сердечно-сосудистой системы |
||||
|
ИБС I ст. |
2 (1,5) |
1 (0,6) |
- |
- |
|
Ладонно-подошвенный синдром |
||||
|
ЛПС I ст. |
2 (1,5) |
- |
2 (1,7) |
- |
Примечание: * – достоверность различия по сравнению с контрольной группой (р≤0,05).
Токсичность неоадъювантной химиотерапии у больных РМЖ
Непосредственная эффективность лечения оценивалась после 2 курсов химиотерапии. Основанием для ее продолжения служило достижение частичной регрессии первичной опухоли и/или пораженных аксиллярных лимфатических узлов. При получении меньшего эффекта или прогрессировании заболевания менялся режим НАХТ либо выполнялся оперативный этап комбинированного лечения. Непосредственная эффективность предоперационной химиотерапии оценивалась по шкале RECIST. Оценка токсичности применяемых режимов проводилась на основании учета частоты и выраженности побочных реакций и осложнений по шкале CTC-NCIC.
После завершения неоадъювантной химиотерапии всем больным выполнялось оперативное лечение в объеме радикальной мастэктомии, радикальной резекции или квадрантэктомии с аксиллярной лимфаденэктомией. В послеоперационном периоде пациенткам проводилось 4 курса адъювантной химиотерапии по схемам FAC или CMF, лучевая и гормональная терапия – по показаниям.
Статистическая обработка полученных результатов проводилась с применением программы Statistica for windows 6.0.
Результаты исследования
Все пациентки перенесли лечение удовлетворительно. Одними из наиболее частых видов осложнений проводимой НАХТ были проявления со стороны желудочно-кишечного тракта, которые носили умеренный характер и, как правило, не превышали 2-й степени выраженности (табл. 1). Среди больных, получавших кселоду, в достоверно большем проценте наблюдений отмечены явления стоматита, что соответствует литературным данным [2].
Гематологическая токсичность как в исследуемых, так и в контрольных группах проявлялась в основном лейкопенией I–II степени, лейкопения III степени наблюдалась редко. Со стороны сердечно-сосудистой системы каких-либо значительных нарушений выявлено не было. Отклонения носили минимальный характер и зарегистрированы в единичных случаях только у больных, получавших в схемах лечения антрациклины (САХ, FAC).
Таблица 2
|
Эффективность |
Кол-во больных, абс.ч. (%) |
|||
|
САХ n = 45 |
FAC n = 50 |
СМХ n = 45 |
CMF n = 50 |
|
|
Полная регрессия |
9 (20) |
9 (18) |
4 (9) |
5 (10) |
|
Полная морфологическая регрессия |
4 (8,8) |
1 (2,2) |
1 (2,2) |
- |
|
Частичная регрессия |
28 (62) |
25 (50) |
25 (55,5) |
20 (40) |
|
Полная + частичная регрессии |
37 (82) * |
34 (68) |
29 (64,5) * |
25 (50) |
|
Стабилизация |
4 (9) |
7 (14) |
15 (33,3) |
18 (36) |
|
Прогрессирование |
4 (9) |
9 (18) |
1 (2,2) * |
7 (14) |
Примечание: * – достоверность различия по сравнению с контрольной группой (р≤0,05).
Непосредственная эффективность НАХТ в сравниваемых группах
Ладонно-подошвенный синдром, описанный как специфическое осложнение при назначении кселоды, проявлялся легкой гиперемией ладонных поверхностей кистей. Эти изменения были отмечены всего у 4 пациенток, получавших НАХТ по схемам САХ (n=2) и СМХ (n=2). Коррекция всех видов развившихся осложнений проводилась стандартными препаратами сопровождения.
Оценка эффективности проведенного предоперационного лечения выполнена у всех больных, включенных в исследование (табл. 2). При неоадъювантной химиотерапии с включением кселоды получены более высокие результаты. Наибольшее количество полных морфологических регрессий опухоли было выявлено у пациенток, получавших лечение по схеме САХ (n=4). По сумме полных и частичных регрессий показатели были выше у больных, которым проводилась предоперационная химиотерапия по схемам САХ и СМХ, по сравнению со стандартными режимами FAC и CMF (р≤0,05). Стабилизация процесса наблюдалась практически с одинаковой частотой вне зависимости от схемы лечения. Прогрессирование заболевания, проявлявшееся в увеличении первичной опухоли, реже отмечалось у больных, получавших кселоду.
Проведение НАХТ позволило уменьшить объем первичной опухоли и создать более благоприятные условия для выполнения органосохранных оперативных вмешательств практически во всех группах. При этом у пациенток, получавших кселоду, эти показатели были выше по сравнению с контрольными группами (р≤0,05).
Так, до начала проведения неодъювантной химиотерапии возможность выполнения органосохранных операций рассматривалась у 45 % больных, получивших в дальнейшем лечение по схеме САХ, у 40 % – FAC, у 47 % – СМХ и у 42 % – получивших CMF. Проведение предоперационной химиотерапии позволило увеличить эти показатели до 75, 60, 69 и 55 % соответственно.
Таким образом, включение кселоды в схемы неоадъювантной химиотерапии у больных операбельным раком молочной железы продемонстрировало более высокие показатели непосредственной эффективности, по сравнению со стандартными режимами FAC и CMF. При этом увеличения проявлений токсичности отмечено не было. Пациентки удовлетворительно переносили лечение, которое осуществлялось преимущественно в амбулаторно-поликлинических условиях. Значимым практическим результатом выполненного исследования является то, что проведенная предоперационная химиотерапия позволила выполнить органосохранные операции у большего количества больных исследуемых групп, по сравнению с группами контроля.


