Культивирование Leuconostoc mesenteroides на мелассе с целью получения декстрана
Автор: Ведяшкина Т.А., Ревин В.В., Шувалова Е.А., Паршуткина Н.Ф.
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Биотехнология
Статья в выпуске: 2, 2008 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14718975
IDR: 14718975
Текст статьи Культивирование Leuconostoc mesenteroides на мелассе с целью получения декстрана
В настоящее время в связи с высокой токсичностью и стоимостью основных клеевых компонентов, используемых для склеивания различных изделий, разрабатываются адгезивные материалы на основе экологически безопасных биокомпонентов, содержащие такие биополимеры, как полисахариды и белковые соединения.
Одним из таких компонентов может выступать полисахарид — декстран, обладающий выраженными адгезивными свойствами. Биосинтез декстрана и его свойства зависят от ряда физико-химических факторов, состава среды и штамма-продуцента. Условия синтеза декстрана отработаны в основном в производстве плазмозаменителей. Получение технического декстрана с использованием пищевого сырья в качестве питательной среды как адгезивного материала в настоящее время изучено мало.
Ценный побочный продукт сахарной промышленности — меласса — имеет богатый качественный и количественный состав. Большое содержание сахарозы, позволяет использовать ее для культивирования продуцента декстрана Leuconostoc mesenteroides. Поэтому целью работы являлось получение адгезивных материалов из отходов свеклосахарной промышленности путем микробиологического синтеза.
В работе использовали штамм Leuconostoc mesenteroides ВКМ 271 З-Д. Субстратом для глубинного культивирования служила меласса, разведенная водой. Оптическую плотность исследуемых образцов определяли на спектрофотометре СФ-46 «Ломо» (Россия).
Для выращивания и поддержания культуры L. mesenteroides использовали сахарозосодержащую среду, описанную в регламенте производства полиглюкина на основе декстрана [7]. В качестве инокулята использовали суспензию суточной биомассы бактерии, выращенной на среде Долса [10]. Мелассу разводили водой до необходимой концентрации сахарозы (pH 6,75).
Культивирование L. mesenteroides в экспериментах по оптимизации условий культивирования проводили в мелассной среде, варьируя содержание сахарозы, исходный pH культивирования, содержание MgSO4, скорости перемешивания. Культивирование проводили как в статических условиях, так и при перемешивании в течение 2—5 сут в зависимости от скорости образования декстрана. Количество биомассы определяли весовым методом. Содержание декстрана определяли весовым методом после двойного осаждения 96 % этанолом [2]. Содержание белка в культуральной жидкости определяли по методу Бредфорд, используя в качестве стандарта бычий сывороточный альбумин [9].
Оптимизация условий синтеза декстрана микроорганизмом L. mesente-roides
в средах на основе мелассы. В промышленности L. mesenteroides культивируют для получения клинических декстранов на минеральной среде с содержанием сахарозы 10— 30 %. При использовании декстранов для технических целей, например в качестве биоадгезива, целесообразнее для синтеза декстрана использовать вторичное сырье, такое как меласса. Были проведены исследования по оптимизации условий синтеза декстрана в средах, содержащих мелассу, в качестве единственного компонента питательной среды. Для этого изучали влияние концентрации сахарозы мелассы, витаминов и ионов магния, pH среды и скорости перемешивания.
Влияние концентрации мелассы на образование декстрана микроорганизмом L. mesenteroides. При культивировании микроорганизмов на регламентированной среде с сахарозой максимальное количество декстрана (49 г / л) было получено на 4-е сутки роста (рис. 1). В экспериментах с использованием среды Долса декстран образовывался уже на 2-е сутки роста, и его выход был на 17 % выше по сравнению с регламентированной средой, составил 68,7 г / л. Выращивание L mesenteroides показало, что концентрация сахарозы мелассы в питательных средах 5,0—17,5 % приводит к увеличению образования декстрана до 56,8 г / л.
Однако более высокая концентрация мелассы — 20—22,5 % начинала подавлять биосинтез декстрана. Уменьшение выхода декстрана на средах с высокой концентраци ей мелассы, возможно, связано с наличием в составе мелассы веществ, ингибирующих ферменты, участвующих в образовании полисахарида, или с ингибированием синтеза конечным продуктом — декстраном.
Влияние pH среды на основе мелассы на образование декстрана. В ряде работ было выяснено, что оптимальное значение pH для развития L. mesenteroides возможно в достаточно широких пределах от 5 до 8, однако ферментативная реакция протекает при pH 5,2—5,6 [5]. Поэтому представляет интерес выявить оптимальный pH среды на основе мелассы. Исходное значение pH питательных сред, используемых для изучения продуцента декстрана и особенностей его образования, составляет 6,8—6,9. Полученные результаты представлены на рис. 2. Оптимальной величиной pH для синтеза декстрана культурой L. mesenteroides, так же как и в случае с контрольным вариантом, является pH 6,75. При этом выход декстрана на данной среде на 15 % выше, чем в контрольной.
Дальнейшее увеличение pH до 7—8 приводит к резкому снижению синтеза декстрана. Таким образом, pH 6,75 является оптимальным и может быть рекомендован для культивирования L. mesenteroides на среде с мелассой в качестве единственного источника питания.
Влияние режима перемешивания на образование декстрана. L. mesenteroides, являясь аэротолерантным, обладает способностью образовывать декстран как в перемеши-
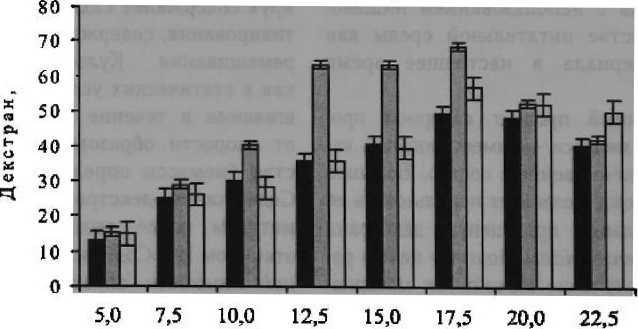
Сахароза,%
■ Реглам ентированная среда tSl Среда Долса Омелассная
Рисунок 1
Влияние концентрации сахарозы мелассы на образование декстрана
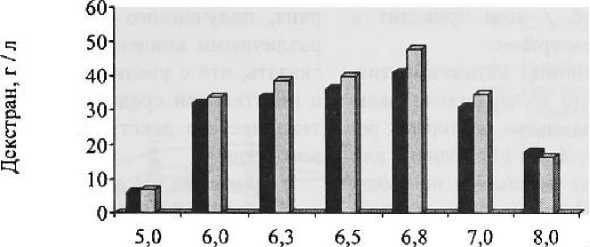
pH
-
■ сахароза □ меласса
Рисунок 2
Влияние pH на образование технического декстрана в средах на основе мелассы
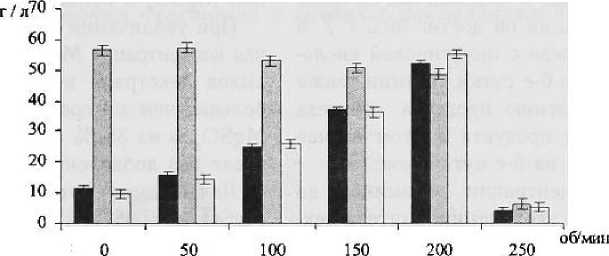
-
■ Регламентированная среда
-
□ Среда Долса
-
□ мепассная
Рисунок 3
Влияние скорости перемешивания на образование декстрана L. mesenteroides ваемых, так и в стационарных условиях. Однако имеются отдельные сведения о том, что в условиях аэрации ускоряется процесс ферментации.
Учитывая эти данные мы проводили культивирование на круговой качалке при 50, 100, 150, 200 и 250 об / мин в течение 4 сут. Использование в регламентированной среде в качестве источника азота хлорида аммония и низких концентраций пептона (0,02—0,03 %) приводило к тому, что максимум накопления декстрана наблюдался позже и по количественным значениям был меньше, чем при применении среды с дрожжевым экстрактом. Анализируя данные рис. 3, можно отметить, что изменение состава среды приводит также к изменению характера зависимости выхода декстрана от режима перемешивания.
При использовании среды с дрожжевым экстрактом разница в накоплении декстрана при статических условиях и при 200 об / мин не превышала 15 %, Выход декстрана при культивировании на среде с мелассой в статических условиях составил 11,3 г / л. При переходе к динамическим условиям происходит увеличение образования декстрана в опытной и в регламентированной средах.
В целом зависимость количества синтезированного декстрана L. mesenteroides от числа оборотов качалки на обеих средах имела сходный характер: при увеличении скорости перемешивания на 50 об / мин выход декстрана увеличивался в среднем на 10 г / л. При 200 об / мин количество декстрана достигло максимума (52,31 г / л на мелассной среде). Дальнейшее увеличение скорости пе ремешивания до 250 об / мин приводит к подавлению синтеза декстрана.
По литературным данным, витамины: тиамин, никотиновая кислота и пантотенат кальция — являются необходимыми факторами роста для лейконостока [1; 4; 8; 11). Однако для мелассной среды влияние витаминов на выход декстрана неизвестно. Поэтому было изучено влияние вышеуказанных витаминов на биосинтез декстрана бактерией L mesenteroid.es.
При внесении витаминов в количестве 0,5 мг / л декстран начинал образовываться во всех средах на 2-е сутки, но в отличие от контроля, наблюдался более продолжительный процесс ферментации. Максимальный выход декстрана в контрольной среде составил 62,8 г / л на 4-е сутки, в то время как на среде с пантотенатом кальция он достиг 69,5 г / л на 5-е сутки, а на среде с никотиновой кислотой — 66,7 г / л на 6-е сутки. Тиамин также способствовал продлению процесса синтеза декстрана — выход продукта в этом случае составил 64,1 г / л на 5-е сутки (рис. 5).
Повышение концентрации витаминов до 1 мг / л привело к увеличению синтеза декстрана, особенно на среде с пантотенатом кальция, в этом случае наблюдался максимальный выход, который составил 74,3 г / л на 5-е сутки.
Меньшее количество декстрана образовывалось в присутствии никотиновой кислоты — 71,5 г / л на 6-е сутки т, е. снова наблюдается более продолжительный процесс ферментации.
Исходя из наших данных, можно заключить, что витамины увеличивают выход декстрана, и наибольшее его количество наблюдается в средах, содержащих 1 мг / л пантотената кальция и никотиновой кислоты.
Совместное влияние ионов Mg2* и pH на выход декстрана. С учеётом важного влияния ионов магния на структуру декстрана [6; 12] и, соответственно, на его свойства было изучено влияние ионов Mg2* на синтез декстрана и определение оптимальной концентрации MgSO4 при варьировании исходного значения pH для максимального синтеза технического декстрана культурой Leuconostoc.
В варианте с pH 6,5 выход декстрана на контрольной среде был на 18,5 % меньше, чем в опытных. При сравнении количества декст рана, полученного на питательных средах с различными концентрациями MgSOr можно сказать, что с увеличением количества MgSO4 в питательной среде от 0,01 до 0,06 % выход технического декстрана остается на одинаковом уровне.
Увеличение pH до 6,75 позволило повысить выход экзополисахарида, однако в этом случае с ростом концентрации соли MgSO4 с 0,01 до 0,06 % происходило снижение количества декстрана. Максимальное декстранооб-разование наблюдалось при росте L. mesenteroid.es в питательной среде с содержанием сульфата магния 0,02 %. В этом случае количество синтезированного декстрана было на 20,5 % выше, чем при использовании MgSO4 в концентрации 0,06 %.
При увеличении pH среды до 7,0 оптимальная концентрация MgSO4 соответствует 0,04 %: выход декстрана в этом варианте на 23 % больше, чем на среде с 0,01 % содержанием MgSO4, и на 35 % больше, чем в контрольной среде без добавления соли (рис. 4).
Дальнейшее увеличение количества MgSO4 до 0,06 % (59,52 г/л) приводит к снижению декстранообразования. Таким образом, полученные результаты свидетельствуют о том, что с увеличением значения pH среды культивирования возрастает оптимальная концентрация MgSO4, необходимая для максимального выхода декстрана.
Влияние ионов Mg2* на фракционный состав декстрана. Известно, что декстраны, образуемые разными видами микробов и даже разными расами (штаммами) одного вида, не идентичны по своему строению [5].
Экзополисахарид, продуцируемый L. mesenteroides штаммом СФ-4 и служащий для приготовления полиглюкина, имеет 93—94 % связей Ь — 1,6 и почти не разветвленную молекулу [3] Известно также, что на структуру и выход технического декстрана сильное влияние оказывают ионы магния (6; 12; 13].
Представляло интерес изучить фракционный состав технического декстрана, синтезированного в средах, содержащих мелассу и MgSO4. Методом переосаждения были получены три фракции: высокомолекулярная (ВМФ), среднемолекулярная (СМФ) и низкомолекулярная (НМФ).
При фракционировании декстрана, выделенного с мелассной среды, произошли потери
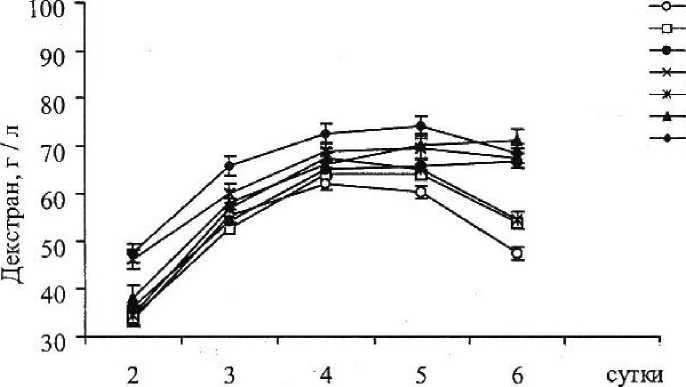
Контроль
Тиамин (0,5 мг/ л)
Никотиновая кислота (0,5 мг/л)
Пантотенат кальция (0,5 мг/л)
Тиамин (1 мг/л)
Никотиновая кислота(1 мг/л)
Пантотенат кальция (1 мг/л)
Рисунок 4
Динамика образования декстрана в средах с добавлением витаминов
-
■ контроль меласса □ 0,01 % сульфат магния 0 0,02 % сульфат магния □ 0,04 % сульфат магния В 0,06% сульфат магния
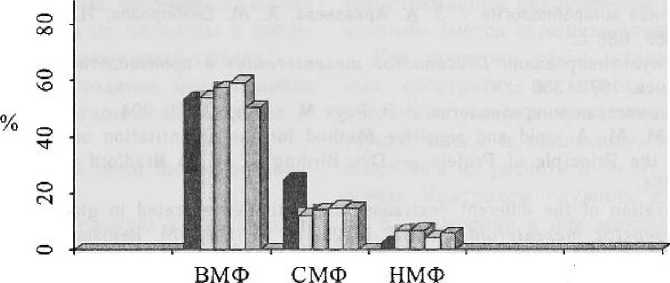
Рисунок 5. Фракционный состав технического декстрана
Рисунок 5
Фракционный состав технического декстрана
(около 19 %), тогда как в контроле общий выход фракций составил 100 %. При росте на среде с мелассой ВМФ составила 53,6 %, что в 1,5 раза меньше, чем в контроле — 78,18 %. СМФ при росте на мелассе составила 24,83 % — это в 1,3 раза больше по сравнению с контролем, НМФ в опытной пробе составила 2,5 %, как и в контроле.
Полученный в ходе работы на мелассной питательной среде с различным количеством соли MgSO^ (от 0,01 до 0,06 %) технический декстран также фракционировали (рис. 5).
В вариантах сред с концентрацией MgSO4 0,02 и 0,04 % доля ВМФ составила 57,5 % и 59,3 % соответственно. Это превышает контроль на 7—10 %.
Количество ВМФ в среде с минимальным содержанием ионов Mg2* практически не отличимо от контроля и составляет 54,2 %. На среде с максимальным содержанием Mg$O4 получили минимальное количество ВМФ — 50,5 %. Добавление MgSO4 привело к снижению СМФ по сравнению с контролем на 43,0 %. С увеличением концентрации ионов
Mg2+ количество синтезируемой СМФ не меняется.
Количество НМФ с увеличением концентрации MgSO4 в питательной среде снизилось с 7 до 4 %. Максимальное количество НМФ получили на среде с концентрацией MgSO^, равной 0,02 %, что практически в три раза превышает количество НМФ в контроле.
Таким образом, исходя из наших результатов, можно сделать вывод, что добавление соли Mg2* приводит к увеличению ВМФ и НМФ декстрана и снижает количество СМФ декстрана. Оптимальная концентрация MgSO4 — 0,02 %.
Список литературы Культивирование Leuconostoc mesenteroides на мелассе с целью получения декстрана
- Блинов Н. П. Химическая микробиология/Н. П. Блинов -М.: Высш. шк., 1989. 448 с.
- Захаров Н. Я. Методы изучения микробных полисахаридов/Н. Я. Захаров, Л. В. Косенко. Киев: Наукова Думка, 1982. 192 с.
- Козинер В. Б. Механизм действия полиглюкина/В. Б. Козинер, Н. А. Федоров. М: Медицина, 1974. 190 с.
- Пекин Б. Биосинтез декстранов штаммами Leuconostoc различного происхождения/Б. Пекич, Л. Вбрашки, М. Хаун//Прикладная биохимия и микробиология. 1991. Вып. 6. С. 27-31
- Преображенская М. Е. Декстраны и декстраназы/М. Е. Преображенская//Успехи биологической химии. 1975. Вып. 16. С. 214-235.
- Промышленная микробиология/3. А. Аркадьева, А. М. Безбородов, И. Н. Блохина и [др.]. М.: Высш. школа, 1989. 688 с.
- Регламент культивирования Leuconostoc mesenteroides в производстве полиглюкина на основе декстранов. Саранск, 1979. 350 с.
- Роуз Э. Химическая микробиология/Э. Роуз М.: Мир, 1971. 294 с.
- Bradford М. М. A rapid and sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein -Dye Birding/М. M Bradford//Anal. Biochem. 1976. V. 72. P. 248-254.
- Characterization of the different dextransucrase activities excreted in glucose, fructose, or sucrose medium by Leuconostoc mesenteroides NRRL B-1299/M. Dols, M. Remaud-Simeon, R. M. Willemot, M. Vignon, P. Monsan//Appl. and Environ. Microbiol. 1998. Vol. 64, № 4. P. 1298-1302.
- Foucaud C. Development of a chemically defined medium for the growth of Leuconostoc mesenteroides/C. Foucaud, A. Francois, J. Richard//Appl. Environ. Microbiol. 1997. V. 63. P. 301-304.
- Germain-Alpettaz V. Identification and characterization of an oligopeptide transport system in Leuconostoc mesenteroides subsp. mesenteroides CNRZ 1463./V. Germain-Alpettaz, C. Foucaud-Scheunemann//Lett Appl Microbiol. 2002. V. 35, № 1. P. 68-73.
- Goyal A. Effect of certain nutrients on the production of dextransucrase from Leuconostoc mesenteroides NRRL B-512F./A. Goyal, S.S. Katiyar//J. Basic Microbiol. 1997. Vol. 37, № 3. P. 197-204.
- Holzapfer W. H. The genus Leuconostoc./W. H. Holzapfer, U. Scillinger//The Procariotes. New-York: Springer Verlag, 1992. V. 2. P. 1508-1534.


