Лапароскопическая экзентерация таза в лечении первично-множественного метахронного злокачественного новообразования. Клинический случай
Автор: Галлямов Э.А., Санжаров А.Е., Агапов М.А., Прохоренко К.А., Гололобов Г.Ю., Дорончук Д.Н., Дейнего В.Г.
Журнал: Хирургическая практика @spractice
Рубрика: Статьи
Статья в выпуске: 3 (47), 2021 года.
Бесплатный доступ
Клинический случай описанный ниже представляет наш опыт хирургического лечения пациента с первично-множественным метахронным раком: 1. Рак сигмовидной кишки рТ4NxM0. Резекция сигмовидной кишки (16.12.2013). Три курса адьювантной химиотерапии по схеме XELOX. Рецидив (2015). Лапаротомия, колопроктэктомия с парааортальной, паракавальной D3 лимфодиссекцией. Илеостомия по Бруку (2015). Один курс химиотерапии (XELOX). 2. Рак нижней трети правого мочеточника pT2N0M0R0. Нефруретерэктомия справа с резекцией мочевого пузыря и семенного канатика справа, эпицистостомия (19.02.2015). Рецидив. Нефростомический дренаж единственной оставшейся левой почки. Спаечная болезнь. Осложнение: прямокишечно-мочепузырный свищ. Учитывая анамнез и коморбидный фон пациента после проведения онкологического консилиума принято решение выполнить лапароскопическую тотальную супралеваторную экзентерацию малого таза, уретерэктомию на уровне верхней трети слева. Продолжительность операции - 280 минут, интраоперационная кровопотеря - 200 мл. Срок пребывание в реанимации - 24 часа, пациент выписан на 7-е сутки после операции, края резекции - негативные (R0). Спустя 12 месяцев - данных за прогрессировавшие заболевания нет.
Тазовая экзентерация, мультивисцеральная резекция, хирургическое лечение, первично-множественный рак
Короткий адрес: https://sciup.org/142231920
IDR: 142231920 | УДК: 616.718.192-089.197.6 | DOI: 10.38181//2223-2427-2021-3-31-39
Текст научной статьи Лапароскопическая экзентерация таза в лечении первично-множественного метахронного злокачественного новообразования. Клинический случай
Проблема хирургического лечения первично-множественного рака – междисциплинарная. Современные протоколы лечения тех или иных злокачественных новообразований (ЗНО) лежат в основах клинических рекомендаций, принадлежащих к конкретной медицинской дисцип-лине.Отсутствие доказательной клинической базы по лечению пациентов с первично-множественными ЗНО (синхронными или метахронными) ставят перед врачами задачу изучения и оценки большого количества клинических случаев.
В 2018 году ЗНО толстой и прямой кишки занимали третье место в мужской популяции и второе по частоте встречаемости у женщин.В количественном эквиваленте это составило 1 800 000 новых случаев и почти 861 000 летальных исходов (data base GLOBOCAN, WHO, 2018) [5]. До 25% случаев выявляется местно-распространенный злокачественный процесс прямой кишки [6]. Рецидив в зоне ранее выполненной операции фиксируется в 6-10% случаях [7].
ЗНО мочевого пузыря – десятое место по распространению во всем мире, в 2018 году диагностировано 549 000 новых случаев и 200 000 смертей. По гендерному признаку заболеванию чаще подвержены мужчины. Показатели заболеваемости и смертности составляют 9,6 и 3,2 на 100 000 лиц мужского пола. Из всей группы ЗНО мочевыводящих путей поражение нижних мочевыводящих путей (мочевой пузырь) – 90-95% среди всех случаев уротелиального рака. Уротелиальный рак верхних мочевыводящих путей (ВМП) встречается довольно редко и составляет 5–10% от всех случаев уротелиального рака [8]. Так же стоит отметить,что рецидив уротелиального рака в мочевом пузыре встречается у 22–47% пациентов [13], а рецидив с контралатеральной стороны – только в 2–6% случаев [14].
По данным разных авторов,частота возникновения синхронного первично-множественного колоректального рака варьируется в пределах 1,1 – 8,1% [1]. Ray P. и соавт. отметили, что первично-множественные опухоли в 13,5% случаев встречаются в мочеполовой системе [2].
Лапароскопическая хирургия зарекомендовала себя как вариант выбора при лечении как единичных,так и первично-множественных форм ЗНО [1, 3, 4]. Тазовая экзентерация является операцией выбора при местно-распространенном процессе органов малого таза [9]. В данной работе группа авторов демонстрирует вариант малоинвазивного эндовидеохирургического лечения пациента с первично-множественным раком
Описание клинического случая
Пациент А., 29 лет, ИМТ 19,5 кг/м2, ASA статус – 3, обратился в клинику ФГБУ ФНКЦ ФМБА в марте 2018 года для планового оперативного лечения. Основной клинический диагноз: Первично-множественный метахронный рак: 1. Рак сигмовидной кишки рТ4NxM0. Резекция сигмовидной кишки (16.12.2013). Три курса адьювантной химиотерапии по схеме XELOX. Рецидив (2015). Лапаротомия, колопроктэктомия с парааортальной, паракаваль-ной D3 лимфодиссекцией. Илеостомия по Бруку (2015). Один курс химиотерапии (XELOX). 2. Рак нижней трети пра-вого мочеточника pT2N0M0R0. Нефруреткрэктомия, резекция мочевого пузыря и семенного канатика справа, эпицистостомия (19.02.2015). Рецидив. Нефростомиче-ский дренаж единственной оставшейся левой почки. Спаечная болезнь. Осложнение: кишечно-мочепузырный свищ. Из анамнеза: в декабре 2013 года поступил в одну из клиник города Москвы с диагнозом – острый флегмонозный аппендицит. Выполнено – лапаротомия, аппендэктомия, интраоперационно обнаружена опухоль сигмовидной кишки,проведена резекция сигмовидной кишки с наложением анастомоза конец в конец. Патоги-стологическое заключение – аденокарцинома сигмовидной кишки с прорастанием всей толщи стенки. В 2014 году проведены 3 курса химиотерапии XELOX (Оксалиплатин и Капецитабин). В феврале 2015 года в ФГБУ «ГНЦК имени А.Н.Рыжих» по поводу прогрессирования заболевания и терминального гидронефроза справа,вы-званного злокачественным новообразованием мочеточ-ника,проведено оперативное лечение в объеме:лапар-томия, комбинированная колпроктэктомия с нефроуре-терэктомией справа с резекцией мочевого пузыря, резекция семенного канатика справа, парааортальная, парака-вальная D3 – лимфодиссекция, эпицистостомия, илиосто-мия по Бруку. С марта 2015 по апрель 2015 года получал курс химиотерапии XELOX (Оксалиплатин и Капецита-бин), однако по причине плохой переносимости от дальнейшего проведения терапии решено отказаться. В ноябре 2018 года находился в одной из клиник города Москвы с диагнозом – острый обструктивный пиелонефрит слева. Проведена чрескожная пункционная нефростомия слева (ЧПНС). В январе 2019 года выполнена компьютерная томография (КТ) с контрастированием и магнитно-резонансная томография (МРТ) с контрастированием. По данным КТ диагностировано образование нижней трети левого мочеточника, уретерогидронефроз, инфильтративные изменения культи прямой кишки, утолщение стенок мочевого пузыря. По данным МРТ – патологическая полость в полости малого таза размерами 49х41 мм., сообщающаяся с просветом культи прямой кишки и мочевым пузырем. Опухоль левого мочеточника. Выраженный спаечный процесс в полости малого таза. Синдром Линча исключен.
Пациент обследован и подготовлен к операции:
Компьютерная томография забрюшинного пространства с контрастированием,образование нижней трети правого мочеточника (рис. 1).
-
2. МРТ малого таза, свищ между культей прямой кишки и мочевым пузырем (рис. 2).
Согласно решению онкоконсилиума – оперативное лечение в объеме: лапароскопическая тотальная супрале-ваторная экзентерация малого таза, уретерэктомия на уровне верхней трети слева.
Техника оперативного вмешательства
В области левого подреберья, оптическом окне, введен оптический троакар. При обзорной лапароскопии вы-
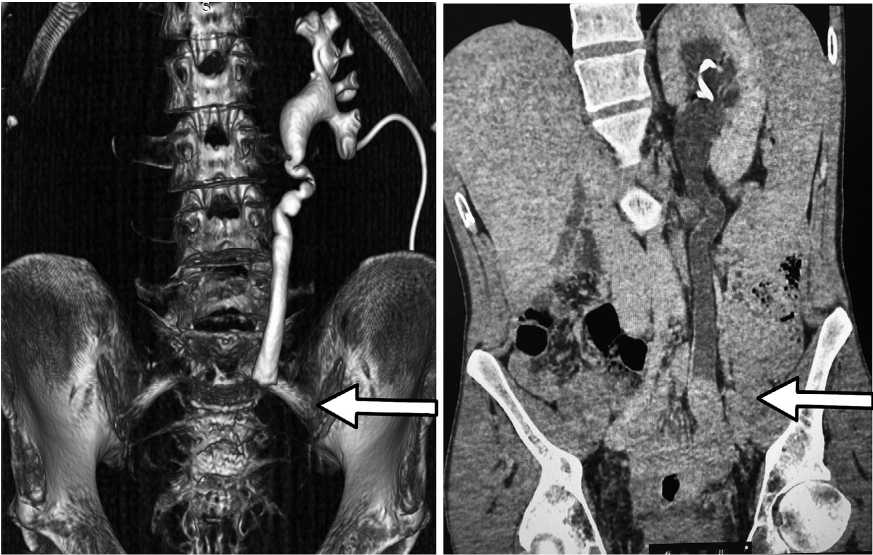
Рис. 1. Компьютерная томография забрюшинного пространства с контрастированием, образование нижней трети правого мочеточника
Fig. 1. Computed tomography of the retroperitoneal space with contrast, formation of the lower third of the right ureter
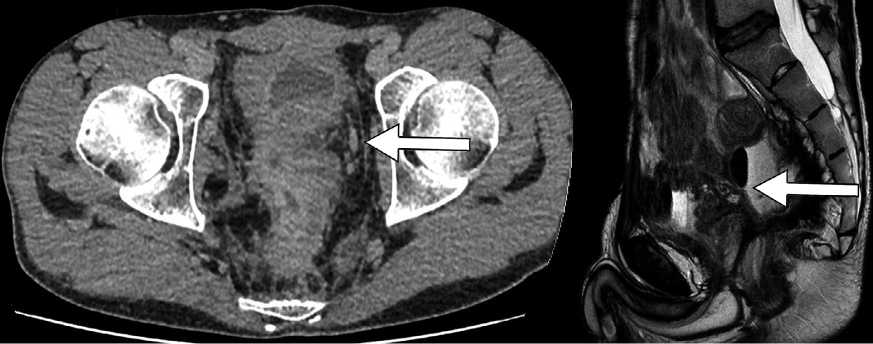
Рис. 2. МРТ малого таза, свищ между культей прямой кишки и мочевым пузырем Fig. 2. MRI of the small pelvis, fistula between the rectal stump and the bladder
явлен выраженный спаечный процесс с вовлечением петель тонкой кишки по белой линии живота, правой подвздошной области и в области малого таза (рис. 3).
С помощью холодных ножниц произведен адгезиоли-зис, установлены дополнительные троакары. Далее произведена тщательная диссекция петель из рубцового конгломерата холодными ножницами с минимальной травматизацией стенки тонкой кишки (рис. 4).
На данном этапе диссекция осуществляется только холодными ножницами, поскольку выделение и рассечение электрохирургическими инструментами, ультразвуковым диссектором, может вызвать термическое повреждение стенки органа со всеми вытекающими ближайшими и отдаленными результатами.Произведено отсечение измененной части тонкой кишки от опухолевого конгломерата. Затем со всех сторон выделен опухо-
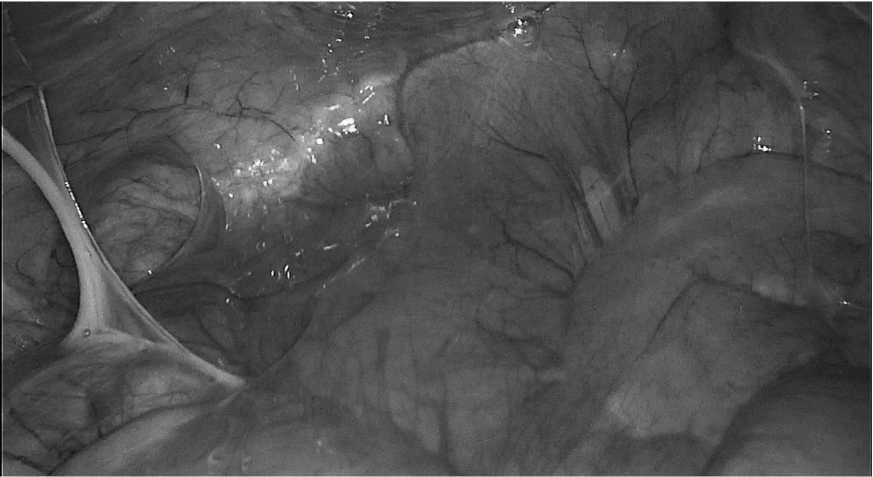
Рис. 3. Интраоперационная картина. Спаечный процесс в брюшной полости
Fig. 3. Intraoperative picture. Adhesion process in the abdominal cavity
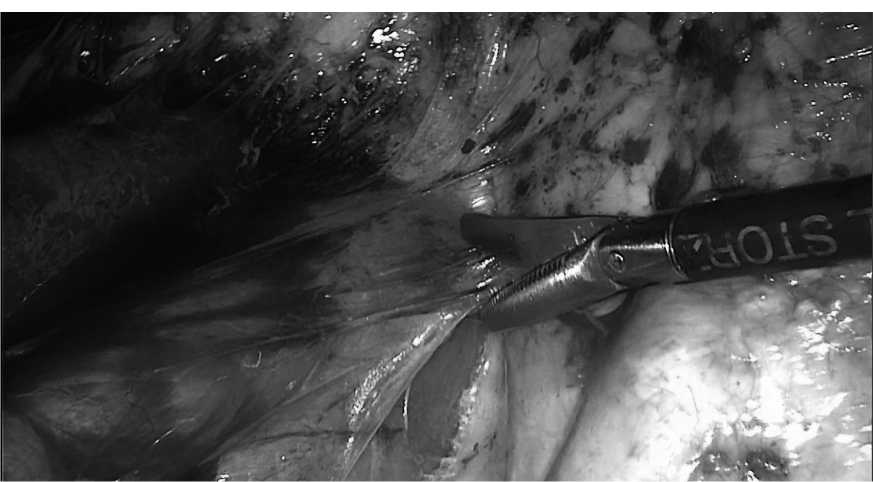
Рис. 4. Интраоперационная картина. Адгезиолизис
Fig. 4. Intraoperative picture. Adhesiolysis
левый конгломерат, состоящий из культи прямой кишки мочевого пузыря (рис.5).
Границы: латеральные генито-феморальные нервы, затем общие подвздошные сосуды от бифуркации аорты наружные и внутренние подвздошные сосуды, пресак-ральная лимфоидная ткань и ткань из запирательных ямок, мышца, поднимающая задний проход (с частичной резекцией мышечной ткани). Выделен значительно увеличенный левый мочеточник размером (20 мм. в диа- метре) до уровня перехода средней трети в верхнюю треть и до уровня впадения в опухолевый конгломерат (рис. 6).
В области перехода средней трети в верхнюю треть мочеточник был клипирован и пересечен.Произведено удаление опухолевого конгломерата единым блоком с частью левого мочеточника. Макропрепарат, включающий в себя мочевой пузырь,среднюю и нижнею треть левого мочеточника, культю прямой кишки с рециди-
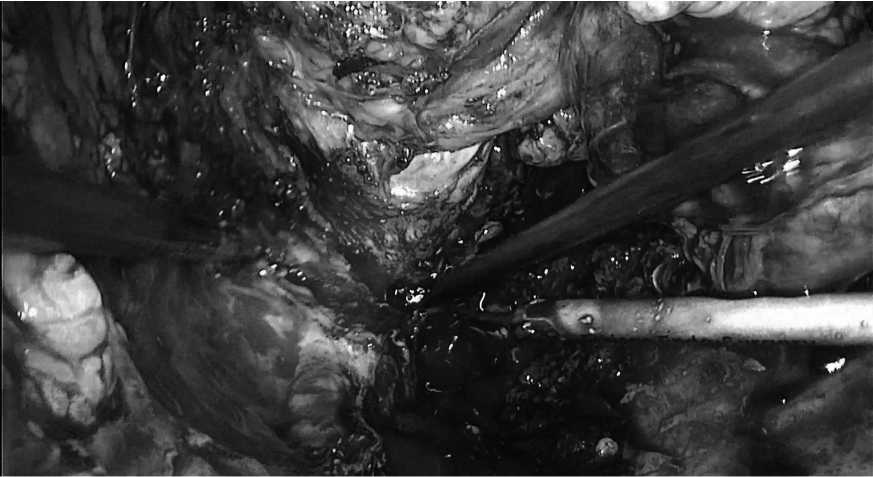
Рис. 5. Интраоперационная картина. Выделение опухолевого конгломерата
Fig. 5. Intraoperative picture. Isolation of tumor conglomerate
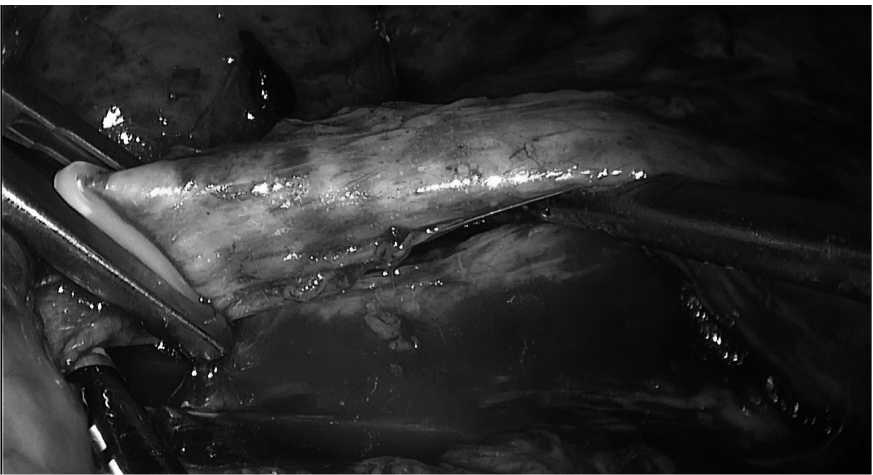
Рис. 6. Интраоперационная картина. Клиширование левого мочеточника
Fig. 6. Intraoperative picture. Clutching the left ureter
вом, погружен в экстракционный пакет. Контейнер извлечен из малого таза через расширенный порт от троакара, установленный ниже пупка по белой линии живота (рис. 7).
Дефект прямой кишки и визуально не измененная мышечная часть тазового дна герметично ушиты при использовании монофиламентной самофиксирующейся рассасывающейся нити 3-0. Нефростомический дренаж удален, произведено бужирование нефростомического свища до размера СН 12. Установлен нефростомический дренаж СН 12, фиксирован к коже двумя швами. Состояние дренажа проконтролировано рентгенологически, установлен адекватно.
Продолжительность операции составила 280 минут. Интраоперационная кровопотеря составила 200 мл. Отсутствовали интраоперационные осложнения. Срок пребывание в реанимации – 24 часа. Страховой дренаж удален на 1 сутки после перевода из реанимации. С учетом гладкого послеоперационного периода и отсутствием ранних послеопеационных осложнений, пациент выписан на 7-е сутки после операции. Пациент направлен к онкологу по месту жительства.
По патогистологическому заключению: морфологические признаки соответствуют рецидиву уротелиальной карциномы мочеточника, grade 3, с инвазией в стенку мочеточника, более половины ее толщины; Края резекции – негативные (R0).
При контрольном КТ – данных за рецидив – нет. В настоящее время (сентябрь 2021 года) пациент регулярно наблюдается у уролога (производится замена нефросто-мического дренажа раз в 3 месяца), онколога (производятся контрольные МРТ и КТ – исследования), работает по профессии (IT-специалист), периодически занимается любительским спортом (бег).
Обсуждение
Первично-множественный рак делится на две категории: синхронный, при котором опухоли развиваются в один период времени до 2-х месяцев; метахронный, при котором опухоли развиваются последовательно, с интервалом более 2-х месяцев [1].
S. Warren и O. Gates в 1932 г. предложили критерии для установления диагноза первично-множественного рака: каждое из образований должно иметь свой гистогенез; должна быть полностью исключена вероятность метастатического происхождения другого образования [10] В представленном клиническом случае данные критерии соответствующие.
Luciani A. и Balducci L. в 2004 году были предложены 2 гипотезы, объясняющие этиологию первично-множественного рака. Первая предполагает наличие мутации которая приводит к появлению опухоли в системах органов или в одной системе органов (семейный полипоз) Вторая гипотеза предполагает,что в один момент времени на организм может воздействовать один канцеро-
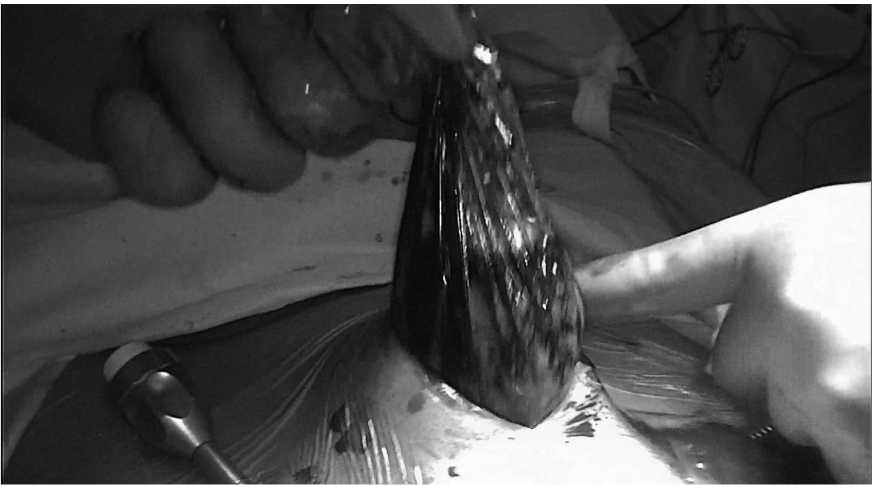
Рис. 7. Интраоперационная картина. Извлечение препарата
Fig. 7. Intraoperative picture. Removing the drug
ген, при его взаимодействии на клеткиразличных органов и систем появляется возможность развития первичномножественного рака [11]. Наследственные/семейные формы переходно-клеточного рака верхних мочевых путей сочетаются с наследственным неполипозным колоректальным раком (синдром Линча) [15].
Vogt A. и соавторы оценили возможные тактики лечения первично-множественного метахронного злокачественного новообразования, предлагая подходы к лечению основанных на реальных случаях, а не на данных проспективный исследований,которых в свою очередь, не так много по данной тематике [12]. Одним из ключевых моментов противоопухолевой терапии состоит из выбора тактики:хирургической или комбинированной. Возможно ли провести одномоментную радикальную операции по удалению опухолей, или же возможно подобрать систематическую терапию, которая будет направленна на лечение оба злокачественных очага? Наличие у пациента единственной почки,адъ-ювантной химиотерапии (АПХТ) в анамнезе, отсутствия доказательной базы неоадьювантной АПХТ при ЗНО верних мочевых путей, рецидиве опухоли прямой кишки с прорастанием в мочевой пузырь, единственным верным решением по мнению авторов – выполнение радикальной мультиорганной резекции (экзентерации).
Многие отечественные и зарубежные авторы уже доказали эффективность тазовой экзентерации при местно-распространенном раке прямой кишки и местно-распространенном раке мочеполовых органов [9, 16, 17]. Более того последняя тенденция использования малоинвазивных методик находит применение не только в стандартных радикальных нефруретерэктомии или тотальной мезоректумэктомии,но и в мультивис-церальных резекциях [18-20].
Заключение
По мнению авторов,учитывая отдаленные результаты хирургического данного пациента и качество его жизни,тазовая экзентерация являлась не операцией «отчаяния», а операцией «спасения». Особенности эндовидеохирургической методики данного оперативного вмешательства помогает достичь наилучших интраоперационных и послеоперационных результа-тов. Стоит отметить, что эндовидеохирургическая тазовая экзентерация – операция экспертного уровня и возможна только для хирургической бригады с большим опытом выполнения лапароскопических вмешательств на органах малого таза.
Список литературы Лапароскопическая экзентерация таза в лечении первично-множественного метахронного злокачественного новообразования. Клинический случай
- Лукьянов А.М., Киценко Ю.Е., Ефетов С.К., Федоров Д.Н., Тулина И.А., and Царьков П.В. Мультидисциплинарное хирургическое лечение первично-множественного рака толстой кишки с сохранением естественного хода кишечника. Клиническая и экспериментальная хирургия, vol. 7, no. 2, 2019, pp. 79-84. https://doi.org/10.24411/2308-1198-2019-12011 [Luk'janov A. M., Kicenko Ju. E., Efetov S. K., Fedorov D. N., Tulina I. A., and Car'kov P. V. Mul'tidisciplinarnoe hirurgicheskoe lechenie pervichno-mnozhestvennogo raka tolstoj kishki s sohraneniem estestvennogo hoda kishechnika. Klinicheskaja i jeksperimental'naja hirurgija. vol. 7, no. 2, 2019, pp. 79-84. https://doi.org/10.24411/2308-1198-2019-12011 (In Russ)]
- Ray P, Sharifi R, Ortolano V, Guinan P. Involvement of the genito-urinary system in multiple primary malignant neoplasms: A review. J Clin Oncol. 1983; 1:574-581
- Кит О.И., Геворкян Ю.А., Солдаткина Н.В., Харагезов Д.А., Колесников В.Е., Милакин А.Г. Первично-множественный колоректальный рак: возможности миниинвазивных оперативных вмешательств. Колопроктология. 2017;(1):38-42. https://doi.org/10.33878/2073-7556-2017-0-1-38-42 [Kit O.I., Gevorkyan Yu.A., Soldatkina N.V., Kharagezov D.A., Kolesnikov V.E., Milakin A.G. Multiple primary colorectal cancer: the possibilities of minimally invasive surgical interventions. Koloproktologia. 2017;(1):38-42. (In Russ.) https://doi.org/10.33878/2073-7556-2017-0-1-38-42]
- Теплов А.А., Грицкевич А.А., Степанова Ю.А., Мирошкина И.В., Пьяникин С.С., Дунаев С.А., Аревин А.Г., Морозова М.В. Первично-множественный рак переходно-клеточного эпителия: диагностика и особенности течения заболевания. Экспериментальная и клиническая урология, no. 4, 2018, pp. 22-29. [Teplov A.A., Grickevich A.A., Stepanova Ju.A., Miroshkina I.V., P'janikin S.S., Dunaev S.A., Arevin A.G., Morozova M.V.. "Pervichno-mnozhestvennyj rak perehodnokletochnogo jepitelija: diagnostika i osobennosti techenija zabolevanija" Jeksperimental'naja i klinicheskaja urologija, no. 4, 2018, pp. 22-29. (In Russ)]
- Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394–424. https://doi.org/10.3322/caac.21492
- Yang TX, Morris DL, Chua TC. Pelvic exenteration for rectal cancer: A system-atic review. Dis Colon Rectum. 2013;56(4):519–31. https://doi.org/ 10.1097/DCR.0b013e31827a7868
- Nielsen M, Rasmussen P, Pedersen B, Hagemann-Madsen R, Lindegaard J, Laurberg S. Early and Late Outcomes of Surgery for Locally Recurrent Rectal Cancer: A Prospective 10-Year Study in the Total Mesorectal Excision Era. Ann Surg Oncol. 2015;22(8):2677–84. https://doi.org/ 10.1245/s10434-014-4317-y
- Волкова М.И., Матвеев В.Б., Медведев С.В., Носов Д.А., Хмелевский Е.В., Черняев В.А. Клинические рекомендации по диагностике и лечению больных с опухолями верхних мочевыводящих путей. М., 2014; 13. [Volkova M.I., Matveev V.B., Medvedev S.V., Nosov D.A., Hmelevskij E.V., Chernjaev V.A. Klinicheskie rekomendacii po diagnostike i lecheniju bol'nyh s opuholjami verhnih mochevyvodjashhih putej. M., 2014; 13. (In Russ)]
- PelvEx Collaborative. Surgical and Survival Outcomes Following Pelvic Exenteration for Locally Advanced Primary Rectal Cancer: Results From an International Collaboration. Ann Surg. 2019;269(2):315–21. https://doi.org/10.1097/SLA.0000000000002528
- Warren S, Gates O. Multiple primary malignant tumors: A survey of the literature and a statistical study. Am J Cancer. 1932; 16:1358-1414
- Luciani A, Balducci L. Multiple primary malignancies. Semin Oncol. 2004; 31:264-273. https://doi.org/10.1053/j.seminoncol.2003.12.035
- Vogt A, Schmid S, Heinimann K, et al. Multiple primary tumours: challenges and approaches, a review. ESMO Open 2017;2:e000172. doi:10.1136/ esmoopen-2017-000172
- Xylinas, E., et al. Multifocal Carcinoma In Situ of the Upper Tract Is Associated With High Risk of Bladder Cancer Recurrence. Eur Urol. 61: 1069.
- Li WM, Shen JT, Li CC, Ke HL, Wei YC, Wu WJ, Chou YH, Huang CH. Oncologic outcomes following three different approaches to the distal ureter and bladder cuff in nephroureterectomy for primary upper urinary tract urothelial carcinoma. Eur Urol. 2010 Jun;57(6):963-9. https://doi.org/10.1016/j.eururo.2009.12.032
- Rouprêt M, Yates DR, Comperat E, Cussenot O. Upper urinary tract urothelial cell carcinomas and other urological malignancies involved in the hereditary nonpolyposis colorectal cancer (lynch syndrome) tumor spectrum. European urology. 2008.1;54(6):1226-36.
- Широкорад В.И. Хирургическое лечение местно-рапространенных опухолей органов малого таза . В.И. Широкорад. – М.: ОАО Издательство "Медицина", издательство "Шико", 2008. [ Shirokorad V.I. Hirurgicheskoe lechenie mestnorasprostranennyh opuholej organov malogo taza . V.I. Shirokorad. – M.: OAO Izdatel'stvo "Medicina", izdatel'stvo "Shiko", 2008. (In Rus-sian)]
- Bacalbasa N, Balescu I, Vilcu M, Neacsu A, Dima S, Croitoru A, et al. Pelvic exenteration for locally advanced and relapsed pelvic malignancies – An analysis of 100 cases. In Vivo (Brooklyn). 2019;33(6):2205–10. https://doi.org/10.21873/invivo.11723
- Ogura A, Akiyoshi T, Konishi T, Fujimoto Y, Nagayama S, Fukunaga Y, et al. Safety of Laparoscopic Pelvic Exenteration with Urinary Diversion for Colorectal Malignancies. World J Surg. 2016;40(5):1236–43. https://doi.org/ 10.1007/s00268-015-3364-2
- Uehara K, Nakamura H, Yoshino Y, Arimoto A, Kato T, Yokoyama Y, et al. Initial experience of laparoscopic pelvic exenteration and comparison with conventional open surgery. Surg Endosc. 2016;30(1):132–8. https://doi.org/10.1007/s00268-015-3364-2
- Bizzarri N, Chiantera V, Ercoli A, Fagotti A, Tortorella L, Conte C, et al. Minimally Invasive Pelvic Exenteration for Gynecologic Malignancies: A Multi-Institutional Case Series and Review of the Literature. J Minim Invasive Gyn. 2019;26(7):1316–26. https://doi.org/10.1016/j.jmig.2018.12.019


