Лапаростомия при боевой абдоминальной травме. критерии возможности и оптимальные сроки закрытия лапаростомы
Автор: Евсеев М.А., Ухов Ф.С., Филиппов А.В., Пархоменко С.А., Тишакова В.Э., Тюкалов Ю.А., Фомин В.С.
Журнал: Московский хирургический журнал @mossj
Рубрика: Военно-полевая хирургия
Статья в выпуске: 4 (94), 2025 года.
Бесплатный доступ
Введение. Статья посвящена анализу применения лапаростомии у пациентов с боевой абдоминальной травмой (БАТ) и определению критериев, сроков и методов её закрытия. При мультифакторном ретроспективном анализе данных 304 пациентов со сформированной на этапах медицинской эвакуации лапаростомой установлено, что сроки и метод закрытия лапаростомы зависят от исходной тяжести травмы, эффективности программных санаций и выбора технологии временного закрытия брюшной полости. Материалы и методы. Проведен ретроспективный мультифакторный анализ первичной медицинской документации выборки из 304 пациентов, госпитализированных в ФГБУ «НМИЦ ВМТ им. А.А. Вишневского» Минобороны России в период 2022–2024 гг. включительно с лапаростомой, сформированной в ходе операции по поводу БАТ на этапах медицинской эвакуации. Результаты исследования. При сопоставлении средних показателей тяжести состояния пациентов 1 и 2 клинических групп на момент госпитализации с этапов медицинской эвакуации в ФГБУ «НМИЦ ВМТ им. А.А. Вишневского» Минобороны России были выявлены достоверные различия (p < 0,05) данных показателей по всем применяемым в исследовании шкалам Оптимальным сроком для первично-фасциального закрытия лапаростомы является период 7–8 суток после первичной операции. Контроль источника инфекции и адекватная системная антибактериальная терапия делают возможным завершение программы открытого ведения закрытием лапаростомы. Закрытие лапаростомы в более поздние сроки ассоциируется с увеличением риска развития интраабдоминальных и раневых осложнений. Первично-фасциальное закрытие лапаростомы не может быть выполнено при наличии кишечного свища, массивного спаечного процесса (Bjork - 2b), обширного дефекта брюшной стенки, интраабдоминальной гипертензии; при данных обстоятельствах закрытие лапаростомы производится наложением кожных швов. Обсуждение. Формирование лапаростомы с проведением последующих санаций брюшной полости на этапах медицинской эвакуации в настоящее время является общепринятой стратегией лечения пациентов с БАТ. Трансформация критериев возможности завершения программы этапных санаций и первично-фасциального закрытия лапаростомы в алгоритмы хирургической тактики при БАТ является предметом дальнейших исследований. Заключение. Проведенное исследование иллюстрирует тот факт, что сроки и технология завершения программы этапных санаций при лапаростомии зависят от исходной тяжести БАТ, адекватности контроля интраабдоминального инфекционного процесса и выбора метода временного закрытия брюшной полости.
Лапаростомия, боевая абдоминальная травма, первично-фасциальное закрытие, этапные санации, перитонит, контроль повреждений
Короткий адрес: https://sciup.org/142246450
IDR: 142246450 | УДК: 617-089 | DOI: 10.17238/2072-3180-2025-4-102-113
Текст научной статьи Лапаростомия при боевой абдоминальной травме. критерии возможности и оптимальные сроки закрытия лапаростомы
Introduction. The article is devoted to the analysis of the use of laparostomy in patients with combat abdominal trauma (BAT) and the definition of criteria, timing and methods of its closure. A multifactorial retrospective analysis of the data of 304 patients with laparostomy formed at the stages of medical evacuation revealed that the timing and method of laparostomy closure depend on the initial severity of the injury, the effectiveness of programmatic sanitation and the choice of technology for temporary closure of the abdominal cavity.
Materials and methods. A retrospective multifactorial analysis of the primary medical documentation of a sample of 304 patients hospitalized at the Vishnevsky National Research Medical Center of the Ministry of Defense of the Russian Federation in the period 2022–2024 inclusive with laparostoma formed during surgery for BAT at the stages of medical evacuation was carried out.
The results of the study. When comparing the average severity of the condition of patients in clinical groups 1 and 2 at the time of hospitalization from the stages of medical evacuation to the Vishnevsky National Research Medical Center of the Ministry of Defense of the Russian Federation, significant differences (p < 0,05) in these indicators were revealed for all scales used in the study. The optimal period for primary fascial closure of laparostomy is the period 7–8 days after the initial operation. Control of the source of infection and adequate systemic antibacterial therapy make it possible to complete the open management program by closing the laparostome. Laparostomy closure at a later date is associated with an increased risk of intra-abdominal and wound complications. Primary fascial closure of the laparostome cannot be performed in the presence of intestinal fistula, massive adhesions (Bjork > 2b), extensive abdominal wall defect, intraabdominal hypertension; under these circumstances, laparostome closure is performed by applying skin sutures.
Discussion. The formation of a laparostomy with subsequent abdominal rehabilitation at the stages of medical evacuation is currently a common treatment strategy for patients with BAT. The transformation of criteria for the possibility of completing the program of stage-by-stage rehabilitation and primary fascial closure of laparostomy into surgical tactics algorithms for BAT is the subject of further research.
Conclusion. The conducted study illustrates the fact that the timing and technology of completing the program of staged rehabilitation for laparostomy depend on the initial severity of BAT, the adequacy of intra-abdominal infection control, and the choice of a method for temporary closure of the abdominal cavity.
Contribution of the authors: all authors have made an equivalent contribution to the writing of the article.
Для получения положительного результата при лечении больных с абдоминальной катастрофой и перитонитом хирург должен избегать стандартных решений.
В. К. Гостищев
Актуальность
Лечение пациентов с травматическими повреждениями органов живота остается одной из наиболее сложных задач современной хирургии, требующей многоэтапного подхода и индивидуального выбора хирургической тактики для каждого клинического случая. В отличие от острых воспалительных заболеваний брюшной полости, где существуют четкие лечебно-диагностические алгоритмы, травматические повреждения характеризуются значительным разнообразием биомеханики повреждений и высоким риском жизнеугрожающих осложнений, таких как: массивное кровотечение и травматический шок, интраабдоминальная контаминация и сепсис, ишемически-реперфузионное повреждение и синдром полиорганной недостаточности. В таких условиях основополагающим стратегическим подходом становится концепция многоэтапного хирургического лечения (отечественный аналог тактики damage control), включающая контроль источников кровотечения и контаминации в ходе первичного экстренного оперативного вмешательства с последующим выполнением восстановительно-реконструктивных этапов в ходе повторных операций после стабилизации общесоматического статуса пациента. Концепция многоэтапного хирургического лечения у пациентов с боевой абдоминальной травмой (БАТ) в настоящее время предполагает облигатное формирование лапаростомы в качестве завершающего этапа экстренного оперативного вмешательства на любом из этапов медицинской эвакуации. Технология лапаростомии – перманентного оперативного доступа в брюшную полость с целью ревизии, контроля локального патологического процесса, этапных санаций и максимально эффективного дренирования интраабдоминального компартмента, была впервые предложена как методика «открытого живота» в 1884 году J. Mikulicz-Radecki и технически воспроизведена в 1928 году J.-L. Faure. В последующие десятилетия идея ла-паростомии была незаслуженно оставлена хирургическим сообществом. Ренессанс формирования лапаростомы как эффективного метода контроля течения перитонита относится к семидесятым-восьмидесятым годам прошлого века и ассоциируется с такими именами как Н.С. Макоха, R. Pichlmayer, J. Hay, В.К. Гостищев и В.П. Сажин: «Сущность метода заключается в том, что после лапаротомии брюшная полость не зашивается, либо ушивается, но временными швами для того, чтобы в послеоперационном периоде можно было осуществить систематические ревизии брюшной полости. Окончательно брюшная полость зашивается только после ликвидации перитонита» [1]. В наше время лапаростомия является абсолютным стандартом в лечении пациентов с распространенным перитонитом, обусловленным гнойно-воспалительными заболеваниями органов брюшной полости и забрюшинного пространства. Целесообразность применения лапаростомии при травматических повреждениях живота описывалась еще в годы Второй мировой войны. Тем не менее, статус стандартного компонента лечебной тактики при абдоминальной травме лапаростомия приобрела только в 1980-е годы в рамках концепции Damage Сontrol (DС) [2]. С течением времени необходимость формирования лапаростомы при завершении экстренного вмешательства по поводу абдоминальной травмы стала очевидной. В настоящее время показаниями к завершению экстренной операции при БАТ формированием лапаростомы являются: гипотермия, декомпенсированные ацидоз и коагулопатия («триада смерти»), нестабильная гемодинамика, необходимость контроля и коррекции висцеральных повреждений в динамике, обширный травматический дефект брюшной стенки, распространенный перитонит, синдром интраабдоминальной гипертензии, необходимость отсроченной реконструкции пищеварительной трубки, наличие ишемии внутренних органов, неполный контроль источника интраабдоминальной контаминации, нагноение лапаротомной раны, медико-тактические показания [3–5].
Именно актуальные в настоящее время медико-тактические показания и действующая концепция многоэтапного хирургического лечения определяют лапаростомию как облигатный завершающий элемент любого оперативного вмешательства из лапаротомного доступа при БАТ.
В зависимости от конкретной клинической ситуации формирование лапаростомы при БАТ может быть осуществлено сведением краев кожной раны провизорными швами, использованием мешка Боготы (Bogota’s bag), применением системы отрицательного давления (вакуум-ассистированная лапаростомия) изолированно или в комбинации с латерали-зацией краев апоневроза сетчатым имплантом, а также ведением «открытого живота» комбинированными методиками [6–9]. Тем не менее, несмотря на очевидные преимущества применения лапаростомии при БАТ, данная технология сама по себе сопряжена с высоким риском развития специфичных для метода ранних и поздних послеоперационных осложнений, таких как инфицирование брюшной полости нозокомиальной микрофлорой с развитием третичного перитонита, возникновение наружных кишечных свищей, тотальный интрааб-доминальный спаечный процесс (по типу «замороженного живота»), нагноение лапаротомной раны, латерализация краев апоневроза белой линии и формирование гигантских вентральных грыж. Возникновение данных осложнений не только увеличивает продолжительность и стоимость лечения, но и существенно влияет на увеличение уровня госпитальной летальности [10, 11].
С учетом наличия закономерной корреляции между длительностью существования лапаростомы и частотой возникновения методспецифичных осложнений вполне очевидным является стремление хирургов к раннему закрытию лапаростомы. При этом необходимость первично-фасциального закрытия лапаростомы с соединением краев апоневроза белой линии или допустимость простого ушивания кожи в лапаротомной ране, очевидно создающего модель фиксированной подкожной эвентрации и в последующем – гигантской вентральной грыжи, остается предметом дискуссии [14, 15]. Кроме того, в настоящее время, несмотря на широкое использование лапаростомии при БАТ, отсутствует единая и обоснованная точка зрения на определение критериев возможности, оптимальные сроки и методы закрытия лапаростомы. В этой связи в хирургическом центре ФГБУ «НМИЦ ВМТ им. А.А. Вишневского» Минобороны России проведен анализ особенностей и результатов лечения пациентов с лапаростомой, сформированной в ходе оперативных вмешательств по поводу БАТ на этапах медицинской эвакуации. Целями предпринятого ретроспективного когортного исследования явились выявление ключевых факторов, влияющих на исходы лечения пациентов с лапаростомой, сформированной по поводу БАТ, определение критериев возможности, оптимальных сроков и возможных методов закрытия лапаростомы.
Материалы и методы
Проведен ретроспективный мультифакторный анализ первичной медицинской документации выборки из 304 пациентов, госпитализированных в ФГБУ «НМИЦ ВМТ им. А.А. Вишневского» Минобороны России в период 2022– 2024 гг. включительно с лапаростомой, сформированной в ходе операции по поводу БАТ на этапах медицинской эвакуации. Средний возраст пациентов составил 39,2 ± 9,9 лет.
Критериями включения в исследование являлись: наличие лапаростомы, сформированной на этапах медицинской эвакуации при операциях по поводу проникающих огнестрельных ранений живота; возраст старше 18 лет и моложе 70 лет. Критериями исключения из исследования служили: наличие комбинированного характера травмы; онкологические заболевания органов брюшной полости/состояние после химиотерапии; оценка по шкале SOFA >12 баллов, APACHE II >25 баллов на момент госпитализации, смерть пациента в период госпитализации.
Параметрами анализа явились: клинические показатели (общесоматический и локальный статусы в динамике, особенности, сроки и результаты оперативных вмешательств, наличие интраабдоминальных и раневых осложнений, длительность госпитализации), лабораторные показатели, показатели интегральных шкал (Injury Severity Score – ISS, Sequential Organ Failure Assessment – SOFA, Acute Physiology and Chronic Health Evaluation-II – АPACHE-II, ВПХ-СГ, Ман-геймский индекс перитонита -МИП, Индекс брюшной полости – ИБП), интенсивность интраабдоминального спаечного процесса по M. Bjork, интраабдоминальный микробный пейзаж в динамике.
Для достижения целей исследования вся совокупность пациентов разделена на две клинические группы по критерию методики закрытия лапаростомы: 1 клиническая группа – пациенты с первично-фасциальным закрытием лапаростомы, n=261; 2 клиническая группа – с закрытием лапаростомы кожными швами, n=43.
Обработку результатов исследования проводили статистическими методами, включавшими расчет относительных величин частоты и распределения по исследуемым группам с определением статистически значимых различий между ними путем расчета t-критерия для независимых выборок с нормальным распределением, U-критерия Манна-Уитни – с ненормальным распределением, критерия согласия Пирсона (χ2) для номинальных переменных. Оценку нормальности распределения рассчитывали путем подсчета критериев Колмогорова-Смирнова и Шапиро-Уилка. Различия данных считались достоверными в случаях, если p-критерий не превышал 0,05. Расчеты вероятностей осуществлялись методом логистической регрессии, а также построением кривой Каплана-Маера. Все расчеты проводились с использованием программ Microsoft Excel 2021 – для описательной статистики, сравнительный анализ – в программе Statistica 14.
Результаты исследования
При сопоставлении средних показателей тяжести состояния пациентов 1 и 2 клинических групп на момент госпитализации с этапов медицинской эвакуации в ФГБУ «НМИЦ ВМТ им. А.А. Вишневского» Минобороны России были выявлены достоверные различия (p < 0,05) данных показателей по всем применяемым в исследовании шкалам – ISS, SOFA, APACHE-II, ВПХ-СГ (табл. 1).
Таблица 1
Средние показатели тяжести состояния пациентов с лапаростомой на момент госпитализации в с этапов медицинской эвакуации
Table 1
Average severity of the condition of patients with laparostoma at the time of hospitalization according to the stages of medical evacuation
|
Шкала/ Scale |
1 группа (среднее ± SD*)/ 1 group (average ± SD*) |
2 группа (среднее ± SD*)/ Group 2 (average ± SD*) |
p |
|
ISS |
16,4 ± 4,2 |
24,2 ± 6,9 |
< 0,05 |
|
SOFA |
1,5 ± 1,3 |
2,7 ± 1,7 |
< 0,05 |
|
ВПХ-СГ |
25,8 ± 6,2 |
32,1 ± 5,8 |
< 0,05 |
|
APACHE-II |
3,4± 2,3 |
5,4± 3,1 |
< 0,05 |
*- SD – стандартное отклонение.
Представленные данные демонстрируют факт наличия у пациентов 2 клинической группы достоверно большей тяжести абдоминальной травмы и, как следствие, наличия худших показателей общесоматического статуса с признаками органной дисфункции по сравнению с аналогичными показателями пациентов 1 группы. Таким образом, тяжесть абдоминальной травмы и связанная с ней тяжесть общесоматического статуса являются факторами, лимитирующими потенциальную возможность первично-фасциального закрытия лапаростомы.
При проведении сравнительного анализа 1 и 2 клинических групп по параметру количества поврежденных органов брюшной полости и забрюшинного пространства (табл. 2) установлено, что наиболее уязвимой структурой при БАТ является тонкая кишка, имевшая повреждения более чем у 90 % пациентов в обеих группах. Среднее количество поврежденных органов было несколько большим во 2 клинической группе (2,83 vs. 2,45), однако эта разница статистически недостоверна (р<0,05), как при сравнении показателя между клиническими группами, так и при сравнении с показателем всей выборки. Корреляция между количеством поврежденных органов и методом закрытия лапаростомы (первично-фасциальное закрытие, закрытие швом кожи) практически отсутствует (r = 0,14); количество повреждённых при БАТ органов не оказывает значимого влияния на успешность устранения лапаростомы (критерий хи-квадрат χ0,28=²; р>0,05).
Таблица 2
Количество поврежденных органов брюшной полости и забрюшинного пространства
Table 2
The number of damaged organs of the abdominal cavity and retroperitoneal space
|
Кол-во поврежденных органов/ Number of damaged organs |
1 группа, % /1 group, % |
2 группа, % /group 2, % |
р |
Всего, % / Total, % |
|
1 |
29,0 |
16,7 |
< 0,05* |
22,9 |
|
2 |
25,8 |
23,3 |
> 0,05 |
24,6 |
|
3 |
19,4 |
20,0 |
> 0,05 |
19,7 |
|
4 |
16,1 |
23,3 |
> 0,05 |
19,7 |
|
5 |
6,5 |
13,3 |
< 0,05* |
9,8 |
|
6 |
3,2 |
3,4 |
> 0,05 |
3,3 |
|
Всего/Total |
100 |
100 |
– |
100 |
При сравнении числа этапных санаций, проведенных пациентам 1 и 2 клинических групп установлено, что во 2 клинической группе потребовалось достоверно большее количество оперативных вмешательств по сравнению с 1 клинической группой: максимальное число этапных санаций 11 vs. 5; среднее число санаций 3,9 vs. 2,7, p<0,001. Более чем половине пациентов во 2 клинической группе потребовалось проведение свыше 3 этапных санаций.
В процессе лечения пациентов с БАТ, поступивших с этапов медицинской эвакуации со сформированной лапаростомой, в промежутках времени между этапными санациями использовались три технологии временного закрытия брюшной полости: наложение провизорных кожных швов, вакуум-ассистированная лапаростомия, временная установка в межапоневротический дефект композитного сетчатого импланта (табл. 3, рис. 1). У пациентов 1 клинической группы временное закрытие брюшной полости во всех случаях проводилось наложением провизорных кожных швов. Технологии вакуум-ассистированной лапаростомии и временной установки композитного сетчатого импланта применялась только у пациентов 2 клинической группы с осложненным течением послеоперационного периода. В этой связи закономерно, что использование технологий вакуум-ассистированной лапаростомии и временной установки композитного импланта сопровождалось снижением числа случаев первично-фасциального закрытия лапаростомы в 4,8 раза по сравнению с использованием провизорных кожных швов (95 % ДИ: 2,1–11,3).
Таблица 3
Применение технологий временного закрытия брюшной полости при лапаростомии
The use of technologies for temporary closure of the abdominal cavity in laparostomy
Table 3
|
Технология временного закрытия брюшной полости/ Technology of temporary closure of the abdominal cavity |
1 группа/ Group 1 |
2 группа/ Group 2 |
Всего/ Total |
|
Провизорные кожные швы/ Provisional skin sutures |
100 % |
76,7 % |
88,5 % |
|
Вакуум-ассистированная ла-паростомия/ Vacuum-assisted laparostomy |
– |
16,7 % |
8,2 % |
|
Временная установка композитного импланта/ Temporary installation of a composite implant |
– |
6,6 % |
3,3 % |
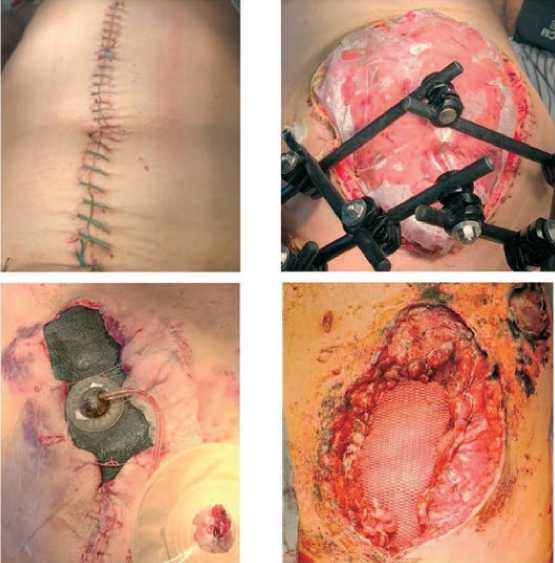
Рис. 1. Технологии лапаростомии в период этапных санаций: а – наложение провизорных кожных швов, б – мешок Боготы (Bogota’s bag), в – вакуум-ассистированная лапаростомия, г – временная установка в межапоневротический дефект композитного сетчатого импланта с медиализацией краев апоневроза
-
Fig. 1. Laparostomy technologies during the stage of rehabilitation: a – application of provisional skin sutures, b – Bogota's bag, c – vacuum-assisted laparostomy, d – temporary insertion of a composite mesh implant into an interaponeurotic defect with medialization of the edges of aponeurosis
Оценка динамики гомеостаза, системного воспалительного ответа и нутритивного статуса у пациентов обеих клинических групп основывалась на сравнении различия лабораторных показателей (С-реактивный белок – СРБ, прокальцитонин – ПКТ, гемоглобин и общий белок) на момент госпитализации и на момент проведения завершающей операции – закрытия лапаростомы (табл. 4).
Отмечено, что у пациентов 2 клинической группы средний уровень ПКТ как на момент госпитализации (12,5±18,3 нг/мл), так и на момент завершающей операции (15,2 ± 20,1 нг/мл) был достоверно выше, чем у пациентов 1 клинической группы (2,8 ± 3,1 нг/мл и 2,5 ± 2,9 нг/мл соответственно), p = 0,02. Аналогично уровень СРБ во 2 клинической группе на момент госпитализации более чем в 2 раза превышал данный показатель у пациентов 1 клинической группы (128,7 ± 98,5 мг/л vs. 56,2 ± 62,4 мг/л) и оставался достоверно более высоким на момент завершающей операции (48,7 ± 55,8 мг/л vs. 142,3 ± 105,6 мг/л), p = 0,01. Указанные различия значений ПКТ и СРБ в клинических группах свидетельствуют об очевидно большей тяжести БАТ и наличии уже на момент госпитализации интраабдоминального и (или) раневого инфекционного процесса у пациентов 2 клинической группы. Тенденция к снижению показателей ПКТ и СРБ у пациентов 1 клинической группы и, напротив, достоверное увеличение данных показателей у пациентов 2 клинической группы указывает на сохраняющийся и прогрессирующий инфекционный процесс, что может косвенно указывать на развитие интраабдоминальных и (или) раневых осложнений. Данный факт коррелирует с достоверным снижением в динамике уровня общего белка (с 52,4 ± 6,1 г/л до 50,2 ± 5,7 г/л; p = 0,03) и гемоглобина (с 92,3 ± 15,4 г/л до 88,6 ± 14,9 г/л; p = 004) у пациентов 2 клинической группы, что может быть связано с персистирующим состоянием катаболизма и отсутствием компенсации по нутритивному статусу.
Таблица 4
Применение технологий временного закрытия брюшной полости при лапаростомии
The use of technologies for temporary closure of the abdominal cavity in laparostomy
Table 4
|
6 III h 1 * |
а |
i +1'- S о Й 5 &Е-2д я§Од Д kz |
1®- i я- 2 2 Q ГГ^ " а (£» |
р |
|
ПКТ, нг/мл |
1 группа/ 1 group |
2,8 ± 3,1 |
2,5 ± 2,9 |
0,45 |
|
2 группа/ 2 group |
12,5 ± 18,3 |
15,2 ± 20,1 |
0,02* |
Окончание Таблицы 4
|
1 ^ W СЛ h! Hi |
Й ЬЛ * "Я S d |
+1 Чч S о Й 5 & £ Q Й-з! е « м Q ^ Д К ^ |
Ш-Is к 1° |
р |
|
СРБ, мг/л |
1 группа/ 1 group |
56,2 ± 62,4 |
48,7 ± 55,8 |
0,32 |
|
2 группа/ 2 group |
128,7 ± 98,5 |
142,3 ± 105,6 |
0,01* |
|
|
Общий белок, г/л/ Total protein, g/l |
1 группа/ 1 group |
55,1 ± 5,3 |
56,8 ± 4,9 |
0,12 |
|
2 группа/ 2 group |
52,4 ± 6,1 |
50,2 ± 5,7 |
0.03* |
|
|
Гемоглобин, г/л/ Hemoglobin, g/l |
1 группа/ 1 group |
98,7 ± 18,2 |
100,5 ± 17,6 |
0,41 |
|
2 группа/ 2 group |
92,3 ± 15,4 |
88,6 ± 14,9 |
0,04* |
*- SD – стандартное отклонение
При оценке внутрибрюшных изменений при первичном оперативном вмешательстве с использованием Мангеймско-го индекса перитонита (МИП) и индекса брюшной полости (ИБП) были выявлены статистически значимые (p<0,001) различия между данными показателями в 1 и 2 клинических группах. Средние значения МИП в 1 клинической группе составили 7,1±2,8 (диапазон 0–16). Во 2 клинической группе среднее значение показателя МИП при первичной операции составило 16,2±7,5 (диапазон 10–32), что указывает на наличие у пациентов данной группы тяжёлого перитонита. Аналогичная картина имела место при сопоставлении средних значений ИБП при первичной операции: 6,7±2,3 (0–12) у пациентов 1 клинической группы и 17,3±6,1 (7–27) у пациентов 2 клинической группы. При этом у пациентов 2 клинической группы были отмечены экстремально высокие значения индексов МИП (до 32) и ИБП (до 27), что ассоциировалось с наличием распространенного перитонита (r=0.54) и сепсиса (r=0.51).
Техническая возможность первично-фасциального закрытия лапаростомы определялась интраоперационным моделированием медиализации и соединения краев апоневроза прямых мышц при контроле внутрибрюшного давления (ВБД). У пациентов 1 клинической группы среднее ВБД в момент закрытия лапаростомы составило 11,9 ± 3,4 мм рт. ст., у пациентов 2 клинической группы показатель ВБД был достоверно выше – 22,4 ± 5,6 мм рт. ст. (p < 0,001, критерий Манна-Уитни). Корреляционный анализ выявил сильную прямую за- висимость (ρ = 0,89, (p < 0,001)), подтверждающую, что ВБД является фактором, определяющим возможность первичнофасциального закрытия лапаростомы.
При сравнении сроков закрытия лапаростомы у пациентов обеих клинических групп были отмечены достоверно более ранние сроки заключительных оперативных вмешательств в 1 клинической группе (3±5,3 суток) по сравнению со 2 клинической группой (10±8,5 суток), p < 0,001. Корреляция между длительностью наличия лапаростомы и возможностью ее первично-фасциального закрытия была установлена с помощью процедуры Kaplan-Meier (рис. 2). Очевидно постепенное снижение с течением времени вероятности первично-фасциального закрытия лапаростомы и реципрокное увеличение вероятности закрытия лапаростомы кожными швами. Ключевая точка разрыва между клиническими группами наблюдается после 7 суток существования лапаростомы: вероятность первично-фасциального закрытия снижается до 76 % (p=0.03), к 10 суткам вероятность первично-фасциального закрытия снижается уже до 50 %, а к 21 суткам – до 30 % (p<0,001).
Для оценки влияния интраабдоминальных и системных послеоперационных осложнений на возможность первично-фасциального закрытия лапаростомы проведен анализ частоты и взаимосвязи осложнений (наличия инфекции в области оперативного вмешательства, сепсиса, энтеростомы, фасциита, кишечных свищей, абдоминального компартмент-синдрома, острого почечного повреждения, венозных тромбоэмболических осложнений, длительной ИВЛ, выраженности спаечного процесса, гемодинамической нестабильности) с вариантом закрытия лапаростомы с учетом кумулятивного эффекта возникших осложнений (табл. 5). Выявлена четкая зависимость между нарастанием числа осложнений и снижением шансов на первично-фасциальное закрытие лапаросто-мы: осложненное течение послеоперационного периода имело место более чем у 50 % пациентов 1 клинической группы и более чем у 95 % пациентов 2 клинической группы.
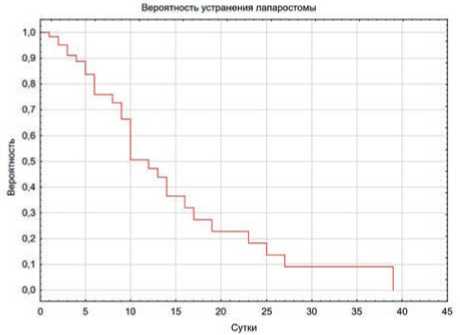
Рис. 2. Расчет вероятности первично-фасциального закрытия в зависимости от сроков устранения лапаростомы
-
Fig. 2. Calculation of the probability of primary fascial closure depending on the timing of laparostomy removal
Таблица 5
Клинически значимые послеоперационные осложнения в клинических группах
Table 5
Clinically significant postoperative complications in clinical groups
|
Осложнение/Complication |
1 группа/ 1 group |
2 группа/ 2 group |
p-value |
|
Перитонит/Peritonitis |
25.8% |
86.2% |
<0.001 |
|
Сепсис/ Sepsis |
19.4% |
65.5% |
<0.001 |
|
Несостоятельность швов/ Suture failure |
12.9% |
55.2% |
<0.001 |
|
Внутрибрюшной абсцесс/ Intra-abdominal abscess |
9,7 % |
34,5 % |
0,02 |
|
Дыхательная недостаточность, ИВЛ/Respiratory failure, ventilation |
12,9 % |
48,3 % |
0,003 |
|
Наличие острого почечного повреждения/ The presence of acute renal injury |
0 % |
13,8 % |
0,04 |
Методом логистической регрессии были выявлены значимые независимые предикторы невозможности первичнофасциального закрытия лапаростомы: распространенный гнойный перитонит (95 % ДИ 2,5–27,6, p<0,001), сепсис (95 % ДИ 1,4–12,0, p=0,009), длительная ИВЛ (95 % ДИ 1,1–13,1, p=0,03). При одновременном наличии более 3 осложнений вероятность первично-фасциального закрытия лапаросто-мы снижается на 58 % (p<0,001). Развитие неполных/полных наружных тонкокишечных свищей исключает возможность первично-фасциального закрытия лапаростомы. При сопоставлении степени выраженности спаечного процесса в брюшной полости у пациентов клинических групп установлено, что спаечный процесс в 1 клинической группе соответствовал 1а и 2а стадиям по M. Bjork. В противоположность этому у пациентов 2 клинической группы спаечный процесс в 44,8 % случаев был классифицирован как ≥2b по M. Bjork.
При оценке динамики интраабдоминального микробного пейзажа в 1 клинической группе во время первой этапной санации брюшной полости у каждого четвертого пациента микробного роста выявлено не было. У пациентов с положительным ростом преобладали грамположительные кокки ( S. aureus, S. saprophiticus, S. epidermidis, S. viridans ) – 53 %. Грамположительные аэробные спорообразующие бактерии рода Bacillus были выявлены у 6,7 % пациентов. Микробные ассоциации грамположительных кокков и грамотрицатель-ных бактерий семейства Enterobacteriaceae выявлены у 13 % пациентов. Степень микробной обсемененности составила 103–105 КОЕ/мл. Фактов микробной резистентности при микробиологических исследованиях в 1 клинической группе выявлено не было.
Во 2 клинической группе микробный пейзаж при проведении первой этапной санации включал в себя аэробную флору – Е. colli – 51 %, Enterococcus spp. – 17 %, Proteus spp. – 16 %, Klebsiella spp. – 14 %, Streptcoccus spp. – 12 %, и анаэробов – Bacteroides spp. – 63 %, Clostridium spp. – 21 %, Peptostreptococcus spp. – 16 %, Peptococcus spp. – 8 %. Степень обсемененности варьировала от 105 до 107 КОЕ/мл и четко коррелировала с источником (уровень повреждения пищеварительной трубки) и длительностью перитонита до операции. К третьей этапной санации отмечалась тенденция к смене микробного пейзажа перитонеального экссудата c появлением в нем полирезистентных нозокомиальных Acinetobacter spp. (11 %), Ps.aeruginosae (13 %) и Klebsiella spp. (12 %) при общем снижении уровня бактериальной обсеме-ненности до 104–106 КОЕ/мл. Последний факт может быть объяснен реализацией эффекта целенаправленной антибактериальной терапии, что при достигнутом контроле за источником инфекции в дальнейшем (4 и 5 санации) приводило к снижению уровня бактериальной обсемененности до 103–105 КОЕ/мл и клиническому разрешению перитонита, несмотря на сохранявшийся качественный состав микрофлоры. У 35,7 % пациентов 2 клинической группы уже при первой санации при уровне обсемененности от 106 до 108 КОЕ/мл в 71 % случаев микрофлора перитонеального экссудата была представлена полирезистентными нозокомиальными штаммами Acinetobacter spp., Ps.aeruginosae, Klebsiella spp., Enterobacter spp . При проведении теста на наличие генов резистентности к гликопептидным и бета-лак-тамным антибиотиков методом ПЦР (БакРезиста GLA) обнаружены гены резистентности – imp, oxa-51-like, ctx-M-1, tem, vanA/B и другие. На второй этапной санации нозокомиальная флора определялась уже более чем в 85 % посевов. На третьей этапной санации у пациентов на фоне достигнутого контроля источника инфекции и тенденции к разрешению органной недостаточности превалирование нозокомиальных штаммов было выявлено только в половине случаев при уровне бактериальной обсемененности 105–106 КОЕ/мл. У пациентов с прогрессирующими перитонитом и органной дисфункцией нозокомиальная флора являлась абсолютно доминирующей с нарастанием бактериальной обсемененности до 108 КОЕ/мл. В первом случае при явлениях разрешающегося перитонита четвертая этапная санация являлась заключительной и сопровождалась устранением лапаростомы. Во втором случае повторные этапные санации (вплоть до 11) не влияли на динамику микробного пейзажа и не сопровождались разрешением перитонита.
Обсуждение
Формирование лапаростомы с проведением последующих санаций брюшной полости на этапах медицинской эвакуации в настоящее время является общепринятой стратегией лечения пациентов с БАТ. Лапаростомия как оперативный прием, завершающий первичное оперативное вмешательство, является неотъемлемой частью концепции многоэтапного хирургического лечения пациентов с БАТ в полной мере позволяет реализовать принципы контроля повреждений и контроля источников инфекции. Тем не менее при всех очевидных преимуществах лапаростомии по сравнению с тактикой релапаротомий «по требованию» при лечении пациентов с БАТ в самом факте наличия лапа-ростомы – обширного дефекта передней брюшной стенки, определяющего возможность контакта брюшной полости с окружающей средой – заложен весьма негативный потенциал, реализуемый при сочетанном действии ряда факторов в образовании наружных тонкокишечных свищей, в развитии тотального спаечного процесса (по типу «заморожениного живота»), в нагноении лапаротомной раны, в латерализации краев апоневроза белой линии и формировании гигантских вентральных грыж [12, 13]. Наличие ла-паростомы у пациентов, находящихся на лечении в отделениях интенсивной терапии, является очевидным фактором риска контаминации брюшной полости полирезистентной нозокомиальной микрофлорой с трансформацией вторичного перитонита в третичный.
C учетом изложенных обстоятельств вполне очевидным является стремление хирургов к закрытию лапаростомы в допустимо ранние сроки с восстановлением всех анатомических слоев передней брюшной стенки для исключения фиксированной подкожной эвентрации и минимизации риска формирования вентральной грыжи. Тем не менее, остаются дискутабельными точные критерии для принятия решения о закрытии лапаростомы в ходе очередной этапной санации и возможности соединения краев апоневроза белой линии при первично-фасциальном закрытии лапаростомы.
Проведенное исследование с анализом выборки пациентов с лапаростомой, сформированной по поводу БАТ на этапах медицинской эвакуации, позволило констатировать следующие факты. Тяжесть абдоминальной травмы и связанная с ней тяжесть общесоматического статуса пациента являются факторами, a priori лимитирующими потенциальную возможность первично-фасциального закрытия лапаростомы. При этом локализация повреждения и количество поврежденных при БАТ органов не являлись факторами, определяющими возможность первично-фасциального закрытия. Напротив, тяжесть системного ответа (шок, сепсис, гиперкатаболизм) на момент госпитализации пациента в медучреждения центра следует считать факторами, лимитирующими возможность первично-фасциального закрытия лапаростомы. При этом отсутствие тенденции к снижению на фоне этапных санаций показателей ПКТ и СРБ, а также сохраняющаяся гипопротеинемия и анемия очевидно являются маркерами персистирующего инфекционного процесса, развития интраабдоминальных и (или) раневых осложнений. Напротив, снижение в динамике показателей ПКТ и СРБ, тенденция к повышению уровня белка и гемоглобина может служить прогностическим признаком возможности раннего первично-фасциального закрытия лапаростомы. Полученные в исследовании результаты подтверждают клиническую ценность МИП и ИБП как объективных критериев тяжести состояния пациентов с БАТ. В этой связи закономерно, что высокие значения этих индексов являются предикторами длительного существования лапаростомы, высокого риска развития ин-траабдоминальных осложнений и невозможности первично-фасциального ее закрытия.
В ходе исследования установлено, что факторами, лимитирующими потенциальную возможность первичнофасциального закрытия лапаростомы также являются такие методы временного закрытия брюшной полости как вакуум-ассистированная лапаростомия и временная установка композитного импланта: использование данных технологий сопровождалось снижением числа случаев первично-фасциального закрытия лапаростомы в 4,8 раза по сравнению с использованием провизорных кожных швов. Величина ВБД, приближавшаяся при моделировании медиализации и соединения краев апоневроза прямых мышц к нормальным физиологическим значениям, определяла возможность принятия решения о первично-фасциальном закрытии. Возможность первично-фасциального закрытия лапаростомы ассоциировалась также с достоверно меньшим количеством проведенных этапных санаций: снятие лапаростомы в период позднее 7 суток от момента первичной операции, как правило, исключало возможность восстановление анатомической структуры передней брюшной стенки и определяло необходимость закрытия лапаростомы кожными швами. Взаимосвязь приведенных факторов заключается в сочетании тяжести интраабдоми-нальных повреждений, висцерального отека с интраабдо-минальной гипертензией, распространенного перитонита, обширных раневых дефектов брюшной стенки, необходимости отсроченной реконструкции тонкой кишки после обструктивных резекций с очевидной необходимостью многократных этапных санаций, установки вак-системы или временного композитного импланта. При этом тотальный инфильтративно-спаечный процесс (по типу «замороженного живота») и латерализация краев апоневроза прямых мышц делали первично-фасциальное закрытие лапаросто-мы практически невозможным.
Анализ динамики интраабдоминального микробного пейзажа при сформированной на этапах медицинской эвакуации лапаростоме позволил сделать следующие выводы. При многократных этапных санациях брюшной полости, независимо от проводимой системной антибактериальной терапии, происходит трансформация микрофлоры перитонеального экссудата с облигатным присоединени- ем нозокомиальных микроорганизмов (Acinetobacter spp., Ps. aeruginosae, Klebsiella spp., Enterobacter spp.) к моменту выполнения третьей этапной санации брюшной полости. Именно в данный момент адекватность контроля источника инфекции и эффект системной антибактериальной терапии определяет направление дальнейшей динамики микробного пейзажа: 1) регресс микробной обсемененности и отсутствие доминирования нозокомиальных штаммов при устранении источника перитонита и его разрешение к 3–5 санациям или 2) прогрессирование бактериального роста при преобладании нозокомиальных штаммов с закономерным негативным исходом третичного перитонита. Таким образом, контроль источника инфекции и адекватная системная антибактериальная терапия делают возможным завершение программы открытого ведения живота третьей санацией брюшной полости с, как правило, первично-фасциальным закрытием лапаростомы. С другой стороны, клиническое и микробиологическое отсутствие разрешения перитонита к моменту третьей санации следует считать маркером неадекватного контроля источника интраабдоминальной инфекции. Несмотря на сохраняющуюся неоднозначность сегодняшних представлений о путях нозокомиального инфицирования брюшной полости (контаминация пищеварительной трубки и транслокация ми-крооганизмов или контактное инфицирование через лапа-ротомную рану), взаимосвязь длительности существования лапаростомы с появлением полирезистентной госпитальной флоры указывает на необходимость по возможности более ранней изоляции брюшной полости от окружающей среды закрытием раны передней брюшной стенки. Дополнительно следует отметить, что продолжение ведения пациентов со сформированной на этапах эвакуации лапаро-стомой по программе открытого живота с лапаростомией является объективно показанной при МИП, превышающем или равном 16 баллам. При меньшем показателе МИП существуют обоснованные предпосылки к закрытию сформированной на этапах эвакуации лапаростомы уже на первой санации в связи с высоким риском контаминации брюшной полости полирезистентной нозокомиальной микрофлорой и трансформацией вторичного перитонита в третичный.
Таким образом, критериями возможности завершения программы этапных санаций и закрытия лапаростомы при БАТ следует считать: 1) разрешение перитонита и отсутствие источников инфекционного процесса в брюшной полости, МИП при первой санации менее 16 баллов; 2) сохраненный пассаж по тонкой кишке (наличие перистальтики, отсутствие механических препятствий пассажу, отсутствие тонкокишечных свищей/энтеростомы) [16, 17]; 3) регресс микробной обсемененности (менее 105 КОЕ/мл) и отсутствие доминирования нозокомиальных штаммов по результатам микробиологического исследования на предшествующей санации. В подавляющем большинстве случаев БАТ контроль источника инфекции и адекватная системная антибактериальная терапия делают возможным закрытие лапаростомы в первично-фасциальном его варианте после третьей санации брюшной полости (7–8 сутки лечения). Отсутствие разрешения перитонита и положительной динамики микробиологического пейзажа к моменту третьей санации следует считать маркером неадекватного контроля источника интраабдоминальной инфекции. Очевидная невозможность первично-фасциального закрытия и необходимость завершения программы этапных санаций кожными швами определяется: наличием наружного кишечного свища, выраженным инфильтративно-спаечным процессом (≥2b по классификации Bjork), обширным раневым дефектом брюшной стенки, невозможностью ме-диализации краев апоневроза прямых мышц, некорригиро-ванная интраабдоминальная гипертензия [18–20].
Заключение
Проведенное исследование иллюстрирует тот факт, что сроки и технология завершения программы этапных санаций при лапаростомии зависят от исходной тяжести БАТ, адекватности контроля интраабдоминального инфекционного процесса и выбора метода временного закрытия брюшной полости. Одним из определяющих факторов успешного лечения пациентов с БАТ следует считать раннее устранение лапаростомы. При этом трансформация совокупности выявленных критериев возможности завершения программы этапных санаций и первично-фасциального закрытия лапаростомы в алгоритмы хирургической тактики является предметом дальнейших исследований.


