Лечение больных гонартрозом внесуставным микрофрактурированием субхондральных зон и костномозговой стимуляцией по методике РНЦ «ВТО»
Автор: Шевцов Владимир Иванович, Макушин Вадим Дмитриевич, Чегуров Олег Константинович, Бирюкова Марина Юрьевна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2009 года.
Бесплатный доступ
Представленная новая медицинская внесуставная технология лечения гонартроза основана на трофостимулирующем эффекте вследствие микрофрактурирования суставных отделов в комбинации с клеточномозговой стимуляцией. Патогенетическим обоснованием применения микропереломов в субхондральных зонах и трансплантации клеточно-тканевой субстанции из костномозгового канала трубчатой кости является создание условий выхода в раневую полость кровяного сгустка с факторами роста, биологически активными веществами и костного мозга с полипотентными мезенхимальными стромальными аутоклетками, что приводит к активизации репаративного хондрогенеза.
Коленный сустав, гонартроз, оперативное лечение, костномозговая стимуляция
Короткий адрес: https://sciup.org/142121232
IDR: 142121232 | УДК: 616.728.3-007.2:
Текст научной статьи Лечение больных гонартрозом внесуставным микрофрактурированием субхондральных зон и костномозговой стимуляцией по методике РНЦ «ВТО»
Согласно данным литературы, современными методами лечения остеоартроза коленного сустава являются хирургические методы с использованием артроскопических операций: абразия субхондральной кости с туннелизацией по Pridie, микрофрактуринг по Steadman, трансплантации: остеохондральные ауто (алло), аутологичных хондроцитов, аутостволовых клеток.
Модификацию микрофрактурирования как разновидности операций костномозговой стимуляции при хронических повреждениях хряща описали А.А. Бурьянов, Ю.Л. Соболевский [1]. Об остеохондральной аутотрансплантации сообщали О.Л. Эйсмонт с соавторами [8]. Несмотря на достаточную разработанность различных артроскопических методик лечения заболеваний хряща остаются не решенными многие вопросы показаний к модификациям внесуставной технологии операций, возникающих осложнений, профилактики и оценки анатомо-функциональных результатов. Недостаточно представлены в литературе сообщения о внесуставных паллиативных деком- прессионно-дренирующих операциях как с объективной медицинской точки зрения, так и субъективного мнения пациентов.
Известно, что современное хирургическое лечение гонартроза должно отвечать следующим требованиям:
-
1. Технически малоинвазивным и простым в выполнении;
-
2. Характеризоваться высокой эффективностью с продолжительным ремиссионным периодом;
-
3. Экономически малозатратным;
-
4. Не исключать возможность в будущем альтернативного хирургического лечения.
В клинике РНЦ «ВТО» при лечении гетерогенного гонартроза разработаны и применяются новые внесуставные методики костномозговой стимуляции в комбинации с микрофрактуриро-ванием субхондральных зон [2, 4, 9, 10].
Целью нашего сообщения является оценка клинико-рентгенологической эффективности нового метода РНЦ «ВТО» у больных гонартрозом.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Нами проанализированы результаты лечения 25 пациентов (29 суставов) в возрасте от 41 до 72 лет (58±1 год) с гетерогенным гонартрозом. У всех пациентов имелась лекарственная зависимость из-за болевого синдрома. Возникала необходимость ортопедической разгрузки сустава (трость или костыль), констатировалось ограничение передвижения, уменьшение толерантности к нагрузке, сниженное самообслуживание и качество жизни. Пациенты до операции обследовались клинически, рентгенологически, сонографически. При помощи МРТ исследования проводились до и после выписки из стационара, а также в сроки от 3-6 месяцев, когда проводили очередное мониторирование. По клинико-рентгенологической классификации, принятой в Центре [7], больных с субком-пенсированной стадией остеоартроза было 15 (17 суставов) декомпенсированной - 10 (12 суставов). Анатомо-функциональные результаты лечения и альгофункциональный индекс изучали по индексным оценкам РНЦ «ВТО» [5, 6].
Всем пациентам выполнена новая методика внесуставного тотального микрофрактурирова-ния субхондральных зон коленного сустава с одновременной костномозговой стимуляцией в терминальных отделах [10]. При этом у 10 (12) больных одновременно выполнялась оперативная коррекция биомеханической оси.
Техническое исполнение методики
Оперативное лечение проводили под эпидуральной анестезией. После обработки нижней конечности раствором антисептика в проекции верхнего отдела костномозговой полости большеберцовой кости сверлом перфорировали передний кортикальный слой большеберцовой кости. В сформированный канал ввинчивали канюлированный винт-фиксатор с мандреном для остеосинтеза. Погружали его конец в костномозговую полость кости. Мандрен удаляли, вместо него в канал винта-фиксатора вводили инъекционную иглу, присоединенную к шприцу (рис. 1).
Осуществляли забор костного мозга с тканевой жидкостью в шприц, посредством вакуумной аспирации из костномозговой полости большеберцовой кости в количестве 2,5-3,0 мл, которое непосредственно после забора разводили стерильным физиологическим раствором 1 : 2. Винт-фиксатор удаляли. На рану накладывали шов и асептическую повязку.
Затем костным перфоратором выполняли веерную субхондральную туннелизацию мыщелков бедренной и большеберцовой костей, косопродольную туннелизацию надколенника. В надколеннике образовывали не менее трех туннелей, но тканевую суспензию не вводили. В каждом мыщелке бедренной и большеберцовой костей формировали субхондрально не менее 4 туннелей (рис. 2). При формировании каждого из 16 туннелей с глубиной до субхондрального слоя по пазу перфоратора в конечную зону туннеля иглой, присоединенной к шприцу, вводили не менее 0,3 мл тканевой жидкости, содержащей прижизненные биологически активные вещества, костный мозг и стромальные клетки из костномозговой полости большеберцовой кости (рис. 3).
Операцию завершали наложением асептических повязок.
После операции на период восстановительного лечения рекомендовали ходьбу с помощью костылей, в последующем с постепенно возрастающей нагрузкой на ногу.
В послеоперационном периоде назначали курс консервативной терапии гонартроза: нестероидные противовоспалительные средства (ортофен), ингибиторы протеаз (контрикал), хондропротекторы и иммуномодуляторы (циклоферон), средства для лечения остеопороза (остеохель «С») и физиолечение. Дозированная нагрузка на конечность с помощью тростей и ЛФК сустава разрешалась на второй день после операции, затем нагрузку рекомендовали постепенно увеличивать до полной с использованием трости.
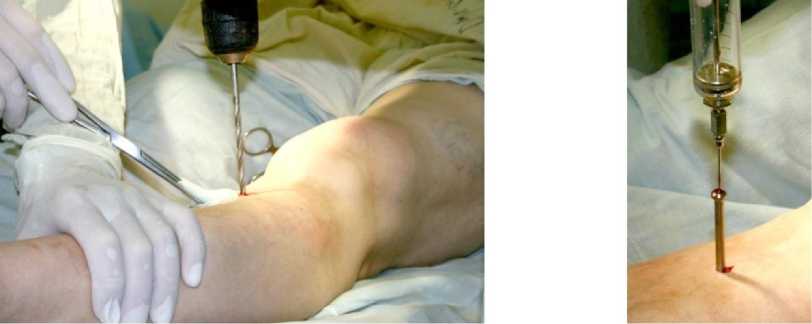
а б
Рис. 1. Фотографии технических приемов во время операции: а - перфорация сверлом переднего кортикального слоя в проекции костномозговой полости большеберцовой кости; б - забор тканевой суспензии из костномозгового канала посредством вакуумной аспирации
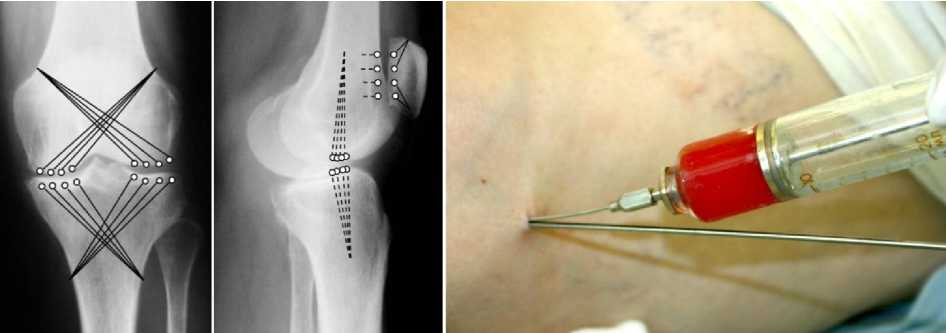
Рис. 2. Схемы образования субхондральных зон активного ремоделирования с введением клеточных элементов при туннелизации мыщелков и надколенника при гонартрозе
Рис. 3. Фотография оперативного приема введение тканевой суспензии по пазу костного перфоратора в терминальный участок туннеля для образования зоны активного ремоделирования
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Двигательный режим положительно сказывался на психо-эмоциональном состоянии пациентов.
Послеоперационный период у всех больных протекал без выраженных соматических нарушений. Осложнений, связанных с применением аутологичной клеточной трансплантации, не наблюдали. Средний срок стационарного лечения, когда выполнялось микрофрактурирование с костномозговой стимуляцией без коррекции биомеханической оси, составил 23±1, а с коррекцией оси – 63±1 день. Снижение или исчезновение болевого синдрома на второй день после операции отмечали все пациенты. При анализе анатомофункциональных результатов лечения от одного года до 3 лет получены следующие данные. У 12 пациентов нормализовалась походка с отсутствием отклонений от ритма. В остальных случаях больные отмечали умеренное нарушение ритма походки и при ходьбе периодически использовали трость. Сопутствующие кисты Бейкера «исчезли» у 4 больных, их имевших, без оперативного вмешательства. Болевой синдром полностью отсутствовал у 23 больных, а у остальных (2) – он был непостоянным и усиливался только при значительной функциональной нагрузке.
В 12 наблюдениях по рентгенограммам отмечалось восстановление конфигурации суставных поверхностей, а у остальных пациентов – улучшение. По данным МР-томографии (14) отмечено увеличение толщины хряща в контактных зонах.
Качество жизни значительно улучшилось у 19 пациентов. В 6 случаях пациенты отмечали ограничение самообслуживания, личных и общественных интересов.
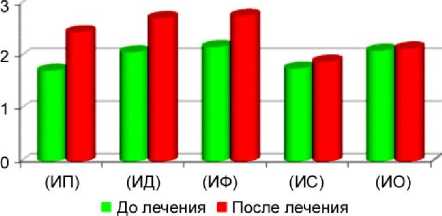
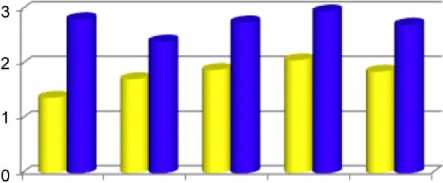
На рисунках 4 и 5 (с табличными данными) приводятся сравнительные индексные критерии
(по 3-балльной системе1), полученные после лечения 25 больных методом туннелизации суставных отделов коленного сустава в сочетании с субхондральной костномозговой трансплантацией в терминальные отделы туннельных каналов 29 суставов.
По всему контингенту лечившихся, средний индекс патологии (СИП) до лечения составлял 1,88±0,04, а после лечения средний индекс реабилитации (СИР) составил 2,57±0,04.
При этом в группе 14 (17) больных, когда наряду с проведением микрофрактурирования и костномозговой стимуляции при гонартрозе производилась оперативная коррекция большеберцовой кости СИП до лечения был равен 1,84±0,07, а после лечения СИР составлял уже 2,55±0,06. При сравнении полученных данных с группой 10 (12) больных, когда предусматривалась оперативная коррекция, средний индекс СИР был выше на 0,7, что свидетельствовало о более высокой эффективности лечения. По нашему мнению, повышение эффективности связано с усилением дренирующего эффекта, вызванного метафизарной остеотомией кости.
Согласно среднему индексу оценки получены следующие анатомо-функциональные результаты лечения больных гонартрозом:
-
1. Хорошие признаны у 19 (21) больных, что составило 76 % наблюдений;
-
2. Удовлетворительные получены у 6 (8) больных, что составило 24 % наблюдений.
Неудовлетворительных исходов лечения в анализируемой группе больных не наблюдалось. Благоприятный ремиссионный период составил до трех лет. Изучение отдаленных анатомо-функциональных результатов лечения продолжается.
1 Отсутствие нарушений оценивали в 3 балла, умеренные нарушения – в 2 балла, а выраженные – в 1 балл.
(ИБ) (ИТ) (ИМС) (ИН) (ИКЖ) До лечения ■ После лечения
|
Индексы |
ИП |
ИД |
ИФ |
ИСС |
ИО |
|
До лечения |
1,72±0,07 |
2,07±0,07 |
2,17±0,06 |
1,76±0,09 |
2,10±0,07 |
|
После лечения |
2,45±0,09 |
2,72±0,07 |
2,76±0,07 |
1,89±0,05 |
2,14±0,07 |
Рис. 4. Сравнительные данные по индексной оценке исходов лечения больных гонартрозом методом субхондрального фрактурирования суставных отделов в сочетании с костномозговой стимуляцией. Достоверность измерений на всех сроках наблюдений Р < 0,001: ИП – походка; ИД - деформация сустава; ИФ – функция; ИСС - склероз субхондральной костной ткани; ИО - остеопороз
|
Индексы |
ИБ |
ИТ |
ИМС |
ИН |
ИКЖ |
|
До лечения |
1,38±0,09 |
1,72±0,07 |
1,89±0,05 |
2,07±0,05 |
1,86±0,05 |
|
После лечения |
2,82±0,05 |
2,41±0,09 |
2,76±0,07 |
2,96±0,01 |
2,72±0,07 |
Рис. 5. Сравнительные данные по индексной оценке исходов лечения больных гонартрозом методом субхондрального фрактурирования суставных отделов в сочетании с костномозговой стимуляцией. Достоверность измерений на всех сроках наблюдений Р < 0,001: ИБ - болевой синдром; ИТ -толерантность к нагрузке; ИМС - мышечная сила; ИН – нестабильность; ИКЖ - оценка больным качества жизни
Сопоставляя полученные данные, можно сформулировать следующее положение: микроф-рактурирование субхондральной кости суставных отделов коленного сустава, в комбинации с костномозговой стимуляцией при остеоартрозе – новый высокотехнологичный вид лечения, позволяющий повысить эффективность лечения больных гетерогенным гонартрозом. Выраженный позитивный эффект достигается как в структурных, так и в функциональных признаках патологии.
Клинический пример.
Больная П., 58 лет, диагноз: левосторонний идиопатический гонартроз II стадии с болевым синдромом. Давность заболевания - 2 года. Лечилась консервативно, принимая анальгетики и хондропротекторы. Эффект лечения был слабо выражен. Испытывала сильные боли в покое и при ходьбе.
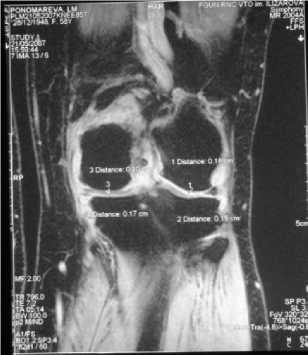
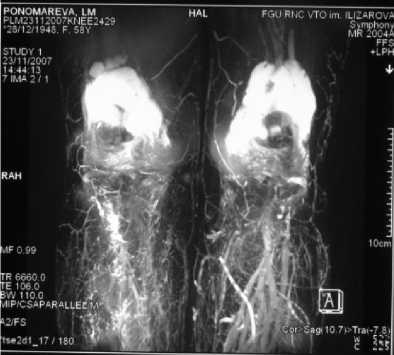
При клиническом обследовании варусного отклонения левой голени при стоянии нет. Сгибательно-разгибательная контрактура левого коленного сустава 90-165º. При пальпации по внутренней поверхности левого коленного сустава отмечала болезненность. На рентгенограмме левого коленного сустава в прямой проекции – признаки гонартроза, характеризующие вторую стадию дегенеративно-дистрофического процесса (субком-пенсированная форма) (рис. 6, а). На МР-томограмме (Т1-режим) левого коленного сустава (рис. 5, а) суставной хрящ до лечения составляет суммарно: в медиальном отделе сустава – 0,27 см, в латеральном отделе – 0,33 см. Определяется трабекулярный отек субхондральных отделов большеберцовой кости. По МР-томограмме (Т2-режим), оценивая кровообращение до лечения (рис. 5, б), в переднезадней и боковой проекциях в области коленного сустава определяется субком-пенсированное кровообращение с бедной артериальной сетью и редкими короткими коллатералями. Сосудистая сеть частично редуцирована, магистральные сосуды спазмированы. Синовиаль- ные завороты сустава увеличены.
Под эпидуральной анестезией после обработки операционного поля в верхний отдел костномозговой полости левой большеберцовой кости после перфорации сверлом кортикальной пластинки со стороны planum tibia ввинчен конюлированный винт-фиксатор с погружением его конца в костномозговую полость. Мандрен удалили и с помощью шприца, соединенного с иглой, получили содержимое из костномозговой полости большеберцовой кости в количестве 2,0 мл, которое развели изотоническим раствором хлорида натрия в пропорции 1:2. Винт-фиксатор удалили. На рану наложили шов и асептическую повязку.
Выполнили косопродольную туннелизацию надколенника с образованием трех туннелей. Затем последовательно произвели веерную субхондральную туннелизацию мыщелков бедренной и большеберцовой костей и по игле, соединенной со шприцем, по пазу костного перфоратора субхонд-рально ввели в разведении 1:2 с физиологическим раствором содержимое из костномозговой полости, содержащее прижизненные биологически активные вещества костного мозга и стромальные клетки по 0,3 мл в конечную зону каждого туннеля. Общее количество туннелей в субхондральных отделах составило 16 (зон активного ремоделирования). На раны наложили асептические повязки.
На второй день после операции больная приступила к ходьбе при помощи костылей с постепенно возрастающей нагрузкой на оперированную конечность. Через 1,5 недели после операции больная отметила отсутствие болей в покое и резкое уменьшение интенсивности болевого синдрома при движении. Увеличилась амплитуда движений в левом коленном суставе (70-180º). Срок стационарного лечения составил 35 дней.
При клиническом осмотре пациентки после выписки из клиники через 6 месяцев болевой синдром отсутствует. Отмечена положительная биологическая динамика структурных элементов в субхондральных зонах. Увеличилась функция сустава: безболезненное полное разгибание и сгибание до 50º. Дистанция стабильной безболезненной ходьбы до 3 км. Больная удовлетворена лечением и отмечает улучшение качества жизни.
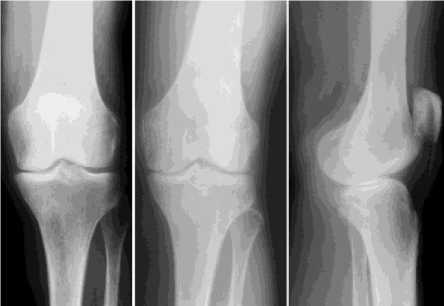
При рентгенологическом обследовании через 6 месяцев после операции (рис. 6, б, в) структура кости в проекции субхондрального слоя мыщелков суставных отделов бедренной и большеберцовой кости улучшена, хрящевая поверхность ровная, склероз субхондрального слоя уменьшился.
На МР-томограмме (Т1-режим) левого коленного сустава (рис. 7, в) суставной хрящ составляет суммарно: в медиальном отделе сустава - 0,33 см, в латеральном отделе - 0,38 см. Определяется уменьшение трабекулярного отека субхондральных отделов большеберцовой кости. При оценке кровообращения на МР-томограмме (Т2-режим) в переднезадней и боковой проекциях в области коленного сустава определяется компенсирован-
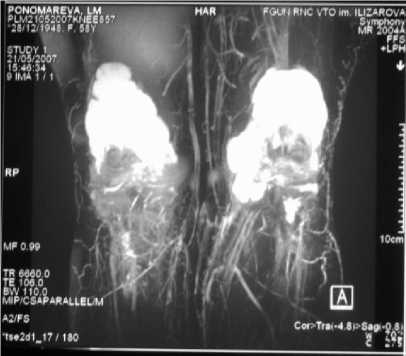
ное кровообращение с множеством развитых коллатералей различного калибра (рис. 7, г). Редукция и спазм сосудистой сети отсутствует. Синовиальные завороты сустава нормальные.
а б в
Рис. 6. Рентгенограммы больной П., 58 лет:
а - до лечения; б, в - через 6 месяцев после лечения
б
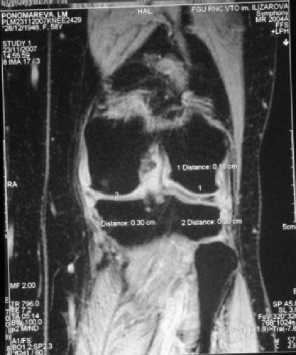
Рис. 7. МР-томограммы больной П., 58 лет: а, б - до лечения (а - на МР-томограмме коленного сустава суставной хрящ составляет суммарно: в медиальном отделе сустава - 0,27 см, в латеральном отделе - 0,33 см. Определяется трабекулярный отек субхондральных отделов большеберцовой кости; б - на МР-томограмме в переднезадней и боковой проекциях в области коленного сустава определяется субкомпенсированное кровообращение с бедной артериальной сетью и редкими короткими коллатералями. Сосудистая сеть частично редуцирована, магистральные сосуды спазмированы. Синовиальные завороты сустава увеличены); в, г - через 6 месяцев после лечения (в - на МР-томограмме коленного сустава суставной хрящ составляет суммарно: в медиальном отделе сустава - 0,30 см, в латеральном отделе - 0,38 см. Уменьшение трабекулярного отека субхондральных отделов большеберцовой кости; г - на МР-томограмме в переднезадней и боковой проекциях в области коленного сустава определяется компенсированное кровообращение с множеством развитых коллатералей различного калибра. Редукция и спазм сосудистой сети отсутствует. Синовиальные затворы сустава нормальные)
г
ЗАКЛЮЧЕНИЕ
Таким образом, новый способ лечения остеоартроза коленного сустава позволяет при использовании малотравматичных оперативных приемов, стимулировать репаративный хондрогенез и потенцировать региональный кровоток. Усиливается трофический эффект в субхондральной зоне. Восстанавливается конфигурация суставных поверхностей и структура субхондральной костной ткани посредством ремоделирования тканевых структур прижизненными биологически активными веществами и стромальными клетками из костномозговой полости большеберцовой кости пациента.
Патогенетическое обоснование оперативного вмешательства заключается в создании условий выхода в раневые терминальные участки (зоны активного ремоделирования) клеток крови с факторами роста и костного мозга с полипотентными мезенхимальными стволовыми аутоклетками [1, 8, 11]. Мы разделяем эту точку зрения [9, 10].
Усиление трофостимулирующего эффекта по нашей технологии достигается введением тканевой суспензии из костномозгового канала большеберцовой кости.
Известно, что расстройство микроциркуляции при гонартрозе вызывает снижение капиллярного кровообращения и ишемию в субхондральной кости. Под влиянием циркуляторных расстройств возникает венозный стаз и гиперемия, уменьшается насыщение кислородом крови в субхондральном слое кости, наступают морфологические изменения костных трабекул, накапливаются костные метаболиты, активирующие протеолитическую активность. Нарушается метаболизм субхондрального слоя и питание хряща. Происходит разрушение протеогликанов хряща, приводящее к его деградации. По нашему мнению при микрофрактурировании субхондральных зон артикулирующих поверхностей сустава потенцирование репаративного хондрогенеза прижизненными биологически активными веществами костного мозга и стромальными клетками из костномозговой полости трубчатой кости с формированием участков активного ремоделирования происходит восстановление постоянства внутритканевого и внутриорганного гомеостаза. В зонах субхондральной кости вскрытых при туннелировании вновь образуются кровеносные сосуды (капилляры). Через стенки сосудов осуществляется обмен веществ между кровью и тканями (воды, ионов, микро-макромолекул клеток, тканевой средой и лимфой). Восстанавливается микроциркуляторная сеть субхондрального слоя. Возникает трофический кооперативный эффект активизации репаративного генеза всех тканей, в том числе и хрящевой. Восстановление трофики приводит к регрессу дегенеративно-дистрофических процессов в суставе. Частичная резорбция кальцифицированного хряща в хрящевом компоненте создает нормальный биологический контакт с прилежащей костью.
Положительная биологическая динамика перестройки структуры хряща и субхондральной костной ткани, выраженный анальгетический эффект и увеличение функции сустава в послеоперационном периоде свидетельствуют об эффективности оперативного пособия и стабильности результата.
ВЫВОД
Предлагаемый способ лечения гонартроза внесуставным микрофрактурированием субхондральных зон и костномозговой стимуляцией по методике РНЦ «ВТО» регулирует местные ме- таболические реакции, повышает репродуктивные свойства хондроцитов, сокращая сроки индукционного хондрогенеза и в настоящее время является новой медицинской технологией.


