Лечение больных раком предстательной железы группы высокого риска (CT3) прогрессирования в ГБУЗ СОКОД
Автор: Воздвиженский Михаил Олегович, Горбачев Андрей Львович, Исаргапов Руслан Маликович, Евсеев Дмитрий Сергеевич
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 3 (39), 2019 года.
Бесплатный доступ
В статье представлен ретроспективный анализ данных историй болезни, амбулаторных карт, данных о смертности больных раком предстательной железы группы высокого риска прогрессирования в ГБУЗ «Самарский областной клинический онкологический диспансер». Изучены 4 методики лечения, - хирургическое лечение с дистанционной лучевой терапией, хирургическое лечение в монорежиме, дистанционная лучевая терапия в комбинации с лучевой терапией, HI-FU терапия в комбинации с лучевой терапией. В группе больных раком предстательной железы высокого риска прогрессирования после хирургического лечения в комбинации с лучевой терапией 8-летняя безрецидивная выживаемость составила 80 %, общая - 82 %. Пятилетние показатели выживаемости статистически не различаются в группах больных хирургического лечения с адъювантной лучевой терапией и без нее. Хирургическое лечение в сочетании с лучевой терапией имеет достоверно лучшие отдаленные показатели выживаемости после 8 лет наблюдения, чем в группе хирургического лечения в качестве монотерапии. Хирургическое лечение в монорежиме имеет достоверно лучшие отдаленные показатели безрецидивной выживаемости и общей выживаемости, чем в группах комбинированного лечения HI-FU терапии с гормональной терапией и лучевой терапии с гормональной терапией.
Рак предстательной железы, хирургическое лечение
Короткий адрес: https://sciup.org/143172224
IDR: 143172224 | УДК: 616-006.66
Текст научной статьи Лечение больных раком предстательной железы группы высокого риска (CT3) прогрессирования в ГБУЗ СОКОД
Введение. Рак предстательной железы в настоящее время является одним из наиболее распространенных злокачественных новообразований у мужчин среднего и пожилого возраста. Наиболее высокая заболеваемость отмечается в индустриально развитых странах, в первую очередь США, Канаде и государствах Европейского Союза, наиболее низкая – в странах Азии. В структуре заболеваемости злокачественными новообразованиями среди мужского населения России по данным за 2016 г. рак предстательной железы занимает 2 место (14 %). В 2016 г. выявлено 38371 случаев впервые в жизни установленных диагнозов рак предстательной железы, в Самарской области 1299 случаев [1]. Столь широкое распространение рака предстательной железы ставит его в ряд наиболее важных социальных проблем современности.
На сегодняшний день существует несколько вариантов классификаций рака предстательной железы по группам риска прогрессирования. В 1998 г. D’Amico и соавт., впервые предложена классификация рака предстательной железы по группам риска прогрессирования, согласно которой к группе высокого группа риска прогрессирования относятся пациенты с уровнем простатспецифического антигена (ПСА) > 20 нг/мл, индексом Глисона 8–10 или клинической стадией ≥ T2c [2]. В практических рекомендациях по лекарственному лечению рака предстательной железы Российского общества клинической онкологии к группе высокого риска прогрессирования относятся пациенты с клинической стадией T3–4 или Глисон ≥ 8 или ПСА >20 нг/мл [3].
По разным данным, почти 20–25 % всех первично диагностируемых случаев рака предстательной железы представлены местно-распространенной формой заболевания [4]. Лечение РПЖ высокого риска, как правило, комбинированное или комплексное. Оптимальное сочетание и последовательность видов лечения остается дискутабельным.
Возможность точно стадировать заболевание предоставляет хирургический метод. При проведении радикальной позадилонной простатэктомии в объем операции входят расширенная тазовая лимфодиссекция, везикулэктомия, апикальная диссекция, удаление сосудистонервного пучка, а также резекция шейки мочевого пузыря, когда опухоль находится у основания, являются обязательными мерами для достижения адекватного локального контроля. [5]. Ряд крупных исследований показывают высокую эффективность хирургического метода лечения [6, 7]. При подозрении на лимфогенную диссеминацию выполнение РПЭ при первичном процессе улучшает выживаемость не только при комплексном подходе, но и при хирургическом лечении как монотерапии [8].
В исследованиях Ward P., et al. и Fallon B., Williams R.D. показаны достоверно лучшие показатели общей выживаемости лечения лучевой терапии в комбинации с гормонотерапии, чем лучевой терапии в монорежиме. [9, 10] В крупном исследовании EORTC 22863 сравнивали лучевую терапию с гормональной терапией и без нее, лучшие результаты безрецидив-ной выживаемости (78 %) достигнуты в группе комбинированного лечения [11].
Цель исследования – оценка результатов лечения больных раком предстательной железы группы высокого риска прогрессирования в ГБУЗ «Самарский областной клинический онкологический диспансер».
Материал и методы. Отдаленные результаты изучены у 212 пациента с клинической стадией cT3a-cT3b, получавших лечение в ГБУЗ СОКОД с 2010 по 2012 г. В качестве методов лечения применялись комбинированное лечение, включающее хирургическое лечение с лучевой терапией, лучевую и HI-FU терапии в комбинации с гормональной терапией, а также хирургическое лечение в монорежиме. Использовалась классификация TNM (7-е издание, 2009 год). Стадирование заболевания производилось на основании клинических данных, уровня ПСА, результатов УЗИ, компьютерной томографии, остеосцинтиграфиии и результатов мультифокальной игольчатой биопсии простаты. Важным критерием включения пациентов в группу исследования являлось исключение метастатического процесса. Под биохимическим рецидивом принималось постоянное повышение уровня ПСА > 0,2 нг/мл в трех измерениях с интервалом ≥ 2 недель.
В связи с задачами исследования больные разделялись в зависимости методики лечения. Сформировано 4 группы:
-
1. Хирургическое лечение с дистанционной лучевой терапией (РПЭ + ДЛТ) 65 пациентов.
-
2. Хирургическое лечение в монорежиме (РПЭ) 40 пациентов.
-
3. Дистанционная лучевая терапия в комбинации с лучевой терапией (ДЛТ + ГТ) 40 пациентов.
-
4. HI-FU терапия в комбинации с лучевой терапией (HI-FU + ГТ) 67 пациентов.
В группе РПЭ+ДЛТ пациентам на первом этапе проводилась радикальная позадилонная простатэктомия с последующей дистанционной лучевой терапией. Средний возраст пациентов составил 63,9 года, среднее значение ПСА крови 15 нг/мл. В группе хирургического лечения пациентам проводилась радикальная позадилонная простатэктомия, средний возраст пациенты составил 66,3 года, среднее значение ПСА крови 15,3 нг/мл. В группе ДЛТ+ГТ пациентам получали гормональную терапию в неоадъювантном режиме с последующей дистанционной лучевой терапией. Средний возраст пациентов составил 69,5 лет, среднее значение ПСА крови 22,7 нг/мл. В группе HI-FU + ГТ пациенты получали гормональную терапию в неоадъювантном режиме с последующим выполнением ТУР HI-FU. Средний возраст пациентов составил 70,5, среднее значение ПСА крови 24,8 нг/мл. Средний возраст пациен- тов в группе РПЭ + ДЛТ 63,9, что является наименьшим показателем во всех группах.
Наиболее возрастные пациенты в группе HI-FU + ГТ (70,5).
Таблица 1
|
Группа |
Параметр |
||||
|
РПЭ + ДЛТ (n = 67) |
РПЭ (n = 40) |
HIFU + ГТ (n = 40) |
ДЛТ + ГТ (n = 65) |
||
|
Средний возраст (годы) |
63.9 |
66,3 |
69,5 |
70,5 |
|
|
Первичный уровень ПСА (нг/мл) |
15 |
15.3 |
22,7 |
24,8 |
|
|
Индекс Глисона |
5 |
8 (12 %) |
2 (5 %) |
5 (12,5 %) |
3 (4,6 %) |
|
6 |
11 (16,4 %) |
11 (27,5 %) |
10 (25 %) |
12 (18,5 %) |
|
|
7 |
34 (50,7 %) |
21 (52,5 %) |
18 (45 %) |
31 (47,7 %) |
|
|
8 |
9 (13,4 %) |
5 (12,5 %) |
6 (15 %) |
14 (21,5 %) |
|
|
9 |
5 (7,5 %) |
1 (2,5 %) |
1 (2,5 %) |
5 (7,7 %) |
|
Расчет выживаемости проводился по методу Kaplan-Meier. Сравнением выживаемости в группах с помощью лог-рангового теста. Критическое значение уровня значимости (р) принимали равным 0,05. Вычисление показателя 5-летней общей и безрецидивной выживаемости.
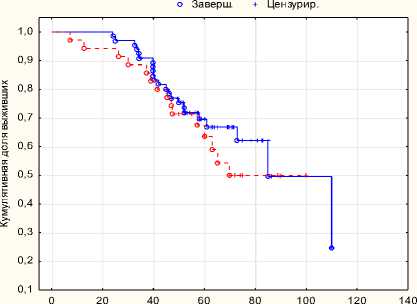
Результаты и обсуждение. При проведении сравнительного анализа групп, не включающих в себя хирургическое лечение, статистически лучшие результаты безрецидивной выживаемости в группе лучевой терапии с комбинации с гормонотерапией (p = 0,00368), в то время как показатели общей выживаемости статистически не различаются.
Кумулятивная доля выживших (Каплан-Мейер)
0 80 100 120 140 ДЛТ+ГТ
Жизни HIFU
Рис. 2. Общая выживаемость ДЛТ + ГТ с HIFU + ГТ p = 0,478
Кумулятивная доля выживших (Каплан-Мейер)
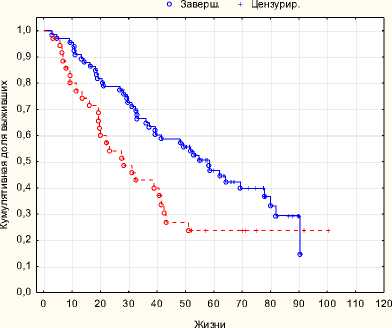
Рис. 1. Безрецидивная выживаемость ДЛТ + ГТ с HIFU + ГТ p = 0,00368
Медиана безрецидивной выживаемости в группе лучевой терапии с гормональной терапией составила 58 месяцев, общей выживаемости 86 месяцев. Медиана безрецидивной вы- живаемости в группе HI-FU терапии с гормональной терапией составила 28 месяцев, общей выживаемости 70 месяцев.
В группе хирургического лечения с адъювантной терапией показатели безрецидивной и общей выживаемости достоверно выше, чем в группах хирургического лечении, лучевой и HI-FU терапии с комбинации с лучевой терапией.
Кумулятивная доля выживших (Каплан-Мейер)
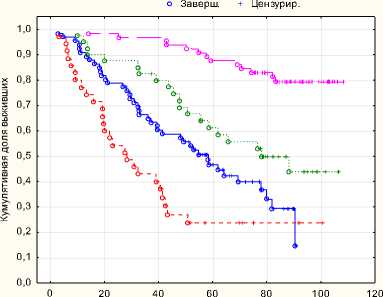
Жизни
Рис. 3. Безрецидивная выживаемость
ДЛТ+ГТ HIFU РПЭ РПЭ+ДЛТ
Кумулятивная доля выживших (Каплан-Мейер)
о Заверш. + Цензурир.
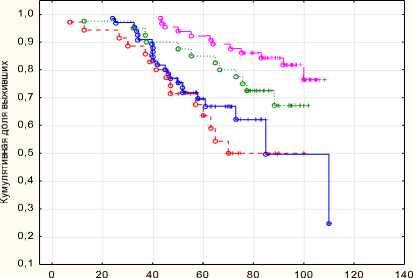
Жизни
Рис. 4. Общая выживаемость
ДЛТ+ГТ HIFU РПЭ РПЭ+ДЛТ
При сравнительном анализе в группе хирургического лечения статистически лучшие показатели безрецидивной и общей выживаемости, чем в группах лучевой терапии с гормональной терапией (p = 0,001 и p = 0,005).
Кумулятивная доля выживших (Каплан-Мейер) о Заверш. + Цензурир.
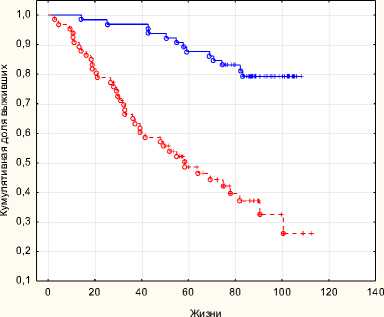
РПЭ+ДЛТ ДЛТ+ГТ
Рис. 5. Безрецидивная выживаемость РПЭ + ДЛТ с ДЛТ + ГТ p = 0,001
Кумулятивная доля выживших (Каплан-Мейер)
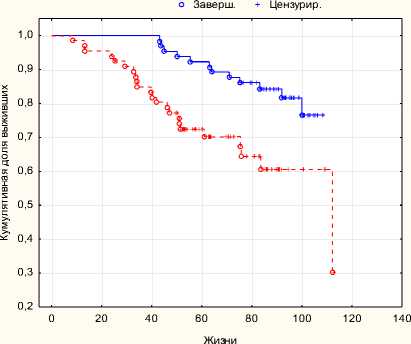
РПЭ+ДЛТ ДЛТ+ГТ
Рис. 6. Общая выживаемость РПЭ + ДЛТ с ДЛТ + ГТ p = 0,005
Так же комбинированное хирургическое лечение показывает статистически лучшие результаты, чем в группе HI-FU терапии с гормональной терапией (p = 0,001 и p = 0,01).
Кумулятивная доля выживших (Каплан-Мейер)
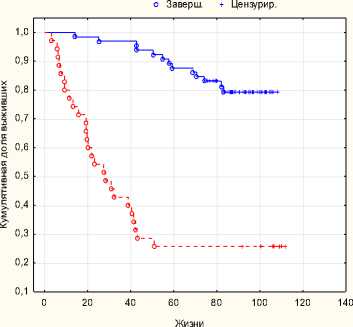
Рис. 7. Безрецидивная выживаемость p = 0,001
Кумулятивная доля выживших (Каплан-Мейер)
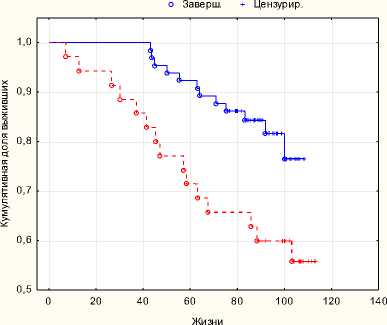
РПЭ+ДЛТ HIFU
Рис. 8. Общая выживаемость p = 0,01
При сравнении групп хирургического лечения с лучевой терапией и без неё изучены пятилетние показатели безрецидивной и общей выживаемости, а также восьмилетние показатели.
Кумулятивная доля выживших (Каплан-Мейер)
о Заверш. + Цензурир.
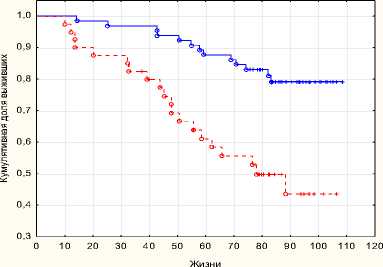
Рис. 9. Безрецидивная выживаемость РПЭ + ДЛТ с РПЭ p = 0,004
Кумулятивная доля выживших (Каплан-Мейер)
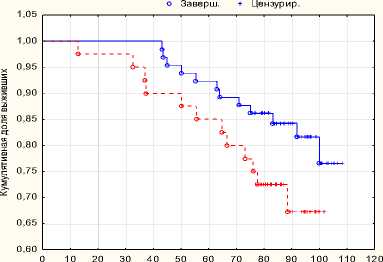
Рис. 10. Общая выживаемость РПЭ + ДЛТ с РПЭ p = 0,04
Пятилетняя безрецидивная выживаемость в группе комбинированного хирургического лечения составила 88 %, в монорежиме 61 %, восьмилетняя безрецидивная выживаемость в группе комбинированного хирургического лечения составила 80 %, в монорежиме 42 %. Пятилетняя общая выживаемость в группе комбинированного хирургического лечения составила 88 %, в монорежиме 61 %, восьмилетняя общая выживаемость в группе комбинированного хирургического лечения составила 80 %, в монорежиме 42 %.
Выводы. Показатели выживаемости больных раком предстательной железы группы высокого риска прогрессирования после хирургического лечения после различных методов лечения в СОКОД представлены в табл. 2.
Применение хирургического метода в лечении больных раком предстательной железы высокого риска прогрессирования, как в монорежиме, так и в комбинации с лучевой терапией достоверно улучшают показатели выживаемости без признаков прогрессии (p < 0,05). Пятилетние показатели общей выживаемости статистически не различаются в группах больных хирургического лечения с адъювантной лучевой терапией и без нее (p = 0,11381), в то время как показатели выживаемости без прогрессии статистически лучше в группе комбини- рованного лечения (p = 0,0035). Хирургическое лечение в сочетании с лучевой терапией имеет достоверно лучшие отдаленные показатели общей выживаемости (82 %) и выживаемости без прогрессии (80 %) после 8 лет наблюдения, чем в группе хирургического лечения в качестве монотерапии (68 % и 42 %).
Таблица 2
|
Параметр |
Пятилетняя безрецидивная выживаемость, % |
Общая пятилетняя выживаемость, % |
Восьмилетняя безрецидивная выживаемость, % |
Общая восьмилетняя выживаемость, % |
|
РПЭ + ДЛТ |
88 % |
92 % |
80 % |
82 % |
|
РПЭ |
61 % |
86 % |
42 % |
68 % |
|
ДЛТ + ГТ |
50 % |
72 % |
— |
— |
|
HIFU + ГТ |
26 % |
71 % |
– |
– |
Список литературы Лечение больных раком предстательной железы группы высокого риска (CT3) прогрессирования в ГБУЗ СОКОД
- Злокачественные новообразования в России в 2017 году (заболеваемость и смертность) / под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. - М.: МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2017. - C. 9, 11.
- D’Amico A.V., Whittington R., Malkowicz S.B. et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA 1998;280(11):969-74. PMID: 9749478.
- Носов Д.А., Гладков О.А., Королева И.А. и др. Практические рекомендации по лечению злокачественных опухолей Российского общества клинической онкологии. - Самара, 2018. - 461 с.
- Bekelman J.E. et al. effectiveness of androgen-deprivation therapy and radiotherapy for older men with locally advanced prostate cancer // Journal of Clinical oncology. - 2015. - Vol. 33. - № 7. - P. 716-722.
- Thompson I.M., Tangen C.M., Paradelo J. et al. Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: long-term follow up of a randomized clinical trial // J Urol. - 2009. - Vol. 181. - P. 956-962.
- Engel J., Bastian P. J., Baur H. et al. Survival benefit of radical prostatectomy in lymph node positive patients. Eur Urol. - 2010. - 57(5). - P. 754-761.
- Dell'Oglio P., Karnes R. J., Joniau S. et al. Very long-term survival patterns of young patients treated with radical prostatectomy for high-risk prostate cancer. Urol Oncol. - 2016. - 34(5). - P. 234.
- Алексеев Б. Я., Нюшко К. М., Воробьев Н. В. и др. Частота и локализация метастазов в лимфатических узлах при выполнении радикальной простатэктомии и расширенной тазовой лимфаденэктомии у больных раком предстательной железы // Онкоурология. - 2012. - № 1. -С. 77-81.
- Warde P., Mason M., Ding K. et al. Combined androgen deprivation therapy and radiation therapy for locally-advanced prostate cancer: a randomized, phase 3 trial. Lancet 2011;378(9809):2104-11.
- Fallon B., Williams R.D. Current options in the management of clinical stage C prostatic carcinoma. Urol Clin North Am1990;17(4):853-66.
- Bolla M., Collette L., van Tienhoven G. et al. Ten year results of long term adjuvant androgen deprivation with goserelin in patients with locally advanced prostate cancer treated with radiotherapy; a phase III EORTC study. Int J Radiat Oncol Biol Phys 2008; 72(1 Suppl.1):30-1.


