Лечение BRAFV600E-позитивного анапластического рака щитовидной железы. Клиническое наблюдение
Автор: Никифорович Петр Алексеевич, Румянцев Павел Олегович, Слепцов Илья Валерьевич, Устинова Татьяна Васильевна, Слащук Константин Юрьевич, Воробьев Сергей Леонидович, Серженко Сергей Сергеевич, Абросимов Александр Юрьевич, Кудрявцева Анна Викторовна, Семенов Арсений Андреевич, Черников Роман Анатольевич, Поляков Андрей Павлович, Феденко Александр Александрович, Болотина Лариса Владимировна, Пайчадзе Анна Александровна, Трушин Александр Юрьевич, Каприн Андрей Дмитриевич, Захарова Галина Сергеевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 5 т.19, 2020 года.
Бесплатный доступ
Анапластический рак щитовидной железы (АРЩЖ) является одной из самых агрессивных и фатальных карцином человека. В мире накоплен опыт системной терапии анапластического рака щитовидной железы различными ингибиторами киназ. Наиболее обнадеживающие результаты получены при использовании комбинации b-Raf и MEK киназных ингибиторов (вемурафениб/дабрафениб и траметиниб/ кобиметиниб соответственно) для терапии нерезектабельного BRAFV600E-позитивного анапластического рака щитовидной железы. По данным литературы, при использовании этой комбинации в качестве неоадъювантной терапии для нерезектабельных опухолей становится возможным проведение дальнейшего хирургического лечения с последующей послеоперационной таргетной терапией и дистанционной лучевой терапией. В статье описан клинический случай АРЩЖ с применением неоадъювантной таргетной терапии. Лечение проводилось на базе трех медицинских учреждений: НМИЦ радиологии (г. Москва), Клиники высоких медицинских технологий им. Н.И. Пирогова (г. Санкт-Петербург) и НМИЦ эндокринологии (г. Москва). Акцент сделан на учете ошибок при диагностике и лечении данного диагноза, так как до сих пор не существует универсального протокола его лечения, а в большинстве случаев возможно проведение только паллиативной терапии. Особое внимание уделено важности применения молекулярной диагностики и современных технологий медицинской визуализации.
Анапластический рак щитовидной железы, таргетная терапия, неоадъювантная терапия, мутация brafv600e
Короткий адрес: https://sciup.org/140254375
IDR: 140254375 | УДК: 616.441-006.6-08 | DOI: 10.21294/1814-4861-2020-19-5-131-144
Текст научной статьи Лечение BRAFV600E-позитивного анапластического рака щитовидной железы. Клиническое наблюдение
Анапластический рак щитовидной железы (АРЩЖ) является чрезвычайно агрессивной злокачественной опухолью с медианой общей выживаемости 3–5 мес [1]. Составляя 1–2 % среди всех карцином щитовидной железы, АРЩЖ является причиной не менее 50 % летальных исходов [2]. Очень редко АРЩЖ развивается спонтанно, в большинстве случаев в результате потери дифференцировки дифференцированного рака щитовидной железы (ДРЩЖ) или иных фолликулярных неоплазий, в клетках которых возникают драйвер- ные мутации (ранние мутационные события), чаще в гене BRAF и генах семейства RAS [3].
В целом АРЩЖ характеризуется значительно большей мутационной нагрузкой по сравнению с ДРЩЖ из-за активации поздних мутационных явлений (мутаций TP53, TERT и PIK3CA ), которые называют мутациями опухолевой агрессии. АРЩЖ характеризуется быстрым инвазивным ростом с прорастанием жизненно важных органов и структур и диссеминацией карциномы, что изначально снижает шансы на радикальную резекцию первичной опухоли и метастазов на шее [4].
Попытки радикальных операций (ларингэктомия, эзофагоэктомия) часто приводят к существенному ухудшению качества жизни пациента, не оказывая значимого влияния на ее продолжительность. Хирургическое лечение с последующей химио-лучевой терапией (ХЛТ) продемонстрировало некоторый положительный эффект в повышении выживаемости, однако у большинства пациентов возникает локальный и/или регионарный рецидив, а чаще всего реализуются отдаленные метастазы, приводящие к летальному исходу [5].
Из всех драйверных мутаций при АРЩЖ только BRAF V600E продемонстрировала возможность проведения таргетной терапии ингибиторами киназ. Комбинация дабрафениб (селективный b-Raf-ингибитор) и траметиниб (селективный МEK-ингибитор) на основании результатов лечения 16 пациентов одобрена FDA в 2018 г. для применения при BRAF V600E -позитивном АРЩЖ [6, 7]. В 1 (6,3 %) из 16 случаев был достигнут полный ответ и у 10 пациентов зарегистрирован частичный ответ на лечение. Медиана общей выживаемости не была достигнута (ожидаемая продолжительность общей выживаемости составила 12 мес в 80 % случаев). То есть применение таргетной терапии показало многообещающие результаты в лечении АРЩЖ при наличии соматической мутации BRAF V600E .
Представленное наблюдение демонстрирует опыт лечения пациентки с BRAFV600E- положительным АРЩЖ с применением таргетной терапии. Лечение проводилось на базе трех медицинских учреждений: НМИЦ радиологии (г. Москва), Клиники высоких медицинских технологий им. Н.И. Пирогова (г. Санкт-Петербург) и НМИЦ эндокринологии (г. Москва).
Клинический случай
Больная 69 лет, в мае 2019 г. отметила жалобы на повышение температуры до 38 оС, пальпируемое образование в проекции левой доли щитовидной железы, болевой синдром. Обследована в МНИОИ им. П.А. Герцена, где по данным трепан-биопсии образования шеи выявлен недифференцированный рак трабекулярного строения. В июне 2019 г. выполнено МРТ шеи (рис. 1), дополненное КТ шеи и органов грудной клетки (рис. 2). При исследовании драйверных мутаций в ткани метастаза в лимфатическом узле методом RT-PCR выявлена мутация BRAFV600E.
На основании данных анамнеза, инструментального и морфологического исследования установлен клинический диагноз: Анапластический рак щитовидной железы IVB стадии (сT2N1aM0). По данным генетического исследования анапластический рак относится к BRAFV600E-положительной форме.
С учетом объема поражения, вовлечения яремной вены и общей сонной артерии опухоль признана нерезектабельной. По жизненным пока-
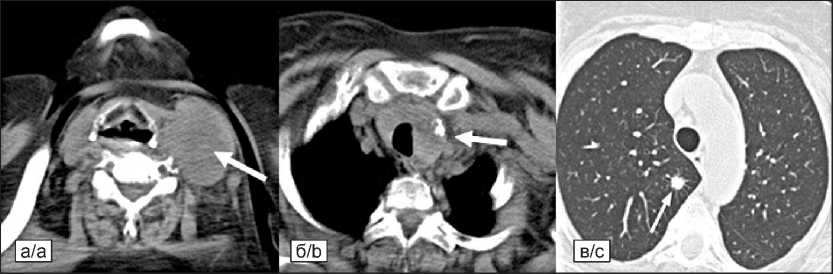
Рис. 1. КТ (06.2019): а) в н/3 шеи слева определяется лимфатический узел, размерами 55×45×45мм; б) образование левой доли щитовидной железы, размерами 26×29×16мм; в) образование 8×9мм в S2 с лучистым контуром единичный бронхопульмональный лимфоузел, размерами до 14×11мм
Fig. 1. СT scan (June 2019): a) lymph node measuring 55×45×45mm in the lower third of the neck on the left; b) lesion measuring 26×29×16mm in the left thyroid lobe; c) lesion measuring 8×9 mm in S2 with a radiant contour, single bronchopulmonary lymph node up to 14×11 mm
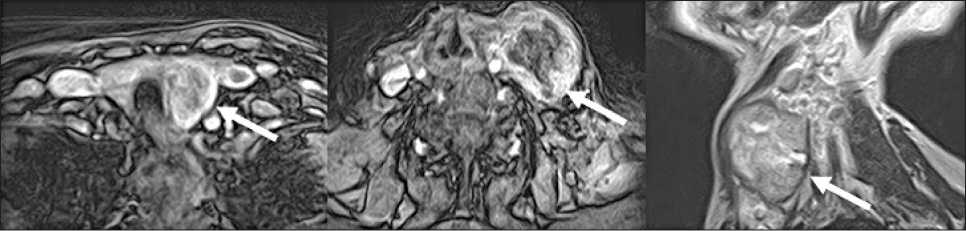
Рис. 2. МРТ (06.2019): образование левой доли щитовидной железы с вовлечением близлежащих сосудов шеи, размерами 50×40×46 мм, аксиальные и сагиттальный срезы. Вовлечение левой общей сонной артерии и левой внутренней яремной вены Fig. 2. MRІ (June 2019): lesion in the left thyroid lobe with the involvement of nearby vessels of the neck, axial and sagittal sections (50×40×46 mm). Іnvolvement of the left common carotid artery and the left internal jugular vein
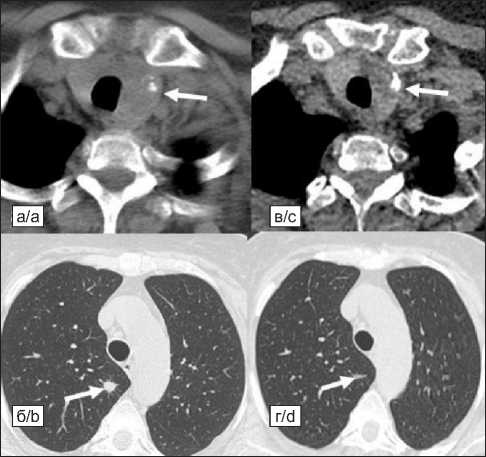
Рис. 3. КТ в динамике на фоне системной терапии, в сравнении с 06.2019 (а, б) и 10.2019 (в, г): уменьшение размеров образования левой доли щитовидной железы и образования S2 правого легкого по данным КТ (точные размеры затруднительно отразить из-за отсутствия контрастирования первой
КТ). Увеличенный бронхопульмональный лимфатический узел справа, единичные очаговые образования легких (в режиме МІP)
Fig. 3. СT scan: a decrease in the size of the lesion in the left thyroid lobe and in the size of the lesion in S2 of the right lung (the exact size is difficult to determine due to the lack of contrasting of the first СT scan). Enlarged bronchopulmonary lymph node on the right, single focal lung lesions (in MІP mode)
заниям с учетом наличия b-Raf+ статуса опухоли рекомендовано проведение таргетной терапии ингибитором b-Raf в комбинации с ингибитором MEK. Проведено 2 курса по схеме вемурафениб 960 мг, перорально 2 раза в день + кобиметиниб 60 мг, перорально в 1–21-й дни, с перерывом 7 дней. На фоне лечения пациентка отметила уменьшение образования на шее, снижение температуры до субфебрильных значений. Лекарственное лечение перенесла удовлетворительно, без выраженных побочных эффектов.
По завершении двух курсов терапии отмечена положительная динамика по данным КТ в сравнении с предыдущим исследованием (рис. 3). Опухоль признана резектабельной, пациентка направлена на хирургическое лечение в Клинику высоких медицинских технологий им. Н.И. Пирогова (Санкт-Петербург). В октябре 2019 г. выполнено хирургическое лечение в объеме тиреоидэктомии и боковой шейной лимфаденэктомии (II–V уровни) с резекцией левой внутренней яремной вены, иссечением коротких мышц шеи с использованием интраоперационного нейромониторинга. При операции: опухоль резко уплотнена, окружена фиброзом, вовлекающим жировую клетчатку, мышцы шеи. Визуализированы все околощитовидные железы, верхние и нижние гортанные нервы (в опухоль не вовлечены). Операция произведена в объеме R0 (подтверждено гистологическим исследованием), с сохранением гортанных нервов с обеих сторон, околощитовидных желез. В послеоперационном периоде функция гортани сохранена, уровень кальция и парат-гормона в пределах референсных значений. Заживление первичным натяжением.
Гистологическое заключение (29.10.19): рак щитовидной железы смешанного строения, анапластический рак (недифференцированная карцинома), плоскоклеточный вариант, с массивным десмопластическим компонентом, очаговыми некрозами, с ростом опухоли в окружающих мягких тканях с участками предсуществующего папиллярного рака; установлены метастазы в лимфатических узлах лишь компонента папиллярного рака без некротических изменений. Существенное уменьшение размеров опухоли, массивный преобладающий десмопластический компонент и некрозы в анапластическом компоненте карциномы отнесены к признакам выраженного лечебного патоморфоза.
При исследовании операционного материала, наряду с гистологической оценкой, выполнены исследования ИГХ-профиля и PD-L1-статуса диморфной опухоли. Клетки недифференцированного рака интенсивно экспрессировали Pax8, умеренно – CK19 и р53, очагово слабо – р63 и TTF1, не экспрессировали Tg; индекс пролиферативной активности Ki67 достигал 30–35 %; PD-L1 (SP263, Ventana) статус оценен как положительный (экспрессия в 80 % опухолевых клеток, экспрессия в 8 % клеток иммунного сопровождения); CPS >1 %. ИГХ-профиль участков папиллярной карциномы отличался интенсивной экспрессией TTF1, Tg, Pax8, CK19 при негативных р63 и р53 и также высоком индексе пролиферативной активности Ki67 – до 25 %; PD-L1 (SP263, Ventana) статус отрицательный (рис. 4).
Пациентке рекомендовано продолжение тар-гетной терапии с параллельным проведением дистанционной лучевой терапии (ДЛТ).
В дальнейшем пациентка обратилась в Институт онкоэндокринологии НМИЦ эндокринологии. Пациентка самостоятельно отменила прием тар-гетной терапии. Лучевая терапия не проводилась. Учитывая данные гистологического заключения о наличии ткани папиллярного рака щитовидной железы с участками высококлеточного варианта и метастазами дифференцированного рака в лимфатические узлы шеи, принято решение провести терапию радиоактивным йодом с целью аблации остаточной тиреоидной ткани и дополнительного стадирования опухолевого процесса.
В ноябре 2019 г. была проведена терапия радиоактивным йодом, активностью 131I 5,64 ГБк. (лабораторно, на фоне экзогенной стимуляции рекомбинантным человеческим тиреотропным гормоном: ТТГ – 120,2 мМЕ/л, АТ к ТГ – 10,0 МЕ/мл,
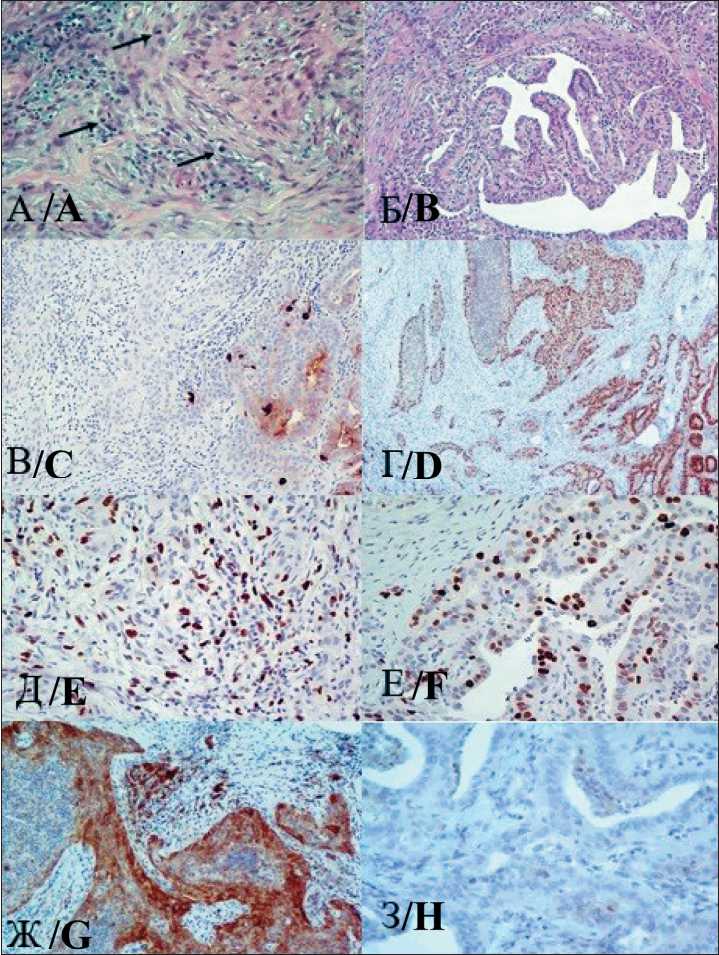
Рис. 4. Гистологическое исследование: А) Анапластическая карцинома, сквамоидный вариант; множественные митозы (указаны стрелками); окраска гематоксилином и эозином; Б) Участки папиллярного рака, tall cell вариант; окраска гематоксилином и эозином;
В) ИГХ-исследование: сохранение экспрессии тиреоглобулина в клетках папиллярного рака (справа), отсутствие экспрессии в участках анапластического рака (слева);
Г) ИГХ-исследование: сохранение экспрессии Pax8 в клетках папиллярного рака (справа), в клетках анапластического рака (слева); ×100; Д) ИГХ-исследование: индекс пролиферативной активности Ki67 в клетках папиллярного рака 25 % (справа); Е) в клетках анапластического рака 40 % (слева);
Ж) PD-L1 статус позитивный в клетках анапластического рака; ×200;
З) ИГХ-исследование: PD-L1 статус папиллярного рака – негативный Fig. 4. Histological examination:
-
А) Аnaplastic carcinoma, squamoid variant; multiple mitoses (indicated by arrows); coloring of hematoxylin and eosin; B) Аreas of papillary cancer, tall cell variant; coloring of hematoxylin and eosin; С) ІHС study: retention of thyroglobulin expression in papillary cancer cells (right), no expression in areas of anaplastic cancer (left);
-
D) ІHС study: preservation of Pax8 expression in papillary cancer cells (right), in anaplastic cancer cells (left);
×100; E) ІHС study: The index of proliferative activity Ki67 in papillary cancer cells is 25 % (right);
-
F) in anaplastic cancer cells 40 % (left); G) PD-L1 status is positive – in anaplastic cancer cells; ×200; H) ІHС study: PD-L1 papillary cancer status – negative
ТГ – 8,09 нг/мл). На третьи сутки выполнена посттерапевтическая сцинтиграфия и ОФЭКТ/ КТ (рис. 5).
Учитывая полученные данные, нельзя было исключить местный рецидив. Для дифференциального диагноза между остаточной опухолевой тканью и гематомой было выполнено МРТ с контрастом (28.11.19), по результатам которого данных, подтверждающих прогрессирование опухоли, не получено (рис. 6). Учитывая гистологическое заключение, хирургическую резекцию в объеме R0, данные сцинтиграфии и МРТ шеи, в ходе консилиума с Клиникой высоких медицинских технологий им. Н.И. Пирогова рекомендовано динамическое наблюдение с ПЭТ/КТ (18F-ФДГ) контролем (рис. 7). Проведение ДЛТ невозможно в связи с наличием послеоперационной гематомы.
Пациентка продолжала наблюдаться, соматическое состояние оставалось удовлетворительным, без жалоб. Принимала левотироксин натрия в супрессивной дозировке 175 мкг, таргетная терапия не проводилась. По данным контрольного КТ шеи и органов грудной клетки (5.03.2020) отмечена картина прогрессирования заболевания (рис. 8), в связи с чем рекомендовано возобновить прием таргетной терапии ингибиторами b-RAF и МEK «ex juvantibus». На фоне таргетной терапии пациентка отметила выраженную положительную динамику: отсутствие кашля, слабости, субфебрильной температуры. Для оценки динамики размеров опухолевых очагов на фоне таргетной терапии рекомендовано контрольное обследование, включая ПЭТ/КТ18F-ФДГ.
В настоящее время продолжает принимать вемурафениб + кобиметиниб с ПЭТ-КТ контролем
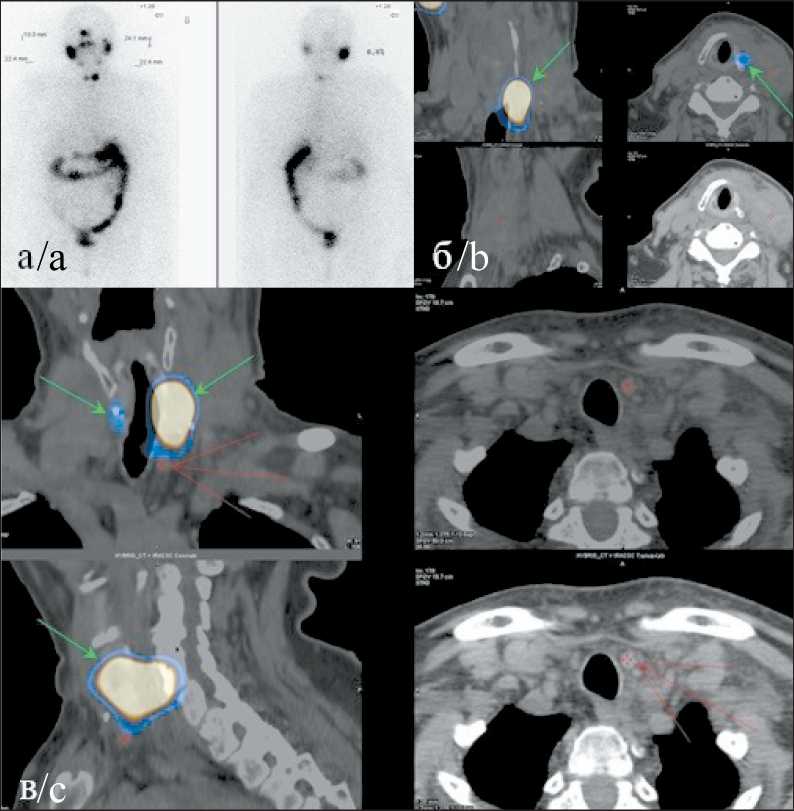
Рис. 5. Сцинтиграфия и ОФЭКТ/КТ (18.11.19):
-
а) на посттерапевтических сцинтиграммах в проекции ложа щитовидной железы определяются два очага гиперфиксации радиофармпрепарата (РФП) – 0,8 % от счета над всем телом; б, в) при ОФЭКТ/КТ очаги гиперфиксации РФП паратрахеально справа и слева – соответствуют накоплению в остаточной тиреоидной ткани (зеленая стрелка). На шее слева, на уровне щитовидного хряща, в проекции грудино-ключично-сосцевидной мышцы определяется мягкотканое образование с нечеткими контурами на нативных сканах, неоднородной плотности, размерами 43×21×50 мм, без признаков накопления 131І. Множественные лимфатические узлы, определяющиеся на уровне яремной вырезки, паратрахеально с обеих сторон, претрахеально, макс. размерами справа – до 6×4×5 мм, слева – до 11×6×12 мм, без признаков накопления 131І І (красная стрелка). В правом легком в S3, S6, S9 очага размерами 2×2 мм; в S2 при настоящем исследовании описанный ранее очаг не визуализируется (поствоспалительного генеза?)
Fig. 5. Scintigraphy and SPEСT/СT (18.11.19):
-
a) on post-therapy scintigrams in the projection of the thyroid bed, two foci of hyperfixation of the radiopharmaceutical (RFP) are determined – 0.8 % of the count over the whole body; b, c) in SPEСT / СT, the foci of RP hyperfixation paratracheally on the right and on the left correspond to the accumulation in the residual thyroid tissue (green arrow). On the neck on the left, at the level of the thyroid cartilage, in the projection of the sternocleidomastoid muscle, a soft tissue lesion with fuzzy contours on native scans, heterogeneous density, measuring 43×21×50 mm, without signs of accumulation of 131І І is determined. Multiple lymph nodes, defined at the level of the jugular notch, paratracheal on both sides, pretracheal, max. dimensions on the right – up to 6×4×5 mm, on the left – up to 11×6×12 mm, without signs of accumulation of 131І І (red arrow). Іn the right lung in S3, S6, S9, the lesion is 2×2 mm in size; in S2 in the present study, the previously described focus is not visualized (post-recovery genesis?)
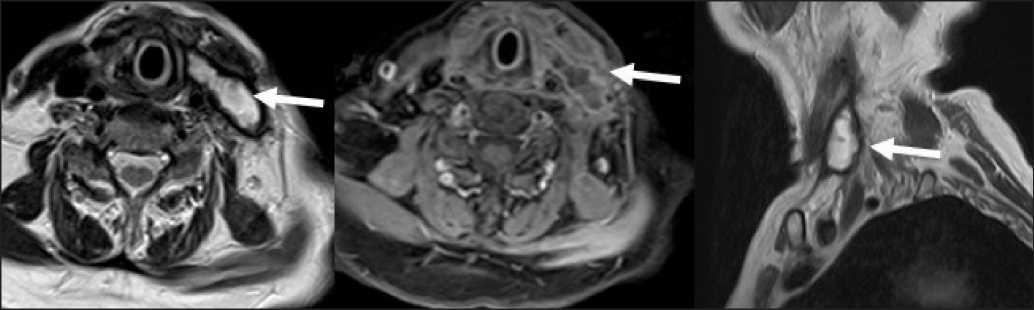
Рис. 6. МРТ шеи (28.11.19). Данная картина соответствует послеоперационной гематоме в мягких тканях нижней трети шеи слева, размерами 43×16×37мм
Fig. 6. MRІ of the neck (28.11.19). This image corresponds to the postoperative hematoma in the soft tissues of the lower third of the neck on the left (43×16×37mm)
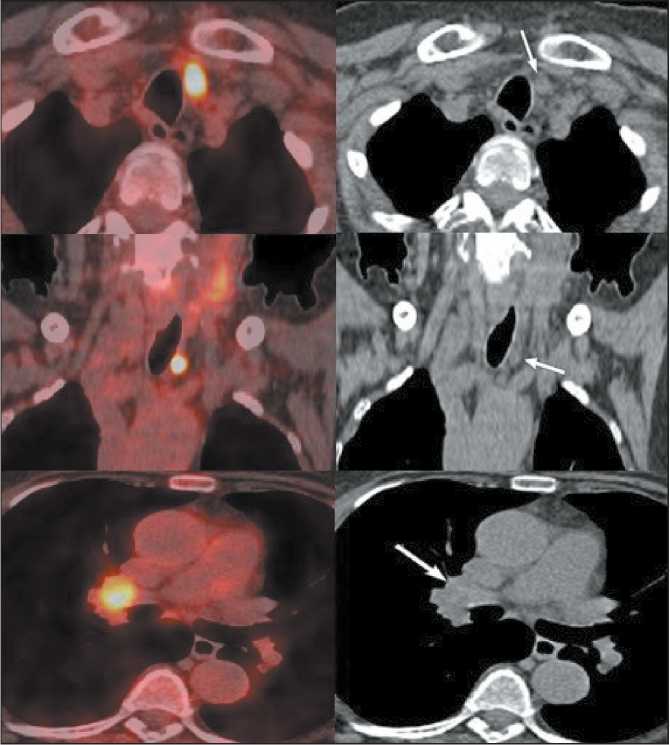
Рис. 7. ПЭТ/КТ с 18F-ФДГ (17.12.19): в ложе щитовидной железы слева и кпереди от трахеи лимфатический узел, размерами 13×9 мм с гиперфиксацией 18F-ФДГ, SUVmax 27,46 (по данным сцинтиграфии этот лимфатический узел не накапливал 131І І). В корне правого легкого в верхней доле визуализируется образование, размерами 26×32 мм
Fig. 7. PET/СT with 18F-FDG (17.12.19). Іn the thyroid bed to the left and anterior to the trachea, a 13×9 mm lymph node with hyperfixation of 18F-FDG, SUVmax 27.46 is visualized (according to scintigraphy, this lymph node did not accumulate 131І І ). Аt the root of the right lung in the upper lobe, a lesion measuring 26×32 mm is visualized
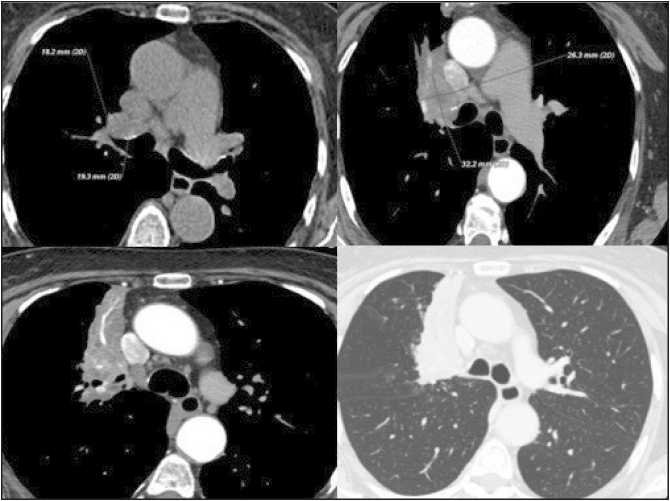
Рис. 8. КТ (5.03.20): центральное образование верхней доли правого легкого с формированием субсегментарного ателектаза, инвазией правого верхнедолевого бронха, верхней ветви правой легочной артерии
Fig. 8. СT scan (5.03.20): central lesion of the upper lobe of the right lung with the formation of subsegmental atelectasis, invasion of the right upper lobe bronchus, the upper branch of the right pulmonary artery
каждые 2–3 мес, по данным которого отмечается разнонаправленная динамика (рис. 9). Самочувствие пациентки удовлетворительное. Период наблюдения к июлю 2020 г. составил 12 мес.
Обсуждение
В настоящий момент стратегия лечения пациентов с АРЩЖ зависит от молекулярно-генетического портрета и распространенности опухоли на момент выявления (без TNM). Из данного наблюдения мы
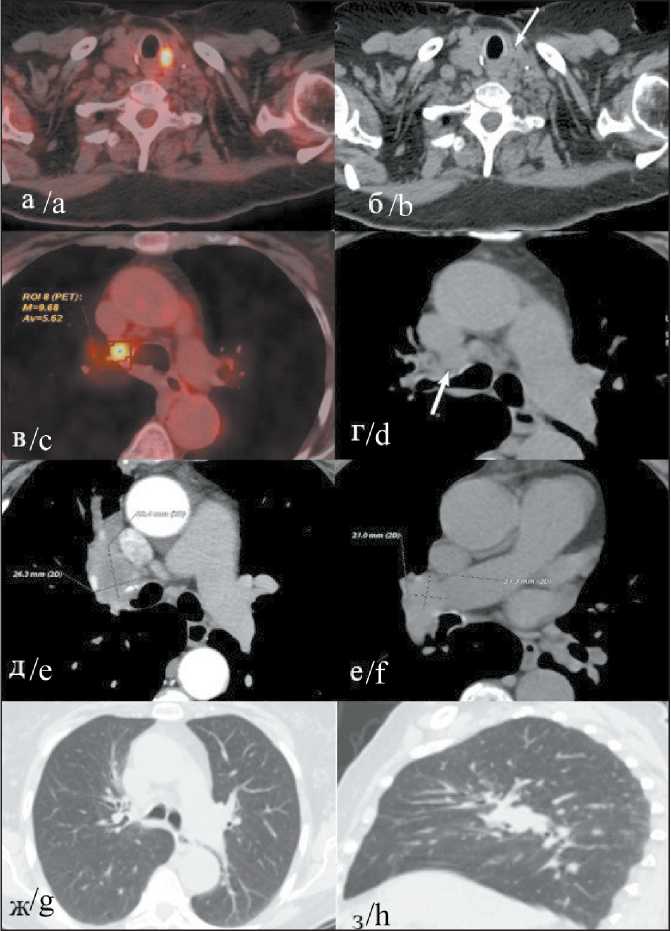
Рис. 9. ПЭТ/КТ с 18F-ФДГ (15.06.20): на фоне проведения повторного курса таргетной терапии отмечается разнонаправленная ПЭТ/КТ-динамика: появление фокуса гиперфиксации 18F-ФДГ в ложе щитовидной железы, паратрахеально слева, без четкой анатомической визуализации дополнительных структур (локальный рецидив?) (а, б); снижение метаболической активности в левом верхнем паратрахеальном лимфоузле; появление гиперфиксации 18F-ФДГ в правом нижнем паратрахеальном лимфоузле (в, г); снижение метаболической активности в бифуркационном лимфоузле; уменьшение размеров (д, е) и метаболической активности правого медиастинального лимфоузла; разрешение субсегментарного ателектаза в верхней доле правого легкого (ж, з) Fig. 9. PET / СT with 18F-FDG (15.05.20): 18F-FDG hyperfixation in the thyroid bed, paratracheally on the left, without clear anatomical visualization of additional structures (local relapse?) (a, b); decreased metabolic activity in the upper left paratracheal l / y; hyperfixation of 18F-FDG in the right lower paratracheal lymph node (c, d); decrease in metabolic activity in the bifurcation lymph node; decrease in the size (e, f) and metabolic activity of the right mediastinal lymph node; resolution of subsegmental atelectasis in the upper lobe of the right lung (g, h)
видим, что точно поставить диагноз возможно только при суммировании данных молекулярногенетических и морфологических исследований, рентгенологической и клинической картины. При диагностике АРЩЖ не всегда возможно получить точное морфологическое заключение. В нашем случае диагностический поиск происходил между низкодифференцированным и анапластическим раком щитовидной железы. Решающими факторами в выборе тактики лечения стали оценка клинической картины, динамики роста опухоли и наличие мутации BRAF V600E (происхождение опухоли из клеток папиллярного РЩЖ, гистотип из высоких клеток). Ранее терапия АРЩЖ ингибиторами b-RAF и MEK была описана в случае нерезектабельно-го BRAF V600E-положительного АРЩЖ, однако в данном случае не удалось перевести опухоль в резектабельное состояние [8].
Данный клинический случай заставил обратить внимание на важность проработки и обсуждения основных моментов диагностики и этапности лечения АРЩЖ, соблюдение которых позволяет в дальнейшем повысить шансы пациента на увеличение общей и безрецидивной выживаемости.
В качестве первичной диагностики и стадиро-вания опухолевого процесса рутинно применяются МРТ и КТ с внутривенным контрастированием, позволяющие определять границы опухоли, оценить вовлечение сосудов и инвазию в окружающие ткани, выявить отдаленные метастазы. Однако применение гибридных методов радионуклидной диагностики, таких как ПЭТ/КТ, в дополнение к стандартным диагностическим методикам может в значительной степени помочь оценить распространенность опухоли, подобрать оптимальный вариант терапии и ее последовательность, а также наблюдать за метаболическим и рентгенологическим ответом на лечение, на ранних стадиях выявлять рецидив/прогрессирование заболевания.
Известно, что все злокачественные опухоли активно потребляют глюкозу, что делает возможным визуализировать их, применяя глюкозу, меченную радиоактивным изотопом (18F-ФДГ). Для дифференцированного рака щитовидной железы (папиллярного и фолликулярного) обычно не характерен повышенный захват глюкозы, так как эта опухоль в большей степени схожа с обычными тиреоидными клетками и намного более активно захватывает йод, что и позволяет эффективно лечить эту группу пациентов с помощью терапии 131I, в отличие от низкодифференцированных вариантов РЩЖ, характеризующихся снижением или потерей способности захватывать йод и повышением захвата, и метаболизма глюкозы пропорционально потере дифференцировки опухоли.
При анапластическом (недифференцированном) РЩЖ наблюдается полная утрата клетками характеристик, типичных для щитовидной железы. Для АРЩЖ ПЭТ/КТ с 18F-ФДГ обладает наивысшими показателями чувствительности (до 100 %) и специфичности (до 90 %) по сравнению со стандартными рентгенологическими методиками, что позволяет выявлять значимо большее количество очагов, однако метод имеет и некоторые ограничения, связанные с разрешающей способностью томографа при визуализации образований, размерами менее 5–6 мм, особенно в легких или печени [9].
Результаты метаанализа показали большую вероятность выявления ФДГ-позитивных метастазов для ДРЩЖ при мутации в гене BRAF V600E. По одной из теорий это связано с тем, что при конститутивной активации b-Raf, помимо нарушения работы натрий-йодного симпортера и снижения выработки тиреоглобулина, происходит активация транспортеров глюкозы (GLUT-1) [10]. Эти данные позволяют дополнительно рекомендовать проведение ПЭТ/КТ с 18F-ФДГ пациентам с АРЩЖ и аналогичной мутацией BRAF V600E до терапии и в процессе динамического наблюдения как наиболее чувствительный и специфичный метод визуализации.
В описываемом случае ПЭТ/КТ с 18F-ФДГ позволила выявить больший объем пораженных лимфатических узлов шеи и средостения по сравнению с рутинными методами диагностики, а также оценить эффект от проводимой терапии. Важно сравнивать динамику размеров опухолевых очагов при ПЭТ/КТ и КТ в виде однотипных исследований (нативных или после внутривенного контрастирования).
Стандартным подходом к лечению резекта-бельных форм АРЩЖ является трехкомпонентная терапия: хирургическое лечение с последующей химиолучевой терапией (ХЛТ). В последние годы стало очевидным, что знание молекулярных особенностей опухоли (в том числе ее мутационного статуса) может помочь при выборе способов терапии. АРЩЖ характеризуется высокой мутационной нагрузкой (в среднем 6 мутаций на опухоль) [11]. Наиболее частыми являются инактивирующие мутации антионкогена p53 , встречающиеся в 70–88 % случаев [12], промотора гена TERT (около 73 %), генов PIK3CA (около 18 %), NRAS (около 18 %) и PTEN (около 15 %) [11].
Так как АРЩЖ часто возникает вследствие дедифференцировки папиллярного рака щитовидной железы, он может сохранять и свойственные для него мутации, в том числе BRAF V600E (встречается примерно в 25–45 % случаев АРЩЖ). Данная мутация является одной из наиболее изученных. В клетках с BRAF V600E происходит конститутивная активация сигнального пути ERK (рис. 10).
Недавно было показано (по аналогии с меланомой), что прием таргетных препаратов, ингибирующих b-Raf (дабрафениба, вемурафениба), пациентами с BRAF V600E-положительным АРЩЖ, приводит к быстрому ответу опухоли и увеличивает
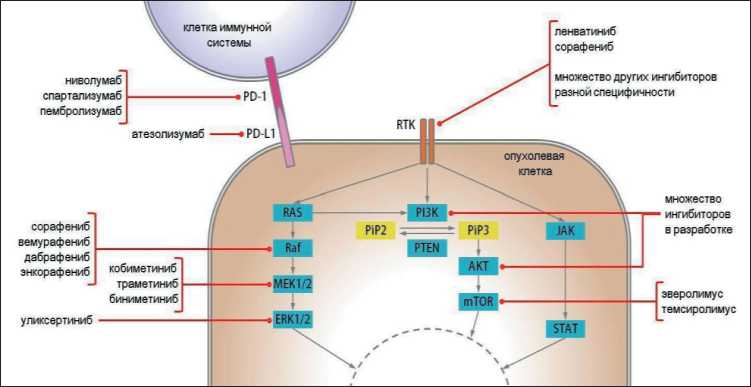
Рис. 10. Схема, отражающая сигнальные пути (ERK, PІ3K/АKT/mTOR, JАK/STАT), регуляция которых часто нарушается в опухолевых клетках, и молекулярные мишени для таргетной терапии. RTK – рецепторные тирозинкиназы (как общие для разных сигнальных путей, так и специфические)
Fig. 10. Diagram showing signaling pathways (ERK, PІ3K/АKT/mTOR, JАK/STАT), the regulation of which is often disrupted in tumor cells, and molecular targets for targeted therapy. RTK – receptor tyrosine kinases (both common for different signaling pathways, and specific)
продолжительность жизни [13]. Однако при применении ингибиторов b-Raf в качестве монотерапии достаточно быстро возникает устойчивость за счет реактивации пути ERK [14]. Поэтому для лечения BRAF V600E-положительных опухолей ингибиторы b-Raf применяют совместно с ингибиторами MEK (траметиниба, кобиметиниба, биниметиниба) [15]. Ранее [7] была оценена эффективность применения дабрафениба совместно с траметинибом после хирургического вмешательства или лучевой терапии в случае BRAF V600E-положительного АРЩЖ. Общий ответ составил 69 % (11 из 16 пациентов), а ожидаемая однолетняя выживаемость – 90 %. Сочетание дабрафениба и траметиниба было одобрено FDA для лечения пациентов с BRAF V600E-положительным АРЩЖ [6].
В перечисленных исследованиях ингибиторы сигнального пути ERK применялись после проведения стандартной терапии (хирургической операции и/или комбинированной лучевой и химиотерапии). Недавно были описаны и примеры неоадъювантной таргетной терапии для нерезектабельных случаев BRAFV600E-положительного АРЩЖ для перевода опухоли в категорию резектабельных. В работе 2018 г. [16] представлена исключительно быстрая регрессия опухоли: на момент диагноза пациент страдал от одышки, дисфагии и затруднения воздушной проводимости, но всего через два дня после начала приема дабрафениба избавился от стридора и тяжелой дисфагии, что позволило избежать проведения трахеостомии. В 2019 г. были описаны еще 5 примеров применения неоадъювантной терапии дабрафенибом и траметинибом для неоперабельного BRAFV600E-положительного АРЩЖ [17]. Во всех случаях удалось провести резекцию первичной опухоли. При этом у пациентов, возобновивших прием дабрафениба и траметиниба после хирургического вмешательства, лучевой и химиотерапии, не наблюдались признаки рецидива заболевания спустя год и более после постановки диагноза.
Отмечено, что применение таргетной терапии зачастую приводит к формированию у опухолевых клеток резистентности к используемым препаратам. В частности, известны различные варианты «обхода» клетками ингибирования сигнального пути ERK. На сегодняшний день есть очень мало данных о механизмах резистентности РЩЖ к терапии сочетанием ингибиторов b-Raf и MEK, но в работе [18] было показано, что это может происходить вследствие мутаций в генах KRAS и NRAS (описаны 4 клинических случая применения дабрафениба с траметинибом, в которых после регистрации прогрессирования заболевания ПРЩЖ и АРЩЖ в опухолевых клетках были выявлены мутации в RAS : KRAS G12C, KRAS G12V, NRAS G13D, NRAS Q61K). Ранее мутации BRAF и RAS считались взаимоисключающими, однако уже описан ряд случаев, когда они определяются в рамках одной опухоли именно после терапии ингибиторами b-RAF и MEK (например, при колоректальном раке [19], при аденокарциноме легкого [20] и ПРЩЖ [21]).
Мутации в KRAS или NRAS приводят к возобновлению активной пролиферации опухолевых клеток, вероятно, за счет активации пути PI3K/ AKT/mTOR (рис. 10). Предполагаемым следующим шагом станут исследования применения ингибиторов RAS или пути PI3K/AKT/mTOR. Недавно два новых селективных ингибитора мутантной формы KRASG12C перешли на стадию клинических исследований 1 и 2 фаз: AMG510 (клинические исследо- вания NCT04380753, NCT04185883, NCT04303780 и NCT03600883) и MRTX849 (клиническое исследование NCT03785249). Для MRTX849 также планируется изучение эффективности совместного применения с новым ингибитором SHP2 – TNO155 (NCT04330664).
Другим примером таргетной терапии АРЩЖ, помимо ингибирования сигнального пути ERK, является использование иммунотерапии. Известно, что клетки АРЩЖ часто сверхэкспрессируют PD-L1 [22], лиганд мембранного белка PD-1, который экспрессируется на Т-клетках (рис. 10). Связывание PD-L1 с PD-1 не позволяет клеткам иммунной системы распознавать клетки опухоли. Соответственно, для лечения АРЩЖ могут применяться антитела к PD-1 (спартализумаб, пембролизумаб) или PD-L1 (атезолизумаб), блокирующие формирование комплекса PD-1/PD-L1. Для пациентов с b-Raf дикого типа такой подход – единственная системная альтернатива химиотерапии. В текущем году были опубликованы результаты клинического исследования спартализумаба (NCT02404441) с участием пациентов с BRAF V600E-отрицательным АРЩЖ [23, 24]. Общий ответ составил 29 % среди пациентов со сверхэкспрессией PD-L1 и 0 % у пациентов с PD-L1-отрицательными новообразованиями. Однолетняя выживаемость составила 52 % в группе PD-L1-положительного АРЩЖ. Таким образом, применение иммунотерапии показывает достаточно положительные результаты.
В соответствии с вышеизложенным наиболее оптимальным для пациентов с АРЩЖ представляется определение молекулярных особенностей опухоли в двух временных точках: как можно быстрее после постановки диагноза для принятия решения о неоадъювантной таргетной терапии и при прогрессировании заболевания. Во втором случае может быть получена информация о причине вторичной устойчивости к проводимой терапии и/или определена мишень для новой системной терапии.
В представленном клиническом случае у пациентки была диагностирована неоперабельная BRAF V600E-положительная опухоль. Таргетная терапия вемурафенибом и кобиметинибом была применена неоадъювантно, в результате чего произошло уменьшение опухоли и проведено хирургическое вмешательство в объеме R0. После резекции опухоли таргетная терапия была отменена решением консилиума на основании радикальности проведенного лечения. Через 4,5 мес динамического наблюдения по данным КТ был зафиксирован рецидив заболевания. После этого прием препаратов возобновлен. ПЭТ/КТ с 18F-ФДГ показала положительную динамику на фоне проводимой таргетной терапии.
Дискуссионным является вопрос продолжительности применения таргетной терапии при АРЩЖ. По мнению исследовательской группы, специали- зирующейся на АРЩЖ, из клиники University of Texas MD Anderson Cancer Center, таргетную терапию следует начинать сразу после постановки диагноза и выявления мутации BRAFV600E, а также продолжать после резекции опухоли и завершения ХЛТ [17]. В 2 из 6 описанных этой группой клинических случаев задержка с возобновлением приема ингибиторов b-Raf и MEK после ХЛТ, по мнению авторов, могла способствовать развитию отдаленных метастазов. Однако в более ранней публикации той же группы описан случай, когда пациент прекращал прием дабрафениба и тра-метиниба после хирургического вмешательства и продолжил его лишь при рецидиве в шейных лимфатических узлах спустя 3,5 мес после резекции опухоли. В этом случае повторное назначение таргетной терапии привело к резорбции метастазов в лимфоузлах [16].
Таким образом, пока слишком мало данных в подтверждение или опровержение необходимости непрерывного приема ингибиторов b-Raf и MEK. В нашем случае пока недостаточна продолжительность наблюдения, однако произошедшее отдаленное метастазирование может быть связано с прерыванием таргетной терапии.
Терапия радиоактивным йодом не входит в стандарты лечения АРЩЖ, однако в нашем случае с учетом гистологических характеристик опухоли (метастазами в лимфатические узлы компонента папиллярного рака щитовидной железы с участками высококлеточного варианта) было принято решение о проведении радиойодаблации с целью элиминации радиойодаффинных клеток и снижения клеточной массы опухоли.
Заключение
Гистологические и цитологические исследования АРЩЖ, в том числе на дооперационном уровне, нередко сопровождаются известными трудностями в связи со структурной и клеточной гетерогенностью опухоли, наличием большого разнообразия морфотипов, существенными различиями в проявлении ИГХ-признаков вплоть до полной утраты большинства и иногда всех специфических биологических маркеров, включением разнообразных генетических путей дедифференцировки и опухолевой пролиферации, поэтому в каждом случае необходимо заручаться вторым (экспертным) мнением по морфологическому материалу, а также использовать дополнительные иммуногистохимические и молекулярно-генетические методики диагностики для оптимизации тактики лечения. Наличие в опухоли мутации BRAFV600E позволяет рассматривать терапию селективными ингибиторами сигнального пути ERK как действенный вариант системного противоопухолевого лечения АРЩЖ. С учетом высокой агрессивности АРЩЖ определение мутации BRAFV600E в опухоли должно проводиться в предельно сжатые сроки, а таргет- ная терапия – сразу после подтверждения наличия данной драйверной мутации в опухоли. ПЭТ/КТ с 18F-ФДГ позволяет наиболее точно оценить ответ на системную терапию. Неоадъювантная тар-гетная терапия дабрафенибом/вемурафенибом и траметинибом/кобиметинибом значительно повышает резектабельность местнораспространенной BRAFV600E-положительной опухоли. Представленный клинический пример подтверждает эффективность комбинации вемурафениб + кобиметиниб.
Список литературы Лечение BRAFV600E-позитивного анапластического рака щитовидной железы. Клиническое наблюдение
- Smallridge R.C., Ain K.B., Asa S.L., Bible K.C., Brierley J.D., Burman K.D., Kebebew E., Lee N.Y., Nikiforov Y.E., Rosenthal M.S., Shah M.H., Shaha A.R., Tuttle R.M.; American Thyroid Association Anaplastic Thyroid Cancer Guidelines Taskforce. American Thyroid Association guidelines for management of patients with anaplastic thyroid cancer. Thyroid. 2012 Nov; 22(11): 1104-39. doi: 10.1089/thy.2012.0302.
- Giuffrida D., Gharib H. Anaplastic thyroid carcinoma: current diagnosis and treatment. Ann Oncol. 2000; 11(9): 1083-9. doi: 10.1023/a:1008322002520.
- Nikiforov Y.E., NikiforovaM.N. Molecular genetics and diagnosis ofthyroid cancer. Nat Rev Endocrinol. 2011; 7(10): 569-80. doi: 10.1038/ nrendo.2011.142.
- Ahmed S., Ghazarian M.P., Cabanillas M.E., Zafereo M.E., Williams M.D., Vu T., Schomer D.F., Debnam J.M. Imaging of Anaplastic Thyroid Carcinoma. AJNR Am J Neuroradiol. 2018 Mar; 39(3): 547-551. doi: 10.3174/ajnr.A5487.
- Rao S.N., Zafereo M., Dadu R., Busaidy N.L., Hess K., Cote G.J., WilliamsM.D., William W.N., Sandulache V., Gross N., Gunn G.B., Lu C., FerrarottoR., Lai S.Y., CabanillasM.E. Patterns of Treatment Failure in Anaplastic Thyroid Carcinoma. Thyroid. 2017 May; 27(5): 672-681. doi: 10.1089/thy. 2016.0395.
- FDA approves dabrafenib plus trametinib for anaplastic thyroid cancer with BRAF V600E mutation [Internet]. https://www.fda.gov/ drugs/resources-information-approved-drugs/fda-approves-dabrafenib-plus-trametinib-anaplastic-thyroid-cancer-braf-v600e-mutation (cited 18.08.2020).
- Subbiah V., KreitmanR.J., Wainberg Z.A., Cho J. Y., Schellens J.H.M., Soria J.C., WenP.Y., Zielinski C., CabanillasM.E., Urbanowitz G., Mook-erjee B., Wang D., Rangwala F., Keam B. Dabrafenib and Trametinib Treatment in Patients With Locally Advanced or Metastatic BRAF V600-Mutant Anaplastic Thyroid Cancer. J Clin Oncol. 2018 Jan 1; 36(1): 7-13. doi: 10.1200/JC0.2017.73.6785.
- ПылевА.Л., ЖандароваА.А., Петров К.С., Романов Д.С., Лисо-вой В.А., Голуб С.В. Анапластический рак щитовидной железы. Есть ли свет в конце туннеля? Опухоли головы и шеи. 2020; 10(1): 10-19. [Pylev A.L., Zhandarova A.A., Petrov K.S., Romanov D.S., Lisovoy V.A., Golub S.V. Anaplastic thyroid cancer. Is there a light at the end of the tunnel? Head and Neck Tumors. 2020; 10(1): 10-19. (in Russian)].
- Ciarallo A., Marcus C., Taghipour M., Subramaniam R.M. Value of Fluorodeoxyglucose PET/Computed Tomography Patient Management and Outcomes in Thyroid Cancer. PET Clin. 2015 Apr; 10(2): 265-78. doi: 10.1016/j.cpet.2014.12.009.
- Santhanam P., KhthirR., SolnesL.B., LadensonP. W. The relationship of BRAF.V600e mutation status to FDG PET/CT avidity in thyroid cancer: a review and meta-analysis. Endocr Pract. 2018; 24(1): 21-26. doi: 10.4158/EP-2017-0080.
- LandaI., Ibrahimpasic T., BoucaiL., SinhaR., KnaufJA., ShahR.H., Dogan S., Ricarte-Filho J.C., Krishnamoorthy G.P., Xu B., Schultz N., Berger M.F., Sander C., Taylor B.S., Ghossein R., Ganly I., Fagin J.A. Genomic and transcriptomic hallmarks of poorly differentiated and ana-plastic thyroid cancers. J Clin Invest. 2016 Mar 1; 126(3): 1052-66. doi: 10.1172/JCI85271.
- Quiros R.M., Ding H.G., Gattuso P., Prinz R.A., Xu X. Evidence that one subset of anaplastic thyroid carcinomas are derived from papillary carcinomas due to BRAF and p53 mutations. Cancer. 2005; 103(11): 2261-8. doi: 10.1002/cncr.21073.
- Lim A.M., Taylor G.R., Fellowes A. , Cameron L., Lee B. , HicksR.J., McArthur G.A., Angel C., SolomonB., RischinD. BRAF Inhibition in BRAFV600E-Positive Anaplastic Thyroid Carcinoma. J Natl Compr Canc Netw. 2016 Mar; 14(3): 249-54. doi: 10.6004/jnccn.2016.0030.
- Paraiso K.H., Fedorenko I.V., Cantini L.P., Munko A.C., Hall M., Sondak V.K., Messina J.L., Flaherty K.T., Smalley K.S. Recovery of phospho-ERK activity allows melanoma cells to escape from BRAF inhibitor therapy. Br J Cancer. 2010 Jun 8; 102(12): 1724-30. doi: 10.1038/ sj.bjc.6605714.
- Flaherty K.T., Infante J.R., Daud A., Gonzalez R., Kefford R.F., Sosman J., HamidO., SchuchterL., Cebon J., IbrahimN., KudchadkarR., BurrisH.A.3rd, FalchookG., AlgaziA., LewisK., Long G.V., PuzanovI., Lebowitz P., Singh A., Little S., Sun P., Allred A., Ouellet D., Kim K.B., Patel K., Weber J. Combined BRAF and MEK inhibition in melanoma with BRAF V600 mutations. N Engl J Med. 2012 Nov 1; 367(18): 1694-703. doi: 10.1056/NEJMoa1210093.
- CabanillasM.E., FerrarottoR., GardenA.S., AhmedS., Busaidy N.L., Dadu R., Williams M.D., Skinner H., Gunn G.B., Grosu H., Iyer P., Hofmann M.C., Zafereo M. Neoadjuvant BRAF- and Immune-Directed Therapy for Anaplastic Thyroid Carcinoma. Thyroid. 2018 Jul; 28(7): 945-951. doi: 10.1089/thy.2018.0060.
- Wang J.R., Zafereo M.E., Dadu R., Ferrarotto R., Busaidy N.L., Lu C., Ahmed S., Gule-Monroe M.K., Williams M.D., Sturgis E.M., Goepfert R.P., Gross N.D., Lai S.Y., Gunn G.B., Phan J., Rosenthal D.I., Fuller C.D., Morrison W.H., Iyer P., Cabanillas M.E. Complete Surgical Resection Following Neoadjuvant Dabrafenib Plus Trametinib in BRAFV600E-Mutated Anaplastic Thyroid Carcinoma. Thyroid. 2019 Aug; 29(8): 1036-43. doi: 10.1089/thy.2019.0133.
- Cabanillas M.E., Dadu R., Iyer P., Wanland K.B., Busaidy N.L., YingA., Gule-MonroeM., Wang J.R., ZafereoM., HofmannM.C. Acquired Secondary RAS Mutation in BRAFV600E-Mutated Thyroid Cancer Patients Treated with BRAF Inhibitors. Thyroid. 2020; 30(9): 1288-96. doi: 10.1089/thy.2019.0514.
- MidthunL., Shaheen S., Deisch J., SenthilM., Tsai J., Hsueh C.T. Concomitant KRAS and BRAF mutations in colorectal cancer. J Gastroin-test Oncol. 2019 Jun; 10(3): 577-581. doi: 10.21037/jgo.2019.01.10.
- AbravanelD.L., NishinoM., ShollL.M., Ambrogio C., AwadM.M. An Acquired NRAS Q61K Mutation in BRAF V600E-Mutant Lung Ad-enocarcinoma Resistant to Dabrafenib Plus Trametinib. J Thorac Oncol. 2018 Aug; 13(8): e131e133. doi: 10.1016/j.jtho.2018.03.026.
- Bunney P.E., Zink A.N., Holm A.A., Billington C.J., Kotz C.M. Orexin activation counteracts decreases in nonexercise activity thermo-genesis (NEAT) caused by high-fat diet. Physiol Behav. 2017 Jul 1; 176: 139-48. doi: 10.1016/j.physbeh.2017.03.040.
- Bastman J.J., SerracinoH.S., Zhu Y., KoenigM.R., Mateescu V., Sams S.B., French J.D. Tumor-Infiltrating T Cells and the PD-1 Checkpoint Pathway in Advanced Differentiated and Anaplastic Thyroid Cancer. J Clin Endocrinol Metab. 2016; 101(7): 2863-2873. doi: 10.1210/jc.2015-4227.
- Naing A., Gainor J.F., Gelderblom H., Forde P.M., ButlerM.O., Lin C.C., SharmaS., Ochoade OlzaM., VargaA., TaylorM., Schellens J.HM., WuH., SunH., SilvaA.P., Faris J., Mataraza J., Cameron S., Bauer T.M. A first-in-human phase 1 dose escalation study of spartalizumab (PDR001), an anti-PD-1 antibody, in patients with advanced solid tumors. J Immunother Cancer. 2020 Mar; 8(1): e000530. doi: 10.1136/jitc-2020-000530.
- Capdevila J., WirthL.J., Ernst T., PonceAixS., Lin C.C., RamlauR., ButlerM.O., Delord J.P., GelderblomH., AsciertoP.A., Fasolo A., FührerD., Hütter-Krönke M.L., Forde P.M., Wrona A., Santoro A., Sadow P.M., Szpakowski S., Wu H., Bostel G., Faris J., Cameron S, VargaA., TaylorM. PD-1 Blockade in Anaplastic Thyroid Carcinoma. J Clin Oncol. 2020 Aug 10; 38(23): 2620-2627. doi: 10.1200/JC0.19.02727.


