Лечение критического ожога с применением фибробластов (клинический случай)
Автор: Богданов С.Б., Поляков А.В., Порханов В.А., Гилевич И.В., Богданова Ю.А., Каракулев А.В., Мелконян К.И., Сотниченко А.С.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Хирургия
Статья в выпуске: 2 т.17, 2021 года.
Бесплатный доступ
Лечение пострадавших с распространенными глубокими ожогами представляет серьезную проблему современной медицины. В первую очередь это связано с высоким уровнем летальности у таких больных от осложнений ожоговой болезни, развивающихся в связи с наличием обширных раневых поверхностей. В данной статье представлен случай успешного лечения подростка с ожогом пламенем на площади 65 % поверхности тела II–III степеней. На примере клинического наблюдения продемонстрирована возможность использования активной хирургической тактики лечения и клеточных культур аутологичных фибробластов в лечении пациента с критической площадью ожогового поражения, что позволило успешно восстановить утраченный кожный покров в условиях дефицита донорских ресурсов, купировать осложнения ожоговой болезни, а также активизировать больного.
Ожог, хирургическое лечение, клеточные технологии
Короткий адрес: https://sciup.org/149135637
IDR: 149135637 | УДК: 616.5–001.1:616–089.844:577.1
Текст научной статьи Лечение критического ожога с применением фибробластов (клинический случай)
1Введение. Тяжелообожженные пациенты нуждаются в активной специализированной комбустио-логической помощи [1]. Комбустиология является одной из самых дорогостоящих областей здравоохранения. Затратной ее делают длительное пребывание в больнице, неоднократные оперативные вмешательства, дорогое оборудование и его эксплуатация [2]. Прогноз при ожогах зависит от многих факторов, среди которых наибольшее значение имеют общее состояние пострадавшего до травмы, локализация и площадь ожога, развитие осложнений, полнота необходимого объема и интенсивности лечебных мероприятий [3]. Летальность у пациентов с обширными ожогами остается высокой, а площадь ожоговой поверхности более 40% является фактором риска смерти [4, 5]. Раневая инфекция при ожоговой травме у детей остается актуальной проблемой современной комбустиологии [6]. Основной причиной смерти пациентов в стадии септикотоксемии является ожоговый сепсис и вызванная им полиорганная недостаточность. Развитие сепсиса у этих больных связано с обширностью глубокого ожога, дефицитом донорских ресурсов кожи для аутопластики, а также их контаминацией внутрибольничными штаммами патогенных микроорганизмов, высокорезистентных к применяемым антибиотикам [7]. У детей с площадью ожогового поражения более 50% достоверно возрастает риск развития инвазивного кандидоза [8]. Сроки доставки ребенка с тяжелой ожоговой травмой в специализированный стационар и активность хирургической тактики имеют существенное значение для показателя выживаемости [9].
Тяжелая ожоговая рана характеризуется разрушением структур кожи и, что более важно, потерей популяций клеток-предшественников, необходимых для регенерации и восстановления кожных слоев, и как итог — нарушением функций кожи. До сих пор аутопластика кожным трансплантатом, взятым из здоровых донорских участков, остается стандартным методом закрытия ожоговой раны в качестве постоянного покрытия [10–13]. При этом большая площадь ожоговой поверхности может привести к ограничению донорских участков для взятия кожных трансплантатов. Для временного покрытия ожоговой раны после некрэктомии используют различные альтернативные покрытия, включая аллогенную кожу (которая, к сожалению, в России не разрешена), ксеногенные и синтетические материалы [14–16]. Указанные методы не являются постоянными покрытиями и никогда не смогут заменить кожный аутотрансплантат, доставляющий основные аутологичные клетки-предшественники, которые будут способствовать восстановлению кожного покрова.
Для ускорения процесса заживления ран и формирования грануляционной ткани используют трансплантацию различных клеточных культур на ожоговые поверхности. В последние десятилетия клеточная терапия стала рассматриваться как дополнительный метод, используемый в сочетании со стандартными методами закрытия кожи, для стимуляции заживления ожоговых ран и восстановления структуры и функций кожи [17, 18]. Однако трудности культивирования кератиноцитов, нестойкость получаемой культуры ограничивают использование этих клеток.
Внимание исследователей и клиницистов было обращено на получение культуры фибробластов и возможности их применения, что рассматривается как наиболее перспективное направление [17, 19, 20].
Описание клинического наблюдения. В настоящее время на базе ГБУЗ «Научно-исследовательский институт — Краевая клиническая больница № 1 им. профессора С. В. Очаповского» минздрава Краснодарского края проводится клиническое исследование по протоколу клеточной терапии ожоговых пациентов аутологичными фибробластами, одобренное локальным этическим комитетом. Официальный опекун пациента дала добровольное информированное согласие на публикацию клинического случая и данных из истории болезни в открытой печати. Лечение проводилось с учетом требований Хельсинской декларации 1975 г. и ее пересмотра в 2013 г.
В ожоговое отделение 1 ноября 2019 г. поступил подросток 14 лет с ожогом пламенем туловища, ягодиц, промежности, верхних и нижних конечностей на площади 65% поверхности тела 11-111 степеней по МКБ-10 (60% поверхности тела — ожоги IV степени по классификации Вишневского). Травму получил в быту 31 октября 2019 г. при неосторожном обращении с бензином. Был госпитализирован в ЦРБ по месту жительства, в дальнейшем по линии санитарной авиации доставлен в НИИ-ККБ № 1. Госпитализирован в реанимационное отделение для проведения интенсивной терапии ожоговой болезни.
Учитывая тяжесть состояния пациента, ожог тяжелой степени, требовалось проведение искусственной вентиляции легких. Было принято решение о включении пациента в протокол клинического исследования по клеточной терапии ожоговых пациентов.
При поступлении ожоговые раны представлены в основном формирующимся плотным сухим струпом темно-коричневого и черного цвета, что потребовало выполнения некротомических разрезов. В дальнейшем в три этапа было произведено хирургическое удаление некроза (по 15% за каждую операцию), скелетное подвешивание нижних конечностей (рис. 1, 2).
Для проведения аутодермопластики с клеточной терапией был выполнен лабораторный этап, который включал в себя получение культуры аутологичных дермальных фибробластов с последующим их тестированием. Выделение культуры фибробластов проводили ферментативным методом после механической обработки образца дермы, забранного со здорового участка кожи пациента. Через 32 дня лабораторного процессинга была получена культура аутологичных фибробластов. Для проведения контроля качества культуры клеток были выполнены исследования: подсчет количества клеток, морфологический анализ, бактериологический контроль, кариотипирование, иммунофенотипирование. В день операции суспензия культуры аутофибробластов в физиологическом растворе 0,9%-го NaCl была подготовлена и транспортирована в операционную для проведения аутопластики.
Течение ожоговой болезни осложнилось развитием ожогового сепсиса, двусторонней деструктивной пневмонии септического генеза, кандидоинфекции, генерализованного кандидоза (кандидемии). В дальнейшем у пациента развились токсико-дисметаболи-ческая кардиопатия, энцефалопатия, церебрастени-ческий синдром, псевдомембранозный колит, острый сфеноидит и фронтит, синдром полиорганной недостаточности (дыхательная, интестинальная, вторич-
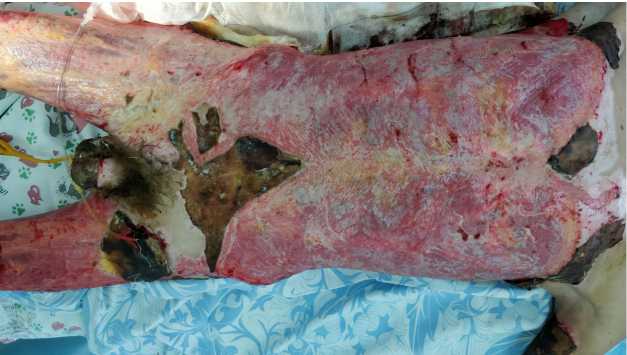
Рис. 1. Гранулирующие раны туловища и конечностей после некрэктомии
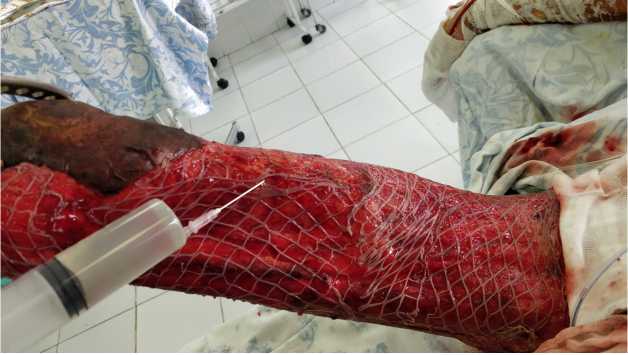
Рис. 3. Кожные трансплантаты на гранулирующих ранах правого бедра и аппликация аутологичных фибробластов
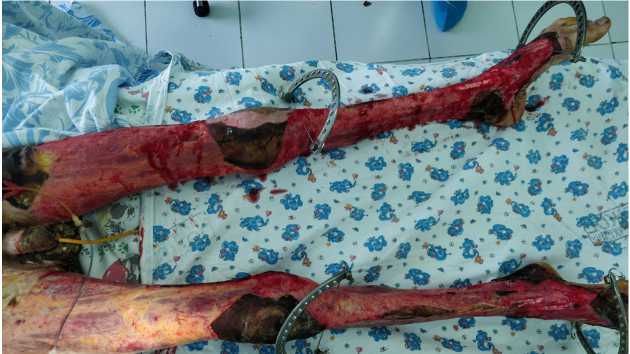
Рис. 2. Металлоконструкции для скелетного подвешивания, установленные на нижних конечностях

Рис. 4. Раневые покрытия, уложенные на кожные трансплантаты после нанесения культуры аутологичных фибробластов
ная иммунная, надпочечниковая), гипохромная анемия средней степени тяжести смешанного генеза. Несмотря на развившиеся осложнения на фоне проводимой интенсивной терапии, больному регулярно проводились хирургические обработки ран, направленные на удаление оставшихся некротических тканей и подготовку раневых поверхностей к отсроченной аутодермопластике. По мере очищения ран и созревания грануляционной ткани пациенту выполняли отсроченные аутодермопластики с высоким индексом перфорации кожных трансплантатов (1:4 и 1:6), использованием клеточных культур аутофибробластов (рис. 3), закрытием прооперированных ран раневыми покрытиями (рис. 4).
Аутофибробласты также наносили на раневые поверхности после взятия кожных аутотрансплантатов для ускорения эпителизации и возможности повторного забора донорской кожи с тех же участков. Полный спектр произведенных оперативных вмешательств представлен в таблице.
Всего пострадавшему было выполнено 37 оперативных вмешательств. В результате проведенного хирургического лечения был субтотально восстановлен кожный покров. Площадь остаточных мелких мозаичных ран, не требующих оперативного лечения и эпителизирующихся спонтанно, составляет менее 2%. Пациент вертикализирован и активизирован
Список произведенных пациенту оперативных вмешательств
|
N п/п |
Дата операции |
Название операции |
|
1 |
01.11.19 |
Некротомии |
|
2 |
05.11.19 |
Фасциальная некрэктомия 15% правой нижней конечности. Скелетное подвешивание правой нижней конечности |
|
3 |
08.11.19 |
Фасциальная некрэктомия 15% левой нижней конечности. Скелетное подвешивание левой нижней конечности. Трахеостомия |
|
4 |
11.11.19 |
Фасциальная некрэктомия 15% туловища |
|
5 |
28.11.19 |
Тангенциальное иссечение гранулирующих ран 30%, отсроченная аутодермопластика 30% с использованием клеточных культур аутофибробластов |
|
6 |
10.12.19 |
Тангенциальное иссечение гранулирующих ран 7%, отсроченная аутодермопластика 7% с использованием клеточных культур аутофибробластов |
|
7 |
17.12.19 |
Тангенциальное иссечение гранулирующих ран 8%, отсроченная аутодермопластика 8% |
|
8 |
26.12.19 |
Тангенциальное иссечение гранулирующих ран 8%, отсроченная аутодермопластика 8% |
|
9 |
03.01.20 |
Хирургическая обработка ран |
Окончание табл.
|
N п/п |
Дата операции |
Название операции |
|
10 |
16.01.20 |
Тангенциальное иссечение гранулирующих ран 5%, отсроченная аутодермопластика 5% с использованием клеточных культур аутофибробластов |
|
11 |
04.02.20 |
Тангенциальное иссечение гранулирующих ран 8%, отсроченная аутодермопластика 8% |
|
12 |
18.02.20 |
Тангенциальное иссечение гранулирующих ран 3%, отсроченная аутодермопластика 3% |
|
13 |
03.03.20 |
|
|
14 |
07.04.20 |
Хирургическая обработка ран |
|
15 |
14.04.20 |
|
|
16 |
16.04.20 |
Хирургическая обработка ран, аутодермопластика 2% правой ягодичной области. Хирургическая обработка ран, аутодермопластика 1 % правой нижней конечности |
|
17 |
21.04.20 |
Хирургическая обработка ран |
|
18 |
11.05.20 |
Хирургическая обработка ран, аутодермопластика 2% ягодиц |
|
19 |
29.05.20 |
Хирургическая обработка ран |
|
20 |
08.06.20 23, 29.07.20; 05, 12, 25, 28, 31.08.20; |
Хирургическая обработка ран, аутодермопластика 2% ран ягодиц и туловища |
|
21–37 |
04, 07, 11, 14, 15, 18, 21, 24, 28.09.20; 02.10.20 |
Хирургическая обработка ран |
(рис. 5), ходит самостоятельно, используя дополнительную опору.
Общая продолжительность пребывания пациента в стационаре превысила один год. Срок лечения в реанимационном отделении составил 340 койкодней, из которых на искусственной вентиляции легких — 260 койко-дней.
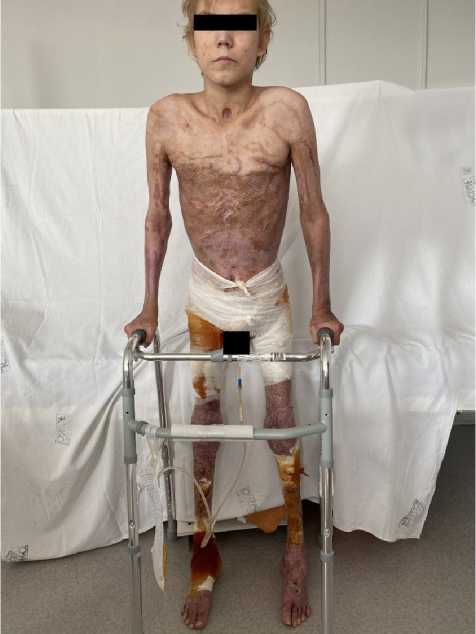
Рис. 5. Пациент перед выпиской из стационара на амбулаторное лечение
Заключение. Ранний перевод пациента с тяжелой ожоговой травмой в специализированное ожоговое отделение многопрофильного стационара позволил успешно оказывать всю необходимую помощь — как хирургическую, так и реанимационную, проводить интенсивную терапию осложнений ожоговой болезни. Активная хирургическая тактика лечения, направленная на удаление некротических тканей оперативным путем и этапно на перевязках, способствовала подготовке ран к аутодермопластике, а внедрение в клиническую практику клеточных культур аутологичных фибробластов — восстановлению кожного покрова в условиях дефицита донорских ресурсов. В дальнейшем это позволило успешно восстановить утраченный кожный покров, купировать осложнения ожоговой болезни, а также активизировать больного. Длительный период пребывания пострадавшего в стационаре фактически является первым этапом в лечении, поскольку впоследствии требуется продолжительная консервативная реабилитация с целью профилактики и коррекции послеожоговых рубцов.
Список литературы Лечение критического ожога с применением фибробластов (клинический случай)
- Грибань П.А., Сотниченко С.А., Терехов СМ. и др. Эвакуация тяжелообожженных как этап активной тактики оказания специализированной комбустиологической помощи. Опыт ФГБУЗ ДВОМЦ ФМБА России. Медицина экстремальных ситуаций 2018; 20 (2): 31-7.
- Унижаева А.Ю., Мартынчик С. А. Медико-экономическая оценка затрат и качества стационарной помощи при ожоговой травме. Социальные аспекты здоровья населения 2012; 28 (6): http://vestnik.mednet.ru/content/view/ 447/30/lang, ш/(дата обращения: 02.11.2020.
- Сахаров С.П., Иванов В.В., Зороастров О.М. и др. Анализ летальных исходов у детей при ожоговой болезни. Вестник экспериментальной и клинической хирургии 2010; 3 (3): 256-9). DOI: https://doi.org/10.18499/2070-478X-2010-3-3-256-259.
- Багин В. А., Руднов В. А., Савицкий А. А. и др. Факторы риска развития и прогноза сепсиса у пациентов с ожоговой травмой. Вестник анестезиологии и реаниматологии 2013; 10 (5): 21-6.
- Жилинский E.B., Часнойть A.M., Алексеев С.А. и др. Анализ летальности, основных прогностических факторов и осложнений среди пациентов с ожоговой травмой. Медицинские новости 2014; (11): 87-91.
- Сахаров С.П., Аксельров M.A., Фролова О. И. Анализ видового состава микроорганизмов у детей с термической травмой. Медицинский альманах 2019; 61 (5-6): 94-7.
- Шакиров Б.М., Аминов У.Х., Хаки-мов Э.А. и др. Летальность при ожоговой болезни и пути ее снижения. Вестник экстренной медицины 2013; (3): 180-1.
- Баиндурашвили А.Г., Колбин А.С, Бразоль M.A. и др. Влияние особенностей хирургического лечения детей с обширной термической травмой на частоту развития инва-зивного кандидоза. Травматология и ортопедия России 2009; 52 (2): 76-80.
- Лекманов А. У, Азовский Д.К., ПилютикОФ. Анализ выживаемости у детей с тяжелой термической травмой, доставленных в первые 72 часа после повреждения. Вестник анестезиологии и реаниматологии 2018; 15 (5): 30-8). DOI: https:// doi.org/10.21292/2078-5658-2018-15-5-30-38.
- Gardien KL, Middelkoop E, Ulrich MM. Progress towards cell-based burn wound treatments. Regenerative Medicine 2014; 9 (2): 201-18. DOI: 10.2217/rme. 13.97.
- Богданов С. Б., Бабичев Р. Г., Марченко Д. Н. и др. Пластика пол-нослойными кожными аутотрансплантатами ран различной этиологии. Инновационная медицина Кубани 2016; (1): 30-7.
- Богданов С. Б. Виды кожных аутопластик: атлас. Краснодар: Клуб печати, 2018; 200 с.
- Богданов С.Б., Бабичев P.Г. Способ забора кожного аутотрансплантата. Изобретения. Полезные модели 2017; (13): 2618166). URL: https://www1.fips.ru/ofpstorage/Doc/IZP M/RUNWC1 /000/000/002/618/166/%D0%98%D0%97-02618 166-00001/document, pdf (дата обращения: 02.11.2020.
- Brusselaers N, Pirayesh A, Hoeksema H, et al. Skin replacement in burn wounds. Journal of Trauma and Acute Care Surgery 2010; 68 (2): 490-501.
- Groeber F, Holeiter M, Hampel M, et al. Skin tissue engineering — in vivo and in vitro applications. Advanced drug delivery reviews 2011; 63 (4): 352-66.
- Богданов СБ., Афаунова O.H. Использование раневых покрытий при хирургическом лечении пограничных ожогов конечностей в функционально активных областях. Врач-аспирант 2016; 79 (6): 4-9.
- Leclerc Т, Thepenier С, Jault Р, et al. Cell therapy of burns. Cell proliferation 2011; 44 (s1): 48-54. 18. Dimitropoulos G, Jafari P, de Buys Roessingh A, et al. Burn patient care lost in good manufacturing practices? Annals of burns and fire disasters 2016; 29(2): 111-5.
- Зорин В. Л., Зорин, А. И., Петракова О. С. и др. Дермальные фибробласты для лечения дефектов кожи. Гены и клетки 2009; 4 (4): 26-40.
- Chua AWC, Khoo YC, Tan BK, et al. Skin tissue engineering advances in severe burns: review and therapeutic applications. Burns & trauma 2016; 4(1): 3.


