Лечение пациентов с перипротезной инфекцией и замещением кавитарных дефектов типа 2С по Paprosky на этапе установки артикулирующего спейсера
Автор: Рожков Н.И., Ермаков А.М., Тряпичников А.С., Сазонова Н.В.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Случай из практики
Статья в выпуске: 5 т.30, 2024 года.
Бесплатный доступ
Введение. В связи с постоянным ростом числа первичных и ревизионных эндопротезирований тазобедренных суставов повышается и частота осложнений. Перипротезная инфекция (ППИ) является наиболее частым и опасным осложнением эндопротезирования, в том числе ППИ с кавитарными дефектами вертлужной впадины (тип 2с по Paprosky).Цель работы - продемонстрировать успешный результат замещения дефектов вертлужной впадины у пациентов с перипротезной инфекцией на этапе установки артикулирующего спейсера.Материалы и методы. Пациентам проведено оперативное лечение с восполнением кавитарных дефектов вертлужной впадины аллокостным пластическим материалом на этапе установки артикулирующего спейсера с антибактериальными препаратами. Проведена клиническая и функциональная оценка эффективности лечения пациентов с ППИ тазобедренного сустава, которым выполнили на первом этапе двухэтапного ревизионного эндопротезирования костную пластику ацетабулярных дефектов. Ремиссию инфекционного процесса оценивали согласно ICM от 2013 года (англ.: International Consensus Meeting), функцию оперированной конечности - по шкале HHS (англ.: Harris Hip Score).Результаты. На контрольном осмотре через 6 мес. после имплантации эндопротеза клинико-лабораторные проявления ППИ и рентгенологические признаки нестабильности компонентов эндопротеза отсутствовали. Костная пластика определена как состоятельная, функция оперированного сустава восстановлена (80-90 баллов по HHS). Достигнута ремиссия инфекционного процесса по ICM.Обсуждение. Клинические наблюдения демонстрируют положительный результат лечения ППИ с пластикой кавитарных дефектов дна вертлужной впадины на этапе установки артикулирующего спейсера. Восполненные ацетабулярные дефекты на санирующем этапе (имплантация спейсера) в последующем улучшают первичную фиксацию и остеоинтеграцию вертлужного компонента при конверсии спейсера на постоянный эндопротез. Это обусловлено увеличением площади соприкосновения вертлужного компонента с костной тканью (нативной костью и ремоделированным аллокостным материалом).Заключение. В результате лечения в первом клиническом случае удалось восстановить функцию сустава с 24 до 85 баллов, а во втором - с 27 до 76 баллов по шкале HHS. Применение методики восполнения дефектов позволило купировать инфекцию, улучшить функциональные результаты.
Клинический случай, двухэтапное ревизионное эндопротезирование, тазобедренный сустав, перипротезная инфекция, остеомиелит, дефекты вертлужной впадины по paprosky
Короткий адрес: https://sciup.org/142243289
IDR: 142243289 | УДК: 616.718.16-004.8-089.844+616.728.2-77-089.843:615.33 | DOI: 10.18019/1028-4427-2024-30-5-706-716
Текст научной статьи Лечение пациентов с перипротезной инфекцией и замещением кавитарных дефектов типа 2С по Paprosky на этапе установки артикулирующего спейсера
Помимо увеличения количества научных статей об актуальности изучения перипротезной инфекции (ППИ) свидетельствуют следующие факторы: повышение продолжительности жизни людей, увеличение трудовой активности пожилого населения в связи с наличием условий, улучшающих качество жизни, закономерно связанный с этим ежегодный рост имплантируемых эндопротезов и, как следствие, увеличение количества инфекционных осложнений [1]. ППИ отмечается в 1–2 % случаев после первичной артропластики и в 4 % наблюдений после ревизионных вмешательств [2]. Двухэтапное ревизионное эндопротезирование остается предпочтительным вариантом лечения ППИ [3]. Однако уровень смертности у пожилых пациентов после многократных оперативных вмешательств по-прежнему остается высоким [4]. Кроме того, нередко отмечаются рецидивы инфекции на фоне присутствия резистентных штаммов микроорганизмов, тяжелого коморбидного состояния пациента и наличия в анамнезе безуспешных ревизионных вмешательств [5]. К тому же, при хроническом течении ППИ после многократных санирующих хирургических вмешательств формируются обширные дефекты костной и мягких тканей [6, 7]. Методики восполнения костных дефектов зависят от их размеров, плотности кости пациента, наличия кавитарных дефектов вертлужной впадины и нарушенной целостности тазового кольца, что определяет качество фиксации и площадь контакта с нативной костью [8]. Тяжёлые дефекты вертлужной впадины составляют 1–5 % причин ревизий ацетабулярного компонента. Этиология возникновения данных дефектов — результат последствий остеолиза, механического расшатывания вертлужного компонента и возникновения инфекции [9]. G. Bori et al. выявили статистически значимые факторы риска развития рецидива ППИ в виде значительных костных дефектов тазобедренного сустава [10]. Сложность восполнения дефектов вертлужной впадины при ревизионных вмешательствах на тазобедренном суставе подтверждается тем, что существует множество вариантов реконструкции, ни один из которых не обладает явным преимуществом перед остальными. Во время ревизионной операции необходимо добиваться надёжной фиксации компонентов эндопротеза с восстановлением костного дефекта дна вертлужной впадины [11].
Цель работы — продемонстрировать успешный результат замещения дефектов вертлужной впадины у пациентов с перипротезной инфекцией на этапе установки артикулирующего спейсера.
МАТЕРИАЛЫ И МЕТОДЫ
В серию клинических случаев включены пациенты, проходившие лечение в клинике костно-суставной инфекции (гнойной остеологии) НМИЦ ТО им. академика Г.А. Илизарова. У исследуемых больных диагностирована хроническая ППИ по Cheng Li [12] с кавитарными дефектами вертлужной впадины типа 2С по Paprosky.
Оценивали дефект костной ткани предварительно по серии рентгенологических снимков. Отмечены рентгенологические признаки дефекта медиальной стенки и передней колонны с нарушением линии Kohler и выраженным лизисом в виде «фигуры слезы».
Пациентам выполнен первый этап оперативного лечения с радикальной санацией очага инфекции и восполнением аллокостным материалом кавитарных дефектов, установлен артикулирующий спей-сер с восстановлением функции конечности.
Методика восполнения дефектов кости произведена в следующей последовательности. Остеопластический матрикс в форме блоков замачивали в физиологическом растворе, затем измельчали с помощью хирургического инструментария. В костно-пластический материал добавляли антибактериальные препараты (1 г ванкомицина и 1 г цефтазидима), далее проводили плотную импакцию дефектов вертлужной впадины.
На втором этапе лечения, после извлечения спейсера, поверхностный слой аллокости брали для бактериологического исследования, которое в последующем не выявило роста возбудителей. Пластический материал был представлен плотной интенсивно кровоточащей костной тканью бледно-желтого цвета, которая незначительно уступала по плотности нативной кости. При этом признаков некроза, секвестрирования и склероза не наблюдали. Интервал между операциями двухэтапного ревизионного эндопротезирования при лечении ППИ тазобедренного сустава составил 5 мес.
Пациенты повторно госпитализированы с диагностикой микробиологического и клеточного состава синовиальной жидкости сустава (количество лейкоцитов и нейтрофилов), а также оценкой гематологических маркеров воспаления (СРБ, СОЭ и лейкоциты) для контроля купирования инфекционного процесса. На основе полученных лабораторных данных принимали решение о возможности проведения второго этапа ревизионного вмешательства с установкой постоянного эндопротеза. Далее проводили контроль динамики показателей гематологического, рентгенологического, бактериологического исследования и функционального состояния оперированной конечности.
Ремиссию инфекционного процесса оценивали согласно ICM от 2013 года ( англ .: International Consensus Meeting), функцию оперированной конечности — по шкале HHS ( англ .: Harris Hip Score).
РЕЗУЛЬТАТЫ
Первый клинический случай
Пациент П., 49 лет, поступил в клинику костно-суставной инфекции (гнойной остеологии) с диагнозом: хроническая гематогенная ППИ правого тазобедренного сустава (согласно Cheng Li); хронический остеомиелит правого бедра и таза, свищевая форма; комбинированная контрактура правого тазобедренного сустава с укорочением правой нижней конечности 2 см; нестабильность тазового компонента эндопротеза (рис. 1). Сопутствующее заболевание: хроническая железодефицитная анемия легкой степени.
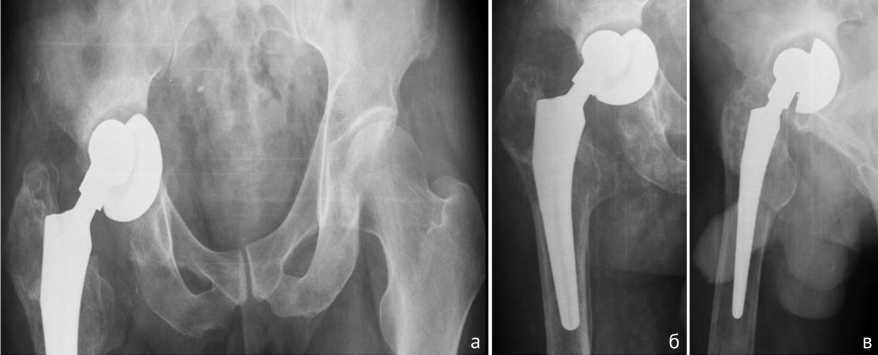
Рис. 1. Рентгенограммы таза в прямой проекции (а) и правого тазобедренного сустава в прямой (б) и боковой (в) проекциях с фокусом 1 м до операции
При поступлении — жалобы на наличие свища в верхней трети правого бедра с гнойным отделяемым, снижение опороспособности, укорочение правой нижней конечности и значительное ограничение объёма движений в правом тазобедренном суставе вследствие болевого синдрома.
Из анамнеза заболевания : февраль 2021 г. — тотальное эндопротезирование правого тазобедренного сустава; через 3 мес. — отек, сильная боль в правом бедре, функционирует свищ с гнойным отделяемым; консервативное лечение без эффекта.
Локальный статус : свищ в области правого бедра, сообщающийся с полостью тазобедренного сустава (абсолютный признак ППИ согласно ICM 2018); относительное укорочение правой нижней конечности составило 2 см; передвигается с помощью костылей. На момент поступления функциональное состояние правого тазобедренного сустава — 24 балла по HHS.
Результаты лабораторных исследований : анемия легкой степени (Hb 91 г/л), повышены СОЭ (97 мм/ч) и СРБ (30 мг/л); в пунктате правого тазобедренного сустава обнаружен рост Staphylococcus aureus — 104 КОЕ/мл.
Операция проведена в 2023 г. Первый этап двухэтапного ревизионного эндопротезирования правого тазобедренного сустава: удаление эндопротеза; дебридмент; установка артикулирующего спейсера. Смоделирована чашка 50/32 из пресс-форм с помощью 1 пакета костного цемента с антибиотиками (1 г ванкомицина и 1 г цефатоксима). Имплантирован тазовый компонент спейсера 50 мм с помощью 1 пакета костного цемента с антибиотиками (2 г ванкомицина и 1 г цефатоксима). Установлена цементная ножка с помощью 1 пакета костного цемента с антибиотиками (4 г ванкомицина и 4 г цефа-токсима). Интраоперационно определен дефект вертлужной впадины 2С типа по Paprosky с тотальной протрузией внутренней стенки, который заместили аллокостной крошкой. Операцию завершили установкой дренажа, послойным ушиванием раны. Рентгенограммы таза и правого тазобедренного сустава в прямой и боковой проекции с фокусом 1 м после оперативного вмешательства представлены на рис. 2.
Кровопотеря составила 500 мл, интраоперационная гемотрансфузия — 500 мл. Результаты интраоперационного микробиологического исследования — Staphylococcus aureus — 104 КОЕ/мл. С импланта высеян Pseudomonas aeruginosa (S) — 104 КОЕ/мл. Рана зажила первичным натяжением. Дренаж удален на 6 сут. после операции.
После первого этапа оперативного вмешательства в течение 6 нед. проводили курс этиотропной антибактериальной терапии. В стационаре пациент 2 нед. внутривенно получал амоксициллин + клавула-новую кислоту 1,2 г 3 р/сут. и левофлоксацин 100 мл 2 р/сут. На амбулаторный этап лечения назначен левофлоксацин 500 мг 2 р/сут. и цефоперазонсульбактам 2,0 г 2 р/сут. внутримышечно на 4 нед.
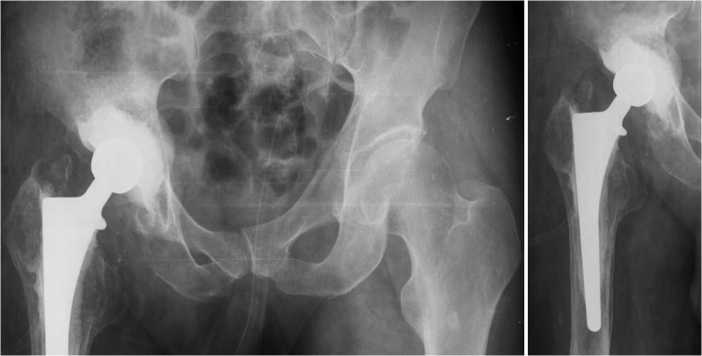
Рис. 2. Рентгенограммы таза и правого тазобедренного сустава после оперативного лечения с восполнением дефектов аллокостью и установленным артикулирующим антибактериальным спейсером
Пациенту рекомендовано использование костылей при ходьбе с ограничением нагрузки на оперированную конечность до следующего этапа оперативного лечения.
Через 1 мес. проведены контрольные исследования СОЭ и СРБ и рентгенография таза и правого тазобедренного сустава (рис. 3). Результаты лабораторных исследований: анемия легкой степени (Hb 118 г/л), СОЭ 10 мм/ч и СРБ 2 мг/л. На контрольном осмотре через 1 мес. установлено, что клинико-лабораторных признаков рецидива заболевания не наблюдается (ран и свищей нет), компоненты спейсера стабильны, функциональное состояние правого тазобедренного сустава составило 64 балла по HHS.
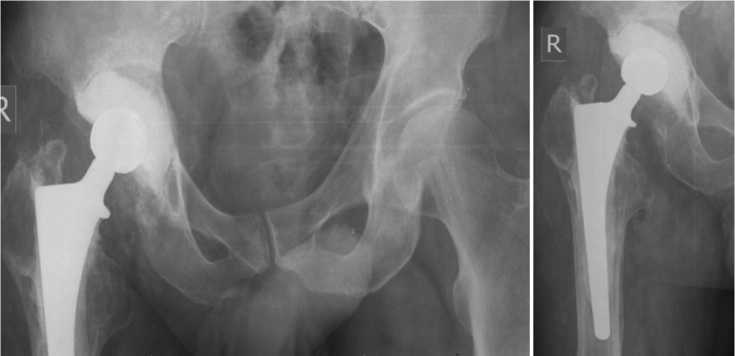
Рис. 3. Рентгенограммы таза и правого тазобедренного сустава через 1 мес. после операции
Спустя 5 мес. пациент поступил в клинику повторно для дообследования и проведения второго этапа оперативного лечения.
Локальный статус : свищей нет, нормотрофический рубец в области правого бедра; передвигается с помощью костылей. На момент поступления функциональное состояние правого тазобедренного сустава — 64 балла по HHS. Результаты лабораторных исследований: из ОАК Hb 130 г/л, СОЭ 20 мм/ч и СРБ 1,4 мг/л. В пунктате правого тазобедренного сустава рост возбудителя не обнаружен.
После обследования проведен второй этап оперативного лечения: ревизионное эндопротезирование правого тазобедренного сустава; удаление спейсера; дебридмент; установка бесцементного эндопротеза. Интраоперационно восполненный дефект был представлен плотной кровоточащей костной тканью бледно-желтого цвета без признаков некроза. Рентгенограмма таза после оперативного вмешательства представлена на рис. 4. Кровопотеря составила 250 мл, интраоперационная гемотрансфузия — 250 мл. Рост возбудителей на удаленном спейсере не выявлен. Рана зажила первичным натяжением. Дренаж удален на шестые сутки после операции.
После второго этапа оперативного вмешательства проводили шестинедельный курс антибактериальной терапии. В стационаре пациент 2 нед. внутривенно получал ванкомицин 1,0 г 2 р/сут. и меропенем 1,0 г 3 р/сут. На амбулаторный этап лечения назначен курс пероральных антибиотиков на 4 нед.: левофлоксацин 500 мг 2 р/сут. и доксициклин 100 мг 2 р/сут.
Пациенту рекомендовано использование костылей при ходьбе с ограничением нагрузки на оперированную конечность в течение 3 мес.
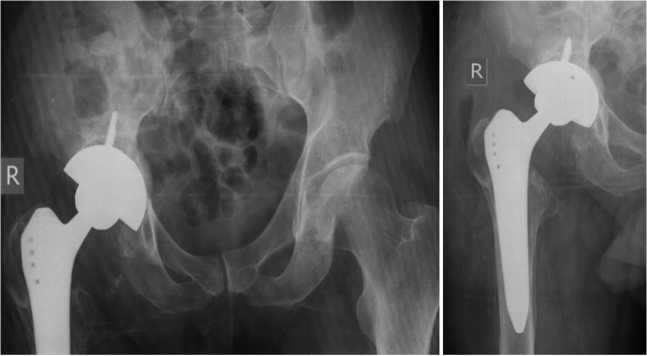
Рис. 4. Рентгенограммы таза и правого тазобедренного сустава в прямой проекции с фокусом 1 м после оперативного вмешательства
Через 6 мес. проведены исследования СОЭ и уровня СРБ и рентгенография таза и правого тазобедренного сустава (рис. 5). Результаты лабораторных исследований: анемия легкой степени (Hb 120 г/л), СОЭ 15 мм/ч и СРБ 3 мг/л. На контрольном осмотре установлено, что клинико-лабораторные признаки рецидива заболевания отсутствуют (свищей нет, нормотрофический рубец), компоненты эндопротеза стабильны, функциональное состояние правого тазобедренного сустава — 85 баллов по HHS.
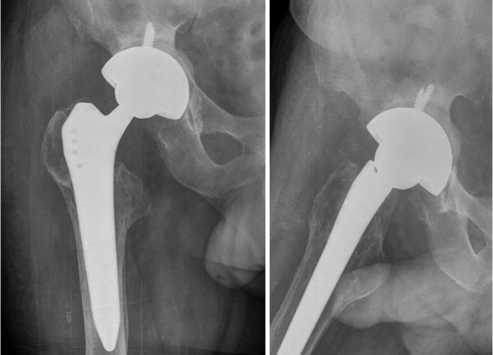
Рис. 5. Рентгенограммы правого тазобедренного сустава через 6 мес. после операции
Второй клинический случай
Пациент Ш., 64 лет, поступил в нашу клинику с диагнозом: хроническая гематогенная ППИ левого тазобедренного сустава (согласно Cheng Li); хронический остеомиелит левого бедра и таза, свищевая форма; комбинированная контрактура левого тазобедренного сустава с укорочением левой нижней конечности 2 см (рис. 6). Сопутствующие заболевания: гипертоническая болезнь 2 ст., риск 3, ХСН-0. ФК-3; атеросклероз артерий конечностей.
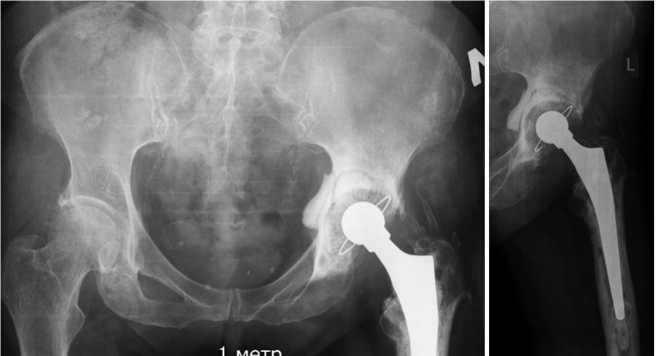
Рис. 6. Рентгенограммы таза и левого тазобедренного сустава с фокусом 1 м до операции
При поступлении — жалобы на наличие свища в области левого бедра с гнойным отделяемым, снижение опороспособности, укорочение левой нижней конечности и выраженный болевой синдром в левом тазобедренном суставе.
Из анамнеза заболевания : болен с 2020 г., травма — перелом шейки левого бедра; 27.02.2020 произведено тотальное эндопротезирование левого ТБС по месту жительства (Чита); в конце 2020 г. появился свищ в области левого ТБС.
Локальный статус : свищ в области левого бедра, сообщающийся с полостью тазобедренного сустава (абсолютный признак ППИ согласно ICM 2018); относительное укорочение левой нижней конечности 2 см; передвигается с помощью костылей. На момент поступления функциональное состояние левого тазобедренного сустава — 27 баллов по HHS, по шкале ВАШ боль оценивали в 5 баллов.
Результаты лабораторных исследований : анемия легкой степени (Hb 121 г/л), повышены СОЭ (93 мм/ч) и СРБ (30 мг/л). В пунктате левого тазобедренного сустава обнаружен рост Providence arustigianii 104 КОЕ/мл.
Операция проведена в 2023 г. Первый этап двухэтапного ревизионного эндопротезирования левого тазобедренного сустава: удаление эндопротеза; дебридмент; установка артикулирующего спейсера. Смоделирована чашка 50/32 из пресс-форм с помощью 1 пакета костного цемента с антибиотиками (1 г ванкомицина и 1 г цефатоксима). Имплантирован тазовый компонент спейсера 50 мм с помощью 1 пакета костного цемента с антибиотиками (2 г ванкомицина и 1 г цефатоксима). Установлена цементная ножка с помощью 1 пакета костного цемента с антибиотиками (5 г ванкомицина и 3 г цефатокси-ма). Интраоперационно определен дефект вертлужной впадины как 2С тип по Paprosky с протрузией дна, который заместили аллокостной крошкой. Операцию завершили установкой дренажа, послойным ушиванием раны. Рентгенограммы таза и левого тазобедренного сустава после оперативного вмешательства представлены на рис. 7. Кровопотеря составила 250 мл, интраоперационная гемотрансфузия — 250 мл. Результаты интраоперационного микробиологического исследования — Providence arustigianii 106 КОЕ/мл, Finegoldiamagna 103 КОЕ/мл. Рана зажила первичным натяжением. Дренаж удален на 7 сут. после операции.
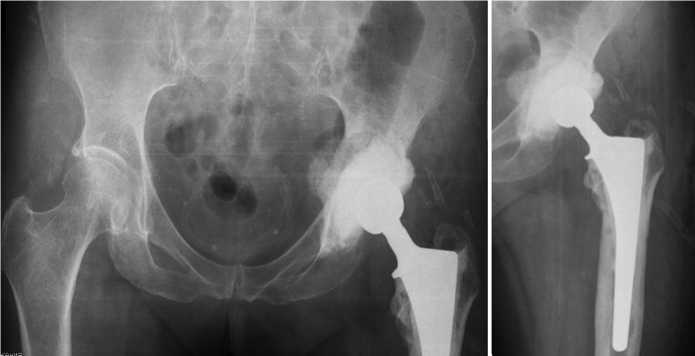
Рис. 7. Рентгенограммы таза и левого тазобедренного сустава после оперативного лечения с восполнением дефектов дна аллокостью и установленным артикулирующим антибактериальным спейсером
После первого этапа оперативного вмешательства проводили шестинедельный курс этиотропной антибактериальной терапии: в стационаре 2 нед. внутривенно ванкомицин 1,0 г 2 р/сут. и цефапе-разонсульбактам 2,0 г 2 р/сут. На амбулаторный этап лечения назначен курс пероральных и внутримышечных антибиотиков на 4 нед.: амоксициллин + клавулановая кислота 1000 мг 2 р/сут. в таблетках и цефаперазонсульбактам 2,0 2 р/сут. внутримышечно.
Далее рекомендовано использование костылей при ходьбе с ограничением нагрузки на оперированную конечность до следящего этапа оперативного лечения.
Через 1 мес. — контроль анализов (СОЭ и СРБ) и повторная рентгенография таза и левого тазобедренного сустава (рис. 8). Результаты лабораторных исследований: анемия легкой степени (Hb 118 г/л), СОЭ 20 мм/ч и СРБ 2 мг/л.
На контрольном осмотре через 1 мес. установлено, что клинико-лабораторные признаки рецидива заболевания отсутствуют (ран и свищей нет, нормотрофический рубец); компоненты спейсера стабильны; функциональное состояние левого тазобедренного сустава — 57 баллов по HHS.
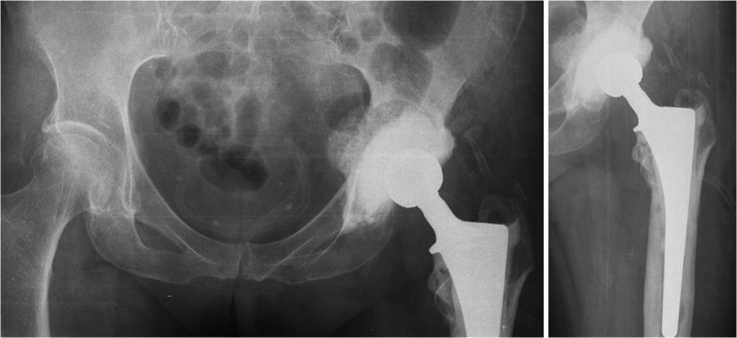
Рис. 8. Рентгенограммы таза и левого тазобедренного сустава через 1 мес. после операции
Через 4 мес. пациент поступил в клинику повторно для дообследования и проведения второго этапа оперативного лечения. Локальный статус: свищей нет; нормотрофический рубец в области левого бедра; передвигается с помощью костылей. На момент поступления функциональное состояние левого тазобедренного сустава 57 баллов по HHS. Результаты лабораторных исследований: из ОАК (Hb 130 г/л), СОЭ 30 мм/ч и СРБ 5мг/л. В пунктате левого тазобедренного сустава рост возбудителя не обнаружен.
В 2023 г. проведен второй этап двухэтапного ревизионного эндопротезирования левого тазобедренного сустава: удаление спейсера; дебридмент; установка бесцементного эндопротеза. Интраоперационно восполненный дефект представлен плотной кровоточащей костной тканью бледно-желтого цвета без признаков некроза. Рентгенограммы таза и левого тазобедренного сустава после оперативного вмешательства приведены на рис. 9. Кровопотеря составила 300 мл, интраоперационная гемотрансфузия — 250 мл. Рост возбудителя с импланта не выявлен. Рана зажила первичным натяжением. Дренаж удален на 5 сут. после операции.
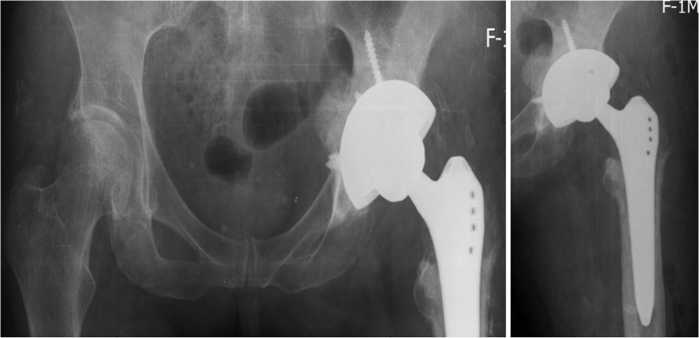
Рис. 9. Рентгенограммы таза и левого тазобедренного сустава после оперативного лечения
Проведен курс антибактериальной терапии в течение 2 нед.: внутривенно линезолид 600 г 2 р/сут. и меро-пенем 1,0 г р/сут. На амбулаторный этап лечения назначен курс пероральных антибиотиков на 4 нед.: амоксициллин + клавулановая кислота 1000 мг 2 р/сут. и левофлоксацин 500 мг 2 р/сут. Пациенту рекомендовано использование костылей при ходьбе с ограничением нагрузки на оперированную конечность в течение 3 мес. Через 6 мес. проведены исследования СОЭ и СРБ и рентгенография таза (рис. 10). Результаты лабораторных исследований: анемия легкой степени (Hb 102 г/л), СОЭ 22 мм/ч и СРБ 6 мг/л.
На контрольном осмотре через 6 мес. установлено, что клинико-лабораторные признаки рецидива заболевания отсутствуют (ран и свищей нет, нормотрофический рубец), компоненты эндопротеза стабильны, функциональное состояние левого тазобедренного сустава — 76 баллов по HHS.
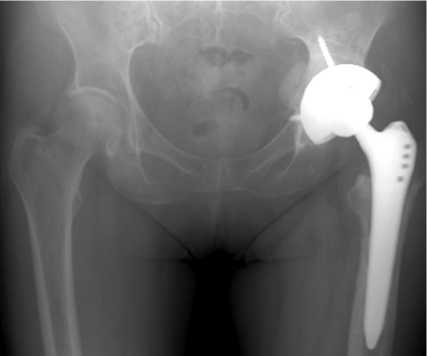
Рис. 10. Рентгенограмма тазобедренного сустава через 6 месяцев после операции
ОБСУЖДЕНИЕ
Лечение ППИ, как правило, требует применения нескольких достаточно травматичных хирургических вмешательств, длительных курсов этиотропной антибиотикотерапии, что в совокупности негативно влияет на качество и продолжительность жизни пациента [13, 14]. В отечественной литературе ограниченно представлены клинические примеры лечения ППИ [15]. При рецидивирующей форме ППИ, устойчивой микрофлоре, значительных костных дефектах хирурги нередко вынуждены использовать радикальные операции, такие как резекционная артропластика и экзартикуляция конечности [16]. В представленных клинических наблюдениях нам удалось избежать возможных осложнений, в том числе повреждения магистральных сосудов, которые, по литературным данным, встречаются в 0,25 % случаев [17].
Существует множество различных видов спейсеров для лечения перипротезной инфекции: блоковидные и артикулирующие, преформированные и изготовленные по индивидуальному заказу, а также изготовленные в операционной [18, 19]. Ревизионное эндопротезирование часто усложняется из-за снижения эластичности тканей и образования плотных рубцов. Значительные кавитарные дефекты дна и стенок вертлужной впадины, сформировавшиеся при выраженном инфекционном процессе, а также остеопороз, влияют на качество остеоинтеграции тазового компонента при установке постоянного импланта на втором этапе оперативного лечения. Главными преимуществами артикулирующего спей-сера после радикальной санации являются компенсация укорочения и восстановление опороспособ-ности, а также заполнение имеющейся раневой полости и препятствие усадке тканей.
В наших клинических примерах на санирующем этапе восполнены кавитарные дефекты и восстановлена функция тазобедренного сустава, подобные клинические данные не представлены в литературе. По литературным данным, отрицательный клинический результат часто сопровождается асептическим расшатыванием, рецидивом инфекции, а также вывихами и возможными перипротезными переломами [20, 21]. Реконструктивное восполнение значительных дефектов может быть сложной задачей для хирургов. При выполнении неоднократных ревизионных оперативных вмешательств на одном и том же суставе количество и качество костной ткани значительно страдает, при значительных дефектах дна используются реконструктивные импланты, что увеличивает стоимость лечения пациентов. Описанные выше примеры демонстрируют выполнение второго этапа ревизионного вмешательства без использования антипротрузионных колец, аугментов и колонн с пористым танталом, что технологически упрощает операцию.
В целом, лечение ППИ — сложная клиническая задача, для решения которой требуется всестороннее наблюдение различных узкопрофильных специалистов (ортопеда, фармаколога, микробиолога и других) и разработка персонифицированного комплекса лечебно-диагностических мероприятий с оптимальным подбором этиотропной антибиотикотерапии и технических средств реализации ревизионных вмешательств (в том числе имплантатов) в каждом конкретном случае [22]. Все вышеперечисленные факторы влияют на продолжительность сроков стационарного лечения пациентов с перипротезной инфекцией и величину финансовых затрат [23, 24].
В представленных клинических примерах дефекты костей вертлужной впадины восполнены костнопластическим материалом. В результате лечения в первом клиническом случае удалось восстановить функцию сустава с 24 до 85 баллов, во втором — с 27 до 76 баллов по шкале HHS, что соответствует литературным данным при применении тактики двухэтапного ревизионного эндопротезирования [25, 26]. Описанная серия клинических наблюдений была небольшой, но с увеличением числа пациентов с выраженными ацетабулярными дефектами методики по их восполнению будут набирать популярность.
ЗАКЛЮЧЕНИЕ
Методика восполнения дефектов при лечении ППИ в продемонстрированных клинических наблюдениях оказалась эффективной и экономически выгодной, позволила купировать инфекцию и улучшить функциональные результаты.
Список литературы Лечение пациентов с перипротезной инфекцией и замещением кавитарных дефектов типа 2С по Paprosky на этапе установки артикулирующего спейсера
- Kurtz S, Ong K, Lau E, et al. Projections of primary and revision hip and knee arthroplasty in the United States from 2005 to 2030. J Bone Joint Surg Am. 2007;89(4):780-785. doi: 10.2106/JBJS.F.00222
- Corvec S, Portillo ME, Pasticci BM, et al. Epidemiology and new developments in the diagnosis of prosthetic joint infection. Int J Artif Organs. 2012;35(10):923-934. doi: 10.5301/ijao.5000168
- Мурылев В.Ю., Куковенко Г.А., Елизаров П.М. и др. Алгоритм первого этапа лечения поздней глубокой перипротезной инфекции тазобедренного сустава. Травматология и ортопедия России. 2018;24(4):95-104. doi: 10.21823/2311-2905-2018-24-4-95-104
- Charette RS, Melnic CM. Two-Stage Revision Arthroplasty for the Treatment of Prosthetic Joint Infection. Curr Rev MusculoskeletMed. 2018;11(3):332-340. doi: 10.1007/s12178-018-9495-y
- Gomez MM, Tan TL, Manrique J, et al. The Fate of Spacers in the Treatment of Periprosthetic Joint Infection. J Bone Joint Surg Am. 2015;97(18):1495-502. doi: 10.2106/JBJS.N.00958
- Shieh SJ, Jou I-. Management of intractable hip infection after resectional arthroplasty using a vastus lateralis muscle flap and secondary total hip arthroplasty. Plast Reconstr Surg. 2007;120(1):202-207. doi: 10.1097/01. prs.0000264067.68714.a6
- Kliushin NM, Ababkov YV, Ermakov AM, Malkova TA. Modified Girdlestone arthroplasty and hip arthrodesis using the Ilizarov external fixator as a salvage method in the management of severely infected total hip replacement. Indian J Orthop. 2016;50(1):16-24. doi: 10.4103/0019-5413.173513
- Winter E, Piert M, Volkmann R, et al. Allogeneic cancellous bone graft and a Burch-Schneider ring for acetabular reconstruction in revision hip arthroplasty. J Bone Joint Surg Am. 2001;83(6):862-867. doi: 10.2106/00004623200106000-00007
- Berasi CC 4th, Berend KR, Adams JB, et al. Are custom triflange acetabular components effective for reconstruction of catastrophic bone loss? Clin OrthopRelatRes. 2015;473(2):528-535. doi: 10.1007/s11999-014-3969-z
- Bori G, Navarro G, Morata L, et al. Preliminary Results After Changing From Two-Stage to One-Stage Revision Arthroplasty Protocol Using Cementless Arthroplasty for Chronic Infected Hip Replacements. J Arthroplasty. 2018;33(2):527-532. doi: 10.1016/j.arth.2017.08.033
- Choi HR, Anderson D, Foster S, et al. Acetabular cup positioning in revision total hip arthroplasty with Paprosky type III acetabular defects: Martell radiographic analysis. Int Orthop. 2013;37(10):1905-1910. doi: 10.1007/s00264-013-2008-0
- Li C, Renz N, Trampuz A. Management of Periprosthetic Joint Infection. Hip Pelvis. 2018;30(3):138-146. doi: 10.5371/ hp.2018.30.3.138
- Ермаков А.М., Клюшин Н.М., Абабков Ю.В. и др. Оценка эффективности двухэтапного хирургического лечения больных с перипротезной инфекцией коленного и тазобедренного суставов. Гений ортопедии. 2018;24(3):321-326. doi: 10.18019/1028-4427-2018-24-3-321-326
- Ekman E, Palomaki A, Laaksonen I, et al. Early postoperative mortality similar between cemented and uncemented hip arthroplasty: a register study based on Finnish national data. Acta Orthop. 2019;90(1):6-10. doi: 10.1080/17453674.2 018.1558500
- Касимова А.Р., Гордина Е.М., Торопов С.С., Божкова С.А. Инфекция, вызванная Stenotrophomonas maltophilia, у пациентов травматолого-ортопедического профиля: клинический опыт и обзор литературы. Травматология и ортопедия России. 2023;29(1):84-94. doi: 10.17816/2311-2905-2027
- Ливенцов В.Н., Божкова С.А., Тихилов Р.М., Артюх В.А. Исходы ревизионного эндопротезирования тазобедренного сустава после резекционной артропластики с несвободной пересадкой мышечного лоскута у пациентов с трудноизлечимой перипротезной инфекцией. Травматология и ортопедия России. 2022;28(3):5-15. doi: 10.17816/2311-2905-1808
- Smith DE, McGraw RW, Taylor DC, Masri BA. Arterial complications and total knee arthroplasty. J Am Acad Orthop Surg. 2001;9(4):253-257. doi: 10.5435/00124635-200107000-00005
- Leunig M, Chosa E, Speck M, Ganz R. A cement spacer for two-stage revision of infected implants of the hip joint. Int Orthop. 1998;22(4):209-214. doi: 10.1007/s002640050244
- Hsieh PH, Shih CH, Chang YH, et al. Treatment of deep infection of the hip associated with massive bone loss: two-stage revision with an antibiotic-loaded interim cement prosthesis followed by reconstruction with allograft. J Bone Joint Surg Br. 2005;87(6):770-775. doi: 10.1302/0301-620X.87B6.15411
- Noordin S, Masri BA, Duncan CP, Garbuz DS. Acetabular bone loss in revision total hip arthroplasty: principles and techniques. Instr Course Lect. 2010;59:27-36.
- Tsai Y, Chang CH, Lin YC, et al. Different microbiological profiles between hip and knee prosthetic joint infections. J Orthop Surg (Hong Kong). 2019;27(2):2309499019847768. doi: 10.1177/2309499019847768
- Яковелли С., Парвизи Д. Кто должен лечить перипротезную инфекцию: необходимость мультидисциплинарно-го подхода. Травматология и ортопедия России. 2019;25(4):28-32. doi: 10.21823/2311-2905-2019-25-4-28-32
- Kurtz SM, Lau EC, Son MS, et al. Are We Winning or Losing the Battle With Periprosthetic Joint Infection: Trends in Periprosthetic Joint Infection and Mortality Risk for the Medicare Population. J Arthroplasty. 2018;33(10):3238-3245. doi: 10.1016/j.arth.2018.05.042
- Божкова С.А., Касимова А.Р., Тихилов Р.М. и др. Неблагоприятные тенденции в этиологии ортопедической инфекции: результаты 6-летнего мониторинга структуры и резистентности ведущих возбудителей. Травматология и ортопедия России. 2018;24(4):20-31. doi: 10.21823/2311-2905-2018-24-4-20-31
- Oussedik SI, Dodd MB, Haddad FS. Outcomes of revision total hip replacement for infection after grading according to a standard protocol. J Bone Joint Surg Br. 2010;92(9):1222-1226. doi: 10.1302/0301-620X.92B9.23663
- Рожков Н.И., Ермаков А.М., Бурцев А.В. и др. Анализ экономической и клинической эффективности одно-и двухэтапных ревизий при лечении перипротезной инфекции тазобедренного сустава (обзор литературы). Гений ортопедии. 2022;28(6):842-851. doi: 10.18019/1028-4427-2022-28-6-842-851


