Лечение рака предстательной железы высокоинтенсивной ультразвуковой абляцией и радикальной простатэктомией: сравнительный анализ отдаленных онкологических результатов
Автор: Соловов Вячеслав Александрович, Тюрин А.А.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Онкоурология
Статья в выпуске: 4 т.17, 2024 года.
Бесплатный доступ
Введение. Сравнить онкологическую эффективность при долгосрочном наблюдении высокоинтенсивной фокусированной ультразвуковой абляции (HIFU) и радикальной простатэктомии (РПЭ) при лечении пациентов с раком предстательной железы (РПЖ).
Рак предстательной железы, ультразвуковая абляция, hifu, радикальная простатэктомия
Короткий адрес: https://sciup.org/142243854
IDR: 142243854 | DOI: 10.29188/2222-8543-2024-17-4-50-55
Текст научной статьи Лечение рака предстательной железы высокоинтенсивной ультразвуковой абляцией и радикальной простатэктомией: сравнительный анализ отдаленных онкологических результатов
экспериментальная и клиническая урология № 4 2024
Рак предстательной железы (РПЖ) является наиболее частым злокачественным заболеванием солидных органов и второй причиной смертности от рака среди мужчин во всем мире [1]. Общепринятые варианты лечения варьируют от активного наблюдения до простатэктомии и дистанционной лучевой терапии (ДЛТ), которые, несмотря на свои преимущества, все же связаны со значительным риском и имеют высокий процент осложнений [2]. В связи с этим динамически развиваются малоинвазивные способы лечения РПЖ, такие как высокоинтенсивная фокусированная ультразвуковая абляция (HIFU), криоабляция. В рамках этой развивающейся парадигмы HIFU, благодаря своему ключевому преимуществу неинвазивности, стала действительной альтернативой «радикальным» способам лечения [3].
Использование высокоинтенсивного фокусированного ультразвука при лечении РПЖ изучается с начала 1990-х годов. Кроме таких неоспоримых преимуществ метода,как неинвазивность и низкое количество послеоперационных осложнений, HIFU так же может являться опцией спасительного лечения при местном рецидиве РПЖ после радикальной простатэктомии (РПЭ), ДЛТ или первичной HIFU-терапии [4]. Несмотря на все возрастающее количество публика-ций,свидетельствующих об удовлетворительных онкологических результатах HIFU-терапии [5], продолжаются споры относительно эквивалентности метода по сравнению с «традиционными» вариантами лечения. Европейская ассоциация урологов, например, не рекомендует первичную HIFU вне клинических исследований из-за отсутствия достаточных долгосрочных проспективных результатов и сравнительных данных с другими методами лечения [6]. И действительно, было опубликовано лишь несколько исследований, отражающих отдаленные онкологические результаты использования HIFU в лечении РПЖ, и, кроме того, недостаточно данных, сравнивающие HIFU с другими вариантами радикального лечения [7].
В связи с этим представляется весьма актуальным изучение клинического значения HIFU терапии при лечении РПЖ при длительном наблюдении.
Целью настоящего исследования является сравнительный анализ отдаленных онкологических результатов лечения РПЖ HIFU-терапии и РПЭ.
МАТЕРИАЛЫ И МЕТОДЫ
Был проведен одноцентровой ретроспективный анализ результатов лечения пациентов,получавших HIFU-терапию и РПЭ в 2008–2010 гг., и сравнение их онкологических результатов. Исследование проводи лось без какого-либо предварительного отбора паци ентов, в него включены пациенты с неметастатическим РПЖ и сравнимыми онкологическими данными.
Критериями включения являлись: верифициро ванный РПЖ cT1N0M0-cT3N0M0.
Критерии исключения : метастатический РПЖ, об ширные оперативные вмешательства на прямой кишке в анамнезе.
Пациенты, получавшие краткосрочную анти андрогенную терапию перед лечением, не были исклю чены из исследования. В таких случаях предлечебная гормонотерапия не рассматривалась как неоадъювант ная терапия, а назначалась индивидуально, чтобы обеспечить безопасность пациента в том случае, когда решение о выборе метода лечения было отложено на несколько недель. Во всех случаях клинический диаг ноз основывался на предоперационных параметрах. Причины смерти, в том числе и от РПЖ, определены согласно раковому регистру. Период наблюдения опре делен как интервал между лечением и датой смерти/ датой последней явки.
Пациенты группы HIFU и их последующее наблюдение
В исследование включены результаты лечения 194 больных, получившие HIFU-терапию. Большая часть пациентов этой группы либо отказались от хи рургического лечения в пользу менее инвазивного спо соба, либо не подходили для РПЭ.
Все процедуры выполнялись с использованием аппарата Ablatherm®. Во всех случаях для обезболивания во время процедуры использовалась спинальная анестезия. Среднее время операции составило 146 мин (60225). Средняя продолжительность госпитализации – 6 дней. Уретральный катетер удалялся в среднем на 5 сутки. Интраоперационных осложнений не было. У большинства пациентов перед лечением была выпол нена трансуретральная резекция (ТУР) предстатель ной железы с целью уменьшения размеров предстательной железы и удаления кальцинатов. Наблюдение после HIFU включало в себя исследование уровня про статспецифического антигена (ПСА) через 1, 3, 6, 12, 18 и 24 месяца, а затем – ежегодно. Онкологические резуль таты оценивались в соответствии с группами риска про грессии по D’Amico [8]. Биохимический рецидив диаг ностировался в соответствии с критериями ASTRO/ Phoenix [9]. Биопсии предстательной железы под конт ролем трансректального УЗИ проводились в случае поло жительного критерия Phoenix или в случае двухкратного повышения уровня ПСА менее, чем за полгода.
Пациенты группы РПЭ и их последующее наблюдение
В исследование были включены 150 пациентов которым была выполнена открытая позадилонная РПЭ. Во всех случаях для обезболивания во время опе рации применялся эндотрахеальный наркоз.
Среднее время операции составило 186 мин (80-245). Средняя продолжительность госпитализации – 14 дней. Уретральный катетер удалялся в среднем на 12 сутки. Критерием биохимического рецидива после проста тэктомии считали уровень ПСА 0,2 нг/мл и более при двух последовательных измерениях [6].
Статистический анализ
Статистический анализ проводился с использова нием SPSS версии 24.0. При сравнении параметриче ских переменных использовался t–критерий, в то время как для непараметрических переменных приме нялся U-критерий Манна-Уитни. Категориальные пе ременные сравнивались с использованием критерия χ2.Одномерный логарифмический ранговый тест ис пользовался для сравнения РПЭ и HIFU, в то время как графики Каплана–Мейера использовались для графи ческого представления.Для оценки влияния лечения на общую выживаемость,безрецидивную выживае мость, канцер-специфическую выживаемость была рассчитана многомерная регрессионная модель про порциональных рисков Кокса для каждой конечной точки. Считалось, что значения р<0,05 указывают на статистическую значимость.
РЕЗУЛЬТАТЫ
Всего в исследование был включено 344 пациента, из которых 194 больных получили HIFU-терапию, 150 была выполнена РПЭ. Характеристики пациентов представлены в таблице 1.
Распределение пациентов с низким, промежуточ ным и высоким риском в соответствии с классифика цией риска d’Amico показано в таблице 1 и статистически значимо не отличалось ( p >0,05).
Максимальный срок наблюдения составил 15 лет для всех групп пациентов. В таблице 2 представлены данные общей,безрецидивной и канцер-специфиче ской выживаемости для группы пациентов, пролечен ных HIFU-терапией, стратифицированных по методам лечения и классификациям риска по D’Amico. В таб лице 3 показаны результаты лечения всех пациентов
Таблица 1. Характеристика пациентов с РПЖ в зависимости от вида лечения
Table 1. Patients’ characteristics with prostate cancer, depending on the type of treatment
Значение показателя Features HIFU HIFU РПЭ RP Всего Total Количество пациентов Number of patients 194 150 344 Возраст медиана, лет (диапазон) Age means, years (range) 69 (51-87) 68 (52-82) 69 (51-87) ПСА до лечения, нг/мл, n (%) PSA before treatment, ng/ml, n (%) 103 (53,1) 68 (35,0) 23 (11,9) <10 68 (57,1) 171 (49,7) 10-<20 51 (34,0) 119 (34,6) ≥20 31 (20,7) 54 (15,7) Сумма баллов по шкале Глисона, n (%) Gleason score, n (%) ≤6 143 (73,7) 28 (18,7) 171 (49,7) 7 32 (16,5) 87 (58,0) 119 (34,6) ≥8 19 (9,8) 35 (23,3) 54 (15,7) Стадия Т, n (%) Stage T, n (%) T1 40 (20,6) 40 (26,7) 80 (23,3) T2 85 (43,8) 69 (46,0) 154 (44,8) T3 69 (35,6) 41 (27,3) 110 (31,9) Группа риска, n (%) Risk group, n (%) Низкий / Low 48 (24,7) 45 (30,0) 93 (27,0) Промежуточный / Intermediate 71 (36,6) 56 (37,3) 127 (36,9) Высокий / High 75 (38,7) 49 (32,7) 124 (36,1) тат экспериментальная и клиническая урология № 4 2024 группы HIFU и РПЭ без деления на группы риска. Общая пятнадцатилетняя выживаемость для пациентов группы РПЭ составила 28,3%, канцер-специфическая (РПЖ) выживаемость – 77,7%, а безрецидивная выживаемость составила 53,7%; для группы HIFU – 48,0%, 79,4%, 69,8%, соответственно. Кривые общей и безреци-дивной выживаемости для обеих групп, рассчитанные по методу Каплан-Мейера, представлены на рисунках 1 и 2 (значение χ2 0,98 и 1,23 соответственно).
В многофакторном регрессионном анализе Кокса (табл. 4) HIFU оказался независимым значимым про-
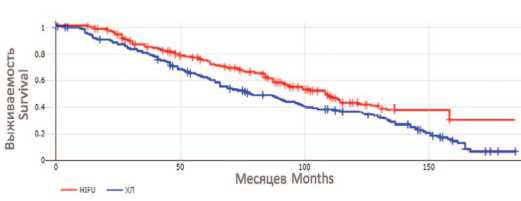
Рис. 1. Кривые общей выживаемости по Каплану-Мейеру для больных группы хирургического лечения и HIFU
Fig. 1. Kaplan-Meier overall survival curves for patients after surgical treatment and HIFU гностическим фактором снижения общей и канцер специфической смертности по сравнению с РПЭ,при этом в случае с биохимическим рецидивом статисти ческой значимости не отмечалось (p=0,071). Высокий балл Глисона и уровень ПСА были значимыми предик торами более высокой канцероспецифической смерт ности в группе HIFU. В группе пациентов с промежуточным и высоким риском прогрессии HIFU терапия значимо влияла на увеличение общей выживаемости по сравнению с РПЭ (табл. 4). У пациентов с низким риском прогрессии статистически значимых отличий выявлено не было.
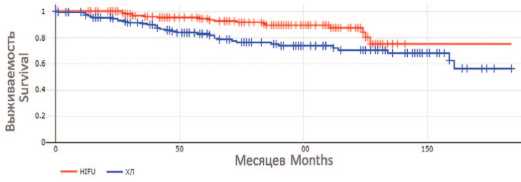
Рис. 2. Кривые безрецидивной выживаемости по Каплану-Мейеру для больных группы хирургического лечения и HIFU
Fig. 2. Kaplan-Meier recurrence-free survival curves for patients in the surgical treatment group and HIFU group
Таблица 2. Общая, безрецидивная, канцер-специфичная выживаемости в группе HIFU Table 2. Overall, relapse-free, cancer-specific survival in the HIFU group
|
Значение показателя Features |
Общая выживаемость, % Overall survival, % |
Канцер-специфическая выживаемость, % Disease-free survival, % |
Безрецидивная выживаемость, % Cancer-specific survival, % |
|
Низкий риск прогрессии Low risk progression |
56,1 |
93,75 |
85,42 |
|
Промежуточный риск прогрессии Intermediate risk of progression |
52,1 |
92,98 |
80,70 |
|
Высокий риск прогрессии High risk of progression |
37,9 |
84,85 |
69,70 |
Таблица 3. Сводная таблица по выживаемости пациентов с РПЖ в зависимости от вида лечения – 15 лет наблюдений
Table 3. Summary table on the survival of patients with prostate cancer, depending on the type of treatment – 15 years of observation
|
Общая выживаемость, % Overall survival, % |
Канцер-специфическая выживаемость, % Disease-free survival, % |
Безрецидивная выживаемость, % Cancer-specific survival, % |
|
|
HIFU HIFU |
48,0 |
79,4 |
69,8 |
|
Радикальная простатэктомия Radical prostatectomy |
28,3 |
77,7 |
53,7 |
Таблица 4. Многофакторный регрессионный анализ Кокса: общая смертность, канцер-специфицеская смертность, биохимический рецидив
Table 4. Multivariable Cox regression model for the end points: overall mortality, cancer-specifc mortality, biochemical recurrence
|
Прогностический фактор The prognostic factor |
Общая смертность ОР (95% ДИ), p Overall mortality HR (95% CI) |
Канцер-специфическая смертность ОР (95% ДИ), p Cancer-specific mortality HR (95% CI) |
Биохимический рецидив ОР (95% ДИ), p Biochemical recurrence HR (95% CI) |
|
РПЭ (по сравнению с HIFU) RPE (compared to HIFU) |
2,08 (1,32; 3,29), p = 0,001 |
3,99 (1,31, 12,07) p = 0,014 |
1,40 (0,96, 2,03) p = 0,071 |
|
Уровень ПСА PSA Level |
0,99 (0,97, 1,01) p = 0,361 |
1,00 (0,97, 1,03) p =0,832 |
1,01 (1,00, 1,01) p = 0,191 |
|
Показатель Глисона Gleason score |
1,05 (0,91, 1,22) p = 0,487 |
1,12 (0,82, 1,53) p = 0,487 |
1,13 (0,99, 1,29) p = 0,061 |
|
Риск прогрессии Risk of progression |
|||
|
Низкий риск прогрессии Low risk of progression |
1,55 (0,71, 1,54) p = 0,785 |
1,39 (0,64, 3,28) p = 0,411 |
0,96 (0,68, 1,35) p = 0,792 |
|
Промежуточный риск прогрессии Intermediate risk of progression |
1,06 (0,68, 1,61) p = 0,762 |
7,41 (1,63, 32,98) p = 0,008 |
1,03 (0,70, 1,58) p = 0,928 |
|
Высокий риск прогрессии High risk of progression |
1,71 (0,80, 3,52) p = 0,169 |
6,07 (0,91, 41,12) p = 0,071 |
1,69 (0,95, 2,89) p = 0,054 |
ОБСУЖДЕНИЕ
Лечение пациентов с неметастатическим РПЖ яв ляется предметом научных дискуссий. В последние де сятилетия появились альтернативные методы лечения, направленные на достижение удовлетворительных он кологических результатов с минимальными побоч ными эффектами [1 0-12]. Среди таких методов HIFU-терапия стала популярной благодаря своей не инвазивности и минимальными осложнениями. В рам ках этого развивавшегося тренда мы провели настоящее исследование для оценки отдаленных онко логических результатов HIFU-терапии.
Насколько нам известно, в русскоязычной литера туре данная публикация является первой, оцениваю щей долгосрочные онкологические результаты HIFU и РПЭ в лечении РПЖ.
Всего в анализ были включены результаты лече ния 344 пациентов (194 получили HIFU терапию, 150 – РПЭ) со сроком наблюдения 15 лет. По результатам на стоящего исследования было выявлено следующее. Во первых, при длительном наблюдении канцер-специфи ческая выживаемость в группе HIFU сопоставима с группой РПЭ, 79,4% и 77,7% соответственно. Во-вто рых, безрецидивная выживаемость в группе HIFU выше, чем в группе РПЭ: 69,8% и 53,7%. В-третьих наши данные продемонстрировали значительно более высокие показатели общей выживаемости в группе HIFU-терапии (48,0% против 28,3%). Возможным объ яснением этого является то, что HIFU-терапия имеет ключевое преимущество – неинвазивность, в то время как РПЭ обладает большим количеством осложнений и побочных эффектов. Другой возможной причиной этих различий является то,что высокие показатели общей выживаемости после HIFU-терапии могут быть обусловлены минимальными физической и психологи ческой травмами во время лечения, с коротким перио дом реабилитации. При этом высокие показатели безрецидивной выживаемости после ультразвуковой абляции могут быть связаны со стимуляцией противо опухолевого иммунного ответа [13].
В ряде работ было показано, что HIFU представ ляется разумной альтернативой для пациентов с лока лизованным РПЖ низкого риска прогрессии [5] однако наше исследование демонстрирует весьма во одушевляющие результаты для больных групп и про межуточного, и даже высокого риска: показатели РПЖ специфичной и безрецидивной выживаемости, в сравнении с аналогичными контрольными точками в группе РПЭ, оказались сопоставимыми.
В 2024 году были представлены данные первого проспективного исследования, в котором был проведен сравнительный анализ онкологической эффективности HIFU терапии и радикальной простатэктомии. В иссле дование были включены результаты лечения 3328 па циентов с локализованным РПЖ, средний срок наблюдения составил 30 месяцев. Исследователи пришли к выводу, что HIFU и РПЭ имеют сопоставимую онкологическую эффективность, при этом HIFU продемонстрировало отличные функциональные результаты [14].
В опубликованном недавно систематическом об зоре и мета-анализе группой экспертов было показано, что HIFU терапия имеет сопоставимые показатели био химической безрецидивной, канцер-специфической, общей выживаемости (58%, 96%, 63%) по сравнению с традиционными методами при лечении локализован ного РПЖ через 10 лет наблюдения. При этом HIFU обеспечивает превосходные функциональные резуль таты и имеет минимальное количество осложнений [15].
Наши же долгосрочные данные не опровергают предыдущие среднесрочные результаты и дают допол нительную информацию за пределами 10-летнего пе риода наблюдения. Сильные стороны нашего исследования, безусловно, заключаются в большом количе стве пациентов и длительном периоде наблюдения. При этом мы включали пациентов всех категорий риска без предварительного отбора. Представленные данные подтверждают, что HIFU является безопасным вариан том лечения,в том числе и для пациентов высокого риска прогрессии. В этом контексте наши результаты дополняют существующие публикации, рекомендую щие HIFU для лечения РПЖ у пациентов низкого и промежуточного риска прогрессии [16-18].
Однако мы не предоставляем данные о функцио нальных результатах и осложнениях, поскольку это вы ходит за рамки данного исследования. Тем не менее, понимание качества жизни в долгосрочной перспек тиве является важнейшим вопросом при планирова нии лечения. Несмотря на онкологические преимущества HIFU-терапии, неинвазивность метода может быть еще одним принципиальным моментом в про цессе принятия решений.
Между тем, настоящее исследованиe имеет ряд ограничений. Во-первых, настоящее исследование было одноцентровым, ретроспективным. Во-вторых, биохимический рецидив после HIFU терапии опреде лялся согласно критериям ASTRO/Phoenix, которые ос нованы на анализе значения ПСА после ДЛТ. При этом учитывалось то,что большинство предыдущих иссле дователей также оценивали эффективность HIFU с по мощью этих критериев. В-третьих, хорошие онкологические результаты могут быть следствием того, что все пациенты получали лечение в одном крупном он кологическом центре с большим опытом проведения HIFU-терапии. И, наконец, включение в исследование больных, получавших неоадъювантную андроген-де привационную терапию (АДТ), так же могло исказить результаты, но мы считаем, что, учитывая краткосроч ность неоадъювантной АДТ, этим фактором можно пренебречь.
ВЫВОДЫ
HIFU терапия может быть альтернативным методом лечения РПЖ для больных группы низкого и промежуточного риска прогрессии. Больные из группы высокого риска должны быть информированы о возможных повторных сеансах HIFU и/или адъювантном лечении. При долгосрочном наблюдении HIFU терапия показала сопоставимые показатели онкологической эффективности по сравнению с РПЭ при лечении больных с раком простаты. Метод позволяет добиться весьма обнадеживающих онкологических результатов при всех плюсах, связанных с его неинвазив-ностью. Разумеется, необходимо больше многоцентровых проспективных рандомизированных исследований с большим числом пациентов, чтобы подтвердить наши данные и оценить долгосрочную эффективность HIFU-терапии.
Список литературы Лечение рака предстательной железы высокоинтенсивной ультразвуковой абляцией и радикальной простатэктомией: сравнительный анализ отдаленных онкологических результатов
- Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2022. CA Cancer J Clin 2022;72(1):7-33. https://doi.org/10.3322/caac.21708.
- Carlsson S, Benfante N, Alvim R, Sjoberg DD, Vickers A, Reuter VE, et al. Long-term outcomes of active surveillance for prostate cancer: the Memorial Sloan Kettering Cancer Center experience. J Urol 2020;203(6):1122-7. https://doi.org/10.1097/JU.0000000000000713.
- Wang A, O'Connor LP, Yerram NK, Nandanan N, Ahdoot M, Lebastchi AH, et al. Focal therapy for prostate cancer: recent advances and future directions. Clin Adv Hematol Oncol 2020;18(2):116-125.
- Chaussy CG, Thüroff S. High-Intensity Focused Ultrasound for the treatment of prostate cancer: a review. J Endourol 2017;31(S1):S30-S37. https://doi.org/10.1089/end.2016.0548.
- Dickinson L, Arya M, Afzal N, Cathcart P, Charman SC, Cornaby A, et al. Medium-term outcomes after whole-gland High-intensity Focused Ultrasound for the treatment of nonmetastatic prostate cancer from a multicentre registry cohort. Eur Urol 2016;70(4):668-74. https://doi.org/10.1016/j.eururo.2016.02.054.
- Mottet N, Bellmunt J, Bolla M, Briers E, Cumberbatch MG, De Santis M, et al. EAU-ESTROSIOG guidelines on prostate cancer. Part 1: screening, diagnosis, and local treatment with curative intent. Eur Urol 2017;71(4):618-29. https://doi.org/10.1016/j.eururo.2016.08.003.
- Thüroff S, Chaussy C. Evolution and outcomes of 3 MHz high intensity focused ultrasound therapy for localized prostate cancer during 15 years. J Urol 2013;190(2):702-10. https://doi.org/10.1016/j.juro.2013.02.010.
- D'Amico AV, Whittington R, Malkowicz SB, Schultz D, Blank K, et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA 1998;280(11):969-74. https://doi.org/10.1001/jama.280.11.969.
- Roach M 3rd, Hanks G, Thames H Jr, Schellhammer P, Shipley WU, Sokol GH, Sandler H. Defining biochemical failure following radiotherapy with or without hormonal therapy in men with clinically localized prostate cancer: recommendations of the RTOG-ASTRO Phoenix Consensus Conference. Int J Radiat Oncol Biol Phys 2006;65(4):965-74. https://doi.org/10.1016/j.ijrobp.2006.04.029.
- Guang ZLP, Kristensen G, Røder A, Brasso K. Oncological and functional outcomes of whole-gland HIFU as the primary treatment for localized prostate cancer: a systematic review. Clin Genitourin Cancer 2024;22(4):102101. https://doi.org/10.1016/j.clgc.2024.102101.
- Bründl J, Osberghaus V, Zeman F, Breyer J, Ganzer R, Blana A, et al. Oncological longterm outcome after whole-gland high-intensity focused ultrasound for prostate cancer-21yr follow-up. Eur Urol Focus 2022;8(1):134-40. https://doi.org/10.1016/j.euf.2020.12.016.
- Rosenhammer B, Ganzer R, Zeman F, Näger T, Fritsche HM, Blana A, et al. Oncological long-term outcome of whole gland HIFU and open radical prostatectomy: a comparative analysis. World J Urol 2019;37(10):2073-80. https://doi.org/10.1007/s00345-018-2613-z.
- Karwacki J, Kiełbik A, Szlasa W, Sauer N, Kowalczyk K, Krajewski W, et al. Boosting the immune response-combining local and immune therapy for prostate cancer treatment. Cells 2022;11(18):2793. https://doi.org/10.3390/cells11182793.
- Parry MG, Sujenthiran A, Nossiter J, Morris M, Berry B, Nathan A, et al. Prostate cancer outcomes following whole-gland and focal high-intensity focused ultrasound. BJU Int 2023;132(5):568-74. https://doi.org/10.1111/bju.16122.
- Rischmann PJ, Coloby P, Chevallier T, Houede N, Villers A, Ploussard G. P2-06 HIFI trial: HIFU vs radical prostatectomy for localized prostate cancer in 3328 cases. Final results. J Urol 2024;211(5S2):e4. https://doi.org/10.1097/01.JU.0001015816.87470.c9.06.
- Hamdy FC, Donovan JL, Lane JA, Metcalfe C, Davis M, Turner EL, et al. ProtecT Study Group. Fifteen-year outcomes after monitoring, surgery, or radiotherapy for prostate cancer. N Engl J Med 2023;388(17):1547-58. https://doi.org/10.1056/NEJMoa2214122.
- van der Poel HG, van den Bergh RCN, Briers E, Cornford P, Govorov A, Henry AM, et al. Focal therapy in primary localised prostate cancer: the European Association of Urology position in 2018. Eur Urol 2018;74:84-91. Eur Urol 2019;75(2):e23-e24. https://doi.org/10.1016/j.eururo.2018.08.043.
- Deivasigamani S, Kotamarti S, Rastinehad AR, Salas RS, de la Rosette JJMCH, Lepor H, et al. Primary Whole-gland ablation for the treatment of clinically localized prostate cancer: a focal therapy society best practice statement. Eur Urol 2023;84(6):547-60. https://doi.org/10.1016/j.eururo.2023.06.013.


