Легочная гипертензия у пациентки с кифосколиотической болезнью сердца
Автор: Карабашева М.Б., Данилов Н.М., Сагайдак О.В., Даренский Д.И., Лазуткина В.К., Чазова И.Е.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Случаи из практики
Статья в выпуске: 3 т.34, 2019 года.
Бесплатный доступ
Кифосколиоз - это комбинированная деформация позвоночника, которая приводит к уменьшению объема «работающей» легочной ткани с развитием альвеолярной гиповентиляции и гипоксической вазоконстрикции легочных артерий. Данные изменения в небольшом проценте случаев вызывают повышение давления в легочной артерии и легочного сосудистого сопротивления. Патогенез легочной гипертензии (ЛГ) при кифосколиозе имеет сходство с ЛГ на фоне обструктивного апноэ сна или гиповентиляции на фоне ожирения. Пациенты с уже сформированной ЛГ теоретически могут быть кандидатами на стандартную патогенетическую терапию препаратами, однако доказательств эффективности данного лечения в настоящее время нет.
Кифосколиоз, легочная гипертензия, альвеолярная гиповентиляция, ингибитор фосфодиэстеразы 5-го типа, хроническая сердечная недостаточность
Короткий адрес: https://sciup.org/149125317
IDR: 149125317 | УДК: 616.131-008.331.1-02:[616.711-007.54/.55-06:616.124.3] | DOI: 10.29001/2073-8552-2019-34-3-172-178
Текст научной статьи Легочная гипертензия у пациентки с кифосколиотической болезнью сердца
Кифосколиоз – это врожденная или приобретенная комбинированная деформация позвоночника, представляющая собой сочетание сколиоза (боковой изгиб) и кифоза (изгиб в переднезаднем направлении). Выраженная деформация позвоночника при кифосколиозе вызывает уменьшение объема «работающей» легочной ткани, развитие альвеолярной гиповентиляции, которая, в свою очередь, приводит к гипоксической вазоконстрикции легочных артерий с последующим устойчивым повышением давления в легочной артерии и легочного сосудистого сопротивления. Согласно действующим рекомендациям, легочная гипертензия (ЛГ) при кифосколиозе относится к группе III (ЛГ вследствие патологии легких и/или гипоксии) [1].
Известно, что развитие ЛГ резко ухудшает прогноз у пациентов с кифосколиозом [2]. Истинная распространенность заболевания неизвестна. По данным детского регистра ЛГ, из 357 пациентов только у 2 имелся диагноз кифосколиоза [3]. В аналогичном регистре у взрослого населения ни у одного из 1 344 пациентов с ЛГ не наблюдалось данного вида деформации позвоночника [4].
Патогенез ЛГ при кифосколиозе имеет сходство с ЛГ на фоне обструктивного апноэ сна или гиповентиляции на фоне ожирения, в связи с чем базовой концепцией в лечении ЛГ является уменьшение нагрузки на аппарат внешнего дыхания посредством проведения неинвазивной вентиляции легких [5]. Пациенты с уже сформированной ЛГ теоретически могут быть кандидатами на стандартную патогенетическую терапию препаратами, направленными на снижение давления в легочной артерии. Доказательств эффективности лечения с использованием патогенетической терапии легочной артериальной гипертензии (ЛАГ-специфической терапии) в отношении прогноза пациентов с кифосколиозом и ЛГ в настоящее время не существует, ввиду чего данный вопрос остается дискутабельным. При этом пациентам с такими заболеваниями легких, как хроническая обструктивная болезнь легких, а также с интерстициальными заболеваниями легких не рекомендуется назначение ЛАГ-специфической терапии в связи с возможным увеличением кровотока в участках с плохой вентиляцией, что в итоге усугубляет имеющуюся гипоксию и ухудшает течение заболевания [1]. Существуют данные, что при кифосколиозе сохраня- ется относительно нормальная структура легочной ткани с минимальным вентиляционно-перфузионным дисбалансом [6]. В одной из работ описан успешный 3-летний опыт применения ингибиторов фосфодиэстеразы 5-го типа и неинвазивной искусственной вентиляцией легких (ИВЛ) у пациента с кифосколиозом [5].
В настоящей статье мы хотим показать, с какими трудностями пришлось встретиться при лечении пациентки с тяжелым кифосколиозом, высокой ЛГ и далеко зашедшей хронической сердечной недостаточностью. На просторах медицинских ресурсов количество зарубежных и отечественных публикаций по данной тематике можно счесть по пальцам, не говоря уже об отсутствии руководств по лечению столь редкой патологии. Все это указывает на необходимость публикации такого рода клинических случаев.
Пациентка Л., 39 лет. В апреле 2017 г. была госпитализирована в Национальный медицинский исследовательский центр кардиологии Министерства здравоохранения Российской Федерации (НМИЦ кардиологии) с жалобами на чувство нехватки воздуха при минимальной физической нагрузке, общую слабость, отеки голеней и стоп, увеличение живота в объеме, учащенное сердцебиение.
Anamnesis morbi
В январе 2017 г. после тяжелой острой респираторной вирусной инфекции (ОРВИ) пациентка впервые отметила появление отечности нижних конечностей, одышку умеренной интенсивности при физических нагрузках. В связи с прогрессирующим ухудшением состояния неоднократно вызывала скорую медицинскую помощь, ей внутривенно вводился фуросемид с хорошим эффектом, который сохранялся в течение нескольких дней, после чего отеки и одышка нарастали вновь. В марте 2017 г. пациентка обратилась за медицинской помощью в поликлинику по месту жительства: по данным эхокардиографии (ЭхоКГ) обращало на себя внимание повышение систолического давления в легочной артерии (СДЛА) до 75 мм рт. ст. Уровень Д-димера был в пределах нормальных значений. По результатам ультразвукового дуплексного сканирования вен нижних конечностей, признаков тромбоза выявлено не было. Проведена мультиспираль-ная компьютерная томография-ангиопульмонография (МСКТ-ангиопульмонография), данных за тромбоэмбо- лию легочной артерии не получено. Назначена симптоматическая терапия.
С апреля 2017 г. пациентка отметила резкое ухудшение состояния, нарастание признаков дыхательной и сердечной недостаточности, в связи с чем была госпитализирована в стационар Москвы. При проведении ЭхоКГ выявлено повышение СДЛА до 90 мм рт. ст.; по данным ультразвукового исследования брюшной полости: признаки асцита (около 400 мл жидкости); при пульсокси-метрии: SpаО2 = 62-67%. Учитывая отсутствие эффекта от проводимой симптоматической терапии и сохранение явлений сердечной недостаточности, пациентка была переведена в НМИЦ кардиологии для определения дальнейшей тактики лечения. На момент поступления принимала: ивабрадин – 7,5 мг 2 раза в день, фуросемид – 40-80 мг утром с учетом выраженности отеков, верошпи-рон – 50 мг утром.
Anamnesis vitae
Выраженный кифосколиоз, со слов больной, является следствием родовой травмы, и его выраженность с возрастом не менялась. В физической активности ограничена. В 2012 г. было оперативное родоразрешение, в послеоперационном периоде находилась на ИВЛ. Однако в связи с неоптимальным режимом ИВЛ, а также имеющимися анатомическими особенностями перераспределения воздушных масс на фоне искривления позвоночника развился пневмоторакс, проводилось дренирование плевральной полости. Выписана домой без признаков дыхательной недостаточности. С 2015 г. частые ОРВИ, отиты, пневмонии.
Данные физикального исследования при поступлении
Рост 142 см, вес 36,4 кг. Индекс массы тела 18 кг/м2. Подкожно-жировой слой развит крайне слабо, кахексия. Температура тела 35,8 °С. Кожные покровы бледные, выраженный цианоз носогубного треугольника, верхние и нижние конечности цианотичны, холодные на ощупь. Сатурация артериальной крови при пульсоксиметрии в пределах 60-65%. Выраженный кифосколиоз с вовлечением всех отделов позвоночника. Напряженные симметричные отеки стоп, голеней, бедер.
В легких при аускультации дыхание жесткое, справа в нижних отделах дыхание не выслушивается, в средних отделах справа и слева ослаблено. Хрипов нет. Частота дыхательных движений (ЧДД) – 28 в минуту.
Верхушечный толчок разлитой, локализуется в области 5-го межреберья по среднеключичной линии. Кроме митральной позиции, аускультация сердца в стандартных точках затруднена. В митральной позиции 1- и 2-й тоны равны, тоны ясные, шумы не выслушиваются. Артериальное давление (АД), измеренное в положении сидя справа 100/60 мм рт. ст., слева 90/60 мм рт. ст., частота сердечных сокращений (ЧСС) 110 уд./мин. Живот увеличен в размерах, признаки асцита, при пальпации мягкий, безболезненный во всех отделах. Печень пальпируется из-под края реберной дуги, выступая на 2 см. Край печени плотный и ровный. Селезенка не пальпируется.
Результаты комплексного клинико-инструментального обследования представлены в таблицах 1, 2 и на рисунках 1–3.
Таблица 1. Общий анализ крови
Table 1. Complete blood cell count
|
Лейкоциты, ×109/л Leukocytes, ×109/L |
6,8 (N:4,8–10,8) |
|
Нейтрофилы, тыс./мкл Neutrophils, thous./μL |
4,9 (N:1,9–8,0) |
|
Нейтрофилы, % Neutrophils, % |
71,7 (N:40,0–74,0) |
|
Лимфоциты, % Lymphocytes, % |
17,9 (N:19,0–48,0) |
|
Лимфоциты, тыс./мкл Lymphocytes, thous./μL |
1,2 (N:0,9–5,2) |
|
Моноциты, % |
9,20 (N:3, |
|
Monocytes, % |
40–12,00) |
|
Моноциты, тыс./мкл Monocytes, thous./μL |
0,63 (N:0,20–1,00) |
|
Эозинофилы, % Eosinophils, % |
0,80 (N:0,00–7,00) |
|
Эозинофилы, тыс./мкл Eosinophils, thous./μL |
0,05 (N:0,00–0,80) |
|
Базофилы, % Basophiles,% |
0,40 (N:0,00–1,50) |
|
Базофилы, тыс./мкл Basophiles, thous./μL |
0,03 (N:0,00–0,20) |
|
Эритроциты, ×1012/л Erythrocytes, ×1012/L |
5,85 (N:4,20–5,40) |
|
Гемоглобин, г/дл |
12,28 |
|
Hemoglobin, g/d, % |
(N:12,00-16,00) |
|
Гематокрит, % Hematocrit, % |
45,4 (N:37,0–47,0) |
|
Средний объем эритроцита, фл Mean corpuscular volume, fL |
77,6 (N:81,0–99,0) |
|
Среднее содержание гемоглобина, пг Mean corpuscular hemoglobin, pg |
21,0 (N:27,0–31,0) |
|
Средняя конц. гемогл. в эритроц., г/дл Mean corpuscular hemoglobin concentration, g/dL |
27 (N:33–37) |
|
Коэф. анизотропии эритроцитов, % |
19,0 |
|
Erythrocyte anisotropy coefficient, % |
(N:11,5–14,5) |
|
Тромбоциты, 109/л Platelets, × 109/L |
205 (N:130–400) |
|
Средний объем тромбоцита, фл Mean platelet volume, fL |
8,6 (N:7,2–11,1) |
Примечание: N – норма. Note: N – norm.
Таблица 2. Биохимический анализ крови
Table 2. Blood chemistry
|
Альбумин, г/л Albumin, g/L |
36,7 |
(N:34,0–48,0) |
|
АЛТ, Ед./л ALT, U/L |
90,0 |
(N:3,0–40,0) |
|
АСТ, Ед./л AST, U/L |
30,0 |
(N:3,0–29,0) |
|
ЛДГ, Ед./л LDH, U/L |
399,0 |
(N:218,0–435,0) |
|
Щелочная фосфатаза, Ед./л Alkaline phosphatase, U/L |
105,0 |
(N:80,0–430,0) |
Окончание табл. 2
End of table 2
|
Альбумин, г/л Albumin, g/L |
36,7 |
(N:34,0–48,0) |
|
Билирубин общий, мкмоль/л Total bilirubin, μmol/L |
16,4 |
(N:1,7–20,5) |
|
Глюкоза, ммоль/л Glucose, mmol/L |
4,30 |
(N:3,50–5,80) |
|
Железо, мкмоль/л Iron, μmol/L |
4,7 |
(N:7,1–26,6) |
|
Калий, ммоль/л Potassium, mmol/L |
5,2 |
(N:3,5-5,3) |
|
Хлор, ммоль/л Chloride, mmol/L |
96,4 |
(N:98,0-108,0) |
|
Натрий, ммоль/л Sodium, mmol/L |
140,0 |
(N:138,0-153,0) |
|
Общий белок, г/л Total protein, g/L |
66,1 |
(N:64,0-83,0) |
|
ГГТ, Ед./л GGT, U/L |
40,0 |
(N:6,0-45,0) |
|
Креатинин, мкмоль/л Creatinine, μmol/L |
56,0 |
(N:44,0-106,0) |
|
С реактивный белок, мг/л C-reactive protein, mg/L |
2,80 |
(N:0,00-5,00) |
|
Определение волчаночного анти- |
31,4 |
|
|
коагулянта: LA 1 (скрининговый) Lupus anticoagulant: LA 1 (screen- |
(отрицательно) |
(N:31,0–44,0) |
|
ing) |
(negative) |
|
|
D-димер, мкг/мл D-dimer, μg/mL |
0,49 |
(N:0,00-0,50) |
|
Скорость оседания эритроцитов, мм/ч Erythrocyte sedimentation rate, mm/h |
2,0 |
(N:0,0-20,0) |
|
BNP, пг/мл BNP, pg/mL |
1270,7 |
(N:0,0-100,0) |
|
Протромбиновое время, с Prothrombin time, s |
12,5 |
(N:5,0-15,0) |
|
Междун. нормализов. отношение International normalized ratio |
1,01 |
(N:0,75-1,15) |
|
Протромбин по Квику, % Quick’s value, % |
97,9 |
(N:70,0-150,0) |
Примечание: N – норма. Note: N – norm.
Проведение ЭхоКГ было крайне затруднено из-за деформации грудной клетки (кифосколиотическое сердце). Были выявлены следующие изменения: следовое количество жидкости в проекции правого предсердия (ПП) и правого желудочка (ПЖ). Дилатация правых отделов сердца с признаками высокого давления в правых камерах сердца (ПП = 23 см2, переднезадний размер ПЖ = 4,7 (баз.) см; выносящий тракт ПЖ = 3,3 см; толщина передней стенки ПЖ = 0,45 см). Расширение легочной артерии и ее ветвей. Высокая ЛАГ: СДЛА = 90 мм рт. ст.; мГДсТК = 67 мм рт. ст. (недооценка из-за трудности измерения трикуспидальной регургитации - ТР), ср.ДЛА = 53 мм рт. ст., давление заклинивания легочной артерии по тканевому миокардиальному допплеровскому исследованию (ДЗЛА по ТМД) = 8 мм рт. ст. Снижение систолической функции ПЖ (TAPSE = 1,4 см; N>1,7 см). Не- достаточность клапана легочной артерии (ЛК) 1-й ст., трикуспидального клапана (ТК) 1–2-й ст. Вторично открытое овальное окно со сбросом справа налево (d~0,4 см). Следовое количество жидкости в полости перикарда. Нижняя полая вена (НПВ) значительно расширена, кол-лабирование ее существенно снижено (отмечается извитость контура НПВ – деформация). Определяется свободная жидкость в брюшной полости – асцит.
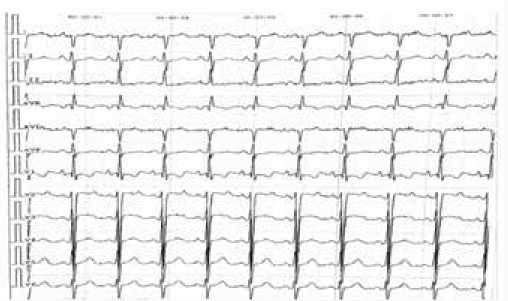
Рис. 1. Электрокардиограмма. Ритм синусовый, тахикардия ЧСС 112 уд./мин. Отклонение электрической оси сердца (ЭОС) вправо. Изменение предсердного компонента с признаками Р-pulmonale. Признаки изменения миокарда вследствие гипертрофии правого желудочка (ПЖ)
Fig. 1. Electrocardiogram. Sinus rhythm, tachycardia heart rate 112 beats per minute. Change in atrial component with signs of P-pul-monale. Right ventricular hypertrophy
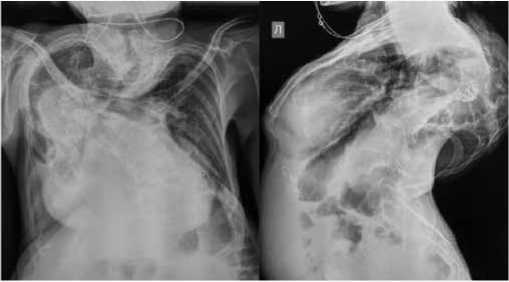
Рис. 2. Рентгенография органов грудной клетки. Выраженная деформация грудной клетки за счет сколиоза, кифоза.
Умеренно выраженный пневмосклероз в видимых отделах легких. Судить о сердце, аорте, диафрагме, синусах не представляется возможным
Fig. 2. Chest X-ray. Severe deformity of the chest due to scoliosis and kyphosis. Moderate pneumosclerosis in the visible regions of the lungs. Evaluation of the heart, aorta, diaphragm, and sinuses was impossible
Учитывая полученные данные, пациентке был выставлен диагноз: Кифосколиотическая болезнь сердца. Кифосколиотическая альвеолярная гиповентиляция. Дыхательная недостаточность 3-й степени. Высокая ЛГ. Функциональный класс IV (ВОЗ). Относительная недостаточность ТК 2-й степени, ЛК – 1-й степени. Вторично открытое овальное окно, со сбросом справа налево. Синусовая тахикардия. Хроническая сердечная недостаточность 2Б стадии.
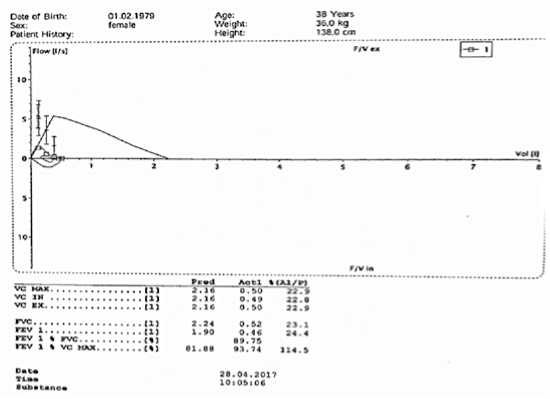
Рис. 3. Спирометрия с компьютерной обработкой данных. Резкое снижение жизненной емкости легких (ЖЕЛ). Показатели проходимости дыхательных путей в пределах возрастной нормы. Максимальная ЖЕЛ вдоха 22,8%, нарушение аппарата вентиляции по рестриктивному типу
Fig. 3. Spirometry with computer processing of data. A sharp decrease in lung capacity. Airway patency within the age norm. Maximum lung capacity of 22.8%, restrictive type of ventilatory impairment.
Учитывая принадлежность к III группе ЛГ, прямых показаний для катетеризации правых отделов сердца не было, однако необходимость инвазивного диагностического вмешательства у данной больной обсуждалась в связи с трудностями оценки тяжести ЛГ при проведении ЭхоКГ. Тем не менее имеющиеся анатомические особенности и тяжесть состояния пациентки не позволили выполнить зондирование правых камер сердца. Пациентке была инициирована ЛАГ-специфическая терапия: силденафил в дозе 5 мг 3 раза в сутки, также проводилась диуретическая терапия фуросемидом – 60 мг в/в, спиронолактоном – 50 мг. С целью преодоления резистентности, учитывая длительный анамнез приема высоких доз фуросемида в домашних условиях, к диуретической терапии был добавлен ацетазоламид (125 мг 3 раза в день). Для увеличения онкотического давления осуществлялась инфузия 20%-го альбумина в объеме 50 мл. На фоне проводимой терапии: диурез без превышения, отеки на нижних конечностях и объем живота на прежнем уровне. На 4-е сутки пребывания пациентки в отделении отмечена тенденция падения сатурации артериальной крови с 65 до 50%. Больная переведена в палату интенсивного наблюдения, состояние стабильное. На фоне инсуффляции увлажненного кислорода со скоростью 2 л/мин – SpаO2 на уровне 100%. На этом фоне пациентка перестала отвечать на вопросы, уровень сознания – сопор, реакция зрачков на свет присутствует, симметричная, реакция на боль сохранена. Для решения вопроса о необходимости ИВЛ пациентка была переведена в блок интенсивной терапии (БИТ).
Результаты газового анализа артериальной крови при переводе в БИТ: pH 7,201, P (CO2) 107,3 мм рт. ст., P (O2) 33 мм рт. ст., Spа (O2) 46%, Hb 15,6 г/л, Ht 46, Na 126 ммоль/л, К 3,6 ммоль/л.
В связи с явлениями метаболического ацидоза начата инфузия гидрокарбоната натрия, кислород отключен, силденафил и диакарб также отменены. На фоне проводимой терапии состояние стабилизировалось и через 10 мин вернулось к прежнему уровню. В дальнейшем пациентке проводилась неинвазивная вентиляция легких с хорошим эффектом.
Обсуждение
Врожденный кифосколиоз с тяжелой деформацией грудной клетки привел к стойкому нарушению вентиляции легких, преимущественно по рестриктивному типу (синдром Риголетто). В результате нарушения дыхательной функции развилась тяжелая и длительная гипоксемии, которая, в свою очередь, индуцировала стойкий вазоспазм и повреждение сосудистой стенки артериол и капилляров легких. Указанные изменения вызвали существенное повышение сопротивления сосудов легких и, как следствие, ЛГ. Применение ЛАГ-специфических препаратов (в рассматриваемом случае – силденафила) на фоне сложных нарушений вентиляции легких привело к усилению перфузии в плохо вентилируемых альвеолах, нарастанию гиперкапнии и гипоксемии. Использование на данном фоне инсуфляции 100%-го кислорода лишь усугубило ситуацию, так как уменьшило тонус дыхательного центра и снизило интенсивность собственного дыхания. В большинстве случаев в организме у пациентов с длительной гипоксемией развиваются механизмы адаптации и компенсации гипоксемии. Вероятнее всего, интенсивная подача кислорода вызвала резкое повышение парциального давления кислорода в крови, что и явилось причиной декомпенсации состояния пациентки. Применение ацетазоламида в качестве препарата, позволяющего преодолеть резистентность к диуретиче- ской терапии, в данном случае не было успешным. Ацетазоламид как блокатор карбоангидразы почек, повысив экскрецию гидрокарбонатов, привел к развитию метаболического ацидоза, что в данной ситуации усугубило уже имеющийся дисбаланс кислотно-щелочного равновесия, но не помогло преодолеть резистентность к диуретикам. У пациентов без выраженной дыхательной патологии ацетазоламид способствует поддержанию нормального уровня насыщения крови кислородом и даже применяется для лечения центрального апноэ сна. Возможно, у данной пациентки препарат усилил имеющийся дыхательный ацидоз, при этом стимуляция дыхательного центра не привела к росту сатурации крови в связи с исходно нарушенным вентиляционно-перфузионным соотношением.
Выводы
Кифосколиоз – редкая патология, которая может осложняться развитием ЛГ с неблагоприятным прогнозом. Лечение таких больных – крайне сложная задача для врача в связи со сложностью патогенеза заболевания. Назначение любых препаратов может нарушить отно- сительную стабильность в состоянии больного, в связи с чем в определенных случаях выбор немедикаментозной тактики является лучшим для пациента.
Оптимальным лечением для больных с ЛГ на фоне ки-фосколиотической болезни сердца при запущенном течении заболевания видится изолированное применение неинвазивной ИВЛ, в частности, ночной неинвазивной вентиляции легких с положительным давлением (NIPPV), которая является более эффективным методом лечения по сравнению с неинвазивной ИВЛ в режиме постоянного положительного давления (Continuous Positive Airway Pressure – CPAP) [7–9]. При тяжелых нарушениях вентиляционно-перфузионного соотношения, что, по-видимому, имеет место у больных с кифосколиозом на последних стадиях, назначение ЛАГ-специфической терапии может усугубить гипоксемию и тем самым ухудшить течение заболевания.
Применение таких препаратов, как ацетазоламид, у больных с ЛГ и рефрактерной к диуретической терапии хронической сердечной недостаточностью должно проводиться под контролем газового состава крови во избежание серьезных нарушений кислотно-щелочного баланса.
Список литературы Легочная гипертензия у пациентки с кифосколиотической болезнью сердца
- Galiè N., Humbert M., Vachiery J.L., Gibbs S., Lang I., Torbicki A. et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: the joint task force for the diagnosis and treatment of pulmonary hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur. Heart J. 2016;37(1):67-119. DOI: 10.1093/eurheartj/ehv317
- Bergofsky E.H., Turino G.M., Fishman A.P. Cardiorespiratory failure in kyphoscoliosis. Medicine. 1959;38:263-318.
- Berger R.M., Beghetti M., Humpl T., Raskob G.E., Ivy D.D., Jing Z.C. et al. Clinical features of pediatric pulmonary hypertension: A registry study. Lancet. 2012;379:537-546. DOI: 10.1016/S0140-6736(11)61621-8
- Hurdman J., Condliffe R., Elliot C.A., Davies C., Hill C., Wild J.M. et al. ASPIRE registry: Assessing the spectrum of pulmonary hypertension indented at a REferral centre. Eur. Respir. J. 2012;39:945-955. DOI: 10.1183/09031936.00078411
- Chaouat A., Weitzenblum E., Krieger J., Oswald M., Kessler R. Pulmonary hemodynamics in the obstructive sleep apnea syndrome: Results in 220 consecutive patients. Chest. 1996;109:380-386. DOI: 10.1378/chest.109.2.380
- Turino G.M., Goldring R.M., Fishman A.P. Cor pulmonale in musculoskeletal abnormalities of the thorax. Bull. NY Acad. Med. 1965;41:959-980.
- Sawicka E.H., Branthwaite M.A. Respiration during sleep in kyphoscoliosis. Thorax. 1987;42:801-808. DOI: 10.1136/thx.42.10.801
- Smith I.E., Laroche C.M., Jamieson S.A., Shneerson J.M. Kyphosis secondary to tuberculosis osteomyelitis as a cause of ventilatory failure: Clinical features, mechanisms and management. Chest. 1996;110:1105-1110.
- Nauffal D., Domènech R., Martínez García M.A., Compte L., Macián V., Perpiñá M. Noninvasive positive pressure home ventilation in restrictive disorders: Outcome and impact on health-related quality of life. Respir. Med. 2002;96:777-783.


