Лекарственно индуцированная артериальная гипертензия у пациента с ишемическим инсультом
Автор: Рамазанов Г.Р., Шевченко Е.В., Муслимов Р.Ш., Алиев И.С.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клинический случай
Статья в выпуске: 4 т.13, 2023 года.
Бесплатный доступ
Прогрессирующий ишемический инсульт - наиболее частая форма инсульта с неврологическим ухудшением. В основе патогенеза прогрессирующего ишемического инсульта лежит расширение зоны инфаркта мозга и уменьшение зоны «пенумбры» в области фокальной ишемии. Ведущая роль в поддержании баланса между необратимой и обратимой ишемией принадлежит церебральному коллатеральному кровотоку. Будучи многофакторным явлением, коллатеральный кровоток обусловлен как морфологическими и функциональными характеристиками коллатерального артериального русла, так и системными факторами, среди которых большое значение принадлежит гемодинамике. Тактику целенаправленного повышения артериального давления с целью улучшения перфузии мозга называют лекарственно-индуцированной артериальной гипертензией. Ряд экспериментальных работ продемонстрировали безопасность и эффективность указанного метода, однако немногочисленность и разнородность данных в исследованиях не позволяют провести мета-анализ и сформировать оптимальный протокол лекарственно-индуцированной артериальной гипертензии. В данной статье мы хотим описать клиническое наблюдение пациентки с ишемическим инсультом на фоне критического стеноза инсульт-связанной внутренней сонной артерии и фибрилляции предсердий, в лечении которой мы применили лекарственно индуцированную артериальную гипертензию.
Церебральный коллатеральный кровоток, ишемический инсульт, перфузия, пенумбра, базисная терапия
Короткий адрес: https://sciup.org/143180695
IDR: 143180695 | УДК: 616.831-005.1:616+616.12-008.1-072.7-002.1 | DOI: 10.20340/vmi-rvz.2023.4.CASE.4
Текст научной статьи Лекарственно индуцированная артериальная гипертензия у пациента с ишемическим инсультом
Неврологическим ухудшением (НУ) при ишемическом инсульте (ИИ) называют появление новых или нарастание исходных симптомов [1, 2]. Данное явление ассоциировано с худшим клиническим исходом заболевания и высокой летальностью [3]. Прогрессирующий ИИ - наиболее частая форма инсульта с НУ. Симптомы при таком течении ИИ связаны с тем же артериальным бассейном, в котором возникла острая церебральная ишемия в дебюте заболевания [4]. В основе патогенеза прогрессирующего ИИ лежит расширение зоны инфаркта мозга и уменьшение зоны «пенумбры» в области фокальной ишемии [5]. Ведущая роль в поддержании баланса между необратимой и обратимой ишемией принадлежит церебральному коллатеральному кровотоку [6].
Будучи многофакторным явлением, коллатеральный кровоток обусловлен как морфологическими и функциональными характеристиками коллатерального артериального русла, так и системными факторами, среди которых большое значение принадлежит гемодинамике [7-11]. Артериальную гипертензию наблюдают у 60-80 % пациентов в дебюте ИИ. Существует гипотеза, что повышение артериального давления (АД) является компенсаторным явлением для обеспечения церебрального кровотока в зоне «пенумбры» [12].
Артериальная гипертензия снижала риск прогрессирующего ИИ по результатам ряда обсервационных исследований и напротив, артериальная гипотензия проявила себя как предиктор НУ у пациентов с ИИ [13-15].
Тактику целенаправленного повышения АД с целью улучшения перфузии мозга называют лекарственно-индуцированной артериальной гипертензией (ЛИГ). В исследованиях с оценкой диффузионно-перфузионного несоответствия по данным магнитно-резонансной томографии продемонстрирована способность ЛИГ уменьшать дефицит перфузии у пациентов с ИИ в остром периоде [16, 17].
Влияние ЛИГ на исход ИИ было предметом изучения в ряде экспериментальных клинических исследований. В качестве индуцирующего агента использовали адреномиметики: фенилэфрин, норэпинефрин, эфедрин, допамин, добутамин, эпинефрин и метараминол. Целевые показатели АД (среднее АД, систолическое АД и диастолическое АД), а также их значения, различались в исследованиях. Варьировали длительность применения адреномиметиков, а также условия их отмены [18-21]. Разнородность этих и других показателей и немногочисленность исследований, изучавших эффективность и безопасность ЛИГ, не позволяют провести на их основании мета-анализ. Однако авторы систематического обзора 27 работ, посвящённых изучению данного вопроса (Str0msnes Т.А. и со-авт., 2022), указывают на целесообразность применения ЛИГ у нескольких категорий пациентов. Среди них пациенты со значительным стенозом или окклюзией инсульт-связанной экстракраниальной или интракраниальной крупной артерии и с устойчивым систолическим АД менее 130 мм рт. ст. [22].
В данной статье мы хотим описать клиническое наблюдение пациентки с ИИ на фоне критического стеноза инсульт-связанной внутренней сонной артерии (ВСА)
и фибрилляции предсердий, в лечении которой мы применили ЛИГ.
Клинический пример
Пациентка 75 лет доставлена в НИИ СП им. Н.В. Склифосовского ДЗМ через один час после угнетения уровня бодрствования, появления сенсомоторной афазии, дисфагии и правосторонней гемиплегии. Степень выраженности неврологического дефицита составила 26 баллов по NIHSS (National Institutes of Health Stroke Scale) и 14 баллов по Шкале комы Глазго. Артериальное давление и частота сердечных сокращений (ЧСС) - 190/100 мм рт. ст. и 90 соответственно, ритм фибрилляции предсердий при электрокардиографии. Компьютерная томография (КТ) исключила внутричерепное кровоизлияние и не визуализировала признаков ишемии (ASPECTS 10 баллов). При КТ-ангиографии интракраниальных и экстракраниальных артерий выше дуги аорты выявлена субокклюзия атеросклеротической бляшкой инсульт-связанной левой ВСА и стеноз правой ВСА до 50 %. Со стороны интракраниальных артерий не было получено данных за значимое сужение, а визуальная оценка не показала асимметрии ветвей СМА (рис. 1 и 2). При магнитно-резонансной томографии -признаки острых ишемических изменений в бассейне левой средней мозговой артерии и церебральной микроангиопатии (рис. 3).
Выполнение системной тромболитической терапии было противопоказано в связи с риском развития симп-томной геморрагической транформации. Пациентка госпитализирована в отделение реанимации и интенсивной терапии, установлен назогастральный зонд, назначены антиагрегантная терапия ацетилсалициловой кислотой в дозе 100 мг в сутки, нефракционированный гепарин с дозой, регулируемой в соответствии со значениями активированного частичного тромбопластинового времи, блокатор протонной помпы. Гипотенивная терапия не назначена. Лабораторные показатели крови и мочи не были отклонены от нормальных значений, кроме креатинина, повышенного до 101 мкмоль/л (скорость клубочковой фильтрации согласно формуле Chronic Kidney Desease Epidemiology Collaboration (CKD-EPI) 47 мл/мин/1,73 м2). Через два часа от начала госпитализации отмечали восстановление ясного сознания при сохраняющемся неврологическом дефиците на фоне систолического АД 150/90 мм рт. ст. При дальнейшем мониторировании систолическое АД изменялось в пределах 136-151 мм рт. ст., а диастолическое - 79-90 мм рт. ст., синусовый ритм восстановился самостоятельно, ЧСС варьировала от 70 до 90 в мин. Через 24 часа восстановилась функция глотания, частично регрессировали двигательный дефицит и афазия. Оценка по NIHSS составила 10 баллов. В начале вторых суток заболевания, на фоне АД 112/57 мм рт. ст., синусового ритма с ЧСС 88 в мин, произошло прогрессирование ИИ с углублением дефицита до 16 баллов по NIHSS. Пациентке катетеризировали яремную вену, начали инфузию норэпинефрина. Систолическое АД достигло целевого интервала 160-180 мм рт. ст. в течение 30 мин и соответствовало ему 75 % измерений. Через 4 часа от начала ЛИГ неврологический дефицит регрессировал до 4 баллов по
NIHSS. В дальнейшем достижение целевых значений АД требовало увеличения дозы норэпинефрина. В начале вторых суток ЛИГ в связи со стойкой тахикардией до 140 уд./мин было решено уменьшить дозу норэпинефрина и снизить целевые значения АД до 140-160 мм рт. ст., а через 40 часов от начала процедуры развился пароксизм фибрилляции предсердий и ЛИГ прекратили. Последую щее снижение АД до значений, соответствующих нормотензии, не привело к НУ. В дальнейшем речевые нарушения регрессировали полностью, сохранялся лёгкий гемипарез. Пациентка была выписана на 17-е сутки госпитализации с оценками по NIHSS - 2 балла, модифицированной шкале Рэнкина - 1, индексу Бартел - 95, индексу мобильности Ривермид -14.
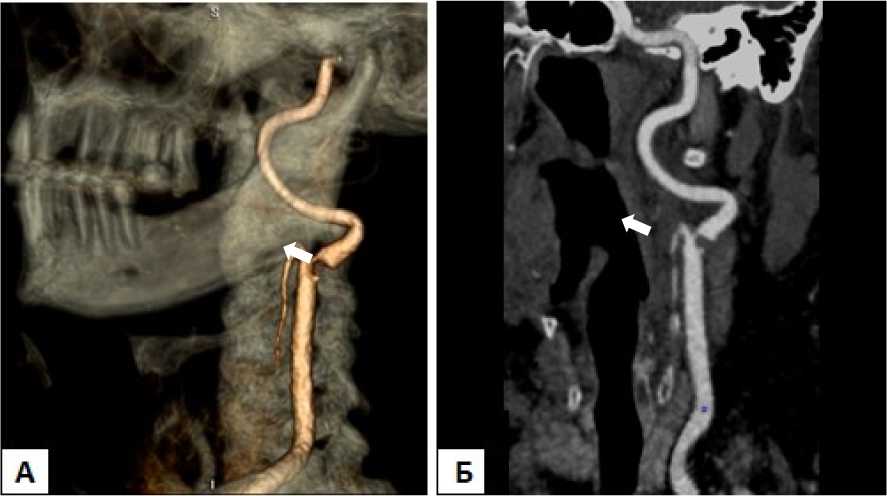
Рисунок 1. КТ-ангиограммы брахиоцефальных артерий: А - трехмерное изображение левой ВСА, Б - косая мультипланарная реконструкция. На уровне устья левой ВСА визуализирована атеросклеротическая бляшка (стрелка), сужающая просвет на 90 %
Figure 1. CT-angiograms of brachiocephalic arteries: A - three-dimensional image of the left ICA, Б - oblique multiplanar reconstruction.
An atherosclerotic plaque (arrow) narrowing the lumen by 90% was visualized at the level of the left ICA aperture (arrow)
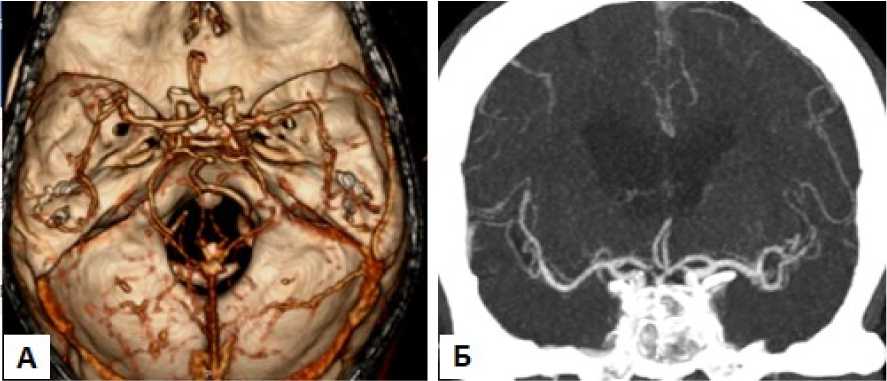
Рисунок 2. КТ-ангиограммы интракраниальных артерий: А - трёхмерное изображение, Б - проекции максимальной интенсивности. Данных за стенозы церебральных артерий не получено
Figure 2. CT-angiograms of intracranial arteries: A - three-dimensional image, Б - maximum intensity projections. No data for stenoses of cerebral arteries were obtained
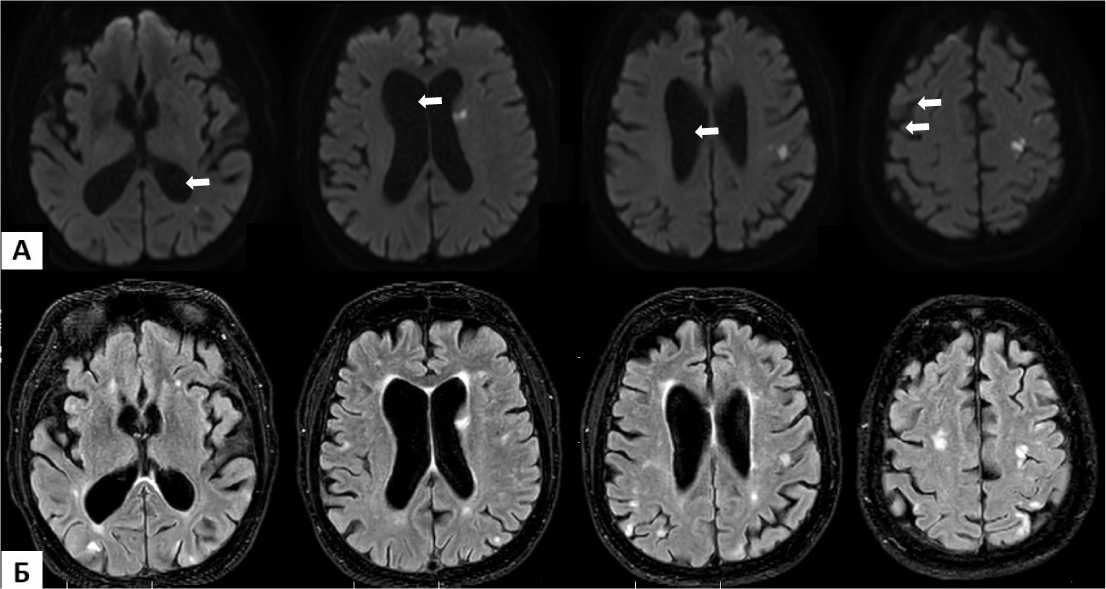
Рисунок 3. Аксиальные MP-томограммы головного мозга в режиме диффузионно-взвешенных изображений (серия А) и Fluid attenuation inversion recovery (FLAIR) (серия Б). Многочисленные очаги острой ишемии в бассейне левой средней мозговой артерии (указаны стрелками) (А). Очаги преимущественно в белом веществе мозга, соответствующие очагам острой церебральной ишемии и микроангиопатии (Б) Figure 3. Axial MR tomograms of the brain in diffusion-weighted imaging mode (series A) and Fluid attenuation inversion recovery (FLAIR) (series B). Multiple foci of acute ischemia in the left middle cerebral artery basin (indicated by arrows) (A). Foci predominantly in the white matter of the brain corresponding to foci of acute cerebral ischemia and microangiopathy (Б)
Обсуждение
Вопрос отбора пациентов, для которых польза ЛИГ превосходила бы риски, связанные с прессорной терапией, остается дискутабельным. Современные клинические рекомендации допускают применение ЛИГ у отдельных пациентов с флюктуирующими симптомами и низким систолическим АД [23]. Ограничение показаний к ЛИГ наличием НУ может, в большей степени, оправдывать риски данной тактики (в связи с возрастающей при НУ вероятностью худшего исхода и летальностью), но, с другой стороны, такой подход может оставить в стороне пациентов, для которых ЛИГ была бы средством не только профилактики потенциального НУ, но и инструментом для улучшения исходного неврологического статуса, как это было показано в клиническом наблюдении Hillis А.Е. и соавт. (2001) [24].
Наличие окклюзии или стеноза более 70 % ипсилатеральной артерии снижают церебральную перфузию. Данные факторы известны как предикторы раннего НУ у пациентов с ИИ [25, 26]. В представленном клиническом наблюдении у пациентки была выявлена субокклюзия инсульт-связанной артерии.
Исходные значения АД, позволяющие инициировать ЛИГ, также не регламентированы. Артериальная гипотензия ассоциирована с риском НУ, однако нормотензии может быть недостаточно для поддержания эффективного церебрального коллатерального кровотока. Так, в наблюдении Oliveira-Filho J. и соавт. (2002) указано, что НУ произошло после снижения АД до значений нормотензии [27]. В ряде контролируемых исследований, показавших безопасность и потенциальную пользу ЛИГ, среднее исходное систолическое АД соответствовало высокому нормальному и, даже, артериальной гипертензии первой-второй степени [18, 20, 28].
В нашем наблюдении исходно тяжёлый неврологический дефицит у пациентки с ИИ был сопряжён с артериальной гипертензией, обеспечивший, по всей видимости, церебральный коллатеральный кровоток, достаточный для компенсации перфузии в бассейне инсульт-связанной ВСА, и последующий значительный регресс неврологического дефицита. Дальнейшее снижения АД обусловлено, вероятно, тем же механизмом, что и снижение АД при успешной реканализации окклюзированной артерии после внутрисосудистой тромбоэмболэктомии [12]. Прогрессирующее снижение АД достигло значений, недостаточных для эффективного церебрального коллатерального кровотока у данной пациентки, и произошло НУ.
Наиболее часто используемыми средствами для ЛИГ в клинических исследованиях были фенилэфрин - селективный агонист α1-адренорецепторов и норэпинефрин -агонист αиβ1-адренорецепторов. В контексте ЛИГ при ИИ ни один из адреномиметиков не обладает подтверждён- ными преимуществами [22]. Лекарственно-индуцированная гипертензия была оценена как достижимая и безопасная в небольших работах с применением каждого из указанных адреномиметиков [29-31]. Исследователи, применявшие фенилэфрин, объясняли свой выбор его селективным действием на α1-адренорецепторы, низкой распространённостью данных рецепторов в сосудах головного мозга и предполагали таким выбором избежать вазоконстрикции церебрального коллатерального русла [18, 31]. Однако несколько исследований на животных с моделью черепно-мозговой травмы показали, что введение фели-эфрина приводит к констрикции пиальных артерий [32]. Необходимо помнить и о коморбидной сердечно-сосудистой патологии при выборе агента для ЛИГ, об оценке актуальности инотропного и хронотропного эффектов агента у каждого конкретного пациента. В исследовании, сравнившем влияние норэпинефрина, фенилэфрина и дофамина на широкий спектр показателей гемодинамики у пациентов с черепно-мозговой травмой, авторы рекомендовали норэпинефрин как препарат выбора для прессорной поддержки из-за более сбалансированного гемодинамического эффекта и наличия выраженного венотонического действия, повышающего преднагрузку [33].
Для ЛИГ в нашем наблюдении мы использовали норадреналин. Применение данного агента позволило достичь и поддерживать целевые значения АД в течение первых 24 часов терапии, однако в дальнейшем обеспечение заданного интервала АД требовало повышения дозы норадреналина, что сопровождалось увеличением ЧСС. В связи с развитием пароксизма фибрилляции предсердий, а также учитывая значительный регресс неврологического дефицита, проведение ЛИГ было решено прекратить. Последовавшее снижение АД не привело к НУ.
Единичные случаи нарушения ритма сердца, сопровождавшие ЛИГ, были описаны в исследованиях с применением как фенилэфрина (пароксизм фибрилляции предсердии у одного из 30-ти пациентов с ЛИГ в исследовании RordorfG. и соавт., 1997), так и норадреналина (пароксизм желудочковой тахикардии у одного из 34-х пациентов с ЛИГ в работе Marzan AS и соавт., 2004) [31,34].
При выборе целевых значения АД мы руководствовались результатами рандомизированного исследования ЛИГ у пациентов с ИИ Nasi L.A. и соавт. (2019), в котором авторы изучали эффективность и безопасность поддержания систолического АД в различных интервалах от 140 до 200 мм рт. ст. Данная работа показала больший шанс хорошего функционального исхода у пациентов с систолическим АД в интервале 161-180 мм рт. ст. Более высокие значения АД были сопряжены с большим числом осложнений [20].
Вывод
Лекарственно-индуцированная гипертензия представляет большой интерес в качестве компонента базисной терапии при ишемическом инсульте. Разрозненность данных и немногочисленность исследований не позволяют в настоящее время сформировать оптимальный протокол лекарственно-индуцированной артериальной гипертензии. Руководствуясь результатами экспериментальных клинических исследований с успешным применением лекарственно-индуцированной артериальной гипертензии, мы использовали данный метод в лечении пациентки с ишемическим инсультом и фактором риска неврологического ухудшения - субокклюзией внутренней сонной артерии. Нам удалось добиться улучшения в неврологическом статусе после прогрессирования инсульта и, завершив лечение, выписать пациентку с высокой степенью независимости в повседневной жизни.
Список литературы Лекарственно индуцированная артериальная гипертензия у пациента с ишемическим инсультом
- Kwon HM, Lee YS, Bae HJ, Kang DW. Homocysteine as a predictor of early neurological deterioration in acute ischemic stroke. Stroke. 2014;45(3):871 -873. PMID: 24448992 https://doi.org/10.1161/STROKEAHA.113.004099
- Horton M, Modi J, Patel SK, Demchuk AM, Goyal M, Hill MD, et al. Refinement of Imaging Predictors of Recurrent Events following Transient Ischemic Attack and Minor Stroke. PLoS One. 2013;8(6):e65752. PMID: 23805187 https://doi.org/10.1371/journal.pone.0065752
- Shkirkova K, Saver JL, Starkman S, Wong G, Weng J, Hamilton S, et al. Frequency, Predictors, and Outcomes of Prehospital and Early Postarrival Neurological Deterioration in Acute Stroke: Exploratory Analysis of the FAST-MAG Randomized Clinical Trial. JAMA Neurol. 2018;75(11): 1364-1374. PMID: 30039165 https://doi.org/10.1001/jamaneurol.2018.1893
- Siegler JE, Samai A, Semmes E, Martin-Schild S. Early Neurologic Deterioration after Stroke Depends on Vascular Territory and Stroke Etiology. J Stroke. 2016;18(2):203-210. PMID: 27283280 https://doi.org/10.5853/jos.2016.00073
- Saber H, Liebeskind DS. Infarct Progression in the Early and Late Phases of Acute Ischemic Stroke. Neurology. 2021 ;97(20 Suppl 2):S60-S67. PMID: 34785605 https://doi.org/10.1212/WNL.0000000000012795
- Jung S, Gilgen M, Slotboom J, El-Koussy M, Zubler C, Kiefer С, et al. Factors that determine penumbral tissue loss in acute ischaemic stroke. Brain. 2013;136(Pt 12):3554-3560. PMID: 24065722 https://doi.org/10.1093/brain/awt246
- van Seeters T, Biessels GJ, Kappelle LJ, van der Graaf Y, Velthuis BK; Dutch acute stroke study (DUST) investigators. Determinants of lep-tomeningeal collateral flow in stroke patients with a middle cerebral artery occlusion. Neuroradiology. 2016;58(10):969-977. PMID: 27438804
- Lin MP, Brott TG, Liebeskind DS, Meschia JF, Sam K, Gottesman RF. Collateral Recruitment Is Impaired by Cerebral Small Vessel Disease. Stroke. 2020;51(5):1404-1410. PMID: 32248770 https://doi.org/10.1161/STROKEAHA.119.027661
- Xu M, Guo W, Rascle L, Mechtouff L, Nighoghossian N, Eker 0, et al. Leukoaraiosis Distribution and Cerebral Collaterals: A Systematic Review and Meta-Analysis. Front Neurol. 2022;13:869329. PMID: 35812112 https://doi.org/10.3389/fneur.2022.869329
- Zhang M, Xing P, Tang J, Shi L, Yang P, Zhang Y, et al. Predictors and outcome of early neurological deterioration after endovascular thrombectomy: a secondary analysis of the DIRECT-MT trial. J Neurointerv Surg. 2022;neurintsurg-2022-018976. PMID: 35688618 https://d0i.0rg/l 0.1136/neurintsurg-2022-018976
- Jiang B, Churilov L, Kanesan L, Dowling R, Mitchell P, Dong Q, et al. Blood Pressure May Be Associated with Arterial Collateralization in Anterior Circulation Ischemic Stroke before Acute Reperfusion Therapy. J Stroke. 2017;19(2):222-228. PMID: 28460496 https://d0i.0rg/l 0.5853/jos.2016.01739
- Carvalho Dias M, Gabriel D, Saraiva M, Campos D, Requena M, García-Tornel Á, et al. Spontaneous systolic blood pressure drop early after mechanical thrombectomy predicts dramatic neurological recovery in ischaemic stroke patients. Eur Stroke J. 2020;5(4):362-369. PMID: 33598554 https://d0i.0rg/l 0.1177/2396987320933384
- J0rgensen HS, Nakayama H, Raaschou HO, Olsen TS. Effect of blood pressure and diabetes on stroke in progression. Lancet. 1994;344(8916): 156-159. PMID: 7912765 https://d0i.0rg/l 0.1016/s0140-6736(94)92757-x
- Vemmos KN, Tsivgoulis G, Spengos K, Zakopoulos N, Synetos A, Manios E, et al. U-shaped relationship between mortality and admission blood pressure in patients with acute stroke. J Intern Med. 2004;255(2):257-265. PMID: 14746563 https://d0i.0rg/l 0.1046/j.1365-2796.2003.01291.x
- J0rgensen HS, Nakayama H, Raaschou HO, Olsen TS. Progredierende apopleksi. Incidens, risikofaktorer og prognose—the Copenhagen Stroke Study [Progressive apoplexy. Incidence, risk factors and prognosis—the Copenhagen Stroke Study]. Ugeskr Laeger. 1995;157(25):3619-3622. (In Danish) PMID: 7652981
- Hillis AE, Ulatowski JA, Barker PB, Torbey M, Ziai W, Beauchamp NJ, et al. A pilot randomized trial of induced blood pressure elevation: effects on function and focal perfusion in acute and subacute stroke. Cerebrovasc Dis. 2003;16(3):236-246. PMID: 12865611 https://d0i.0rg/l 0.1159/000071122
- Chalela JA, Dunn B, Todd JW, Warach S. Induced hypertension improves cerebral blood flow in acute ischemic stroke. Neurology. 2005;64(11): 1979. PMID: 15955961 https://doi.org/10.1212/01.WNL.0000156360.70336.18
- Bang OY, Chung JW, Kim SK, Kim SJ, Lee MJ, Hwang J, et al. Therapeutic-induced hypertension in patients with noncardioembolic acute stroke. Neurology. 2019;93(21):e1955-e1963. PMID: 31645472 https://doi.org/10.1212/WNL.0000000000008520
- Deng C, Campbell D, Diprose W, Eom C, Wang K, Robertson N, et al. A pilot randomised controlled trial of the management of systolic blood pressure during endovascular thrombectomy for acute ischaemic stroke. Anaesthesia. 2020;75(6):739-746. PMID: 31833064 https://doi.Org/10.1111/anae.14940
- Nasi LA, Martins SCO, Gus M, Weiss G, de Almeida AG, Brondani R, et al. Early Manipulation of Arterial Blood Pressure in Acute Ischemic Stroke (MAPAS): Results of a Randomized Controlled Trial. Neurocrit Care. 2019;30(2):372-379. PMID: 30460598
- Hillis AE, Wityk RJ, Beauchamp NJ, Ulatowski JA, Jacobs MA, Barker PB. Perfusion-weighted MRI as a marker of response to treatment in acute and subacute stroke. Neuroradiol. 2004;46(1):31-39. PMID: 14673553 https://doi.org/10.1007/s00234-002-0918-4
- Str0msnes TA, Kaugerud Hagen TJ, Ouyang M, Wang X, Chen C, Rygg SE, et al. Pressor therapy in acute ischaemic stroke: an updated systematic review. Eur Stroke J. 2022;7(2):99-116. PMID: 35647316 https://doi.Org/10.1177/23969873221078136
- Алекян Б.Г., Апашеев A.M., Белкин А.А., Богатырева М.Д., Бойцов С.А., Боцина А.Ю., и др. Ишемический инсульт и транзиторная ишемическая атака у взрослых. Клинические рекомендации. 2022. URL: https://evidence-neurology.ru/content/downloadfiles/13/kr-po-ii-i-tia_2022_finalnii-v_ru_1650370148.pdf [Alekyan B.G., Alasheev A.M., Belkin A.A., Bogatyreva M.D., Boitsov S.A., Botsina A.Yu., etc. Ischemic stroke and transient ischemic attack in adults. Clinical recommendations. 2022. URL: https://evidence-neurology.ru/content/down-loadfiles/13/kr-po-ii-i-tia_2022_finalnii-v_ru_1650370148.pdf (In Russ)]
- Hillis AE, Barker PB, Beauchamp NJ, Winters BD, Mirski M, Wityk RJ. Restoring blood pressure reperfused Wernicke's area and improved language. Neurology. 2001 ;56(5):670-672. PMID: 11245724 https://doi.Org/10.1212/wnl.56.5.670
- Ois A, Martinez-Rodriguez JE, Munteis E, Gomis M, Rodríguez-Campello A, Jimenez-Conde J, et al. Steno-occlusive arterial disease and early neurological deterioration in acute ischemic stroke. Cerebrovasc Dis. 2008;25(1-2):151-156. PMID: 18212520 https://d0i.0rg/l 0.1159/000113732
- Erdur H, Scheitz JF, Ebinger M, Rocco A, Grittner U, Meisel A, et al. In-hospital stroke recurrence and stroke after transient ischemic attack: frequency and risk factors. Stroke. 2015;46(4):1031 -1037. PMID: 25737318 https://doi.Org/10.1161/STROKEAHA.114.006886
- Oliveira-Filho J, Pedreira BB, Jesus PA, Souza PE, Bacellar AS. Hipertensao induzida farmacológicamente em paciente com isquemia em territorio vértebro-basilar associada com estenose vertebral bilateral [Pharmacologically-induced hypertension in a patient with vertebrobasilar territory ischemia associated with bilateral vertebral stenosis]. Arq Neuropsiquiatr. 2002;60(2-B):498-501. (In Portuguese) PMID: 12131959
- Lee MH, Kim JG, Jeon SB, Kang DW, Kwon SU, Kim JS. Pharmacologically Induced Hypertension Therapy for Acute Stroke Patients. J Stroke. 2019;21 (2):228-230. PMID: 31161767 https://doi.org/10.5853/jos.2019.00437
- Koenig MA, Geocadin RG, de Grouchy M, Glasgow J, Vimal S, Restrepo L, et al. Wityk RJ. Safety of induced hypertension therapy in patients with acute ischemic stroke. Neurocrit Care. 2006;4(1):3-7. PMID: 16498187 https://doi.Org/10.1385/NCC:4:1:003
- Schwarz S, Georgiadis D, Aschoff A, Schwab S. Effects of induced hypertension on intracranial pressure and flow velocities of the middle cerebral arteries in patients with large hemispheric stroke. Stroke. 2002;33(4):998-1004. PMID: 11935051 https://d0i.0rg/l 0.1161/01 .str.0000014584.17714.2e
- Rordorf G, Cramer SC, Efird JT, Schwamm LH, Buonanno F, Koroshetz WJ. Pharmacological elevation of blood pressure in acute stroke. Clinical effects and safety. Stroke. 1997;28(11):2133-2138. PMID: 9368553 https://doi.org/10.1161/01.str.28.11.2133
- Froese L, Dian J, Gomez A, Unger B, Zeiler FA. Cerebrovascular Response to Phenylephrine in Traumatic Brain Injury: A Scoping Systematic Review of the Human and Animal Literature. Neurotrauma Rep. 2020;1 (1):46-62. PMID: 34223530 https://doi.org/10.1089/neur.2020.0008
- Сычев A.A., Потапов A.A., Бирг T.M., Полупан А.А., Ошоров А.В., Баранич А.И., и др. Анализ инотропной и вазопрессорной терапии у пациентов в остром периоде тяжелой черепно-мозговой травмы. Анестезиология и реаниматология. 2022;3:63-67. https://doi.org/10.17116/anaesthesiology202203163 [SychevA.A., Potapov А.А., Birg Т.М., Polupan A.A., OshorovA.V., Paranich A.I., etc. Analysis of inotropic and vasopressor therapy in patients in the acute period of severe traumatic brain injury. Anesthesiology and resuscitation. 2022;3:63 67. https://doi.org/10.17116/anaesthesiology202203163 (In Russ)]
- Marzan AS, Hungerbühler HJ, Studer A, Baumgartner RW, Georgiadis D. Feasibility and safety of norepinephrine-induced arterial hypertension in acute ischemic stroke. Neurology. 2004;62(7):1193-1195. PMID: 15079024 https://doi.org/10.1212/01.wnl.0000118303.45735.04


