Лимфатические осложнения после выделения венозных кондуитов при операциях аортокоронарного шунтирования
Автор: Манвелян Д.В., Вечерский Ю.Ю., Затолокин В.В., Кузнецов М.С., Козлов Б.Н.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Обзоры и лекции
Статья в выпуске: 3 т.36, 2021 года.
Бесплатный доступ
Осложнения, связанные с нарушениями лимфатического оттока нижних конечностей, постоянно встречаются в сердечно-сосудистой хирургии, когда речь идет о выделении венозных кондуитов и вмешательствах на бедренных сосудах. Несмотря на относительно низкую частоту, их лечение требует значительных усилий и не всегда приносит ожидаемых плодов, а своевременная диагностика нарушений лимфатического оттока зачастую затруднена. Это становится причиной повторных госпитализаций, хирургических вмешательств, длительного пребывания в стационаре и утраты трудоспособности. Однако проблеме лимфатических осложнений по-прежнему не уделяется достаточно внимания. В данной статье освещаются патогенез, предикторы лимфатических осложнений, а также варианты и подходы к их лечению и диагностике.
Коронарное шунтирование, лимфатические осложнения, лимфосцинтиграфия, лимфовенозный анастомоз
Короткий адрес: https://sciup.org/149139350
IDR: 149139350 | УДК: 616.132.2-089.86:616.14-77-06:616.42 | DOI: 10.29001/2073-8552-2021-36-3-27-34
Текст обзорной статьи Лимфатические осложнения после выделения венозных кондуитов при операциях аортокоронарного шунтирования
Осложнения, связанные c нарушениями лимфатического оттока, имеют большое значение в хирургической практике и сопряжены с травматизацией лимфатических коллекторов и узлов [1]. Прежде всего данная проблема встречается в онкологии ввиду частой необходимости лимфодиссекции пакета регионарных лимфатических узлов при оперативных вмешательствах [2] либо их поражении опухолевым процессом [3]. Операциями риска лимфатических осложнений являются онкогинекологические и онкоурологические операции, что обусловлено вмешательством в «критических областях» (паховая область и подмышечная впадина) ввиду непосредственной близости манипуляций с регионарными лимфатическими узлами [4].
Особую значимость нарушения лимфатического оттока имеют в сосудистой хирургии, когда речь идет о вмешательствах на сосудах нижних конечностей [5, 6]. При операциях по поводу варикозной болезни вен нижних конечностей в 2,2% случаев в послеоперационном периоде наблюдаются осложнения лимфатической природы. Высокий риск отмечается у возрастных пациентов, пациентов с ожирением, а также при повторных кроссэктомиях в связи с рецидивом варикозной болезни, то есть при вмешательствах в паховой области. Усовершенствование хирургической техники и подхода, а также стремление к минимально инвазивным методам коррекции позволили сократить частоту подобных осложнений [5]. Стоит подчеркнуть, что любые вмешательства на бедренных сосудах паховой области (реконструктивные операции, подключение гемодиализа, периферической экстракорпоральной мембранной оксигенации – ЭКМО и др.) потенциально могут приводить к лимфатическим осложнениям [6].
В кардиохирургии также неизбежно приходится сталкиваться с лимфатическими осложнениями при выделении большой подкожной вены при операциях аортокоронарного шунтирования. Частота лимфатических осложнений при традиционном выделении большой подкожной вены может колебаться от 14 [7] до 50,6% [8]. Минимально инвазивные методы выделения способствовали значимому сокращению осложнений лимфатической природы [7, 9].
Клиническими проявлениями лимфатических осложнений являются лимфорея, лимфоцеле, ранний лимфатический отек и лимфедема. Лимфореи представляют собой истечение наружу прозрачной жидкости, богатой белком (лимфы). Лимфореи могут иметь стойкий характер и приводить к формированию лимфатического свища. Сохраняющийся лимфатический свищ является причиной трофических нарушений с формированием язв, рефрактерных к консервативной терапии [10]. Лимфоце-ле – это кистозное скопление лимфатической жидкости из поврежденного лимфатического канала, образующее карман в мягких тканях раны с формированием капсулы. Продолжающееся накопление жидкости вызывает деструкцию тканей и лимфорею [11, 12].
Повреждение лимфатических коллекторов и нарушение капиллярной фильтрации после искусственного кровообращения являются причинами развития раннего лимфатического отека [13]. Нарушение микроциркуляции и накопление жидкости в интерстициальном пространстве приводят к нарушению оксигенации тканей, что значительно ухудшает заживление ран. Ранний лимфатический отек, как правило, разрешается в течение 4–6 нед. [14].
В последующем стойкая дисфункция лимфатической системы приводит к развитию вторичной, ятрогенной лимфедемы [15]. В процессе развития лимфедемы происходит накопление в межклеточных пространствах крупнодисперсных, осмотически высокоактивных белков, продуктов белкового метаболизма и жидкости. Накопление белка в межклеточных пространствах вызывает разрастание соединительной ткани, это усиливает динамическую недостаточность лимфатической системы. В тканях усиливается гипоксия, нарастают лимфостаз, лимфэктазия, клеточная инфильтрация [16]. Подобные изменения приводят к нарушению местного иммунного ответа, возникают предпосылки для рецидивирующих кожных инфекций, главным образом, рожистого воспаления [15]. Создается порочный круг – каждый последующий рецидив рожистого воспаления сопровождается лимфангиитом с развитием фиброза тканей и прогрессированием лимфостаза, а лимфостаз, в свою очередь, повышает риск последующего рецидива. Лимфедема имеет непрерывно рецидивирующее течение, приводит к резко выраженному фиброзу кожи, подкожной клетчатки и фасции [16]. Прогрессирование трофических нарушений, в конечном итоге становится причиной стойкой утраты трудоспособности [15].
Лечение лимфатических осложнений в послеоперационном периоде является очень трудоемким процессом, требующим длительных повторных госпитализаций, вы- соких затрат на дополнительное консервативное лечение и возможные хирургические вмешательства, что заметно ухудшает качество жизни пациентов [4]. Это связано с тем, что они зачастую могут носить длительно персистирующий характер [10, 17], как правило, клинически проявляются после выписки из стационара [12], приводят к выраженным трофическим нарушениям и повышают риск вторичного инфицирования [6, 15]. Поэтому осложнения вследствие нарушения лимфатического оттока требуют своевременной диагностики и максимально раннего начала коррекции.
Различают консервативные и хирургические методы лечения. К консервативным методам относятся эластическое бинтование конечностей или ношение компрессионного трикотажа I–II класса, назначение лекарственных препаратов, действие которых направлено на повышение тонуса венозной стенки, стимуляцию лимфодренажа из тканей, борьбу с отеком, улучшение микроциркуляции [16, 18]. Консервативное лечение при несвоевременном лечении имеет весьма ограниченную эффективность и не может быть применено при отдельных формах нарушений [6].
Одним из вариантов борьбы с лимфоцеле является пункционная аспирация жидкости с последующим эластическим бинтованием, однако при этом после выписки возникает рецидив осложнения. Более радикальной процедурой является активное дренирование полости под контролем ультразвукового исследования, эффективное дренирование способствует ликвидации и спаданию полости. После прекращения оттока жидкости дренаж удаляется. Процесс дренирования достаточно долгий и может длиться несколько недель для опорожнения лим-фоцеле большого объема. В течение этого времени пациент должен проходить профилактическую антибактериальную терапию для предотвращения инфекции [12]. В процессе дренирования допустима инстилляция доксициклина в качестве местного склерозирующего средства с целью сокращения сроков заживления [4, 12, 19].
При трофических язвах на фоне длительно существующего лимфатического свища или лимфоцеле больших объемов проводится верификация и лигирование поврежденного лимфатического коллектора с хирургической обработкой и пластикой дефекта кожно-фасциальным или мышечно-кожным лоскутом на сосудистой ножке [10]. Оперативное лечение при формировании распространенных трофических язв осуществляется в два этапа с временным разделением этапов лигирования и пластики дефекта. Подобное разделение необходимо для того, чтобы в межэтапный период произошло уменьшение размеров и выраженности инфильтрации язвенного дефекта [20].
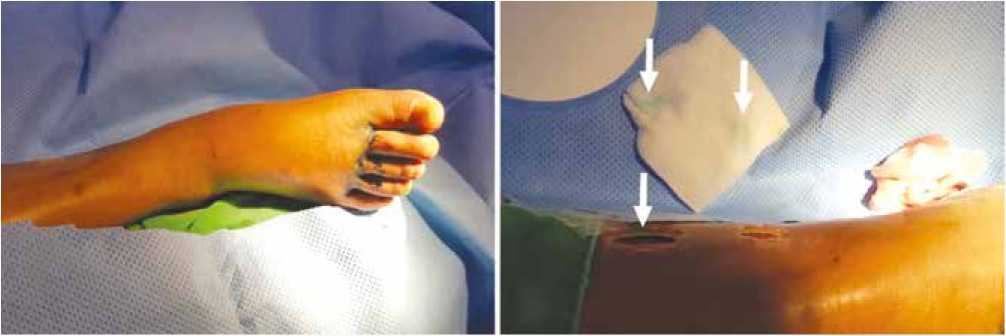
Для выявления поврежденных лимфатических сосудов непосредственно перед основным этапом проводится инъекции лимфотропных красителей (метиленовый синий, индоциановый зеленый, изосульфановый синий), которые по поврежденным лимфатическим сосудам через некоторое время появляются в ране (рис. 1) [10, 20]. В качестве альтернативы лигирования поврежденного лимфатического сосуда некоторые авторы проводят его эмболизацию под контролем педальной лимфографии, однако данный метод технически достаточно сложен [20].
А
B
Рис. 1. Визуализация поврежденного лимфатического коллектора [20]. А. Вид стопы после внутрикожных инъекций метиленого синего в межпальцевые промежутки. В. Появление метиленового синего на дне раны через поврежденный лимфатический коллектор
Fig. 1. Visualization of the damaged lymphatic collector [20]. A. View of the foot after intradermal injections of methylene blue into the interdigital spaces. B.
The appearance of methylene blue at the bottom of the wound through the damaged lymphatic collector
Лигирование поврежденных лимфатических сосудов должно осуществляться только после тщательного анатомо-функционального исследования (при наличии альтернативных путей оттока) и должно быть строго селективным [19]. Неселективное лигирование может приводить к вторичной лимфедеме или даже вторичной лим-форее из-за высокого давления в лигированном сосуде. Поэтому при отсутствии альтернативных путей оттока следует отказаться от этой процедуры и отдать предпочтение формированию лимфовенозного анастомоза, в ходе которого создается соустье между поврежденным лимфатическим сосудом ниже места повреждения и сопровождающей веной [4, 19].
Наложение лимфовенозного анастомоза способствует сохранению лимфодренажной функции с прямым дренажом лимфы в венозное русло, практически исключается вероятность развития вторичной лимфедемы (рис. 2) [4], однако при этом требуется наличие микрохирургической установки, которой оснащены далеко не все центры [19].
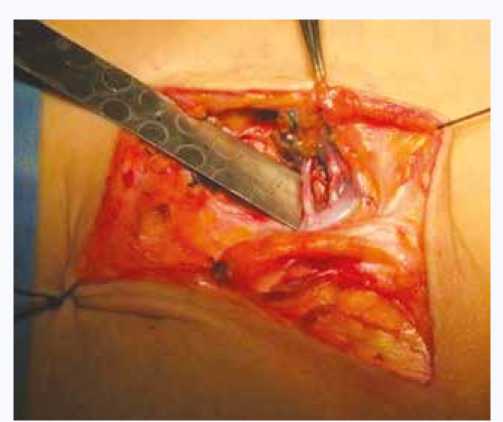
Рис. 2. Внешний вид сформированного лимфовенозного анастомоза [4]
Fig. 2. The appearance of the formed lymphovenous anastomosis [4]
При устойчивых лимфореях с формированием лимфатического свища описан положительный опыт применения терапии отрицательным давлением (аппаратная вакуум-терапия), в основе которой лежит создание замкнутой системы с постоянным отрицательным давлением [6, 21]. Предполагается, что положительные эффекты вакуум-терапии обусловлены улучшением микроциркуляции под воздействием отрицательного давления, удалением из раны факторов, ингибирующих раневое заживление, таких как металлопротеазы [11]. Благодаря этому происходит уменьшение раневого отделяемого с очищением раны и формированием грануляционной ткани [6].
Широкая распространенность нарушений лимфатического оттока при выделении большой подкожной вены обусловлена тесной анатомо-функциональной взаимосвязью лимфатической и венозной систем. Они являются звеньями единой дренажной системы, и нарушение фильтрационно-резорбционного равновесия из-за высокого давления или застоя в венозном русле всегда компенсируется усилением лимфатического оттока [1, 22].
Лимфатическая сосудистая система начинается со слепо кончающихся лимфатических капилляров, которые транспортируют лимфатическую жидкость через преколлекторы, коллекторы, цистерну хили и грудной проток в кровеносную систему [15]. Лимфатическая система нижних конечностей состоит из широко разветвленных коллекторов, объединяющихся в отводящие лимфатические сосуды. Различают глубокие, поверхностные и перфорантные лимфатические сосуды, сопровождающие вены нижних конечностей и формирующие периваскулярные сети вокруг них. Эпифасциальные лимфатические сосуды объединяются в вентромедиальный и дорсолатеральный пучки, сопровождающие подкожные вены нижних конечностей. Дорсолатеральный лимфатический пучок дренируется в лимфатические узлы подколенной области, а вентромедиальный – в паховые лимфатические узы [23–25].
Расположение лимфатических коллекторов зависит от выраженности подкожной клетчатки, а также от анатомической области [15, 24]. При малой толщине подкожной клетчатки лимфатические коллекторы расположены в непосредственной близости к коже [24]. Наибольшая ширина вентромедиального лимфатического пучка наблюдается в области голени и колена, где лимфатические коллекторы распределены по всей толще подкожно-жировой клетчатки, а наименьшая – на бедре и в паховой области, где лимфатические коллекторы в виде узкого пучка (в среднем 3 мм) сопровождают большую подкожную вену [15]. Исходя из особенностей расположения лимфатических коллекторов на нижней конечности, следует, что высокий риск повреждения лимфатических коллекторов наблюдается у худощавых пациентов, а также при выделении венозных кондуитов на бедре.
Тесная анатомо-функциональная взаимосвязь лимфатического и венозного оттока от нижних конечностей является причиной неизбежного повреждения лимфатических коллекторов при выделении большой подкожной вены с развитием нарушений лимфатического оттока [24]. В связи с этим своевременная диагностика состояния лимфатического оттока имеет первостепенное значение.
Выделяют общеклинические (антропометрические и волюмометрические методы) и специальные (рентгеноконтрастные лимфо- и флебография, исследование биоп-татов лимфатических узлов и сосудов, ультразвуковое исследование, компьютерная и магнитно-резонансная томография) методы оценки состояния лимфатической системы нижних конечностей. Несмотря на разнообразие специальных методов диагностики, многие из них имеют низкую доказательность (неэффективны при отдельных формах и стадиях патологии лимфатического оттока), высокую инвазивность и риск осложнений (особенно после применения масляных рентгеноконтрастных препаратов) и, как правило, не дают представлений о функциональном состоянии лимфатической системы нижних конечностей [16, 26]. По этой причине широкое распространение в клинической практике получила радионуклидная лимфосцинтиграфия [24, 26].
Различают статическую и динамическую лимфосцинтиграфию. Наибольшее применение имеет динамическая лимфосцинтиграфия, поскольку она позволяет провести количественную оценку функционального состояния лимфатической системы, тогда как статическая лимфосцинтиграфия направлена на оценку морфологического состояния [25].
Метод позволяет в полной мере оценить функциональное состояние лимфатической системы, характеризуется высокой чувствительностью и специфичностью, а также низкой лучевой нагрузкой [24, 26]. В основе исследования лежит транспорт радиофармпрепарата по лимфатическим коллекторам с записью сцинтиграмм на гамма-камере и последующей обработкой с помощью прикладного пакета программ. В качестве радиофармпрепарата, как правило, применяется коллоидный фитатный раствор 99mTc с размерами коллоидных частиц 10–100 нм [1, 24, 27]. Размер коллоидных частиц имеет принципиальное значение, поскольку частицы размером менее 10 нм проникают в кровеносные капилляры [25]. Радиофармпрепарат в объеме 0,1–0,3 мл внутрикожно вводят в первый межпальцевой промежуток для визуализации поверхностной лимфатической системы. Исследование проводится в 2 этапа. На первом этапе (в покое) оценивается резорбтивная способность, скорость лимфатического оттока, на втором этапе (после физической нагрузки) – лимфодинамика [24].
Несмотря на высокую чувствительность и специфичность, радионуклидная лимфосцинтиграфия не нашла широкого применения в сердечно-сосудистой хирургии для своевременной диагностики и лечения нарушений лимфатического оттока, а на практике рутинно используется в онкологии и при органической патологии лимфатической системы. Известно ограниченное количество публикаций по оценке лимфатического оттока нижних конечностей после забора венозных кондуитов для аортокоронарного шунтирования, результаты которых свидетельствуют о высокой прогностической ценности метода.
По данным О.В. Лавренюка и соавт., лимфосцинтиграфия нижних конечностей позволяет оценить влияние метода выделения венозных кондуитов на развитие раневых осложнений лимфатической природы в раннем послеоперационном периоде. Авторами исследования проводилась лимфосцинтиграфия нижних конечностей до операции и на седьмые сутки после операции. Ранний лимфатический отек выявлялся антропометрическим исследованием путем измерения окружности нижних конечностей в контрольных точках, разница в 1 см и более считалась критерием отека. Наличие и степень нарушений лимфатического оттока определялись по отчетливости визуализации паховых лимфатических узлов на втором этапе обследования. Эндоскопический метод, несмотря на преимущественное выделение венозных кондуитов с области бедра, не приводил к развитию сцинтиграфических признаков нарушения лимфодре-нажа, тогда как открытое выделение значительно чаще приводило к выраженным и умеренным нарушениям, которые сопровождались клиническими проявлениями [1]. На основании результатов было сделано предположение, что оценка исходного состояния лимфатической системы до операции позволит избрать необходимую хирургическую тактику с целью улучшения непосредственных результатов аортокоронарного шунтирования и снижения риска возникновения нарушений лимфатического дренажа.
В другом, несколько схожем, исследовании эндоскопическое выделение способствовало сокращению частоты нарушений лимфатического оттока в раннем послеоперационном периоде по сравнению с традиционным методом выделения, но без статистической значимости (62,5% – в группе открытого выделения и 42,86% – в группе эндоскопического выделения, р = 0,250). Все случаи нарушения лимфатического оттока при эндоскопическом выделении были связаны с появлением депо накопления в области колена (в месте хирургического доступа), рисунок 3 [27].
При открытом выделении структурными нарушениями лимфатического оттока стали конверсия магистрального типа движения радиофармпрепарата в диффузный, появление рефлюкса в глубокие коллекторы или депо накопления на уровне голени и наличие прерывания на уровне колена (рис. 4) [27].
C.E. Belczak и соавт. [14] исследовали развитие лимфедемы у пациентов через 3 мес. после аортокоронарного шунтирования. Венозные кондуиты у данной когорты пациентов выделялись по методу «кожных мостиков» для уменьшения травматичности. В ходе работы проводилась волюметрическая оценка наличия отека, параллельно проводилась лимфосцинтиграфия нижних конечностей.
А
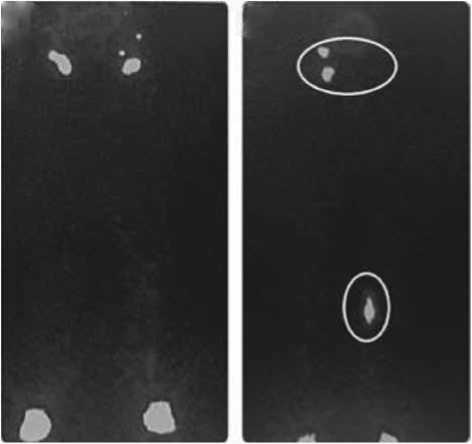
Рис. 3. Лимфосцинтиграфия в динамике у пациента после эндоскопического выделения большой подкожной вены (вид спереди) [27]. А. Отсутствие нарушений лимфатического оттока до операции. В. Лимфосцинтиграфия после операции. Появление уровня перерыва и депо накопления на уровне колена после эндоскопического выделения вены. Паховые лимфатические узлы не визуализируются на стороне забора вены [27]
Fig. 3. Dynamic lymphoscintigraphy in a patient after endoscopic harvesting of the great saphenous vein (front view) [27]. A. Absence of disorders of lymphatic outflow before surgery. B. Lymphoscintigraphy after surgery. The appearance of break level and accumulation depot at the knee level after endoscopic vein isolation. Inguinal lymph nodes are not visualized on the side of the vein collection [27]
А
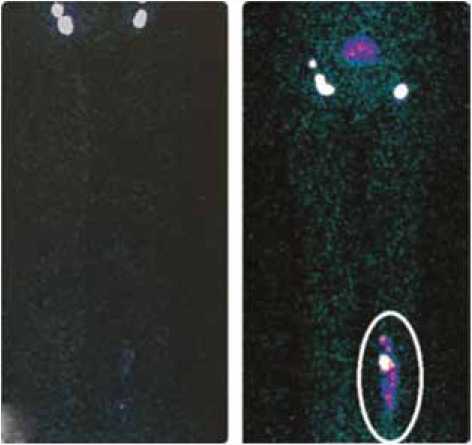
В
Рис. 4. Лимфосцинтиграфия в динамике у пациента после открытого выделения большой подкожной вены (вид спереди) [27]. А. Отсутствие нарушений лимфатического оттока до операции. В. Появление депо накопления на уровне голени после открытого выделения вены Fig. 4. Dynamic lymphoscintigraphy in a patient after open harvest of the great saphenous vein (front view) [27]. A. Absence of disorders of lymphatic outflow before surgery. B. Appearance of the accumulation depot at the level of the leg after open vein isolation
Лимфедема была выявлена у 31,8% пациентов, ее развитие сопровождалось появлением депо накопления на уровне колена и рефлюксом радиофармпрепарата [14]. Развитие лимфедемы у значимой части пациентов через 3 мес. после операции свидетельствовало о том, что даже модифицированная методика выделения с оставлением «кожных мостиков» приводила к развитию нарушений лимфатического оттока.
Заключение
Повреждение лимфатических сосудов неизбежно при выделении венозных кондуитов ввиду тесной анатомо-функциональной взаимосвязи венозного и лимфатического русла. Это является причиной развития осложнений, которые клинически могут проявляться только после выписки из стационара. В госпитальном периоде основное внимание хирурга направлено на кардиальное благополучие, профилактику и лечение стернальных осложнений, при этом не уделяется должного внимания нарушениям лимфатического оттока. Без своевременной диагностики лечение зачастую откладывается, что может приводить к развитию и прогрессированию необра- тимых изменений и стойкой утрате трудоспособности. Лечение лимфатических осложнений – это порой трудоемкий и высокозатратный процесс без гарантии достижения желаемого результата, что не может не сказаться на качестве жизни и удовлетворенности пациентов. По этой причине своевременная диагностика подобных осложнений важна с прогностической и профилактической точек зрения.
На сегодняшний день наиболее чувствительным и специфичным методом оценки функционального состояния лимфатического русла нижних конечностей является радионуклидная лимфосцинтиграфия нижних конечностей. Она позволяет верифицировать пациентов группы риска развития лимфатических осложнений с целью коррекции хирургического подхода к выделению венозных кондуитов. Поэтому некоторыми исследователями рекомендуется программа по профилактике и лечению осложнений нарушения лимфатического оттока, которая подразумевает рутинное выполнение радионуклидной лимфосцинтиграфии для выявления пациентов группы риска раневых осложнений и максимально раннее дифференцированное лечение [22].
Список литературы Лимфатические осложнения после выделения венозных кондуитов при операциях аортокоронарного шунтирования
- Лавренюк О.В., Чернявский А.М., Волков А.М., Терехов И.Н., Нимаев В.В. Состояние лимфатического русла нижних конечностей после открытого и эндоскопического выделения большой подкожной вены при операции коронарного шунтирования. Ангиология и сосудистая хирургия. 2013;19(3):46–51.
- Fuller J., Guderian D., Kohler C., Schneider A., Wendt T.G. Lymph edema of the lower extremities after lymphadenectomy and radiotherapy for cervical cancer. Strahlenther. Onkolog. 2008;184(4):206–211. DOI: 10.1007/s00066-008-1728.
- Новиков Р.В. Радиоизотопная лимфосцинтиграфия при раке предстательной железы: современный взгляд на проблему. Экспериментальная и клиническая урология. 2017;(2):26–33.
- Boccardo F., Campisi C.C., Molinari L., Dessalvi S., Santi P.L., Campisi C. Lymphatic complications in surgery: Possibility of prevention and therapeutic options. Updates Surg. 2012;64(3):211–216. DOI: 10.1007/s13304-012-0165-0.
- Pittaluga P., Chastanet S. Lymphatic complications after varicose veins surgery: Risk factors and how to avoid them. Phlebology. 2012;27(1):139–142. DOI: 10.1258/phleb.2012.012s12.
- Twine C.P., Lane I.F., Williams I.M. Management of lymphatic fistulas after arterial reconstruction in the groin. Ann. Vasc. Surg. 2013;27(8):1207–1215. DOI: 10.1016/j.avsg.2013.01.003.
- Athanasiou T., Aziz O., Al-Ruzzeh S., Philippidis P., Jones C., Purkayastha S. et al. Are wound healing disturbances and length of hospital stay reduced with minimally invasive vein harvest? A meta-analysis. Eur. J. Cardiothorac. Surg. 2004;26(5):1015–1026. DOI: 10.1016/j.ejcts.2004.07.013.
- Вечерский Ю., Манвелян Д., Затолокин В., Шипулин В., Козлов Б. Новый метод эндоскопического выделения вены для коронарного шунтирования. Врач. 2019;30(4):28–34. DOI: 10.29296/25877305-2019-04-05.
- Raja S.G., Sarang Z. Endoscopic vein harvesting: technique, outcomes, concerns & controversies. J. Thorac. Dis. 2013;5(6):S630–637. DOI: 10.3978/j.issn.2072-1439.2013.10.01.
- Piza-Katzer H., Pilz E. Distal external lymph fistula of the tibia as a complication of vena saphena magna harvesting. Vasa. 1992;21(1):85–86 (In German.).
- Abai B., Zickler R.W., Pappas P.J., Lal B.K., Padberg F.T. Jr. Lymphorrhea responds to negative pressure wound therapy. J. Vasc. Surg. 2007;45(3):610–613. DOI: 10.1016/j.jvs.2006.10.043.
- Molina J.E. Lymphocele after vein harvesting. In book: Cardiothoracic surgical procedures and techniques. Cham: Springer; 2018:63–66. DOI: 10.1007/978-3-319-75892-3_13.
- Siddiqi M.S. Saphenous vein harvest wound complications: risk factors, identification, prevention, and management. Chronic Wound Care Management and Research. 2016;(3):147–156. DOI: 10.2147/CWCMR.S82601.
- Belczak C.E., de Godoy J.M., Cruz J.A.F., Tyszca A.L., Neto H.J., Caffaro R.A. Lymphoscintigraphic findings: Delayed oedema after great saphenous vein harvesting. Phlebology. 2011;26(5):185–190. DOI: 10.1258/phleb.2010.010071.
- Schacht V., Luedemann W., Abels C., von Rautenfeld D.B. Anatomy of the subcutaneous lymph vascular network of the human leg in relation to the great saphenous vein. Anat. Rec. (Hoboken). 2009;292(1):87–93. DOI: 10.1002/ar.20765.
- Алексеев С.А., Кошевский П.П. Нарушения лимфатического оттока: лимфостаз, лимфедема: учеб.-метод. пособие. Минск: БГМУ; 2016:20.
- Singh N., Agarwal A. Lymphocele following saphenous vein harvesting.Ibnosina Journal of Medicine and Biomedical Sciences. 2011;3(5):188–189. DOI: 10.4103/1947-489X.210892.
- Жуков Б.Н., Яровенко Г.В., Каторкин С.Е., Мышенцев П.Н. Современные аспекты консервативного лечения больных с лимфовенозной недостаточностью нижних конечностей. Вестник хирургии имени И.И. Грекова. 2009;168(1):38–40.
- Watfa W., Campisi C., Ryan M., Matter M., Cherix S., Sörelius K. et al. Lymphatic leaks of the Thigh and Inguinal Region: Combined plastic surgery approaches for an effective treatment algorithm. Ann. Рlast. Surg. 2020;85(6):661–667. DOI: 10.1097/SAP.0000000000002310.
- Cha J.G., Lee S.Y., Hong J., Ryeom H.K., Kim G.C., Do Y.W. Transpedal lymphatic embolization for lymphorrhea at the graft harvest site after coronary artery bypass grafting. Yeungnam Univ. J. Med. 2020;38(1):74–77. DOI: 10.12701/yujm.2020.00297.
- Кузнецов М.С., Шипулин В.М., Козлов Б.Н., Насрашвили Г.Г., Панфилов Д.С., Сондуев Э.Л. и др. Опыт использования комбинированного метода воздушно-плазменной терапии в кардиохирургии. Клин. И эксперимент. хир. Журн. им. акад. Б.В. Петровского. 2020;8(2):73–82. DOI: 10.33029/2308-1198-2020-8-2-73-82.
- Миннебаев М.М., Мухутдинова Ф.И., Тагирова Д.Р., Мухутдинов Д.А. Современные представления о функционировании лимфатической системы в норме и патологии. Казанский медицинский журнал. 2006;87(1):43–47.
- Földi M., Földi Е. Földi’s textbook of lymphology: for physicians and lymphedema therapists; 3th edit. Munchen: Elsevier Health Sciences; 2012:657.
- Национальное руководство по радионуклидной диагностике; под ред. Ю.Б. Лишманова, В.И. Чернова; в 2-х томах, т. 2. Томск: STT; 2010:418.
- Szuba A., Shin W.S., Strauss H.W., Rockson S. The third circulation: radionuclide lymphoscintigraphy in the evaluation of lymphedema. J. Nucl. Med. 2003;44(1):43–57.
- Амосов В.И., Кацев В.М., Дмитриева Л.А., Лапекин С.В. Лимфосцинтиграфия нижних конечностей: диагностические возможности метода. Регионарное кровообращение и микроциркуляция. 2002;1(3–5):48–52.
- Вечерский Ю., Манвелян Д., Затолокин В., Завадовский К., Сазонова С., Усов В. и др. Состояние нижней конечности после коронарного шунтирования. Врач. 2019;30(6):53–59. DOI: 10.29296/25877305-2019-06-1.
- Francesco B., Corrado C., Giuseppe M., Emanuela B., Chiara B., Francesco P. et al. Prevention of lymphatic injuries in surgery. Microsurgery. 2010;30(4):261–265. DOI: 10.1002/micr.20735.


