Люминисцентный анализ состояния митохондрий при воздействии некоторых тяжелых металлов
Автор: Абдулаев Вагаб Рафикович, Мурадова Гульзия Руслановна, Абдуллаева Наида Муртузалиевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Полезные ископаемые
Статья в выпуске: 5-1 т.17, 2015 года.
Бесплатный доступ
Изучено воздействие ионов тяжелых металлов на митохондрии печени крыс методом собственной и зондовой флуоресценции. При воздействии тяжелых металлов наблюдается падение интенсивности суммарной и триптофановой флуоресценции. В митохондриях при инкубации в среде, содержащей ионы свинца, происходит существенное повышение коэффициента микровязкости в общих липидах. В модельной системе обнаружено отчетливое снижение миграции энергии с митохондриальных белков на пирен по сравнению с контролем.
Флуоресценция, митохондрии, тяжелые металлы
Короткий адрес: https://sciup.org/148204024
IDR: 148204024 | УДК: 576.32.36
Текст научной статьи Люминисцентный анализ состояния митохондрий при воздействии некоторых тяжелых металлов
Кадмий и свинец являются одними из наиболее токсичных и опасных тяжелых металлов (ТМ). Как чрезвычайно распространенные во внешней среде токсические вещества они включены в списки приоритетных загрязняющих веществ многими международными организациями, в том числе Всемирной организацией здравоохранения. Известно, что ТМ обладают выраженными кумулятивными свойствами, высокой биохимической активностью по отношению к сульфгидрильным, тиоловым, карбоксильным и другим активным группам белков и аминокислот. Митохондрии являются мишенью для токсического действия солей ТМ, что подтверждается изменением их формы, структуры и размеров. Это может быть связано с преимущественным распределением ТМ в митохондриальной фракции клеток, хотя на долю митохондриальной фракции приходилось не более 10% кадмия, в то время как митохондрии составляют около 12% от клеточного объема [ 7 ] .
Среди существующих оптических методов флуоресцентные методы анализа являются одними из наиболее чувствительных для определения количественного содержания вещества в биологических образцах. Параметры флуоресценции чувствительны к структуре окружения флуорофора, поэтому флуоресцентные методы применяются также и для изучения структурных превращений в различных веществах. Также одним из информативных биофизических методов исследования структуры и динамических свойств биомембран
является метод флуоресцентных зондов, позволяющий получить адекватную информацию о биообъекте: поверхностном заряде, микровязкости, полярности, толщине липидного бислоя [ 9 ] .
Цель исследований: оценить in vitro воздействие ионов ТМ на митохондрии печени крыс методом собственной и зондовой флуоресценции.
Материалы и методы исследования . Спектрально-флуоресцентные характеристики образцов получены при комнатной температуре. Флуоресцентно спектральные измерения проводились на спектрофлуориметре Hitachi F-7000. Митохондрии из печени крыс выделяли по методу [ 6 ] . Митохондрии инкубировались 30, 90, 180 мин. в среде с различной концентрацией (0,05-0,1 мМоль) ацетата свинца (Pb(CH 3 COO) 2 ), хлорида кадмия (CdCl 2 ) и в системе генерации свободных радикалов (FeSO 4 +H 2 O 2 ). Интенсивность собственной флуоресценции мембраны измеряли при возбуждении светом с длиной волны 280 нм и 295 нм. Результаты выражали в условных единицах. Выбор флуоресцентных зондов осуществлялся, исходя из возможности одновременного сканирования глубинных и поверхностных слоев мембраны. В качестве флуорофоров были выбраны следующие соединения: пирен, 1-анилинонафталин-8-сульфо-нат (АНС) ( λ в =365 λ э =470 нм). Для измерения вязкости липидного бислоя вблизи белков (область бе-лок-липидного взаимодействия) использовали длину волны возбуждения λ в =280 нм, спектральная ширина щелей была 1,5/5нм. Для измерения микровязкости липидного бислоя вдали от белков (область липид-липидного взаимодействия) использовали длину волны возбуждения λ в =337 нм, спектральная ширина щелей составляла 1,5/2,5. При этом максимумы эмиссии наблюдались при λ э =370 и 390 нм (пики излучения возбужденных мономеров пирена), λ э =470 нм (максимум излучения возбужденного димера пирена) [ 1 ] . Полученные спектры обрабатывались в программе OriginPro 9.0
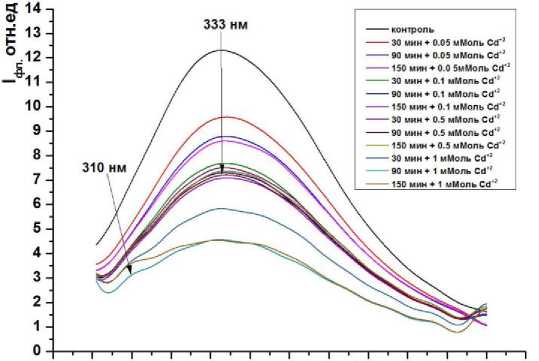
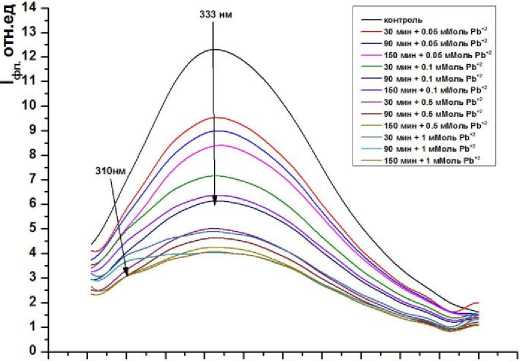
Результаты исследований и их обсуждение. Как видно из рис. 1-3 в митохондриях при использовании всех модельных систем наблюдается от 1,5 до 5-ти кратное падение интенсивности суммарной и триптофановой флуоресценции (некоторые графики не отражены в статье). Интересно, что падение интенсивности флуоресценции мало зависит от длительности инкубации в системе, содержащей ионы ТМ. Тогда как увеличение концентрации приводит к существенному, многократному падению, как суммарной, так и триптофановой флуоресценции митохондрий.
Из спектров собственной белковой флуоресценции митохондрий, следует, что оба металла уменьшают её интенсивность, при этом, концентрации 0,05-0,1 мМоль существенно не изменяют других спектральных параметров (λмакс., изменение спектральной асимметрии). Этот факт можно объяснить тушением ионами ТМ флуоресценции поверхностных триптофановых и тирозиновых остатков, поскольку флуоресценция первых формирует длинноволновое, а вторых коротковолновое крыло суммарного спектра [3]. В противном случае, если бы тушению подвергалась флуоресценция лишь одной люминофорной группы, то в эксперименте регистрировалось бы изменение асимметрии спектральной линии. Здесь уместно напомнить, что при используемой длине волны возбуждения (280 нм) поглощают все белковые люминофоры. В тоже время считать тушение флуоресценции ионами ТМ единственной причиной снижения интенсивности флуоресценции неверно, так как при концентрации ионов кадмия и свинца 0,51 мМоль в среде инкубации митохондрий, в коротковолновой области спектра суммарной флуоресценции появляется пик в виде плеча на λмакс.=310 нм. Данный пик соответствует флуоресценции аминокислотных остатков тирозина (рис. 1, 2). Учитывая известный факт, что спектры флуоресценции хромофоров тирозина по положению и форме практически не отличаются при значительных отклонениях свойств окружения, наблюдаемые изменения могут быть отнесены за счет вызванного ионами тяжелых металлов конформационного изменения структур мембранных белков митохондрий [2]. Исходя из современных представлений, такое возгорание тирозиновой флуоресценции может быть обусловлено, как дополнительным излучением потушенных в водном растворе тирозиновых остатков, так и уменьшением эффективности переноса энергии с тирозина на триптофан. Но в любом случае это свидетельствует о конфор-мацнонных перестройках белков в липидном окружении [9].
В контроле флуоресценция остатков тирозина практически отсутствуют, так как значительная доля энергии возбуждения, полученная тирозиновыми остатками, может мигрировать на трипто-фанилы и высвечиваться в качестве триптофанового компонента [ 3 ] . Инкубация митохондрий в системе генерации АФК снижает интенсивность суммарной и триптофановой флуоресценции примерно в 5 раз относительно контроля. При этом в спектре суммарной флуоресценции наблюдается длинноволновой сдвиг (333 ^ 340 нм), а триптофановой (334 ^ 338 нм) (рис. 3).
Ионы ТМ, особенно двухвалентных металлов (ртуть, свинец, кадмий), связываются с сульфгидрильными (SH-группами) специфичных или неспецифичных белков, выполняющих различные функции связывают белков, в том числе мембранных ферментов и ионных каналов, нарушая их третичную, вторичную структуру вследствие чего увеличивается доступность аминокислотных остатков к окислителю, что сопровождается их инактивацией [ 11 ] .
От свойств липидной фазы мембран, таких, как вязкость, поверхностный заряд, полярность, зависит работа мембранных ферментов и рецепторов. В табл. 1 представлены результаты флуоресценции зонда АНС при добавлении его к мембранным структурам в контроле и при инкубации в среде содержащий 0,1 мМоль ацетат свинца.
290 300 310 320 330 340 350 360 370 380 390 400 410
А, нм
Рис. 1. Суммарная флуоресценция митохондрий крыс при инкубации в 0,05-1 мМоль растворе CdCl 2
290 300 310 320 330 340 350 360 370 380 390 400 410
Л, нм
Рис. 2. Суммарная флуоресценция митохондрий крыс при инкубации в 0,05-1 мМоль растворе Pb(CH 3 COO) 2
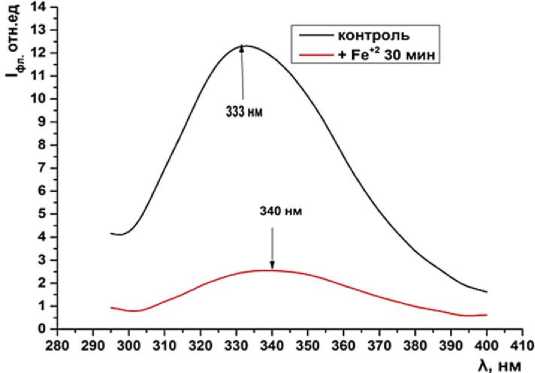
Рис. 3. Суммарная флуоресценция митохондрий крыс при инкубации в системе генерации АФК FeSO 4 + Н 2 О 2
Как видно из табл. 1 интенсивность флуоресценции АНС существенно возрастает при инкубации мембранных структур с ацетатом свинца относительно контроля. Это находит своё объяснение в увеличении связывания анионного зонда с модифицированной катионами металлов поверхностью мембран, несущей в нативном состоянии суммарный отрицательный заряд.
Основным механизмом процесса модификации мембран ТМ является перекисное окисление липидов (ПОЛ). Известно, что ПОЛ, индуцированное действием солей ТМ, наиболее интенсивно протекает в митохондриях, вызывая нарушение их функции [10]. ПОЛ непосредственно катализируется ионами металлов. Активация свободнорадикального окисления под действием металлов может быть связана также с истощением естественных антиоксидантов (аскорбиновой кислоты и токоферола) в клетках и/или с изменением активности антиокислительных ферментов (каталазы и супероксиддисмутазы). Последняя включает в себя: клеточные ферменты (супероксиддисмутазу, глутатионтрансферазу, каталазу), некоторые компоненты плазмы (трансферрин, церрулоплаз-мин, альбумин), способные связывать металлы с переходной валентностью [10].
Из табл. 1 видно, что инкубация митохондрий с ацетатом свинца влечёт за собой незначительное нарушения полярности в гидрофобных участках липидного матрикса и в анулярных липидах митохондрий, поскольку значение индекса полярности существенно не изменяется. В то же время ацетат свинца обусловливает уменьшение степени эксимеризации пирена, который находится в обратной зависимости от микровязкости липидов мембран (табл. 1). Это явление может быть вызвано двумя причинами: повышением микровязкости мест локализации пирена в районе гидрофобных остатков жирных кислот липидного бислоя [ 2 ] и перераспределением зонда из липидной фракции мембран в белко-вую. Так как в белках зонд не эксимеризуется [ 12 ] , будет наблюдаться кажущееся снижение степени эксимеризации, определенной по соотношению интенсивностей флуоресценции эксимерной и мономерной форм пирена.
Таблица 1. Показатели текучести поверхностных и глубоких слоев мембран митохондрий при инкубации + 0,1 мМоль Pb+2 методом зондовой флуоресценции
|
Мембранная структура |
АНС λ в =365 λ фл =470 |
λв=280 (пирен) |
λв=334 (пирен) |
Величина миграции энергии, % |
||
|
I 470 /I 390 микровязкость анулярных липидов |
I 370 /I 390 полярность анулярных липидов |
I 470 /I 390 микровязкость общих липидов |
I 370 /I 390 полярность общих липидов |
|||
|
митохондрии |
0,23 |
0,98 |
0,72 |
1,23 |
0,71 |
81,7 |
|
митохонд-рии+Pb+2 |
0,73 ⃰ |
0,75 ⃰ |
0,60 |
0,82 ⃰ |
0,59 |
57,6 ⃰ |
Примечание ⃰- достоверное различие относительно контроля
В митохондриях при инкубации в среде содержащей ионы свинца происходит существенное повышение коэффициента микровязкости в общих липидах (на 34%) относительно контроля. Оценка параметров взаимодействия пирена с мембраной митохондрий в опытной группе при инкубации с ионами свинца позволила обнаружить отчетливое снижение показателя миграции энергии с триптофанов на пирен по сравнению с контрольными значениями (табл. 1).
Выводы: на основании анализа результатов проведенных исследований можно прийти к заключению, что ионы свинца связываются с отри- цательно заряженными поверхностными группами митохондриальных мембран, вследствие чего модифицируют заряд наружного мембранного слоя. При этом изменяется не только конформация мембранных белков, но происходит существенное увеличение микровязкости глубинных участков липидного матрикса без изменения их полярности, а также падение показателя миграции энергии с белков на пирен.
Статья подготовлена при поддержке Министерства образования и науки Рф, соглашение № 14.В37.21.0192.
-
6.
-
7.
-
8.
-
9.
-
10.
-
1.
-
2.
-
3.
-
4.
-
5.
Список литературы Люминисцентный анализ состояния митохондрий при воздействии некоторых тяжелых металлов
- Добрецов, Г.Е. Флуоресцентные зонды в исследовании клеток, мембран и липопротеинов. -М.: Наука, 1989. 320 с.
- Лебедь, О.И. Влияние дихлордивинилфосфата на структуру плазмалеммы гепатоцитов//Проблемы современной токсикологии. 1999. № 3. С. 95-99.
- Лебедь, О.И. Характер нарушения структурных свойств микросом гепатоцитов солями кадмия и лантана//Проблемы современной токсикологии. 1998. №3. С. 108-113.
- Леонова, Г.А. Биогеохимическая индикация загрязнения водных экосистем тяжелыми металлами//Водные ресурсы (качество и охрана вод, экологические аспекты). 2004. Т. 31, №2. С. 215-222.
- Орлов, Д.С. Экология и охрана биосферы при химическом загрязнении/Д.С. Орлов, Л.К. Садовникова, И.Н. Лозановская. -М: Высшая школа, 2002. 334 с.
- Barogi, S. Lack of major changes in mitochondria from liver, heart, and skeletal muscle of rats upon ageing/S. Barogi, A. Baracca, G. Parenti Castelli et al.//Mech. Ageing Dev. 1995. Vol. 84. P. 139-150.
- Gobe, G. Mitochondria, reactive oxygen species and cadmiumtoxicity in the kidney/G. Gobe, D. Crane//Toxicology Letters. 2010. V. 198(1). P. 49-55.
- Lakowicz, J.R. Principles of Fluorescence Spectroscopy. 3rd ed. 2006. XVI. 954 p.
- Passada, R. Effect of intraperitoneal cadmium administration on mitochondrial enzymes in rat tissue//Toxicol. 1983.V. 27. Р. 81.
- Satarug, S. Long-term exposure to cadmium in food and cigarette smoke, liver effects and hepatocellular carcinoma//Curr. Drug Metab. 2012. V. 13. P. 257-271.
- Vanderkooi, J.M. Pyrene. A probe of lateral diffusion in the hydrophobic region of membranes/J.M. Vanderkooi, J.B. Callis//Biochemistry. 1974. V. 13, № 19. P. 4000.


