Логистическая регрессия для оценки связи воспалительных маркеров плазмы крови и развития астении при шизофрении
Автор: Симонов А.Н., Зозуля С.А., Клюшник Т.П.
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Биологические исследования
Статья в выпуске: 3 (120), 2023 года.
Бесплатный доступ
Актуальность. Астенический синдром, являясь наиболее распространенным транснозологическим синдромом, в рамках различных заболеваний встречается в 15-30% случаев, сопровождает инфекционные (туберкулёз, грипп, COVID-19) и соматические заболевания (хроническая сердечная недостаточность, хроническая обструктивная болезнь легких), а также выявляется при неврологических и психических расстройствах, негативно влияя на клинический исход заболевания и существенно снижая качество жизни пациентов.
Астения, шизофрения, воспаление, маркеры, прогноз, бинарная логистическая регрессия
Короткий адрес: https://sciup.org/142239810
IDR: 142239810 | УДК: 616.151:616.895.8:616.8-009.17:004.652.8 | DOI: 10.26617/1810-3111-2023-3(120)-21-28
Текст научной статьи Логистическая регрессия для оценки связи воспалительных маркеров плазмы крови и развития астении при шизофрении
Астенический синдром (АС) представляет собой психопатологическое состояние, проявляющееся слабостью, повышенной утомляемостью, быстрой истощаемостью, плохой переносимостью физических, умственных и психических нагрузок, перепадами настроения [1, 2]. АС является самым распространенным транснозологическим синдромом, частота встречаемости которого в рамках различных заболеваний колеблется от 15% до 30% [3]. Астения сопровождает многие инфекционные (туберкулёз, грипп, COVID-19) [4, 5, 6] и соматические заболевания (хроническая сердечная недостаточность, хроническая обструктивная болезнь легких) [7, 8], а также выявляется при неврологических и психических расстройствах [9, 10], негативно влияя на клинический исход заболевания и существенно снижая качество жизни пациентов.
Сложность проблемы АС для общемедицинской практики связана, прежде всего, с разнообразием теоретических взглядов исследователей на систематику астенических расстройств, поли-морфностью клинических проявлений и особенностей течения, а также отсутствием четких диагностических критериев астении [3, 11, 12]. Недостаточно изученными и дискутабельными остаются патогенетические механизмы астенических расстройств. В литературе приводятся данные, подтверждающие связь АС с дисрегуляцией иммунной системы и вегетативной нервной системы, нейроэндокринными нарушениями, сосудистой дисфункцией, нарушением регуляции клеточно-молекулярного энергетического метаболизма [13, 14, 15, 16].
Вовлеченность воспалительных реакций в развитие астении отмечается многими исследователями. Так, в ряде работ зарубежных авторов со- общается о цитокиновом дисбалансе, характеризующемся повышением уровня как провоспали-тельных, так и противовоспалительных цитокинов (преимущественно ИЛ-1, ИЛ-6, ИЛ-10, ФНО-α), а также о нарушении их соотношения, развитии острофазного ответа и избыточной активации (согласно некоторым данным ‒ дисрегуляции) клеточно-опосредованного иммунного ответа при АС [17, 18, 19]. Принимая во внимание то обстоятельство, что астения может развиваться при различных хронических заболеваниях инфекционной и неинфекционной природы, ассоциированных с воспалением, можно предположить, что её развитие связано с изменением состояния иммунной системы ‒ снижением иммунозащитного функционирования.
Результатами собственных исследований показано, что развитие астении при шизофрении – хроническом заболевании, ассоциированном с повышенным уровнем различных маркеров воспаления [20], сопровождается изменением спектра этих маркеров. Основной особенностью совокупности этих показателей у пациентов с АС при шизофрении является низкая энзиматическая активность лейкоцитарной эластазы (ЛЭ) на фоне высокого уровня других маркеров воспаления [21, 22]. ЛЭ ‒ сериновая протеаза азурофильных гранул нейтрофилов, которая секретируется во внеклеточное пространство при активации нейтрофилов и развитии воспаления [23]. Одна из функций ЛЭ заключается в увеличении проницаемости кровеносных сосудов, в том числе гематоэнцефалического барьера [24], а её протеолитическая активность регулируется ингибитором ‒ α1-протеиназным ингибитором (α1-ПИ), синтезирующимся в печени. Одновременно с этим α1-ПИ относится к белкам острой фазы воспаления, поскольку его индукторами являются провоспали-тельные цитокины [25]. Предположительно, наблюдаемое снижение активности ЛЭ может быть связано с функциональным истощением нейтрофилов и/или их трансмиграцией в мозг через нарушенный гематоэнцефалический барьер вследствие длительно текущего хронического воспаления, являющего важным патогенетическим звеном шизофрении.
Настоящая работа является продолжением этого исследования и посвящена разработке прогностической модели с целью вероятностной оценки развития АС при шизофрении по энзиматической активности ЛЭ и α1-ПИ с использованием бинарной логистической регрессии.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Использование логистической регрессии для оценки связи активности лейкоцитарной эластазы и α1-протеиназного ингибитора плазмы крови и развития астении при шизофрении.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось на основе базы данных, включающей клинико-психопатологические, социально-демографические и иммунологические показатели 95 пациентов (92 мужчины и 3 женщины) от 22 до 55 лет (средний возраст – 40,2±6,5 года) c приступообразно-прогредиентной (F20.x1) и непрерывной (параноидной) (F20.00) формами шизофрении, из которых у 61 пациента был диагностирован астенический симптомокомплекс. Клинико-психопатологические и социальнодемографические показатели включали следующие пункты: верифицированный диагноз по МКБ-10, длительность заболевания, психометрическая оценка по шкале позитивных и негативных симптомов PANSS (Positive and Negative Syndrome Scale) и по субъективной шкале оценки астении MFI-20 (Multidimensional Fatigue Inventory), а также пол и возраст пациентов. Иммунологические показатели включали результаты определения энзиматической активности ЛЭ (нмоль/мин·мл) и функциональной активности α1-ПИ (ИЕ/мл) в плазме крови по методам, подробно описанным нами ранее [21].
Статистическую обработку данных проводили с использованием программ R (R version 3.2.4) и STATA (version 12.1). Анализ базы данных состоял из следующих основных этапов: описательная статистика и корреляционный анализ взаимосвязи воспалительных маркеров с наличием (отсутствием) астенического симптомокомплекса у пациентов с шизофренией, построение математической модели бинарной логистической регрессии и проверка качества модели. Критический уровень статистической значимости был выбран при p<0,05.
Логистическая регрессия . Является разновидностью общей линейной модели, назначение которой состоит в анализе связи между несколькими независимыми переменными (в данном случае – энзиматической активности ЛЭ и функциональной активности α1-ПИ) и зависимой переменной (шизофрения без астении, шизофрения с астенией) [26, 27].
Модель бинарной логистической регрессии в данной работе использовали для двух целей: 1) оценки вероятности развития АС у пациентов с шизофренией; 2) оценки относительного вклада каждой из независимых переменных, в данном случае активности ЛЭ и α1-ПИ, в развитие АС при шизофрении.
Прогностическую эффективность модели оценивали при помощи следующих критериев: общая точность (accuracy), чувствительность (sensitivity), специфичность (specificity) и площадь под ROC-кривой (AUC ‒ area under curve).
Оптимальный порог отсечения (Optimal CutOff Value). ROC-анализ позволяет оценить такую важную в практическом отношении величину, как оптимальный порог отсечения. Порог отсечения – это величина, которая разделяет выборку на две категории исхода и на основании этого позволяет принимать решение о наличии того или иного состояния. Для определения оптимальной пороговой точки в данной работе использовали индекс У.Дж. Юдена (Youden's Index).
Отношение шансов . Для оценки количественного вклада каждой независимой переменной (ЛЭ и α1-ПИ) в развитие астенического синдрома при шизофрении использовали величину отношения шансов (ОШ), определяемую по формуле:
Г p ( у = i| x i + k ) И p( y = i| x i ) ) = еьъ_
^ 1 - p (Y = 1| X; + k) J ^ 1 - p (Y = 1 | X; ) J где b – коэффициент при независимой переменной в модели логистической регрессии (ЛЭ и α1-ПИ), k ‒ величина изменения этих независимых переменных.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В таблице 1 приведены данные описательной статистики, результаты проверки нормальности распределений при помощи теста Шапиро‒Уилки и результаты сравнения активности воспалительных маркеров в группах пациентов с шизофренией без астении и с астенией при помощи параметрического теста Стьюдента.
Т а б л и ц а 1. Описательная статистика лабораторных показателей в группах пациентов с шизо- френией без астении и шизофренией с астенией
|
Показатель |
ЛЭ, нмоль/ мин·мл |
α1-ПИ, ИЕ/мл |
|
Шизофрения без астении |
||
|
Среднее |
244,5 |
44,9 |
|
Стандартное отклонение |
29,3 |
11,6 |
|
Минимум |
153,4 |
28,7 |
|
Максимум |
293,3 |
73,2 |
|
Число пациентов |
34 |
|
|
Тест Шапиро‒Уилки, p-значение |
0,055 |
0,71 |
|
Критерий Стьюдента, p-значение |
р<0,05 |
0,14 |
|
Шизофрения с астенией |
||
|
Среднее |
195,8 |
47,4 |
|
Стандартное отклонение |
31,49 |
11,0 |
|
Минимум |
127,4 |
23,2 |
|
Максимум |
254,8 |
69,0 |
|
Число пациентов, абс. |
61 |
|
Как можно заключить из таблицы 1, гипотеза о нормальности распределений величин активности ЛЭ и α1-ПИ не отвергается. Критерий Стьюдента выявил, что средние значения в сравниваемых группах статистически значимо (p<0,05) различаются только для величины ЛЭ.
Были также оценены величины коэффициентов точечно-бисериальной корреляции между активностью изучаемых воспалительных маркеров и исходом, т.е. развитием или отсутствием у пациента АС. Установлено, что статистически значимым (р<0,05) оказался только коэффициент корреляции для ЛЭ (-0,62). Полученные результаты дают основание для построения математической модели бинарной логистической регрессии, предсказывающей развитие АС при шизофрении.
В таблице 2 приведены основные результаты анализа полученной регрессионной модели, предназначенной для определения вероятности развития астенического синдрома при шизофрении по иммунологическим показателям ЛЭ и α1-ПИ.
Т а б л и ц а 2. Результаты компьютерного анализа модели логистической регрессии
|
Показатель |
Коэффициент |
Стандартная ошибка |
Z-статистика |
p-величина |
|
Константа |
11,71 |
2,97 |
3,94 |
<0,05 |
|
ЛЭ |
-0,057 |
0,012 |
-4,66 |
<0,05 |
|
α1-ПИ |
0,027 |
1,06 |
0,28 |
0,29 |
Из таблицы 3 видно, что статистически значимым (р<0,05) является только регрессионный коэффициент при ЛЭ. Коэффициент при α1-ПИ статистически значимо не отличается от нулевого значения (р>0,05). Поскольку сравнение моделей с включением статистически незначимого предиктора α1-ПИ и без него, проведенное при помощи дисперсионного анализа, обнаружило отсутствие статистически значимых различий двух моделей логистической регрессии, то в качестве окончательной модели была выбрана модель с включением обоих предикторов:
P=1/(1+exp[-(11,71-0,057^ЛЭ+0,027^а1-ПИ)] (2) где Р – вероятность развития астении, exp ‒ основание натурального логарифма, 11,71 – регрессионная константа, 0,057 ‒ коэффициент при показателе ЛЭ, 0,027 – коэффициент при показателе α1-ПИ.
Полученную модель (2) необходимо было проверить на её адекватность наблюдаемым данным в целом. Адекватность конечной модели в общем случае оценивается величиной удвоенной разности логарифмов функций максимального правдоподобия для модели со всеми независимыми переменными (LL model) и модели без независимых переменных (LL null). Данная величина имеет распределение Хи-квадрат Пирсона и показывает уровень согласованности модели регрессии со всеми независимыми переменными (ЛЭ и α1-ПИ).
В таблице 3 приведены результаты проверки адекватности модели (2) данным. Показано, что удвоенная разность логарифма максимального правдоподобия между моделью с включением воспалительных маркеров (LL model) и моделью без них (LL null) составила 45,17, что соответствует достигнутому уровню статистической значимости критерия хи-квадрат с двумя степенями свободы при значении р<0,05. Это свидетельствует о том, что модель хорошо описывает наблюдаемые клинические данные.
Т а б л и ц а 3. Результаты компьютерного анализа проверки адекватности окончательной модели (2)
|
LL null |
LL model |
LR chi2(2) |
Pr>chi2 |
|
|
Модель (2) |
-61,96 |
-39,38 |
45,17 |
<0,05 |
Таким образом, полученная математическая модель бинарной логистической регрессии (2), связывающая вероятность развития астении при шизофрении с такими маркерами воспаления, как активность ЛЭ и α1-ПИ, адекватно описывает наблюдаемые клинические данные и может быть использована для предсказания наличия у пациентов с шизофренией развития АС по уровню определяемых для конкретного пациента показателей активности ЛЭ и α1-ПИ.
Для оценки диагностической эффективности полученной модели логистической регрессии традиционно используется ROC-анализ, связывающий чувствительность и специфичность диагностического теста. Графическим представлением такой зависимости является ROC-кривая, где по оси Y откладывается чувствительность (Sensitivity), а по оси X – единица минус специфичность теста (1-Specificity). На рисунке 1 представлена ROC-кривая для логистической модели (2).
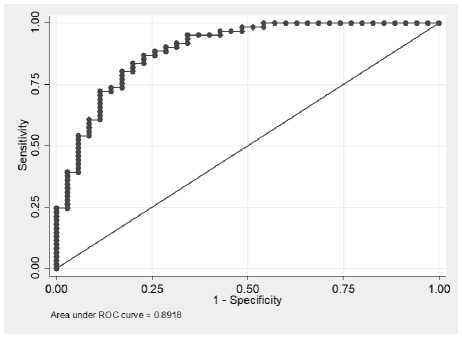
Р и с у н о к 1. ROC-кривая для полученной модели логистической регрессии
Количественной оценкой ROC-кривой является величина площади под кривой ‒ AUC (Area Under Curve), величина которой для полученной модели равна 0,89, что указывает на очень хорошее качество используемой модели.
В таблице 4 представлены результаты оценки эффективности модели бинарной логистической регрессии.
Т а б л и ц а 4. Результаты оценки эффективности модели бинарной логистической регрессии
|
Чувствительность |
Специфичность |
Правильная классификация |
AUC |
|
93,44% |
76,47% |
87,37% |
0,89 |
В таблице 5 приведены значения пороговых точек отсечения для воспалительных маркеров по методу Юдена с 95% доверительными интервалами (95% ДИ).
Т а б л и ц а 5. Значения пороговых точек по методу Юдена с 95% доверительными интервалами
|
Показатель |
Optimal_cutpoint |
95% ДИ |
|
ЛЭ |
230 |
212÷244 |
|
α1-ПИ |
39,2 |
37,3÷51,7 |
В таблице 6 приведены примеры значений отношения шансов в зависимости от изменения ЛЭ и α1-ПИ, подтверждающие, что шансы развития астении уменьшаются при повышении изменений ЛЭ, а для α1-ПИ – наоборот, увеличиваются.
Т а б л и ц а 6. Отношение шансов в зависимости от величин изменений ЛЭ и α1-ПИ
|
ОШ_α1-ПИ |
ОШ_ЛЭ |
Величина изменений показателя |
|
1,027368 |
0,944594 |
1 |
|
1,055485 |
0,892258 |
2 |
|
1,084371 |
0,842822 |
3 |
|
1,114048 |
0,796124 |
4 |
|
1,144537 |
0,752014 |
5 |
|
1,309964 |
0,565525 |
10 |
|
1,716007 |
0,319819 |
20 |
|
2,247908 |
0,180866 |
30 |
|
2,94468 |
0,102284 |
40 |
|
3,857426 |
0,057844 |
50 |
ЗАКЛЮЧЕНИЕ
Результаты проведенного исследования свидетельствуют, что изученные воспалительные показатели ‒ энзиматическая активность ЛЭ и функциональная активность α1-ПИ статистически значимо связаны с вероятностью развития астенического синдрома у пациентов с шизофренией и могут использоваться как объективные биологические маркеры этого состояния.
Разработанная математическая модель бинарной логистической регрессии с использованием показателей ЛЭ и α1-ПИ является высокоэффективной и может дополнять клиническое обследование пациентов, способствуя объективной диагностике астенического синдрома у пациентов с шизофренией и, следовательно, своевременной терапевтической коррекции и повышению качества жизни пациентов.
Список литературы Логистическая регрессия для оценки связи воспалительных маркеров плазмы крови и развития астении при шизофрении
- Лебедев М.А., Палатов С.Ю., Ковров Г.В., Щукина Е.П., Биняминов Х.Т. Астения ‒ симптом, синдром, болезнь. Эффективная фармакотерапия. Неврология и психиатрия. 2014. № 1. С. 30-38.
- Latimer KM, Gunther A, Kopec M. Fatigue in adults: evaluation and management. Am Fam Physician. 2023 Jul;108(1):58-69. PMID: 37440739.
- Соколова Л.П., Старых Е.В. Астенический синдром в общетерапевтической практике. Журнал неврологии и психиатрии им. С.С. Корсакова. 2022. Т. 122, № 4. С. 44-51. doi: 10.17116/jnevro202212204144
- Yang TY, Lin CL, Yao WC, Lio CF, Chiang WP, Lin K, Kuo CF, Tsai SY. How mycobacterium tuberculosis infection could lead to the increasing risks of chronic fatigue syndrome and the potential immunological effects: a population-based retrospective cohort study. J Transl Med. 2022 Feb 21;20(1):99. doi: 10.1186/s12967-022-03301-1. PMID: 35189895; PMCID: PMC8862378.
- Barry MA, Arinal F, Talla C, Hedible BG, Sarr FD, Ba IO, Diop B, Dia N, Vray M. Performance of case definitions and clinical predictors for influenza surveillance among patients followed in a rural cohort in Senegal. BMC Infect Dis. 2021 Jan 7;21(1):31. doi: 10.1186/s12879-020-05724-x. PMID: 33413174; PMCID: PMC7790019.
- Хайбуллина Д.Х., Максимов Ю.Н. Астенический постковидный синдром. Журнал неврологии и психиатрии им. С.С. Корсакова. 2023. Т. 123, № 3. С. 61 69. doi: 10.17116/jnevro202312303161
- Фомичева А.В., Волель Б.А., Трошина Д.В., Андреев Д.А., Симонов А.Н., Зозуля С.А., Клюшник Т.П. Клинические особенности астенических расстройств при хронической сердечной недостаточности. Журнал неврологии и психиатрии им. С.С. Корсакова. 2023. Т. 123, № 2. С. 104-111. doi: 10.17116/jnevro2023123021104
- Goërtz YMJ, Looijmans M, Prins JB, Janssen DJA, Thong MSY, Peters JB, Burtin C, Meertens-Kerris Y, Coors A, Muris JWM, Sprangers MAG, Wouters EFM, Vercoulen JH, Spruit MA. Fatigue in patients with chronic obstructive pulmonary disease: protocol of the Dutch multicentre, longitudinal, observational Fantastique study. BMJ Open. 2018 Apr 10;8(4):e021745. doi: 10.1136/bmjopen-2018-021745. PMID: 29643168; PMCID: PMC5898336.10.
- Щукин И.А., Лебедева А.В., Чубыкин В.И., Сороколетов С.М., Солдатов М.А. Астения у пациентов с хроническими неврологическими заболеваниями. Клиницист. 2013. № 2. С 64-71.
- Смулевич А.Б., Дубницкая Э.Б. Астения и коморбидные психические расстройства. Психиатрия и психофармакотерапия. 2009. № 4. С. 4-7.
- Аведисова А.С., Ястребов Д.В. Оценка диагностики и терапии астенических расстройств по результатам анкетирования врачей общей практики. Журнал неврологии и психиатрии им. С.С. Корсакова. 2010. Т. 110, № 2. С. 56 60.
- Чутко Л.С., Сурушкина С.Ю. Астенические расстройства. История и современность. Журнал неврологии и психиатрии им. С.С. Корсакова. 2020. Т. 120, № 6. С. 131-136. doi: 10.17116/jnevro2020120061131
- Silverman MN, Heim CM, Nater UM, Marques AH, Sternberg EM. Neuroendocrine and immune contributors to fatigue. PM R. 2010 May;2(5):338-46. doi: 10.1016/j.pmrj.2010.04.008. PMID: 20656615; PMCID: PMC2933136.
- Newton JL, Okonkwo O, Sutcliffe K, Seth A, Shin J, Jones DE. Symptoms of autonomic dysfunction in chronic fatigue syndrome. QJM. 2007 Aug;100(8):519-26. doi: 10.1093/qjmed/hcm057. Epub 2007 Jul 7. PMID: 17617647.
- Sandvik MK, Sørland K, Leirgul E, Rekeland IG, Stavland CS, Mella O, Fluge Ø. Endothelial dysfunction in ME/CFS patients. PLoS One. 2023 Feb 2;18(2):e0280942. doi: 10.1371/journal.pone.0280942. PMID: 36730360; PMCID: PMC9894436.
- Anderson G, Maes M. Mitochondria and immunity in chronic fatigue syndrome. Prog Neuropsychopharmacol Biol Psychiatry. 2020 Dec 20;103:109976. doi: 10.1016/j.pnpbp.2020.109976. Epub 2020 May 26. PMID: 32470498.
- Yang T, Yang Y, Wang D, Li C, Qu Y, Guo J, Shi T, Bo W, Sun Z, Asakawa T. The clinical value of cytokines in chronic fatigue syndrome. J Transl Med. 2019 Jun 28;17(1):213. doi: 10.1186/s12967-019-1948-6. PMID: 31253154; PMCID: PMC6599310.
- Morris G, Maes M, Berk M, Puri BK. Myalgic encephalomyelitis or chronic fatigue syndrome: how could the illness develop? Metab Brain Dis. 2019 Apr;34(2):385-415. doi: 10.1007/s11011-019-0388-6. Epub 2019 Feb 13. PMID: 30758706; PMCID: PMC6428797.
- Deumer US, Varesi A, Floris V, Savioli G, Mantovani E, López-Carrasco P, Rosati GM, Prasad S, Ricevuti G. Myalgic Encephalomyelitis/Chronic Fatigue Syndrome (ME/CFS): An Overview. J Clin Med. 2021 Oct 19;10(20):4786. doi: 10.3390/jcm10204786. PMID: 34682909; PMCID: PMC8538807.
- Клюшник Т.П., Бархатова А.Н., Шешенин В.С., Андросова Л.В., Зозуля С.А., Отман И.Н., Почуева В.В. Особенности иммунологических реакций у пациентов пожилого и молодого возраста с обострением шизофрении. Журнал неврологии и психиатрии им. С.С. Корсакова. 2021. Т. 121, № 2. С. 53-59. doi: 10.17116/Jnevro202112102153
- Якимец А.В., Зозуля С.А., Олейчик И.В., Клюшник Т.П. Особенности динамики клинико-биологических показателей астенического симптомокомплекса у больных шизофренией в процессе иммунотропной терапии. Журнал неврологии и психиатрии им. C.C. Корсакова. 2018. Т. 118, № 3. С. 70-76. doi: 10.17116/jnevro20181183170-76
- Симонов А.Н., Клюшник Т.П., Зозуля С.А. Доказательная психиатрия: параклиническая диагностика астенического синдрома шизофрении на основе определения лейкоцитарно-ингибиторного индекса. Психиатрия. 2020. Т. 18, № 2. С. 6-12. doi: 10.30629/2618-6667-2020-18-2-6-12
- Taylor S, Dirir O, Zamanian RT, Rabinovitch M, Thompson AAR. The Role of Neutrophils and Neutrophil Elastase in Pulmonary Arterial Hypertension. Front Med (Lausanne). 2018 Aug 3;5:217. doi: 10.3389/fmed.2018.00217. PMID: 30131961; PMCID: PMC6090899.
- Bao Dang Q, Lapergue B, Tran-Dinh A, Diallo D, Moreno JA, Mazighi M, Romero IA, Weksler B, Michel JB, Amarenco P, Meilhac O. High-density lipoproteins limit neutrophil-induced damage to the blood-brain barrier in vitro. J Cereb Blood Flow Metab. 2013 Apr;33(4):575-82. doi: 10.1038/jcbfm.2012.206. Epub 2013 Jan 9. PMID: 23299241; PMCID: PMC3618395.
- Faust D, Raschke K, Hormann S, Milovic V, Stein J. Regulation of alpha1-proteinase inhibitor release by proinflammatory cytokines in human intestinal epithelial cells. Clin Exp Immunol. 2002 May;128(2):279-84. doi: 10.1046/j.1365-2249.2002.01843.x. PMID: 11985518; PMCID: PMC1906393.
- Fleiss JL, Williams JB, Dubro AF. The logistic regression analysis of psychiatric data. J Psychiatr Res. 1986;20(3):195-209. doi: 10.1016/0022-3956(86)90003-8. PMID: 3772822.
- Hosmer Jr. DW and Lemeshow S. Applied logistic regression. 2000/ 2nd Edition, John Wiley & Sons, Inc., New York. doi: 10.1002/0471722146


