Лучевая терапия рецидива рабдомиосаркомы околоушной слюнной железы после хирургического удаления (клинический случай)
Автор: Черняев Д.В., Галимов Е.В., Козин В.А., Зуков Р.А., Семнов Э.В.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клинический случай
Статья в выпуске: 6 т.14, 2024 года.
Бесплатный доступ
Актуальность. Лечение такой редкой и гетерогенной онкопатологии, как саркома мягких тканей, требует комплексного подхода с обязательным обсуждением каждого пациента на мультидисциплинарном консилиуме. Хирургическое удаление первичной опухоли должно проводиться в профильных центрах после тщательной диагностики и формирования персональной стратегии противоопухолевой терапии. Крайне важно ещё на дооперационном этапе оценить риски местного рецидива заболевания и реализовать преемственность лечения пациента при нерадикальности операции. Радио- и химиорезистентность сарком снижает эффективность лучевой и лекарственной терапии, а несвоевременное начало лечения ещё больше ухудшает прогноз для пациента. Современное радиотерапевтическое оборудование и техника подведения дозы ионизирующего излучения позволяют преодолеть порог радиорезистентности злокачественных клеток и добиться уменьшения опухолевой массы. Описание клинического случая. Пациент с подозрением на злокачественное новообразование правой околоушной слюнной железы был прооперирован в объёме резекции, по результатам гистологического исследования подтверждена карциносаркома слюнной железы G3 (pT2N0M0) без указания края резекции. Через 1 месяц после хирургического удаления опухоли пациентом был отмечен местный рецидив заболевания, однако дальнейшего противоопухолевого лечения пациент не получал. Только через 1 год пациент поступил в онкологический диспансер, где после верификации местного рецидива и телемедицинской консультации с федеральным центром получил паллиативную лучевую терапию. Облучение проводилось в два этапа - мультифракционированным гипофракционным облучением в разовой дозе 3,7 Гр два раза в день до суммарной дозы 14,8 Гр (19 изоГр) и далее после 3-недельного перерыва ежедневное гипофракционное облучение в разовой дозе 3 Гр до суммарной дозы 61 изоГр. На фоне лечения удалось добиться редукции опухолевой массы на 85 % от исходного размера, уменьшения болей, улучшения общесоматического статуса и качества жизни. К сожалению, ответ был непродолжительным, ввиду агрессивности гистологической формы заболевания, проведение санационной операции на остаточную опухоль не было реализовано в указанном клиническом случае.
Рабдомиосаркома, остаточная опухоль, рецидив, гипофракционирование
Короткий адрес: https://sciup.org/143184005
IDR: 143184005 | УДК: 616.428-006.6-085.849.1:616-089 | DOI: 10.20340/vmi-rvz.2024.6.CASE.4
Текст научной статьи Лучевая терапия рецидива рабдомиосаркомы околоушной слюнной железы после хирургического удаления (клинический случай)
Competing interests. The authors declare no competing interests.
Funding. This research received no external funding.
Compliance with ethical principles. The authors confirm that they respect the rights of the people participated in the study, including obtaining informed consent when it is necessary.
Cite as: Chernyaev D.V., Galimov E.V., Kozin V.A., Zukov R.A., Semenov E.V. Radiation therapy for recurrence of rhabdomyosarcoma of the parot- id salivary gland after surgical removal (clinical case). Bulletin of 2024;14(6):124–130.
Актуальность
Саркомы мягких тканей (СМТ) представляют собой опухоли соединительной ткани – опухоли связок, сухожилий, мышц и жировой ткани, происходящие из примитивной мезодермы. Эта разнородная группа опухолей, включающая более 100 гистологических подтипов, объединена вместе из-за схожести морфологической картины и клинических проявлений [1]. На долю СМТ приходится не более 1 % от всех злокачественных новообразований у взрослых. В России на 2023 год частота заболеваемости данной разновидностью опухоли крайне мала и составляет 21,4 случая на 100 тыс. населения или 2812 человек в абсолютных числах [2]. Ввиду редкости заболевания и неоднородности опухолей решение в выборе тактики ведения пациента должна принимать мультидисциплинарная врачебная комиссия, в состав которой входят врач-патологоанатом, врач-рентгенолог, онколог-хирург, радиотерапевт и химиотерапевт, а также смежные специалисты по реабилитации и ортопедии, что доказано улучшает отдалённые результаты лечения пациентов [3]. Объём и последовательность терапии должны быть обсуждены до начала лечения, а ключевая роль на ранних стадиях отдаётся локальным методам воздействия, именно поэтому требу- the Medical Institute “REAVIZ”: Rehabilitation, Doctor and Health.
ется тесное сотрудничество между хирургом и радиотерапевтом. Основным методом лечения локализованной СМТ является широкое иссечение опухоли в пределах здоровых тканей с учётом принципов футлярности и зональности [4] . При этом риск локального рецидива колеблется от 0–18 % при отрицательном крае резекции до 42–93 % при наличии остаточной опухоли в области иссечения, что зависит от размеров образования, его расположения, глубины инвазии и степени злокачественности клеток [5] . У пациентов с повышенным риском местного рецидива лучевая терапия (ЛТ) применяется в дополнение к хирургическому лечению для уменьшения объёма резекции (при неоадъювантной терапии) и повышения локального контроля над заболеванием (как адъювантное лечение) [6] . Лучевая терапия может проводиться до или после операции, в самостоятельном варианте при нерезектабильном образовании или при олигометастатическом процессе, а также паллиативно для уменьшения объёма опухолевой массы и снижения болевого синдрома. Основной проблемой при выборе тактики лечения является низкая чувствительность СМТ к химиотерапии (ХТ) и ЛТ, именно поэтому предпочтение отдаётся стереотаксическому облучению и гипофракционированию, которые позволяют подвести круп-
ные аблативные дозы ионизирующего излучения и тем самым преодолеть радиорезистентность опухоли. Так, для сарком мягких тканей a / в принятое считать от 2 до 6 Гр [7] , что обосновывает необходимость применения крупного фракционирования и позволяет прогнозировать лучший исход по сравнению с конвенциональным облучением.
Приведённый клинический случай демонстрирует эффективность лучевой терапии рецидива рабдомиосаркомы околоушной слюнной железы после нерадикального хирургического лечения, несмотря на непродолжительный результат.
Клинический случай
Пациент Ф., 78 лет, в анамнезе в феврале 2023 г. проходил лечение в Забайкальском краевом онкологическом диспансере, где по подозрению на злокачественное новообразование (ЗНО) была выполнена резекция правой околоушной железы, по результатам гистологического исследования - карци-носаркома слюнной железы G3 (pT2N0M0), данные о крае резекции отсутствуют, рекомендовано динамическое наблюдение. Через 1 месяц после выполнения операции пациент отметил рост уплотнения под послеоперационным рубцом, однако за помощью не обращался ввиду запланированного переезда в Красноярский край. В ноябре 2023 года, когда образование достигло 5 см в диаметре, обратился к ЛОРу в поликлинику по месту жительства с жалобами на слабость, утомляемость, субфебрильную температуру тела, симптомами общей интоксикации. Далее мужчина был направлен в Красноярский краевой клинический онкологический диспансер (КККОД), где был дообследован. По результатам КТ с внутривенным болюсным контрастированием от декабря 2023 года отмечалась неоднородность структуры правой околоушной железы, гипо-, изоденсивной плотности участок, неравномерно накапливает контрастный препарат, с неровными чётко-нечёткими наружными контурами, прилежит к шиловидному отростку, сосцевидному отростку, распространяется до угла нижней челюсти, убедительно участков контактной деструкции не выявлено, прилежит к окружающим мышцам, образование общими размерами около 47x47x51 мм. Решением врачебного консилиума (ВК) от декабря 2023 года пациенту выдано направление на госпитализацию в отделение опухолей головы и шеи КККОД, где в январе 2024 года проведена биопсия опухоли правой околоушной слюнной железы, подтверждён рецидив карциносаркомы, материал направлен на иммуногистохимическое исследование (ИГХ). По результатам ИГХ от февраля 2024 г. - патологические изменения соответствуют веретеноклеточной рабдомиосаркоме, с учётом возраста, агрессивной гистологической картины и низкого уровня экспрес- сия Myogenin, вероятно, MyoD1-мутантной. При повторной КТ с контрастным усилением установлено, что опухоль достигла размеров 86x77x77 мм, наблюдаются признаки инвазии в прилежащие мышцы (преимущественно в грудино-ключичнососцевидную), образование частично окутывает яремную вену, суживая её просвет (признаки инвазии), прекраниальный отдел внутренней сонной артерии контрастируется неравномерно, вероятно за счёт пристеночных тромботических масс. Решением ВК КККОД с учётом результатов гистологического заключения и ИГХ рекомендован пересмотр стёкол, блоков в НМИЦО им. Н.Н. Блохина с последующей консультацией химиотерапевта. По результатам пересмотра ИГХ - дифференциальный диагноз между злокачественной опухолью из оболочек периферических нервов, grade 3 по FNCLCC (3+2+1) и веретеновидноклеточной рабдомиосаркомой, grade 3 по FNCLCC (3+2+1), рекомендовано провести паллиативный курс ДЛТ на опухоль шеи справа, разовая доза (РД) 3,7 Гр, 2 раза в день, два дня.
Ввиду семейных обстоятельств только в апреле 2024 года пациент поступил в дневной стационар радиотерапии, клинически при пальпации в области правой околоушной железы определяется опухоль плотной консистенции, неподвижная вколоченная, до 12 см в диаметре, с чётким бугристым контуром, признаками распада, сукровичным отделяемым (рис. 1), пациент астеничен, соматический статус ECOG-2, ближе к 3. Субъективно пациент жалуется на болезненность в области правой половины шеи, принимает НПВС (Кетопрофен) по 200 мг в сутки, слабость, утомляемость, отсутствие аппетита, похудел на 5 кг за 3 месяца, субфебрильная температура тела, неприятный запах из образования, нарушение сна.
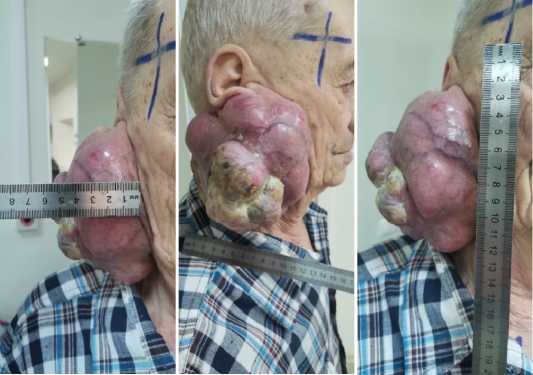
Рисунок 1. Опухоль до начала лучевой терапии
Figure 1. Tumor before the start of radiation therapy
Проведена КТ топометрия на уровне челюстнолицевой области с толщиной срезов и шагом 5 мм в положении лежа на спине с фиксацией головы. После оконтуривания зон облучения и дозиметрии (рис. 2) согласно рекомендациям НМИЦ им. Н.Н. Блохина проведён паллиативный курс ДЛТ мультифракционированием с разовой дозой (РД) в 3,7 Гр 2 раза в сутки № 2 до суммарной дозы (СД) 14,8 Гр на первичный очаг, что соответствует 19 изоГр при пересчёте по линейно-квадратичной модели (ЛКМ) со средней α / β для СМТ в 4 Гр [7] . Лечение реализовано на линейном ускорителе электронов «Unique» в режиме конформной лучевой терапии (3D-CRT), доза на критические структуры была в пределах толерантности.
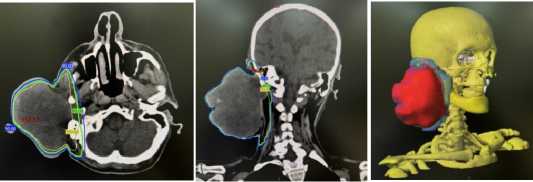
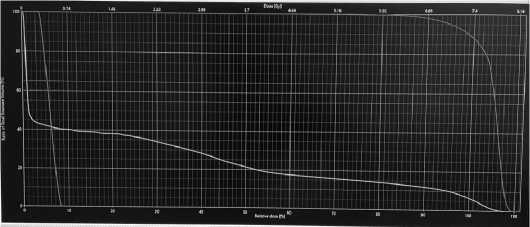
Рисунок 2. Распределение дозы в объеме облучения и гистограмма доза-объем (DVH), правая улитка внутреннего уха (розовый цвет), нижняя челюсть (желтый цвета) и PTV (красный цвет) Figure 2. Dose distribution within the irradiation volume and dosevolume histogram (DVH): right cochlea of the inner ear (pink), lower jaw (yellow), and PTV (red)
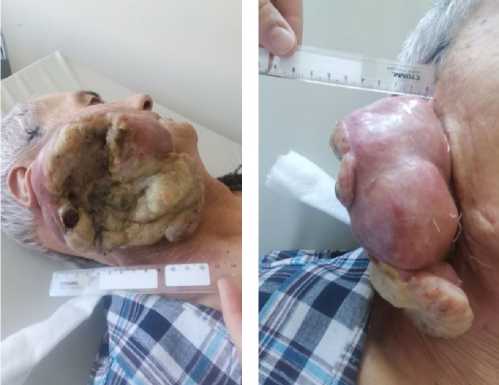
Рисунок 3. Опухоль после СД 19 изоГр (5 недель после окончания) Figure 3. Tumor after a total dose of 19 Gy (5 weeks post-treatment
С целью дезинтоксикационной терапии в процессе лечения проведена инфузия 1,5 % раствора меглюмина натрия сукцината (Реамберин) 500 мл 2 раза в день, 2 дня. Пациент выписан на 6-е сутки от дня госпитализации, субъективно состояние стабильное, новых жалоб или ухудшения общего состояния не отмечает.
Через 3 недели (май 2024 г.) после проведённых сеансов ДЛТ отмечалась частичная фрагментация опухоли (рис. 3), состояние пациента стабильное, однако симптомы интоксикации продуктами распада опухоли стали более выражены, назначена сопроводительная терапия.
Проведена повторная телемедицинская консультация с НМИЦО им. Н.Н. Блохина, учитывая положительную динамику рекомендовано продолжить паллиативный курс ДЛТ на опухоль правой околоушной слюнной железы до радикальных доз в РД 3 Гр до СД 60–66 Гр с учётом полученных ранее фракций. Таким образом, пациент повторно поступил в дневной стационар радиотерапии КККОД, где проходил лечение согласно описанным рекомендациям с мая по июнь 2024 года. Лечение продолжено на линейном ускорителе электронов «Unique» в режиме конформной лучевой терапии (3D-CRT) в варианте гипофракционированной ЛТ с РД 3 Гр №12 до СД 36 Гр (42 изоГр). С учётом полученного ранее облучения СД составила 61 изоГр, доза на критические структуры была в пределах толерантности. По завершению ДЛТ отмечалась выраженная редукция опухоли на 85 % от исходного размера (рис. 4). Субъективно пациент отмечает улучшение самочувствия, повышение аппетита, набор массы тела, нормализацию температуры и общесоматического статуса до ECOG-1, уменьшение болей, доза НПВС (Кетопрофена) снижена до 50 мг на ночь.
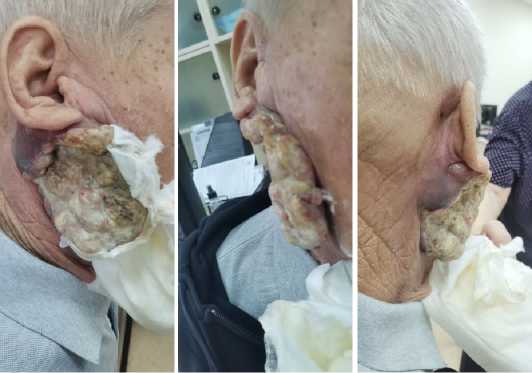
Рисунок 4. Опухоль после СД 61 изоГр (день выписки)
Figure 4. Tumor after a total dose of 61 Gy (day of discharge)
Проведена повторная ВК в начале июля 2024 года для определения возможности хирургического удаления остаточной опухоли (санационная операция), принято решение повторить инструментальную диагностику для определения глубины инвазии образования и оценки анестезиологических рисков. К сожалению, уже к концу июля отмечен бурный рост саркомы, по результатам КТ с внутривенным болюсным контрастированием наблюдалось неоднородность структуры правой околоушной железы, которая выраженно деформирует кожу (вероятно с наличием язвенных дефектов), прилежит к шиловидному отростку, сосцевидному отростку, распространяется вдоль угла нижней челюсти с признаками инвазии прилежащих мышц (преимущественно грудиноключично-сосцевидной), частично окутывает яремную вену, суживая её просвет, распространяется в заушную область и деформирует наружный слуховой проход, суживает просвет последнего, образование общими размерами около 100×51×94 мм. Субъективно общесоматический статус ухудшился до ECOG-3, возобновились и усилились боли, нарастала интоксикация. Повторная ТМК с НМИЦ им. Н.Н. Блохина постановила невозможность проведения противоопухолевой лекарственной терапии ввиду распада опухоли. Учитывая тяжесть состояния, пациенту дано направление на госпитализацию в паллиативное отделение КККОД для проведения посиндромной терапии.
Обсуждение
Саркома мягких тканей представляет собой целую группу гетерогенных по источнику происхождения, локализации, гистологической форме и агрессивности злокачественных новообразований, объединённых клеточным происхождением из соединительной ткани. Большинство СМТ локализуется в области туловища и конечностей, но могут возникать на любых участках тела, включая область головы и шеи (5–15 % случаев), забрюшинное пространство и внутренние органы. Относительно редкая встречаемость данной онкопатологии, не более 1 % от всех злокачественных новообразований у взрослых [1] , зачастую приводит к неправильной оценке заболевания врачами общей лечебной сети, запущенности онкологического процесса или неправильному началу лечения в непрофильных центрах без должной подготовки и хирургического опыта, что ухудшает прогноз для пациентов.
Эффективность терапии снижает и сама биология саркомы, которая относится к радиорезистент-ным и малочувствительным для противоопухолевой лекарственной терапии опухолям. С физической точки зрения низкая чувствительность СМТ к ЛТ обусловлена превалированием квадратичного компонента клеточной гибели β над линейным компо- нентом гибели α, что обуславливает малое отношение α/β в линейно-квадратичной модели, характерное для поздно реагирующих тканей и радиорезистентных ЗНО. Именно поэтому для успешного лечения сарком необходимо применять гипофракционные режимы облучения, разовая доза при которых больше чем классические 1,8–2 Гр за фракцию. Такой вариант фракционирования ведёт к большим изменениям биологического эффекта от ЛТ, хотя и требует повышения точности подводимого энергетического пучка с помощью конформного (3D-CRT) или модулированного по интенсивно-сти/объёму облучению (IMRT/ViMAT) [8].
Активно обсуждаются возможности неоадъювантной радиотерапии СМТ [9] . Так, недавно проведённый мета-анализ Albertsmeier M. И соавт., включающий восемь исследований с участием более 1600 пациентов, показал, что предоперационная ЛТ снижает объём оперативного лечения, значимо улучшает как локальный контроль над опухолью, так и выживаемость пациентов, хотя и повышает риски послеоперационных осложнений [11] . Однако, несмотря на достаточно обнадёживающие результаты, первоочередной опцией в стратегии комбинированного лечения пациентов с рассматриваемым недугом по-прежнему остаётся хирургическое удаление опухоли [10] . Что касается запущенных и высокоагрессивных сарком, то примерно у 50 % пациентов с саркомой мягких тканей высокой степени злокачественности развиваются метастазы, требующие паллиативного лечения в основном с использованием системной противоопухолевой терапии.
Отдельно необходимо остановиться на адъювантной лучевой терапии (АЛТ) СМТ, которая является неотъемлемым компонентом комбинированного лечения для локализованных стадий заболевания с высоким риском местного рецидива. Наличие микроскопически положительного края (R1) является показанием для реиссечения и/или проведения послеоперационной лучевой терапии [10] . Риск локорегионального рецидива после АЛТ зависит не только от гистологических особенностей опухоли, но и от её расположения, так для сарком конечностей данный показатель находится в пределах 8–15 % [12] , а для СМТ головы и шеи достигает 54 % [13] . При этом ввиду низкой эффективности противоопухолевой лекарственной терапии, как последней опции для данного заболевания, местный рецидив опухоли напрямую связан с общей выживаемостью и является, в большинстве случаев, основной причиной смерти больных (65–74 %) [14 –17] . Таким образом, выполнение ЛТ после хирургического вмешательства является оправданной и значимой лечебной опцией.
Заключение
Лучевая терапия является эффективным и неотъемлемым компонентом комбинированного лечения сарком мягких тканей, способная редуцировать опухолевую массу и позволяющая нередко перевести злокачественное образование в резектабельное состояние, минимизируя таким образом объём операции. Ввиду биологических особенностей сарком необходимо использовать укрупнённые режимы фракционирования для достижения тумороцид-ного результата. Решение в выборе тактики ведения пациента должна принимать мультидисциплинарная врачебная комиссия на основании факторов риска местного рецидива и прогрессирования заболевания, коморбидной патологии и желании пациента. Ввиду агрессивности ряда гистологических форм СМТ лечение обязано быть преемственным и комплексным, не должно откладываться после завершения одного из этапов противоопухолевой терапии, будь то хирургия, радио- или химиотерапия. Залогом эффективной онкологической помощи пациентам с данным недугом является тесное сотрудничество не только отдельных специалистов, но и коллаборация онкологических учреждений в зависимости от их опыта и материальной оснащённости.
Список литературы Лучевая терапия рецидива рабдомиосаркомы околоушной слюнной железы после хирургического удаления (клинический случай)
- Fletcher C.D.M., Bridge J.A., Hogendoorn P.C.W., Mertens F., editors. WHO Classification of Tumours of Soft Tissue and Bone. 4th ed. IARC; Lyon, France: 2013.
- Каприн А.Д., Старинский В.В., Шахзадова А.О. Состояние онкологической помощи населению России в 2023 году. М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2024. Kaprin A.D., Starinsky V.V., Shakhzadova A.O. The state of oncological care for the population of Russia in 2023. Moscow: P.A. Herzen Moscow Oncology Research Institute − branch of the National Medical Research Center of Radiology of the Ministry of Health of Russia, 2024. (In Russ).
- Blay JY, Soibinet P, Penel N, et al. Improved survival using specialized multidisciplinary board in sarcoma patients. Ann Oncol. 2017. Nov 1;28(11):2852–2859.
- Алиев М.Д., Бохян Б.Ю., Буров Д.А. Прогностическая роль края резекции в хирургии сарком мягких тканей. Саркомы костей, мягких тканей и опухоли кожи. 2013;1:60-66. Aliev M.D., Bokhan B.Yu., Burov D.A. Prognostic role of resection margin in surgery of soft tissue sarcomas. Bone, soft tissue sarcomas and skin tumors. 2013;1:60-66. (In Russ).
- Serletti J.M., Carras A.J., O’Keefe R.J., Rosier R.N. Functional outcome after soft-tissue reconstruction for limb salvage after sarcoma surgery. Plast. Reconstr. Surg. 1998;102:1576–1583. https://doi.org/ 10.1097/00006534-199810000-00036
- Albertsmeier M, Rauch A, Roeder F, et al. External Beam Radiation Therapy for Resectable Soft Tissue Sarcoma: A Systematic Review and Meta-Analysis. Ann Surg Oncol. 2018;25(3):754–767.
- Yang G, Yuan Z, Ahmed K, et al. Genomic identification of sarcoma radiosensitivity and the clinical implications for radiation dose personali-zation. Transl Oncol. 2021;14:101165.
- Jang S.Y., Liu H.H., Mohan R. Underestimation of low-dose radiation in treatment planning of intensity-modulated radiotherapy. Int. J. Radiat. Oncol. Biol. Phys. 2008;71:1537–1546. https://doi.org/ 10.1016/j.ijrobp.2008.04.014
- Haas R.L.M., Delaney T.F., O’Sullivan B., Keus R.B., Le Pechoux C., Olmi P., Poulsen J.-P., Seddon B., Wang D. Radiotherapy for management of extremity soft tissue sarcomas: Why, when, and where? Int. J. Radiat. Oncol. Biol. Phys. 2012;84:572–580. https://doi.org/ 10.1016/j.ijrobp.2012.01.062
- Министерство здравоохранения Российской Федерации. Клинические рекомендации «Саркомы мягких тканей» 2022. Ministry of Health of the Russian Federation. Clinical guidelines "Soft tissue sarcomas" 2022. URL: https://cr.minzdrav.gov.ru/schema/515_2
- Albertsmeier M., Rauch A., Roeder F., Hasenhütl S., Pratschke S., Kirschneck M., Gronchi A., Jebsen N.L., Cassier P.A., Sargos P., et al. Exter-nal Beam Radiation Therapy for resectable Soft Tissue Sarcoma: A systematic review and meta-analysis. Ann. Surg. Oncol. 2018;25:754–767. https://doi.org/ 10.1245/s10434-017-6081-2
- Folkert M.R., Singer S., Brennan M.F., Kuk D., Qin L.X., Kobayashi W.K., Cragi A.M., Alektiar K.M. Comparison of local recurrence with con-ventional and intensity-modulated radiation therapy for primary soft-tissue sarcomas of the extremity. J. Clin. Oncol. 2014;32:3236–3241. https://doi.org/ 10.1200/JCO.2013.53.9452
- Bentz B.G., Singh B., Woodruff J., Brennan M., Shah J.P., Kraus D. Head and neck soft tissue sarcomas: A multivariate analysis of outcomes. Ann. Surg. Oncol. 2004;11:619–628. https://doi.org/ 10.1245/ASO.2004.03.006
- Mattavelli D., Miceli R., Radaelli S., Mattavelli F., Cantu G., Barisella M., Quattrone P., Stacchiotti S., Sangalli C., Casali P.G., et al. Head and neck soft tissue sarcomas: Prognostic factors and outcome in a series of patients treated at a single institution. Ann. Oncol. 2013;24:2181–2189. https://doi.org/ 10.1093/annonc/mdt126
- Eeles R.A., Fisher C., A’Hern R.P., Robinson M., Rhys-Evans P., Henk J.M., Archer D., Harmer C.L. Head and neck sarcomas: Prognostic factors and implications for treatment. Br. J. Cancer. 1993;68:201–207. https://doi.org/ 10.1038/bjc.1993.314
- Le Vay J., O’Sullivan B., Catton C., Cummings B., Fornasier V., Gullane P., Simm J. An assessment of prognostic factors in soft-tissue sarcoma of the head and neck. Arch. Otolaryngol. Head. Neck Surg. 1994;120:981–986. https://doi.org/ 10.1001/archotol.1994.01880330061011
- Willers H., Hug E.B., Spiro I.J., Efird J.T., Rosenberg A.E., Wang C.C. Adult soft tissue sarcomas of the head and neck treated by radiation and surgery or radiation alone: Patterns of failure and prognostic factors. Int. J. Radiat. Oncol. Biol. Phys. 1995;33:585–593. https://doi.org/ 10.1016/0360-3016(95)00256-X


