Лучевая терапия в лечении местнораспространенных тимом: клинический случай
Автор: Макарова К.С., Гуменецкая Ю.В., Салимов З.М., Усачева А.Ю., Агабабян Т.А., Иванов С.А., Каприн А.Д.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 3 т.24, 2025 года.
Бесплатный доступ
Актуальность. Тимома – опухоль из эпителиальных клеток вилочковой железы. В случаях, когда полное удаление опухоли невозможно из-за ее местного распространения, целесообразно проведение неоадъювантной терапии, которая может включать химиотерапию, лучевую терапию или их комбинацию. Описание клинического случая. Пациент К., 41 год. В марте 2022 г. установлен диагноз: Тимома, тип В3, сT3N0M1a, IVA ст. По данным компьютерной томографии от 18.02.22: опухоль в переднем отделе средостения, размерами 12,0×8,0×14,5 см, с распространением на правое легкое и перикард, компрессией крупных сосудов; единичные узловые образования по плевре. С 19.03.22 по 26.05.22 проведено 4 цикла полихимиотерапии (ПХТ) CAP. С 9.08.22 по 24.11.22 – 6 курсов ПХТ этопозид + цисплатин. Стабилизация. В январе 2023 г. самостоятельно обратился в МРНЦ им. А.Ф. Цыба, проведен онкологический консилиум. С учетом распространенности опухолевого процесса хирургическое лечение не показано, рекомендовано проведение лучевой терапии. С 16.02.23 по 3.04.23 проведен курс конформной дистанционной лучевой терапии на область опухоли средостения в режиме традиционного фракционирования, СОД 60 Гр. Лечение перенес удовлетворительно. При контрольном обследовании – уменьшение размеров опухоли с достижением резектабельности. С учетом положительной динамики после лучевой терапии, удовлетворительного общего состояния и возраста пациента принято решение о проведении операции. 15.09.23 выполнено удаление новообразования средостения с резекцией и пластикой перикарда, верхняя и средняя лобэктомия, прецизионное удаление образований париетальной плевры. При контрольном обследовании в октябре 2024 г. – прогрессирование в виде узловых образований по диафрагмальной плевре справа. Проведен онкологический консилиум, рекомендована химиотерапия пеметрекседом. В настоящее время состояние пациента удовлетворительное, он продолжает работать, социально активен. Заключение. Применение индукционной химиотерапии и лучевой терапии при местнораспространенных нерезектабельных тимомах позволяет повысить возможность полного удаления опухоли, что, в свою очередь, может способствовать улучшению результатов лечения. Редкость патологии и отсутствие стандартных подходов к лечению местнораспространенных опухолей тимуса определяют актуальность проблемы и необходимость оптимального решения о тактике лечения в каждом клиническом случае.
Местнораспространенная тимома, лучевая терапия, индукционная терапия
Короткий адрес: https://sciup.org/140310586
IDR: 140310586 | УДК: 616.438-006-08:615.849.1 | DOI: 10.21294/1814-4861-2025-24-3-190-197
Текст научной статьи Лучевая терапия в лечении местнораспространенных тимом: клинический случай
Тимома – опухоль, происходящая из эпителиальных клеток вилочковой железы. По данным канцер-регистра США, частота ее встречаемости составляет 0,13–0,15 на 100 тыс. населения [1]. Данное заболевание составляет около 50 % первичных новообразований переднего средостения у взрослых. Пик заболеваемости приходится на возраст 40–60 лет. Для тимом характерны медленный рост и местное распространение опухоли; отдаленные лимфогенные и гематогенные метастазы встречаются редко. В трети случаев заболевание протекает бессимптомно и обнаруживается случайно при рентгенографических исследованиях.
Общепринятой клинической классификацией тимом, основанной на оценке распространенности опухолевого процесса, является классификация Masaoka–Koga [2]. В последние годы для стади-рования также применяют классификацию TNM (международная классификация стадий злокачественных новообразований), основанную на объединенных данных Международной группы по изучению опухолей вилочковой железы (ITMIG) и Международной ассоциации по изучению рака легкого (IASLC) [3]. Тимомы демонстрируют широкую вариабельность морфологического строения и, согласно гистологической классификации ВОЗ (Всемирной организации здравоохранения) (5-я редакция от 2021 г.), их подразделяют на 5 типов: А, АВ, В1, В2, В3 [4]. Тимомы типа В более склонны к рецидивам и чаще встречаются на поздних стадиях по сравнению с типами А и АВ.
Основным методом лечения тимом является хирургический, заключающийся в полном удалении опухоли в объеме R0-резекции. Радикальное хирургическое лечение является наиболее значимым прогностическим фактором отдаленной общей и безрецидивной выживаемости [5]. Однако в ряде случаев из-за отсутствия симптомов на ранних стадиях заболевание выявляют поздно, когда опухоль уже нерезектабельна. В случаях, когда полное удаление опухоли невозможно из-за ее местного распространения, целесообразно рассмотреть назначение неоадъювантной терапии для снижения стадии и достижения резектабельности. Объем неоадъювантного лечения может включать химиотерапию, лучевую терапию или их комбинацию. Однако до настоящего времени не проведено рандомизированных исследований по данному вопросу и оптимальный объем неоадъювантной терапии не определен. Учитывая вышесказанное, актуальность проблемы лечения местнораспространенных нерезектабельных тимом не вызывает сомнений.
Клинический случай
Пациент К., 41 год. По поводу боли «колющего» характера в грудном отделе позвоночника в октябре 2022 г. обратился за медицинской помощью по месту жительства. Клиническая ситуация расценена как проявление остеохондроза, проведена терапия, без эффекта. В январе 2022 г. перенес новую коронавирусную инфекцию (COVID-19), по поводу чего была выполнена спиральная компьютерная томография органов грудной клетки (СКТ ОГК) (рис. 1). Ранее, в течение нескольких лет, пациент не выполнял рентгенологическое исследование ОГК.
Пациент обратился в онкологический центр, где 02.03.22 под УЗ-контролем выполнена трепан-биопсия образования переднего средостения. Морфологическое исследование (04.03.22): фрагменты эпителиальной опухоли солидного строения с низким клеточным полиморфизмом, слабо выраженным диффузным лимфоцитарным инфильтратом, фигуры митоза не определяются. Иммуногистохимическое исследование: общий цитокератин (AE1/AE3) положителен в клетках опухоли. Лимфоцитарный инфильтрат представлен CD5-позитивными, TdT-позитивными T-клетками. Заключение: тимома, тип В3.
Установлен диагноз: Тимома, тип В3, сT3N0M1a, IVA ст. Симптомов миастении не отмечено. С 19.03.22 по 26.05.22 проведено 4 цикла полихимиотерапии (ПХТ) по схеме CAP (цисплатин, доксорубицин, циклофосфамид). При контрольном обследовании – стабилизация. 12.07.22 выполнена торакотомия справа, процесс признан нерезекта-бельным, выполнена биопсия образования плевры. Гистологическое исследование (19.07.22): метастаз тимомы, тип В3, в париетальную плевру.
Материал опухоли сходного морфологического строения с ранее взятым биоптатом.
С 09.08.22 по 24.11.22 проведено 6 курсов ПХТ по схеме: этопозид 100 мг/м2, в 1–3-й дни + цисплатин 75 мг/м2, в 1-й день, цикл – 21 день. Выполнена контрольная СКТ ОГК (рис. 2). Консилиум от 01.02.23 – учитывая стабилизацию процесса, рекомендовано наблюдение.
В январе 2023 г. самостоятельно обратился в Медицинский радиологический научный центр (МРНЦ) им. А.Ф. Цыба, проведен онкологический консилиум. С учетом распространенности процесса хирургическое лечение не показано, рекомендована попытка проведения курса дистанционной лучевой терапии на область опухоли тимуса.
С 16.02.23 по 03.04.23 проведен курс конформной дистанционной лучевой терапии на область опухоли средостения. Объем видимой опухоли (GTV) составил 532 см3. В результате дозиметрического планирования достигнуто следующее покрытие планируемого объема облучения (PTV) – D95 % = 95,3 %. Лечение проведено на линейном ускорителе электронов Varian TrueBeam с применением технологии ротационной лучевой терапии с модуляцией интенсивности излучения (VMAT), ежедневной объемной визуализацией мишени (CBCT) в режиме традиционного фракционирования, разовая очаговая доза 2 Гр, 1 раз в день, ежедневно, 5 дней в неделю, до СОД 60 Гр. Лечение перенес удовлетворительно. Отмечено развитие острого лучевого пневмонита II степени (RTOG (Американская онкологическая группа по радиационной терапии), CTCAE v. 5 (Общие критерии терминологии нежелательных явлений, версия 5), проведена консервативная терапия с положительным эффектом.
Через 1 мес после лучевой терапии выполнена контрольная СКТ ОГК, при которой отмечено уменьшение размеров опухоли (рис. 3). Рекомендовано наблюдение, продолжена терапия острого лучевого пневмонита.
В сентябре 2023 г. повторно проведен онкологический консилиум. С учетом положительной динамики после лучевой терапии (уменьшение размеров опухоли с достижением резектабель-ности), удовлетворительного общего состояния и возраста пациента принято решение о проведении хирургического лечения. 15.09.23 в МРНЦ им. А.Ф. Цыба выполнено хирургическое лечение – стер-ноторакотомия справа, удаление новообразования средостения с резекцией и пластикой перикарда, резекция правого диафрагмального нерва, верхняя и средняя лобэктомия с апикальной плеврэктомией, прецизионное удаление образований париетальной плевры.
Морфологическое заключение (27.09.23): морфология опухоли не противоречит тимоме тип В3 с терапевтическим патоморфозом II степени по Лавниковой – в опухоли обширные очаги фибро-
а/a б/b
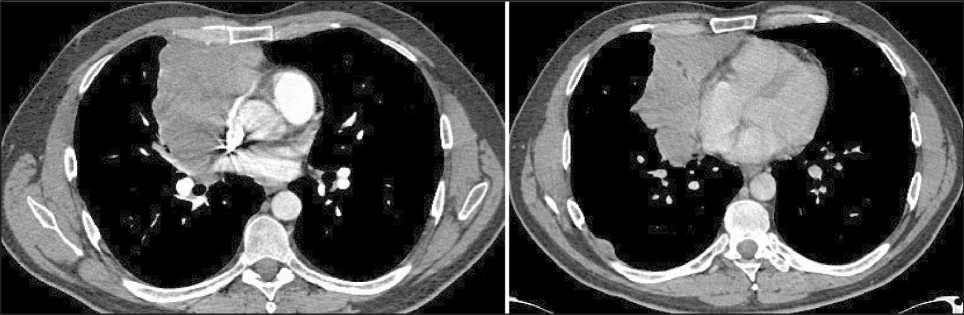
Рис. 1. СКТ органов грудной полости с контрастным усилением (18.02.22). Опухоль в переднем отделе средостения, размерами 12,0×8,0×14,5 см, с распространением на верхнюю, среднюю доли правого легкого, с инвазией в перикард, компрессией верхней полой вены, правого предсердия, правой легочной артерии, верхней легочной вены; единичные узловые образования по ходу задней костальной и диафрагмальной плевры справа, размерами до 20×13 мм.
Примечание: рисунок выполнен авторами
Fig. 1. CT scan of the chest organs with contrast enhancement (18.02.22). Tumor in the anterior mediastinum measuring 12.0×8.0×14.5 cm and spreading to the upper and middle lobes of the right lung, with invasion of the pericardium, compression of the superior vena cava, right atrium, right pulmonary artery, and superior pulmonary vein; single nodular lesions measuring to 20×13 mm along the posterior costal and diaphragmatic pleura on the right. Note: created by the authors
а/a б/b
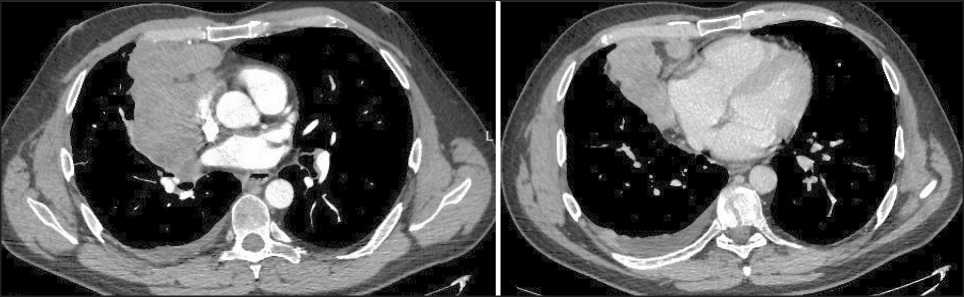
Рис. 2. СКТ органов грудной полости с контрастным усилением (20.01.23). При контрольном КТ-исследовании опухоль в переднем отделе средостения без значимого изменения размеров (11,4×7,5×13 см), узловые образования по ходу задней костальной и диафрагмальной плевры справа, прежних размеров и количества, появление выпота в правой плевральной полости. Примечание: рисунок выполнен авторами
Fig. 2. CT scan of the chest organs with contrast enhancement (20.01.23). Tumor in the anterior mediastinum without significant changes in size (11.4×7.5×13 cm); nodular lesions along the posterior costal and diaphragmatic pleura on the right are of the same size and number; appearance of effusion in the right pleural cavity. Note: created by the authors
а/a б/b
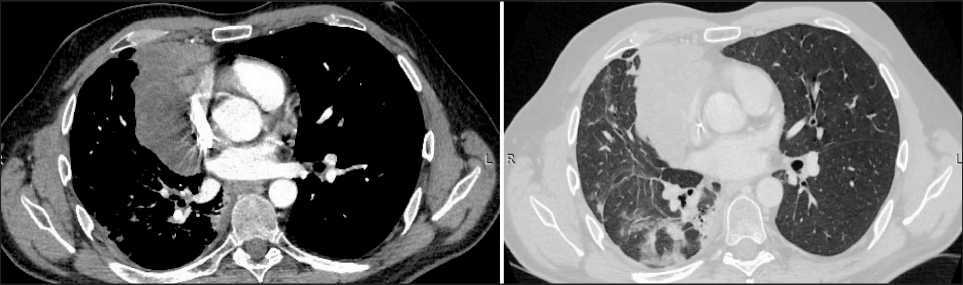
Рис. 3. СКТ органов грудной полости с контрастным усилением (5.05.23). При контрольном КТ-исследовании отмечено уменьшение размеров опухоли в переднем отделе средостения до 9,8×6,0×11,0 см, узловых образований по ходу костальной и диафрагмальной плевры справа – до 18×9 мм, появление интерстициальных изменений, участков инфильтрации легочной ткани в правом легком (проявления острого лучевого пневмонита) и уменьшение количества жидкости в правой плевральной полости.
Примечание: рисунок выполнен авторами
Fig. 3. CT scan of the chest organs with contrast enhancement (5.05.23). Decrease in the tumor size in the anterior mediastinum to 9.8×6.0×11.0 cm, and decrease in nodular lesions along the costal and diaphragmatic pleura on the right to 18×9 mm; appearance of interstitial changes, areas of lung tissue infiltration in the right lung (manifestations of acute radiation pneumonitis) and decrease in the amount of fluid in the right pleural cavity. Note: created by the authors
а/a б/b
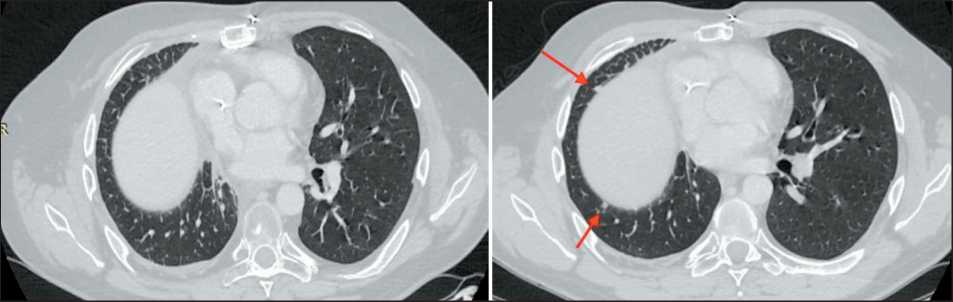
Рис. 4. СКТ органов грудной клетки с контрастным усилением от 03.10.24 (рис. б), при сравнении с КТ-данными от 12.03.24 (рис. а) – появление узловых образований по диафрагмальной плевре справа (стрелки). Примечание: рисунок выполнен авторами Fig. 4. CT scan of the chest organs with contrast enhancement (03.10.24). Comparison of CT data obtained in March, 2024 (figure a) with CT data obtained in October, 2024 (figure b) shows the appearance of nodular lesions along the diaphragmatic pleura on the right (arrows). Note: created by the authors
за, поля фибрина, опухоль врастает в перикард, париетальную и висцеральную плевру. В четырех перибронхиальных лимфатических узлах опухоли не обнаружено. Края резекции долевых бронхов и сосудов интактны.
Продолжено динамическое наблюдение за пациентом. При контрольном обследовании в октябре 2024 г. зарегистрировано прогрессирование – появление узловых образований по диафрагмальной плевре (рис. 4). Проведен онкологический консилиум, рекомендована противоопухолевая лекарственная терапия октреотидом, однако с учетом отсутствия экспрессии рецепторов к соматостатину (тип 2А, 5) принято решение о проведении химиотерапии по схеме: пеметрексед 500мг/м2, внутривенно, 1-й день, цикл – каждый 21-й день.
В настоящее время состояние пациента удовлетворительное, он продолжает работать, социально активен, находится в процессе рекомендованного курса лекарственной терапии.
Обсуждение
Оптимальная тактика лечения местнораспространенных опухолей тимуса до настоящего времени не определена. Радикальное хирургическое лечение имеет решающее значение для улучшения прогноза заболевания, но достижение R0-резекции может быть затруднено из-за инвазии в окружающие структуры. В таких случаях индукционная терапия играет важную роль в снижении стадии опухоли и обеспечении возможности ее хирургического удаления. В настоящее время химиотерапия является наиболее широко используемой индукционной терапией при местнораспространенных тимомах, при этом стандартным подходом являются схемы лечения на основе препаратов платины и антрациклинов [6]. В представленном клиническом случае индукционная химиотерапия не привела к значимому изменению объема опухоли или уменьшению степени инвазии в окружающие ткани и нами было принято решение о проведении курса дистанционной лучевой терапии.
Применение лучевой и химиолучевой терапии (ХЛТ) в качестве неоадъювантной терапии менее распространено. По данным анализа, проведенного с использованием базы данных Европейского общества торакальных хирургов, только 1 % пациентов (12 из 2030) получали дистанционную лучевую и 3 % (57 из 2030) – химиолучевую терапию в качестве индукционной терапии [7].
Немногочисленные публикации, сообщающие о результатах применения предоперационной лучевой терапии, сделаны в эпоху 2Д-лучевой терапии. Так, E. Akaogi et al. [8] сообщили о 12 пациентах с опухолями тимуса III–IV стадии, прорастающими в магистральные сосуды, которые подверглись предоперационной лучевой терапии в СОД от 12 до 21 Гр двумя передне-задними полями. В этой когорте частота полной резекции составила 75 %. Гистологическое исследование послеоперационного материала выявило выраженный фиброз опухоли у всех пациентов. M. Ribet et al. [9] представили результаты ретроспективного анализа лечения 113 пациентов с тимомой, 19 из которых проведена предоперационная 2Д-лучевая терапия. У 10 (52,6 %) из 19 пациентов достигнута полная резекция. Общая 5-летняя выживаемость составила 43,7 %. Данные о токсичности лечения не предоставлены.
В 2014 г. R.J. Korst et al. [10] опубликовали результаты проспективного многоцентрового исследования II фазы с применением предоперационной ХЛТ больным с местнораспространенными опухолями тимуса. В исследование включен 21 пациент, которым проведена предоперационная конформная дистанционная лучевая терапия (в том числе с применением технологии лучевой терапии с модуляцией интенсивности излучения (IMRT)) до СОД 40–45 Гр в комбинации с ПХТ по схеме: цисплатин 50 мг/м2, в 1, 8, 29, 36-й дни + этопозид 50 мг/м2, в 1–5 и 29–33-й дни. Частота R0-резекции составила 77 %. При медиане наблюдения 27 мес выживаемость без прогрессирования среди пациентов, у которых была достигнута полная резекция, составила 100 %.
Схожая частота R0-резекции (80 %) после индукционной ХЛТ у пациентов с опухолями тимуса III–IVА стадии по Masaoka продемонстрирована в исследовании C. Wright et al. [11]. Десяти больным (у 70 % – тимома, тип Б3) проведена предоперационная конформная дистанционная лучевая терапия (IMRT) до СОД 33–49 Гр в комбинации с двумя циклами платиносодержащей ПХТ.
Таким образом, результаты немногочисленных исследований о применении предоперационной химиолучевой терапии при местнораспространенных опухолях тимуса демонстрируют возможность достижения высокого уровня полных резекций. В настоящее время применение лучевой терапии в самостоятельном варианте в объеме индукционной терапии может быть рассмотрено в ограниченных случаях, когда не может быть проведена ПХТ. В представленном клиническом случае лучевая терапия проведена в самостоятельном варианте, обусловленном объемом и сроками ранее проведенной ПХТ, при этом, несмотря на высокий риск развития осложнений, была подведена СОД 60 Гр.
При неоперабельных опухолях тимуса ХЛТ может быть применена в самостоятельном варианте с радикальными намерениями. В 2020 г. X.W. Fan et al. [12] опубликовали результаты проспективного исследования II фазы, в котором проанализировали результаты применения самостоятельной ХЛТ не-резектабельных эпителиальных опухолей тимуса. В исследование были включены 56 пациентов, из которых у 22 была тимома, у 34 – рак тимуса. У 14,3 % пациентов установлена III стадия, у 10,7 % – IVA стадия, у 75 % – IVB стадия. Химиолучевая терапия проведена в следующем объеме: курс конформной дистанционной лучевой терапии с применением технологии IMRT в РОД 2 Гр до СОД 54-60 Гр на фоне ПХТ по схеме: этопозид 75 мг/м2 + цисплатин 25 мг/м2, в 1–3-й дни и 29–31-й дни. Частота объективного ответа на лечение для всей группы составила 85,7 %, для пациентов с тимомой – 81,8 %. При медиане наблюдения 46 мес (7–101) 5-летняя общая выживаемость составила 56,2 %. Развитие острого пневмонита I–II степени отмечено у 44,6 %;


