Лучевые фенотипы хронической обструктивной болезни легких у пациентов с сахарным диабетом второго типа
Автор: Павлова А.С., Лукина О.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.38, 2023 года.
Бесплатный доступ
Актуальность работы обусловлена отсутствием систематизированных данных об особенностях поражения легких у больных хронической обструктивной болезнью легких (ХОБЛ) и сахарным диабетом второго типа (СД2).Цель работы: выявление основных лучевых фенотипов поражения легочной ткани у пациентов с ХОБЛ и СД2.Материал и методы. Было проведено одномоментное обсервационное исследование с анализом клинических данных, результатов лабораторных и инструментальных исследований (исследование функции внешнего дыхания, компьютерная томография органов грудной полости), у пациентов с ХОБЛ в сочетании с СД2 (57 человек).Результаты. У пациентов с сочетанием ХОБЛ и СД2 было выявлено преобладание преимущественно бронхитического типа ХОБЛ над эмфизематозным, с наличием статистически достоверных связей между рядом компьютерно-томографических признаков (наличие воздушных ловушек, бронхиолита) и результатами лабораторных исследований (количество эозинофилов в крови, количество лейкоцитов в крови и мокроте, количество макрофагов в мокроте, уровни IL-33, TNF-α, С-реактивный белок (СРБ), соотношение IFN-γ/IL-4), что может отображать влияние разных патогенетических аспектов воспаления на формирование структурных изменений в легочной ткани.Выводы. Для пациентов с сочетанием ХОБЛ и СД2 более характерно наличие бронхитического фенотипа ХОБЛ с отсутствием сливающихся и деструктивных форм эмфиземы легких. Широкая распространенность бронхитического фенотипа ХОБЛ у пациентов с сопутствующим СД2 может быть обусловлена преимущественными изменениями в мелких дыхательных путях, развитием микроангиопатии, а также инфекционным фактором, поскольку пациенты с СД2 в целом более восприимчивы к инфекциям, включая респираторные.
Компьютерная томография, сахарный диабет второго типа, фенотипы хронической обструктивной болезни легких
Короткий адрес: https://sciup.org/149143653
IDR: 149143653 | УДК: 616.379-008.64-02:616.23/.24-002.2-07 | DOI: 10.29001/2073-8552-2022-608
Текст научной статьи Лучевые фенотипы хронической обструктивной болезни легких у пациентов с сахарным диабетом второго типа
Мультиспиральная компьютерная томография органов грудной полости имеет значительные преимущества перед рентгенографией в диагностике патологических изменений в легких у пациентов с хронической обструктивной болезнью легких (ХОБЛ): возможность проведения инспираторно-экспираторных маневров для выявления бронхиальной обструкции, дифференциальной диагностики с другими заболеваниями, выявления бронхоэктазов, а также позволяет визуализировать изменения на уровне ацинусов и бронхиол [1]. В настоящее время особое значение, помимо описания морфологических изменений в паренхиме легких и бронхах, придается выделению лучевых фенотипов ХОБЛ (бронхитического и эмфизематозного), поскольку они связаны с различным течением заболевания [2], для них характерны различные осложнения [3], имеются отличия в ответе на терапию [4, 5], различные коморбидные состояния [6]. Оценка преобладания того или иного фенотипа ХОБЛ проводится одномоментно с анализом показателей функции внешнего дыхания; как предложено в работе J.-H. Lee и соавт. [4], выделяются возможные функционально-лучевые субтипы.
В свою очередь, компьютерная томография органов грудной полости у больных сахарным диабетом второго типа (СД2) практически не используется в клинической практике. Несмотря на имеющиеся литературные сведения о морфологических изменениях в легочной ткани у пациентов с СД2 [7] и рассмотрении легких в качестве органа-мишени при диабете, единой методики исследования легких у данной группы пациентов не разработано [8].
В современной литературе имеются сведения о преобладании бронхитического фенотипа ХОБЛ у пациентов с диабетом по сравнению с пациентами без диабета [9]. Согласно другим авторам, у пациентов с сочетанием ХОБЛ и СД2 по данным компьютерной томографии выявлялись расширенные сосуды паренхимы легких субсегментарного уровня, что свидетельствовало о наличии нарушений микроциркуляции, с развитием микроангиопатии и нарушением перфузии периферических отделов легких [10] и формированием парасептальной эмфиземы.
Таким образом, изучение особенностей компьютерно-томографической картины органов грудной полости у пациентов с сочетанием ХОБЛ и СД2 представляет интерес с позиций фенотипирования выявленных изменений [11], что в дальнейшем будет иметь значение для выбора тактики лечения данной группы пациентов.
Материал и методы
Проведено одномоментное обсервационное исследование, включавшее анализ клинических данных (частота и выраженность обострений, тяжесть течения заболевания), результатов лабораторных (показатели клинического и биохимического анализов крови, уровней цитокинов (IL-1β, IL-4, IL-6, IL-17, IL-33, TNF-α, IFN-γ) в сыворотке крови) и инструментальных исследований (исследование функции внешнего дыхания (ФВД), компьютерная томография органов грудной полости) у пациентов с ХОБЛ в сочетании с СД2 (57 человек). Группу обследованных составляли 34 (59,6%) мужчины и 23 женщины (40,4%), средний возраст больных – 63,6 ± 8,8 лет.
Критериями включения в исследование являлись: a) возраст от 48 до 75 лет; б) подписанное информированное добровольное согласие, одобренное локальным этическим комитетом; в) диагнозы ХОБЛ и СД2, установленные в соответствии с действующими клиническими рекомендациями [12].
Критерии исключения составляли: 1) сопутствующее заболевание органов дыхания (бронхиальная астма, пневмония, пневмоторакс, идиопатический легочный фи- броз и др.), в том числе наличие острой респираторной инфекции; 2) наличие или планирование беременности, необходимость лактации; 3) наличие значимой декомпенсированной сопутствующей патологии, онкологических и иммуновоспалительных заболеваний. При этом в группе обследованных определялись различные варианты течения ХОБЛ, различная встречаемость и тяжесть дыхательной недостаточности (табл. 1).
Таблица 1. Характеристики течения хронической обструктивной болезни легких
Table 1. Characteristics of severity of chronic obstructive pulmonary disease
|
Тяжесть течения ХОБЛ Severity of COPD |
ХОБЛ + СД2, n (%) COPD + DM2, n (%) |
|
Легкая Mild |
14 (24,6%) |
|
Средняя Moderate |
20 (35,1%) |
|
Тяжелая Severe |
17 (29,8%) |
|
Крайне тяжелая Very severe |
6 (10,5%) |
Примечание: ХОБЛ – хроническая обструктивная болезнь легких.
Note: COPD – chronic obstructive pulmonary disease.
Как показано в таблице 1, среди обследованных преобладали пациенты со средней тяжестью течения заболевания.
Компьютерная томография органов грудной полости выполнялась на аппаратах Optima 660 GE, Optima 540 производство General Electric Hangwei Medical Systems Co. Ltd (США). После выполнения нативного сканирования в положении пациента лежа с руками за головой, без наклона гентри, а также применения функциональной методики (сканирование в моменты задержки дыхания при завершенном вдохе и выдохе) у всех пациентов оценивались изменения в легочной ткани и бронхах. В процесс анализа последовательно входили: 1) оценка распространенности эмфизематозной перестройки легких согласно методическим рекомендациям Флейшнеровского общества [13] с определением преобладающего типа центриацинарной эмфиземы, наличия парасептальной эмфиземы, буллезной эмфиземы; 2) оценка проявлений болезни мелких бронхов (формирование синдрома дерева в почках, воздушных ловушек в момент завершенного выдоха, визуализация бронхиолоэктазов в субплевральных отделах обоих легких; 3) оценка лучевых проявлений заболеваний крупных бронхов (утолщение и деформация стенок долевых, сегментарных и субсегментарных бронхов).
Оценка распределения протяженности эмфизематозной перестройки проводилась с помощью программ обработки изображения на рабочих станциях AW SERVER 2.0, AW SERVER 3.4 (GE, США) с выделением синим цветом и количественной оценкой объема легочной ткани с плотностью меньше -930 HU. Согласно классификации ХОБЛ по J.-H. Lee и соавт. [4], проводилось разделение пациентов на клинико-функциональные субтипы ХОБЛ: преимущественно бронхитический (КТ-индекс эмфиземы ≤ 20%, объем форсированного выдоха за первую секунду (ОФВ1) ≤ 45%), преимущественно эмфизематозный (КТ-индекс эмфиземы > 20%, ОФВ1 > 45%), легкий смешанный (КТ-индекс эмфиземы ≤ 20%, ОФВ1 > 45%)
и тяжелый смешанный (КТ-индекс эмфиземы > 20%, ОФВ1 ≤ 45%) варианты.
Результаты
Одной из особенностей поражения легких у данной группы пациентов оказалось наличие различной протяженности эмфизематозной перестройки легочной ткани при достоверно незначимых отличиях скоростных показателей проходимости дыхательных путей, что позволило нам использовать классификацию, предложенную J.-H. Lee и соавт. [4], для определения преобладающего клинико-функционального субтипа среди пациентов с ХОБЛ и СД2. Результаты анализа представлены в таблице 2.
Таблица 2. Встречаемость клинико-функциональных субтипов хронической обструктивной болезни легких у пациентов с сочетанием хронической обструктивной болезни легких и сахарным диабетом второго типа
Table 2. The occurrence of clinical and functional subtypes of chronic obstructive pulmonary disease in patients with a combination of chronic obstructive pulmonary disease and type 2 diabetes mellitus
|
Клинико-функциональный субтип Sybtype |
ХОБЛ + СД2, n (%) COPD + DM2, n (%) |
|
Преимущественно эмфизематозный вариант Emphysema-dominant sybtype |
0 (0%) |
|
Легкий смешанный вариант Mild-mixe sybtype |
43 (78,2%) |
|
Тяжелый смешанный вариант Severe-mixed sybtype |
5 (9,1%) |
|
Преимущественно бронхитический вариант Obstruction-dominant sybtype |
7 (12,7%) |
Примечание: ХОБЛ – обструктивной болезнью легких.
Note: COPD – chronic obstructive pulmonary disease.
Как показано в таблице 2, эмфизематозный субтип без выраженной бронхиальной обструкции не определялся ни у одного из пациентов с сочетанием ХОБЛ и СД2 в обследованной группе. Наиболее частым функционально-лучевым субтипом являлся легкий смешанный вариант, при котором по данным исследования ФВД ОФВ1 составлял больше 45% от должного, а протяженность эмфизематозной перестройки, количественно оцененная с помощью программного обеспечения, не превышала 20%.
При визуальной оценке паренхимы легких было выявлено преобладание эмфизематозной перестройки легочной ткани за счет центриацинарной эмфиземы, что потребовало ее дальнейшей детальной оценки. Согласно классификации Флейшнеровского общества [13], выделяют 5 типов центриацинарной эмфиземы легких: 1) тип а – единичные участки повышения прозрачности легочной ткани на уровне ацинуса, занимающие менее 0,5% от площади легочной зоны; 2) тип b – множественные участки повышения прозрачности легочной ткани, занимающие часть ацинуса, занимающие не более 0,5–5% площади легочной зоны; 3) тип с – множественные, четко очерченные участки повышения прозрачности легочной ткани на уровне ацинуса, занимающие более 5% от площади любой легочной зоны; 4) тип d – сливающиеся центрилобулярные и панлобулярные участки эмфиземы, с формированием полностью измененных вторичных легочных долек; 5) тип е – панлобулярные участки вздутия легочной ткани с увеличением объема легочной дольки и нарушением архитектоники легочной ткани. Также у обследованных пациентов встречались и другие типы эмфизематозной перестройки легочной ткани – панлобулярная, парасептальная, перицикатрическая эмфизема.
Распределение типов эмфиземы легких, согласно консенсусу Флейшнеровского общества у пациентов с сочетанием ХОБЛ и СД2, представлено в таблице 3.
Таблица 3. Распределение видов эмфизематозной перестройки легочной ткани у пациентов с сочетанием хронической обструктивной болезни легких и сахарного диабета второго типа
Table 3. Distribution of types of emphysema lung tissue in patients with a combination of COPD and type 2 diabetes mellitus
|
Тип эмфиземы Type of emphysema |
ХОБЛ + СД2, n = 57 COPD + DM2, n = 57 |
|
Тип a Type a |
4 (12,5%) |
|
Тип b Type b |
10 (32,3%) |
|
Тип c Type c |
13 (41,9%) |
|
Тип d Type d |
0 (0%) |
|
Тип e Type e |
0 (0%) |
|
Панлобулярная эмфизема Panlobular emphysema |
13 (37,1%) |
|
Парасептальная эмфизема Paraseptal emphysema |
18 (52,9%) |
|
Перицикатрическая эмфизема Paracicatricial emphysema |
2 (6,3%) |
Примечание: ХОБЛ - обструктивной болезнью легких.
Note: COPD - chronic obstructive pulmonary disease.
Как показано в таблице 3, среди пациентов с сочетанием ХОБЛ и СД2 не встречались типы d и е эмфиземы легких, которые характеризуются сливающимися и деструктивными панлобулярными эмфизематозными изменениями, занимающими большую площадь легочной ткани. Данные результаты в целом согласуются с имеющимися литературными данными о значимости поражения бронхов у пациентов с ХОБЛ и СД2 [5] и преобладании у этих пациентов участков центриацинарной эмфиземы. Частота выявления парасептальной эмфиземы в обследованной группе пациентов также была достаточно высокой, что поддерживает гипотезу о сочетанном складе сосудистых изменений, вызванных системным воспалением и эндотелиальной дисфункцией, и изменений в дистальных генерациях бронхов в развитии эмфизематозной перестройки легочной ткани у пациентов с сочетанием ХОБЛ и СД2.
На основании полученных компьютерно-томографических данных с помощью программ цифровой обработки изображения (построение «маски плотности») нами проводился количественный анализ распространенности участков повышенной воздушности с оценкой преимущественной локализации эмфизематозных изменений, при этом верхнедолевая локализация эмфизематозной перестройки легочной ткани преобладала в обследованной группе пациентов (27,3%).
Легкий смешанный субтип ХОБЛ, являясь крайне характерным для этой группы пациентов, характеризуется сочетанием паттернов повышения воздушности легочной ткани и признаков поражения мелких и мельчайших бронхов, таких как формирование синдрома «дерева в почках» и / или множественных мелких центрилобулярных очагов, отражающих заполнение вязким секретом терминальных отделов бронхиального дерева. Протяженность эмфизематозной перестройки у этих пациентов может быть незначительной, однако поражение бронхиального дерева имеет тяжелый характер и приводит к выраженному снижению функциональных показателей внешнего дыхания (рис. 1).
Клиническое наблюдение
Пациент Ш., 47 лет, с наличием метаболического синдрома и сочетанием впервые выявленной ХОБЛ и СД2, хорошо контролируемого диетой (см. рис. 1).
При развитии у пациентов с ХОБЛ тяжелого течения морфологические изменения в легочной ткани нарастали, при этом им также сопутствовали паттерны поражения крупных и мелких бронхов. В качестве примера компьютерно-томографических характеристик больного с коморбидной патологией рассмотрим случай пациента Б., 73 лет, страдающего ХОБЛ крайне тяжелого течения, GOLD IV ст., клинической группой D, в сочетании с СД2. Страдает ХОБЛ в течение 19 лет, СД2 – в течение 20 лет.
Данные компьютерно-томографического исследования приведены на рисунке 2, продемонстрировано наличие мозаичной пневматизации легких и центрилобулярных очагов, которые свидетельствуют о поражении мелких дыхательных путей.
Учитывая значимую роль системного воспаления в патогенезе как ХОБЛ, так и СД2, нами также было проанализировано влияние уровня цитокинов на развитие так называемых деструктивных форм эмфиземы. Результаты анализа уровней цитокинов при различных видах эмфизематозной перестройки представлены в таблице 4.
Таблица 4. Уровни цитокинов при разных типах эмфизематозной перестройки легочной ткани
Table 4. Cytokine levels in different types of emphysema
Показатели Indicators
ХОБЛ + СД2
COPD + DM2
IL-33, пг/мл
IL-33, pg/ml
Нет панлобулярной эмфиземы, n = 18
Absence of panlobular emphysema, n = 18
Есть панлобулярная эмфизема, n = 9
Presence of panlobular emphysema, n = 9
Уровень значимости р p -value
IL-6, пг/мл
Il-6, pg/ml
Нет парасептальной эмфиземы, n = 12
Absence of paraseptal emphysema, n = 12
Есть парасептальная эмфизема, n = 15
Presence of paraseptal emphysema, n = 15
Уровень значимости р p -value
3,10 (0,01–16,32)
0,01 (0,01–1,39)
0,050
2,77 (0,01–8,52)
0,01 (0,01–0,48)
0,050
Примечание: ХОБЛ – обструктивной болезнью легких, указаны Me ( Q 1– Q 3), применен критерий Манна – Уитни.
Note: COPD – chronic obstructive pulmonary disease, Me ( Q 1– Q 3) are given, the Mann – Whitney test is applied.
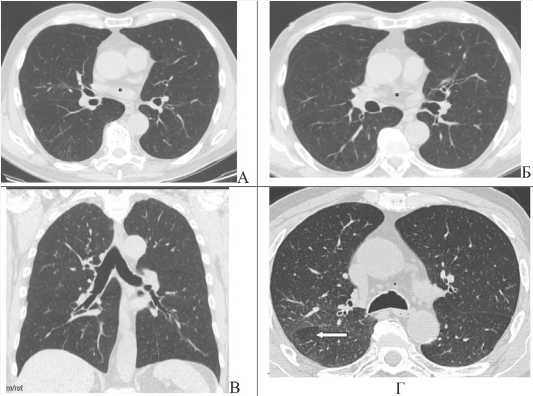
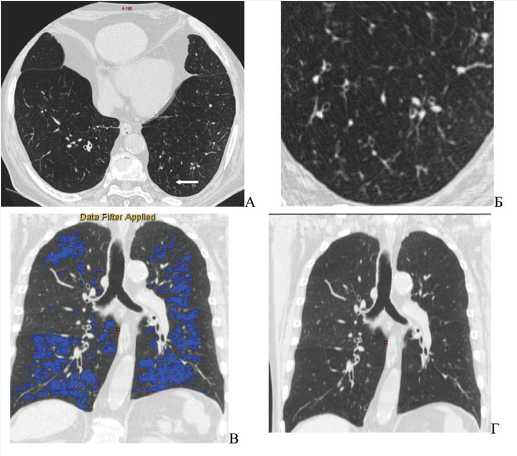
Рис. 1. КТ-картина легкого смешанного субтипа хронической обструктивной болезни легких у пациента с сочетанием обструктивной болезни легких и сахарного диабета второго типа. По результатам компьютерной томографии органов грудной полости визуализируется КТ-картина участков центриацинарной эмфиземы легких (А) в сочетании с изменениями в крупных бронхах (Б), мелких бронхах (Б), с формированием воздушных ловушек (стрелка) в момент завершенного выдоха (Г). При цифровой оценке объема пораженной ткани (В) определяется диффузное распределение выявленных изменений с 2,4% эмфизематозно измененной ткани в правом легком, 2,3% – эмфизематозно измененной ткани в левом легком
Примечание: КТ – компьютерная томография.
Fig. 1. CT scan of a mild mixed subtype of COPD in a patient with a combination of COPD and DM2. According to the results of computed tomography of the thoracic cavity organs, a CT picture of the areas of centriacinar emphysema of the lungs (A) is visualized in combination with changes in large bronchi (Б), small bronchi (Б), with the formation of air traps (arrow) at the time of completed exhalation (Г). When digitally assessing the volume of the affected tissue (B), the diffuse distribution of the detected changes is determined with 2.4% of emphysematous tissue in the right lung, 2.3% of emphysematous altered tissue in the left lung
Note: CT – computed tomography, DM2 - diabetes mellitus, COPD -chronic obstructive pulmonary disease.
Рис. 2. КТ-картина преимущественно тяжелого смешанного субтипа хронической обструктивной болезни легких у пациента с сочетанием хронической обструктивной болезни легких и сахарным диабетом второго типа. Визуализируется компьютерно-томографическая картина участков панлобулярной и центриацинарной эмфиземы легких в сочетании с изменениями в крупных бронхах (Г), мелких бронхах (Б), с формированием картины дерева в почках (стрелка) у пациента (А). При цифровой оценке объема пораженной ткани определяется диффузное распределение выявленных изменений с 14% эмфизематозно измененной ткани в правом легком, 16,8% эмфизематозно измененной ткани в левом легком (В). Обращает на себя внимание увеличение объема жировой клетчатки в переднем средостении Примечание: КТ – компьютерная томография.
Fig. 2. CT-scans of severe mixed subtype of COPD in a patient with a combination of COPD and DM2. A computed tomographic picture of areas of panlobular and centriacinar emphysema of the lungs is visualized in combination with changes in large bronchi (Г), small bronchi (Б), with the formation of a picture of a tree in the kidneys (arrow) in the patient (A). When digitally assessing the volume of the affected tissue, the diffuse distribution of the detected changes is determined with 14% of emphysematous altered tissue in the right lung, 16.8% of emphysematous altered tissue in the left lung (В). Increase in the volume of fatty tissue in the anterior mediastinum Note: CT – computed tomography, DM2 - diabetes mellitus, COPD -chronic obstructive pulmonary disease.
Как показано в таблице 4, уровень IL-33 у пациентов с сочетанием ХОБЛ и СД2 при наличии признаков панлобулярной эмфиземы был ниже по сравнению с подгруппой с присутствием панлобулярной эмфиземы. Уровень IL-6 у пациентов в группе с сочетанием ХОБЛ и СД2 был выше у пациентов без признаков парасептальной эмфиземы, что может являться отражением малой продолжительности ХОБЛ и преимущественным поражением элементов бронхиального дерева.
При проведении корреляционного анализа показателей ФВД и протяженности эмфизематозной перестройки легочной ткани у данной группы пациентов отмечаются значимые отрицательные корреляционные связи между скоростными показателями (ОФВ1, пиковой объемной скоростью выдоха (ПОСвыд), средней объемной скоростью форсированного выдоха (СОС25–75)) и достоверные положительные – с объемными показателями (общей емкостью легких (ОЕЛ), остаточным объемом легких (ООЛ), функциональной остаточной емкостью (ФОЕ)), что характеризует нарастание обструктивных изменений и гипе- ринфляции у пациентов с распространенной эмфиземой легких.
Рассмотрим теперь особенности данных клинического и лабораторного обследования пациентов с лучевым бронхитическим фенотипом. В соответствии с ранее описанной методикой лучевого обследования пациентов после оценки распространенности эмфизематозной перестройки легочной ткани проводилась оценка патологии мелких бронхов, а также оценивались клинические и лабораторные показатели. В группе пациентов с сочетанием ХОБЛ и СД2 и наличием КТ-признаков бронхиолита отмечались достоверно более низкие уровни лейкоцитов сыворотки крови, но значимо более высокое содержание лейкоцитов и альвеолярных макрофагов в мокроте, что отображало выраженность местного воспалительного ответа у пациентов с коморбидной патологией. При исследовании ФВД отмечалось достоверное повышение сопротивления дыхательных путей и снижение резервного объема выдоха, что может отражать большую выраженность обструктивных нарушений у пациентов с выраженным поражением элементов бронхиального дерева (р < 0,05).
Относительно такого лучевого признака, как воздушные ловушки с данными лабораторных исследований при анализе нами были получены статистически значимые результаты, отображенные в таблице 5.
Таблица 5. Частота появления лучевых признаков воздушных ловушек и результаты межгруппового сравнения данных лабораторных исследований
Table 5. Frequency of air trapping with laboratory data comparing
|
Показатели Indicators |
ХОБЛ + СД2 COPD + DM2 |
|
Эозинофилы, 109/л Eosinophils, 109/l |
|
|
Нет воздушных ловушек, n = 33 Absence of air-trapping, n = 33 |
0,17 (0,02–0,25) |
|
Есть воздушные ловушки, n = 14 Presence of air-trapping, n = 14 |
0,01 (0,00–0,15) |
|
Уровень значимости р p -value |
р = 0,045* |
|
IL-33 (lg) |
|
|
Нет воздушных ловушек, n = 11 Absence of air-trapping, n = 11 |
2,02 (0,51–3,34) |
|
Есть воздушные ловушки, n = 4 Presence of air-trapping, n = 4 |
2,22 (1,55–3,77) |
|
Уровень значимости р p -value |
р = 0,412 |
|
HbA1c, % |
|
|
Нет воздушных ловушек, n = 31 Absence of air-trapping, n = 31 |
6,2 (5,7–6,7) |
|
Есть воздушные ловушки, n = 14 Presence of air-trapping, n = 14 |
6,7 (6,3–7,2) |
|
Уровень значимости р p -value |
р = 0,020* |
|
С-реактивный белок, мг/л C-reactive protein, mg/l |
|
|
Нет воздушных ловушек, n = 32 Absence of air-trapping, n = 32 |
3,0 (1,5–6,5) |
|
Есть воздушные ловушки, n = 14 Presence of air-trapping, n = 14 |
10,0 (3,4–21,9) |
|
Уровень значимости р p -value |
р = 0,027* |
Примечание: ХОБЛ – обструктивной болезнью легких, указаны Me ( Q 1– Q 3), применен критерий Манна – Уитни. Статистически значимые различия отмечены знаком *.
Note: COPD – chronic obstructive pulmonary disease, Me ( Q 1– Q 3) are given, the Mann – Whitney test is applied. Statistically significant differences are marked with *.
Как следует из таблицы 5, у пациентов с сочетанием ХОБЛ и СД2 и наличием воздушных ловушек по данным компьютерной томографии органов грудной полости отмечаются достоверно более низкие уровни эозинофилов по сравнению с пациентами этой же группы, но без КТ-признаков воздушных ловушек. Данные результаты могут отражать меньшую роль эозинофилов в развитии гиперинфляции и эмфиземы легких. Кроме того, в группе с сочетанием ХОБЛ и СД2 различий в подгруппах с наличием и без воздушных ловушек различий по уровню IL-33 не отмечалось, что, возможно, указывает на вклад данного цитокина в развитие гиперинфляции легких у пациентов с ХОБЛ без диабета. Рассматривая взаимосвязь нарушений углеводного обмена с наличием морфологических изменений, были получены следующие резуль- таты: пациенты с ХОБЛ и СД2 и наличием воздушных ловушек характеризовались более высокими уровнями HbA1c. Возможно, данные результаты объясняются повышенным гликированием белков паренхимы легких и мелких дыхательных путей, что может приводить к нарушению эластичности тканей и формированию воздушных ловушек. Кроме того, у пациентов с сочетанием ХОБЛ и СД2, у которых по данным компьютерной томографии органов грудной полости выявлялись признаки воздушных ловушек, отмечались более высокие уровни С-реактив-ного белка (СРБ) по сравнению с пациентами без воздушных ловушек.
Таким образом, анализируя результаты, можно сделать следующие выводы:
-
1. У пациентов с сочетанием ХОБЛ и СД2 не встречался преимущественно эмфизематозный субтип, согласно классификации J.-H. Lee и соавт. При этом у пациентов с сочетанием ХОБЛ и СД2 превалировал легкий смешанный вариант ХОБЛ, для которого характерна эмфизематозная перестройка легочной ткани за счет центриацинарной эмфиземы. Протяженность эмфизематозной перестройки легочной ткани коррелировала с IFN-γ.
-
2. Среди пациентов с лучевым бронхитическим фенотипом ХОБЛ уровни IL-33 были выше, а также определялось достоверное повышение сопротивления дыхательных путей и снижение резервного объема выдоха, что является отражением обструктивных нарушений у пациентов с выраженным поражением элементов бронхиального дерева (р < 0,05).
-
3. У пациентов с сочетанием ХОБЛ и СД2 было выявлено наличие значимых связей между рядом КТ-признаков (наличие воздушных ловушек, бронхиолита) и результатами лабораторных исследований (количество эозинофилов в крови, количество лейкоцитов в крови и мокроте, количество макрофагов в мокроте, уровни IL-33, TNF-α, СРБ, соотношение IFN-γ/IL-4), что может отображать влияние разных патогенетических факторов воспаления на формирование структурных изменений в легочной ткани).
Заключение
Исходя из полученных данных, можно заключить, что для пациентов с сочетанием ХОБЛ и СД2 более характерно наличие бронхитического фенотипа ХОБЛ с отсутствием сливающихся и деструктивных форм эмфиземы легких. Широкая распространенность бронхитическо-го фенотипа ХОБЛ у пациентов с сопутствующим СД2 может быть обусловлена преимущественными изменениями в мелких дыхательных путях, развитием микроангиопатии [15], а также инфекционным фактором, поскольку пациенты с СД2 в целом более восприимчивы к инфекциям, включая респираторные. Также у пациентов с выраженными лучевыми проявлениями бронхиальной обструкции [13, 14], у которых по данным компьютерной томографии органов грудной полости выявлялись признаки воздушных ловушек, отмечались более высокие уровни СРБ по сравнению с пациентами без воздушных ловушек, что также подтверждается литературными данными [16].
Для этой группы пациентов характерно достоверное повышение сопротивления дыхательных путей и снижение резервного объема выдоха, отражающее выраженность обструктивных нарушений у пациентов с протяженным поражением элементов бронхиального дерева (р < 0,05). Имеются сведения о нарушении хемотаксической, фагоцитирующей, бактерицидной активности полиморфноядерных лейкоцитов при диабете [17], что способствует бактериальной инвазии и колонизации дистальных отделов дыхательных путей, что наиболее актуально для пациентов с преимущественно бронхитическим субтипом ХОБЛ.
Лучевые методы позволяют выявлять основной фенотип поражения легочной ткани у пациентов с СД2, что, в свою очередь, имеет значение для определения вариантов терапии коморбидных состояний, обусловленных системной воспалительной реакцией и присоединением воспалительных изменений, вызванных инфекцией дыхательных путей.
Список литературы Лучевые фенотипы хронической обструктивной болезни легких у пациентов с сахарным диабетом второго типа
- Тюрин И.Е. Визуализация хронической обструктивной болезни легких. Практическая пульмонология. 2014;2:40–46. [Tjurin I.E. Visualization of chronic obstructive pulmonary disease. Practical pulmonology. 2014;2:40–46. (In Russ.)]. URL: https://cyberleninka.ru/article/n/vizualizatsiya-hronicheskoy-obstruktivnoy-bolezni-legkih-1 (18.08.2023).
- Куколь Л.В., Арчакова Л.И., Молокова Е.Р. Основные фенотипы хронической обструктивной болезни легких. Медицинский альянс. 2019;1:38–45. [Kukol L.V., Archakova L.I., Molokova E.R. The main phenotypes of chronic obstructive pulmonary disease. Medical alliance. 2019;1:38–45. (In Russ.)]. URL: https://med-alyans.ru/index.php/Hahn/article/view/563/666 (18.08.2023).
- Лукина О.В., Амосов В.И., Золотницкая В.П., Бугаев С.С., Горбунков С.Д. Лучевая диагностика нарушений кровообращения у больных хронической обструктивной болезнью легких различных фенотипов. Лучевая диагностика и терапия. 2013;4(4):88–94. [Lukina O.V. Amosov V.I., Zolotnickaja V.P., Bugaev S.S., Gorbunkov S.D. Radiation diagnosis of circulatory disorders in patients with chronic obstructive pulmonary disease of various phenotypes. Diagnostic radiology and radiotherapy. 2013;4(4):88–94. (In Russ.)].
- Lee J.-H., Lee Y.K., Kim E.-K., Kim T.-H., Huh J.W., Kim W.J. et al. Responses to inhaled long-acting beta-agonist and corticosteroid according to COPD subtype. Respiratory medicine. 2010;104(4):542–549. DOI: 10.1016/j.rmed.2009.10.024.
- Kauczor H.U., Wielpütz M.O., Owsijewitsch M., Ley-Zaporozhan J. Computed tomographic imaging of the airways in COPD and asthma. J. Thorac. Imaging. 2011;26(4):290–300. DOI: 10.1097/RTI.0b013e3182277113.
- Camiciottoli G., Bigazzi F., Magni C., Bonti V., Diciotti S., Bartolucci M. et al. Prevalence of comorbidities according to predominant phenotype and severity of chronic obstructive pulmonary disease. Int. J. Chron. Obstruct. Pulmon. Dis. 2016;11:2229–2236. DOI: 10.2147/COPD.S111724.
- Katsiki N., Steiropoulos P., Papanas N., Mikhailidis D.P. Diabetes mellitus and chronic obstructive pulmonary disease: an overview. Exp. Clin. Endocrinol. Diabetes. 2021;129(10):699–704. DOI: 10.1055/a-1038-3883.
- Gläser S., Krüger S., Merkel M., Bramlage P., Herth F.J. Chronic obstructive pulmonary disease and diabetes mellitus: a systematic review of the literature. Respiration. 2015;89(3):253–264. DOI: 10.1159/000369863.
- Pitocco D., Fuso L., Conte E.G., Zaccardi F., Condoluci C., Scavone G. et al. The diabetic lung – A new target organ? Rev. Diabet Stud. 2012;9(1):23–35. DOI: 10.1900/RDS.2012.9.23.
- Peng Y., Zhong G.-C., Wang L., Guan L., Wang A., Hu K. et al. Chronic obstructive pulmonary disease, lung function and risk of type 2 diabetes: a systematic review and meta-analysis of cohort studies. BMC Pulm. Med. 2020;20(1):137. DOI: 10.1186/s12890-020-1178-y.
- Hersh C.P. Make B.J., Lynch D.A., Barr R.G., Bowler R.P., Calverley P.M.A. et al. Non-emphysematous chronic obstructive pulmonary disease is associated with diabetes mellitus. BMC Pulmonary Medicine. 2014;14:164. DOI: 10.1186/1471-2466-14-164.
- Чучалин А.Г., Авдеев С.Н., Айсанов З.Р., Белевский А.С., Лещенко И.В., Овчаренко С.И. и др. Хроническая обструктивная болезнь легких: федеральные клинические рекомендации по диагностике и лечению. Пульмонология. 2022;32(3):356–392. [Chuchalin A.G., Avdeev S.N., Aisanov Z.R., Belevskiy A.S., Leshchenko I.V., Ovcharenko S.I. et al. Federal guidelines on diagnosis and treatment of chronic obstructive pulmonary disease. Pulmonology. 2022;32(3):356–392. (In Russ.)]. DOI: 10.18093/0869-0189-2022-32-3-356-392.
- Lynch D.A., Austin J.H., Hogg J.C., Grenier P.A., Kauczor H.U., Bankier A.A. et al. CT-definable subtypes of chronic obstructive pulmonary disease: A statement of the Fleischner Society. Radiology. 2015;277(1):192–205. DOI: 10.1148/radiol.2015141579.
- Rogliani Р., Lucà G., Lauro D. Chronic obstructive pulmonary disease and diabetes. COPD Res. Pract. 2015;1:3. DOI: 10.1186/s40749-015-0005-y.
- Шойхет Я.Н., Коновалов В.К., Савельев С.Г., Титова Е.А., Дуков Л.Г., Гервальт В.Я. и др. Компьютернотомографические и гистологические изменения в легких при сахарном диабете. Бюллетень СО РАМН. 2008;130(2):63–67. [Shoikchet Y.N., Konovalov V.K., Saveljev S.G., Titova E.A., Dukov L.G., Gervalt V.Y. et al. Computed tomographic and histologic changes in lung in diabetes mellitus. Bjulleten SO RAMN. 2008;130(2):63–67. (In Russ.)]. URL: https://radiomed.ru/sites/default/files/59248635.pdf (18.08.2023).
- Katsogiannos P., Kamble P.G., Pereira M.J., Sundbom M., Carlsson P.-O., Eriksson J.W. et al. Changes in circulating cytokines and adipokines after RYGB in patients with and without type 2 diabetes. Obesity (Silver Spring). 2021;29(3):535–542. DOI: 10.1002/oby.23093.
- Suganami T., Tanimoto-Koyama K., Nishida J., Itoh M., Yuan X., Mizuarai S. et al. Role of the Toll-like receptor 4/NF-kappaB pathway in saturated fatty acid-induced inflammatory changes in the interaction between adipocytes and macrophages. Arterioscler. Thromb. Vasc. Biol. 2007:27(1):84–91. DOI: 10.1161/01.ATV.0000251608.09329.9a.


