Магнитно-резонансная и компьютерная томография у пациентов с нарушениями ритма после кардиохирургических вмешательств
Автор: Шляппо М.А., Александрова С.А., Сопов О.В., Голухова Е.З.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Обзоры
Статья в выпуске: 3, 2024 года.
Бесплатный доступ
Прогресс лечения аритмий связан с разработкой и внедрением в клиническую медицину ряда электрофизиологических методов, позволяющих с высокой степенью достоверности определить и локализовать формирование и проведение электрического возбуждения. В то же время увеличение числа инвазивных процедур может приводить к росту осложнений, связанных с проводимыми вмешательствами, что в свою очередь требует от специалистов лучевой диагностики понимания основных этапов техники проводимых вмешательств, и, соответственно, механизмов развития возможных осложнений и их локализации. Цель статьи - представить современные данные исследований по использованию возможностей компьютерной и магнитно-резонансной томографии в диагностике осложнений при интервенционном и хирургическом лечении нарушений ритма сердца.
Лучевая диагностика, кт сердца, мрт сердца, нарушения ритма сердца, фибрилляция предсердий, желудочковые экстрасистолы, аблация, криобаллонная аблация (кба), радиочастотная аблация (рча), осложнения, стеноз легочной вены, свищ, атриоэзофагеальный свищ, гематома, имплантированные устройства
Короткий адрес: https://sciup.org/143183522
IDR: 143183522 | УДК: 616-073.756.8 | DOI: 10.38109/2225-1685-2024-3-66-73
Текст обзорной статьи Магнитно-резонансная и компьютерная томография у пациентов с нарушениями ритма после кардиохирургических вмешательств
Данная статья распространяется на условиях «открытого доступа», в соответствии с лицензией CC BY-NC-SA 4.0 («Attribution-NonCommercial-ShareAlike»/ «Атрибуция-Не-коммерчески-СохранениеУсловий» 4.0), которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Чтобы ознакомиться с полными условиями данной лицензии на русском языке, посетите сайт: by-nc-sa/4.0/
This is an open access article distributed under the terms of the Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0) License , which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
Нарушения ритма сердца занимают значимое место в структуре сердечно-сосудистых заболеваний, являясь причиной увеличения риска смертности. Прогресс лечения аритмий связан с разработкой и внедрением в клиническую медицину ряда электрофизиологических методов, позволяющих с высокой степенью достоверности определить и локализовать формирование и проведение электрического возбуждения. Увеличение числа инвазивных процедур приводит к росту осложнений, связанных с проводимыми вмешательствами, что в свою очередь требует от специалистов лучевой диагностики понимания развития возможных осложнений и их локализации. Цель статьи – представить современные данные исследований по использованию возможностей компьютерной (КТ) и магнитно-резонансной томографии (МРТ) в диагностике осложнений при интервенционном и хирургическом лечении нарушений ритма сердца. Методы компьютерной и магнитно-резонансной диагностики являются неотъемлемой частью кардиологических исследований у пациентов с патологией сердечно-сосудистой системы.
Как известно, существенным преимущественном КТ сердца с контрастным усилением является пространственное разрешение, позволяющее определить синтопию и рассмотреть точечные структуры. Преимуществом кардио-МРТ с контрастным усилением является визуализация тканевых характеристик с оценкой фиброзных изменений и наличия отёка миокарда.
КТ И МРТ ВИЗУАЛИЗАЦИЯ ВОЗМОЖНЫХ ОСЛОЖНЕНИЙПРИ ИНТЕРВЕНЦИОННОМ ЛЕЧЕНИИ ФП
В соответствии с последними рекомендациями по лечению фибрилляции предсердий, наиболее распространенной аритмии среди населения, основным методом катетерного лечения является изоляция легочных вен (ЛВ). В настоящее время применяется криобаллонная (КБА), обладающая замораживающим эффектом, и радиочастотная, обладающая термическим эффектом, аблация (РЧА). Крупными рандомизированными исследованиями отмечена сопоставимость по эффективности и безопасности точечной РЧА и КБА [1]. РЧА используется для лечения различных аритмий путем термического повреждения участков тканей, ответственных за возникновение и поддержание нарушений ритма сердца. Чтобы обеспечить постоянную электрическую блокаду, РЧА должна создать непрерывную линию трансмуральных поражений.
Несмотря на обширные успехи и клинические показатели РЧА, необходима послеоперационная оценка состояния миокарда и сердечно-сосудистой системы в целом в связи с тем, что некоторые осложнения имеют скрытую и не острую клиническую картину. По данным крупных мировых центров частота осложнений у пациентов, перенесшие радиочастотную аблацию, составляет не более 5% [2]. В исследовании Yang Е с соавт. серьезные осложнения встречались в 3,9% случаев и наиболее частым являлись гематома в месте доступа (1,3%), тампонада сердца (1,1%) и острые нарушения мозгового кровообращения/ транзиторные ишемические атаки (0,9%) [3]. Редкое, но довольно серьезное осложнение РЧА, которое как правило требует открытого кардиохирургического вмешательства, является формирование интрамуральной гематомы левого предсердия (ЛП) [4]. Интрамуральные гематомы предсердий представляет собой заполненное кровью образование между эндокардом и миокардом или эпикардом не сообщающееся с истинной полостью ЛП. В основе развития этого осложнения лежит диссекция стенки ЛП, а анатомическая близость огибающей артерии и коронарного синуса к задней стенке левого предсердия создают предпосылки для развития такого осложнения при малоинвазивных вмешательствах
-
[5] . Интрамуральные гематомы могут протекать как бессимптомно и выявляться случайно, так и могут быть причиной развития острой левожелудочковой недостаточности, с развитием отёка легких, артериальной гипотонии, нарушения ритма и проводимости. Гематомы больших размеров могут приводить к фатальным осложнениям за счет компрессии легочных вен и/ или обструкции просвета митрального клапана. Для подтверждения наличия гематомы необходимы визуализирующие методики (рис. 1).
При используемых в настоящее время методах аблации частота одного из тяжелых осложнений – стенозов легочных вен (более 70%) составляет примерно 0,5-2,0% [6]. КТ и МРТ являются предпочтительными методами оценки этого осложнения и степени стеноза: легкой (менее 50%), средней (50-70%) и тяжелой (более 70%) [7]. Стенозы легочных вен менее 50% встречаются достаточно часто, и не являются клинически значимыми в долгосрочной перспективе. Изменения в размерах легочных вен формируются, как правило, через 4-6 месяцев после аблации. Клиническая картина выраженного стеноза или окклюзии легочных вен у многих пациентов похожа на симптомы тромбоэмболии легочной артерии (ТЭЛА) [8], однако КТ-картина при этих заболеваниях различна, что определяет их дифференциальную диагностику [9]. КТ-ангиографию часто используют для диагностики приобретенного стеноза легочных вен, ориентируясь по измерениям устьев легочных вен на основании мультипланарных изображений. Стеноз легочной вены следует рассматривать как осложнение при уменьшении размеров вены по сравнению со значениями, полученными до оперативного вмешательства (рис. 2).
Атриоэзофагеальный свищ является редким осложнением абляции с зарегистрированной частотой до 0,1-0,25% [10]. Поскольку пищевод проходит вдоль задней стенки левого предсердия, существует риск его повреждения во время процедуры абляции. Процесс начинается с термического и ишемического повреждения пищевода в момент процедуры, в течение следующих нескольких дней из-за глотания и рефлюкса повреждение прогрессирует до перфорации и образования свища. Первые симптомы могут проявляться спустя несколько недель после проведенной аблации. Наиболее распространенными проявлениями фистулы являются лихорадка, озноб, инсульт (воздушная или септическая эмболия), септический шок или внезапная смерть. Компьютерные методы визуализации (КТ или МРТ грудной клетки) являются лучшими диагностическими методами для выявления свища. В то время как эндоскопическое исследование таких пациентов может привести к клиническому ухудшению. Чрезвычайно высока смертность при консервативном лечении, а быстрое хирургическое вмешательство дает наилучшие шансы на выживание [11].
КТ И МРТ ВИЗУАЛИЗАЦИЯ ВОЗМОЖНЫХ ОСЛОЖНЕНИЙПРИ ИНТЕРВЕНЦИОННОМ ЛЕЧЕНИИ ЖЭ
Адекватность применения энергии в современной электрофизиологии в основном измеряется электрическими конечными точками во время процедуры (индуцируемость аритмии, локальный блок распространения или исчезновение электрического сигнала). Однако термическая травма приводит к неоднородному поражению, а частичное или полное восстановление повреждения является частым источником рецидивов после абляции сложного субстрата [12]. Практические методы визуализации, такие как МРТ сердца, могут обеспечить возможность интра-или перипроцедурной обратной связи с оператором, указывая на достижение целей процедуры и степени повреждения необходимых участков миокарда сердца.
Магнитно-резонансное исследование сердца позволяет выявлять острое радиочастотное поражение, которое будет прояв- ляться отёком стенки, феноменом нарушения перфузии и субэндокардиальным накоплением (рис. 3, 4).
Для определения зон отёка необходимы Т2 взвешенные изображения, на которых отёк проявляется повышенным МР-сигналом. Практически для подавления сигнала крови, окружающей эпикардиальной и средостенной жировой клетчатки используется метод кратковременного восстановления инверсии (STIR)
-
[13] . Необходимо отметить, что современное количественное параметрическое Т2-картирование позволяет измерять время релаксации Т2 независимо от степени отёка тканей.
Радиочастотно-индуцированные неусиленные темные очаги напоминают феномен нарушения перфузии («no-reflow») при остром инфаркте миокарда и постоянно наблюдаются даже в зонах предыдущих рубцовых изменений. Рядом авторов описа-
A
C
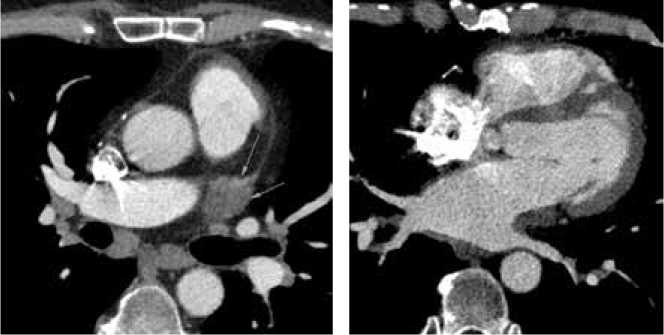
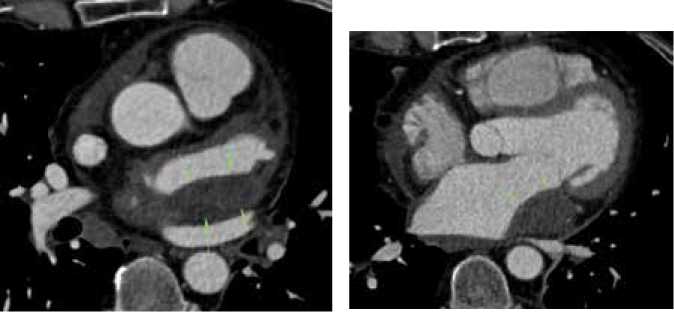
Рисунок 1. КТ-ангиография интрамуральной гематомы ЛП после радиочастотной аблации по поводу эктопической предсердной тахиаритмии.
Мужчина с аритмическим анамнезом в течение 2-х лет и антиаритмической терапией без эффекта, поступил в клинику для проведения РЧА в связи с ухудшением состояния. Пациенту проведена операция ЭФИ, РЧА эктопической предсердной тахикардии из устья коронарного синуса. В послеоперационном периоде возникли боли в грудной клетке, затруднение дыхания. При проведении МСКТ-АГ грудной клетки выявлено образование (гематома) в области латеральной стенки левого предсердия и ушка ЛП (A. поперечный срез на уровне полости ЛП после РЧА, стрелками показано образование в стенке ЛП и визуализируется уменьшение диаметра левой нижней легочной вены; B – поперечный срез на уровне ушка ЛП после РЧА, стрелками показано образование в стенке ЛП). При динамическом наблюдении в течение месяца по ЭхоКГ данное образование не уменьшалось в размерах, а в течение последней недели отмечалось нарастание боли в области грудной клетки, плохо купирующийся противовоспалительными и обезболивающими препаратами, повышение температуры тела до 37,4 гр., сухой кашель, выраженная слабость, недомогание, снижение толерантности к нагрузкам. На основании данных анамнеза, результатов КТ и динамики развития симптоматики было принято решение выполнить оперативное вмешательство в условиях искусственного кровообращения для ревизии и удаления тромботического образования из левого предсердия, интраоперационно вмешательство было дополнено перевязкой ушка левого предсердия, линейной аблацией коронарного синуса и изоляцией ЛВ. Спустя несколько месяцев выполнена повторная МСКТ АГ органов грудной клетка (C. – поперечный срез на уровне полости ЛП после открытой операции, стрелками показано остаточное образование в стенке ЛП; D. – поперечный срез на уровне ушка ЛП после открытой операции, стрелкой показано ушитое ушко ЛП), образование в стенке ЛП отсутствует.
Figure 1. CT-angiography of an intramural LА hematoma after radiofrequency ablation for ectopic atrial tachyarrhythmia.
A man with an arrhythmic history for 2 years and antiarrhythmic therapy without effect, was admitted to the clinic for RFA due to deterioration of his condition. The patient underwent surgery for EFS, RFA ectopic atrial tachycardia from the mouth of the coronary sinus. In the postoperative period, chest pain and difficulty breathing occurred. During chest CT-angiography, a formation (hematoma) was revealed in the area of the lateral wall of the left atrium and the LA auricle (A. a cross section at the level of the LA cavity after RF, arrows show formation in the LA wall and a decrease in the diameter of the left inferior pulmonary vein is visualized; B – a cross section at the level of the LA auricle after RFA, arrows show formation in the LA wall). During dynamic observation during a month by echocardiography, this formation did not decrease in size, and during the last week there was an increase in chest pain, poorly relieved by anti-inflammatory and painkillers, an increase in body temperature to 37.4 g, dry cough, pronounced weakness, malaise, decreased exercise tolerance. Based on the anamnesis data, CT results and dynamics of the development of symptoms, it was decided to perform surgery in conditions of artificial circulation to revise and remove thrombotic formation from the left atrium, intraoperative intervention was supplemented by ligation of the left atrium auricle, linear ablation of the coronary sinus and LV isolation. A few months later, repeated chest CT-angiography was performed (С. – a cross-section at the level of the LA cavity after open surgery, arrows show residual formation in the LA wall; D. – a cross section at the level of the LA auricle after an open operation, the arrow shows the bruised LA auricle), there is no formation in the LA wall.
но, что размер и глубина острого радиочастотного повреждения линейно коррелирует с падением импеданса и мощностью радиочастотного излучения, и обратно пропорционально успешности процедуры [14].
Примечательно, что по литературным данным, РЧА-индуцированные неишемические поражения были значительно глубже у пациентов, у которых результат процедуры достигнут не был. В отличие от абляции фибрилляции предсердий, где транс-муральность поражений имеет решающее значение для долгосрочного успеха, при катетeрной абляции модификация арит-могенного субстрата посредством правильно спроектированных линий и целенаправленного устранения поздних потенциалов обычно имеет большее значение, чем глубина поражений. С другой стороны, такое наблюдение можно объяснить стремлением оператора повысить эффективность.
Необходимо обратить внимание, что благодаря современным достижениям кардио-МРТ может обеспечить визуализацию анатомии, субстрата аритмии и аблационного поражения при проведении электрофизиологических процедур в режиме реального времени в отсутствии ионизирующего излучения [15, 16].
Эпикардиальный доступ для абляции желудочковых и наджелудочковых аритмий обычно выполняется посредством «сухой» пункции под мечевидным отростком и часто комбинируется с эндокардиальной катетерной абляцией для повышения эффективности. Однако такой доступ связан с большей частотой осложнений, по данным различных авторов, до 13,7%, к которым относятся повреждение миокарда или эпикардиальных артерий и вен, пункция ПЖ, внутрибрюшное кровотечение из-за повреждения печени, свищи перикарда. Перикардиальное кровотечение и тампонада, наиболее частые осложнения, подтверждаемые по данным эхокардиографии. КТ с контрастным усилением позволяет в неясных случаях выявить активный участок кровотечения [17].
КТ И МРТ ВИЗУАЛИЗАЦИЯ ОСЛОЖНЕНИЙ ИМПЛАНТАЦИИ АКТИВНЫХ КАРДИАЛЬНЫХ УСТРОЙСТВ
Сохраняется небольшой процент осложнений после имплантации активных кардиальных устройств. По этиологическим факторам выделяют медико-биологические и технические осложнения [18]. К первым принято относить гемоперикард, венозный тромбоз, образование гематомы в ложе аппарата, стимуляция ложа аппарата, пролежень аппарата, пейсмекерный синдром, инфекционные осложнения и др. К техническим относятся факторы, обусловленные состоянием электрода и его взаимодействием с имплантированным устройством – нарушение контакта между стимулятором и электродом, надлом или перелом электрода, дислокация электрода, дислокация аппарата и др. К наиболее грозным осложнениям относят надлом и, особенно, перелом электрода, его распространенность составляет от 0,1 до 4,2% [19]. Обычно причинами перелома электрода являются выраженная физическая нагрузка, травмы грудной клетки, приводящие, к уменьшению расстояния между ключицей и ребром и сдавлению электрода. Именно поэтому наиболее частое место перелома электрода – промежуток между ключицей и первым ребром.
Неудовлетворительная фиксация электрода в соединительной части устройства и к окружающим тканям, дислокация электрода в другую сердечную полость или полую вену или наличие избыточных петель также относят к техническим осложнениям, которые могут проявляться преходящим или постоянным нарушением стимуляции по данным электрокардиографии. Традиционное рентгенологическое обследование органов грудной клетки дает полноценную информацию о положении и целостности элементов имплантированных систем [20].
Неоптимальная фиксация электродов и электрокардиостимулятора может стать причиной неисправности имплантированного устройства и дислокации электродов, в связи с этим выделяют ряд синдромов – Твиддлера, Рила и Ратчета [21; 22]. Синдром Твиддлера связан с вращением устройства в его ложе, что приводит к многократным поворотам электродов вдоль их продольной оси. Это осложнение может возникать в течение года после имплантации, считается серьезнее, чем синдром Рила из-за возможной поломки и смещения электродов. Вращение устройства в его ложе и вследствие этого поворот электродов вдоль поперечной оси, из-за чего они напоминают пружину, называют синдромом Рила. Он развивается раньше – в течение месяца после имплантации. Указанные осложнения могут возникать в случае большого ложа устройства и неадекватной фиксации аппарата в нем, а также у пациентов с патологическим ожирением или пациентов с прогрессирующими когнитивными расстройствами [23]. Синдром Ратчета заключается в ином механизме – вытягивании электрода, без намотки на аппарат, из-за постепенного смещения электродов с их фиксирующих защит [22].
Электроды имплантированных устройств могут перфорировать стенку камеры сердца, это следует учитывать, если конец электрода проецируется в пределах 3мм от внешней стенки сердца [21]. Мультипланарные реконструкции при КТ исследованиях позволяют достоверно оценить перфорацию миокарда (рис. 5).
Острые перфорации миокарда, как правило, протекают с яркой клинической симптоматикой, в то время как поздние перфорации могут протекать бессимптомно и обнаруживаться только
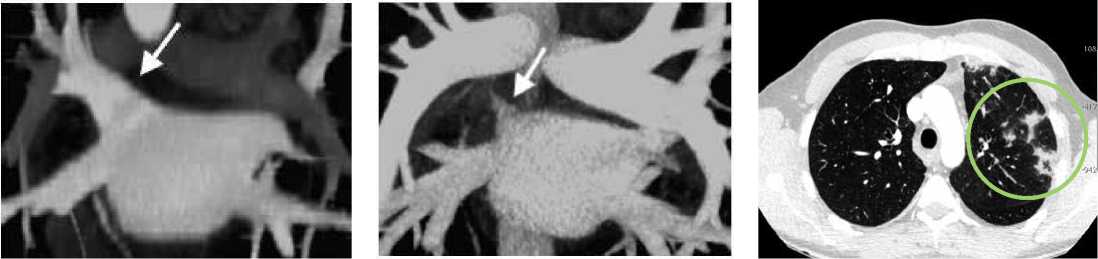
Рисунок 2. МСКТ левого предсердия. Мультипланарная реконструкция:
A. До проведения аблации, устье легочной вены четко определяется. B. После проведения РЧА, окклюзия устья легочной вены. C. Легочное окно, увеличенная плотность легочной ткани и интерстициальный отек, обусловленный венозным застоем – «венозные инфаркты» (красный круг).
Picture 2. Left atrium CT. Multiplanar reconstruction:
-
A. Before ablation, the mouth of the pulmonary vein is clearly defined. B. After RFA, occlusion of the mouth of the pulmonary vein. C. Pulmonary window, increased density of lung tissue and interstitial edema caused by venous congestion – “venous infarctions” (red circle).
при плановой оценке имплантированного устройства [24]. По данным аутопсии встречаемость перфорации при бессимптомном течении достигала 27% [25].
Возможны различные осложнения, специфичные только для этапа имплантации левожелудочкового электрода: диссекция или перфорация коронарных вен, дислокация и неадекватная стимуляция левого желудочка, в некоторых случаях стимуляция диафрагмы [26]. В связи с чем не стоит забывать о необходимости дооперационного обследования пациентов, включающего МРТ и КТ с контрастированием для определения синтопии и
A
B
C
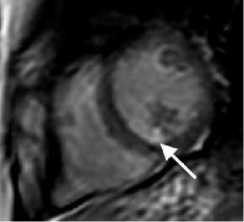
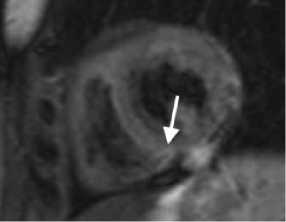
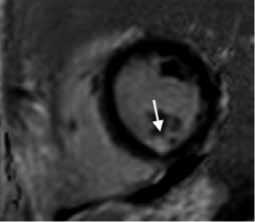
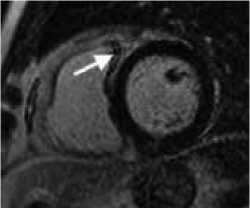
Рисунок 3. МРТ сердца с контрастом у пациента после РЧА ЛЖ:
-
А. Короткая ось ЛЖ на уровне средней трети, последовательность STIR, отмечается локальная зона отёка миокарда. B. Короткая ось ЛЖ на уровне средней трети, последовательность PSIR. C. Короткая ось ЛЖ на уровне средней трети, последовательность 3D IR-TFE. Отмечается субэндокардиальное накопление КВ по заднему сегменту ЛЖ с интрамиокардиальным распространением по заднеперегородочному сегменту ЛЖ (ближе к ПЖ) на базальном и среднем уровнях.
-
Figure 3. Cardiac MRI with contrast in a patient after RFA LV:
-
A. short axis of the LV at the level of the middle third, STIR sequence, a local area of myocardial edema is noted. B. short axis of the LV at the level of the middle third, sequence PSIR. B. LV short axis at the level of the middle third, 3D IR-TFE. There is a subendocardial contrast agent enhancement in the posterior segment of the LV with intramyocardial distribution along the posteroseptal segment of the LV (closer to the RV) at the basal and middle levels.
C
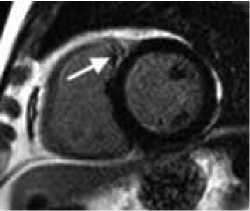
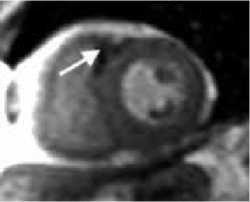
Рисунок 4. МРТ сердца с контрастным усилением у пациента У. 65лет, поступившего в нашу клинику с жалобами на общую слабость, преимущественно в послеобеденный период дня, головокружение.
Считает себя больным в течении 7-8лет, за два года до поступления был обнаружен стеноз правой коронарной артерии с одномоментным стентированием этой артерии. При обследовании в центре на Холтеровском мониторировании выявлено более 25 тыс. желудочковых экстрасистол, 3х морфологий (двунаправленные комплексы), парных 1906, групповых 129, отклонения сегмента ST не зафиксированы. На Эхо-КГ сократительная функция миокарда ЛЖ удовлетворительная, незначительная дисфункция митрального и трикуспидального клапанов. При проведении коронарографии значимых сужений коронарных артерий не выявлено, ранее имплантированный стент проходим, без признаков рестенозирования. Выполнена операция: радиочастотная аблация очагов эктопических желудочковых аритмий правого желудочка. При ЭФИ проведено картирование, и наиболее ранняя зона регистрируется в выводном отделе ПЖ. Ранние точки в ЛЖ и ВОЛЖ не найдены. В ранней зоне выполнены 5 орошаемых РЧ – воздействий (мощность 30 Вт, орошение 20 мл/миг) общей продолжительностью 5 минут. При этом наблюдается уменьшение числа ЖЭ. После операции на Холтеровском мониторировании сохраняется желудочковая эктопическая активность в виде 15330 за сутки, двух морфологий. Выполнено МРТ сердца через 4 дня после аблации, по данным которого: A. короткая ось ЛЖ на базальном уровне, T1 динамическая TrueFISP последовательность с контрастированием; стрелкой показано сниженный МР-сигнал, соответствующей геморрагическому пропитыванию. B. короткая ось ЛЖ на базальном уровне, последовательность PSIR раннее постконтарастная серия, стрелкой показан субэндокардиальный участок артефакт магнитной восприимчивости, характерный для крови, окруженной участком повышенного МР-сигнала. C. короткая ось ЛЖ на базальном уровне, последовательность PSIR поздняя постконтрастная серия, стрелкой показан участок выпадения МР-сигнала, окруженный зоной повышенного МР-сигнала.
Picture 4. Contrast-enhanced MRI of the heart in patient U., 65 years old, who was admitted to our clinic with complaints of general weakness, mainly in the afternoon, and dizziness.
He considers himself ill for 7-8 years; two years before admission, stenosis of the right coronary artery was discovered with immediate stenting of this artery. During the examination at the center, Holter monitoring revealed more than 25 thousand ventricular extrasystoles, 3 morphologies (bidirectional complexes), paired 1906, group 129, no ST segment deviations were recorded. On Echo, the contractile function of the LV myocardium is satisfactory, with minor dysfunction of the mitral and tricuspid valves. Coronary angiography revealed no significant narrowing of the coronary arteries; the previously implanted stent was passable, without signs of restenosis. An operation was performed: radiofrequency ablation of foci of ectopic ventricular arrhythmias of the right ventricle. During EPI, mapping was carried out, and the earliest zone was recorded in the outflow tract of the RV. Early points in the LV and LVOT were not found. In the early zone, 5 irrigated RF impacts were performed (power 30 W, irrigation 20 ml/mg) with a total duration of 5 minutes. At the same time, a decrease in the number of PVCs is observed. After the operation, Holter monitoring preserves ventricular ectopic activity in the form of 15330 per day, two morphologies. Cardiac MRI was performed 4 days after ablation, according to which: A. short axis of the LV at the basal level, T1 dynamic TrueFISP sequence with contrast; The arrow indicates a decreased MR signal, consistent with hemorrhagic permeation. B. short axis of the LV at the basal level, PSIR sequence early post-contrast series, the arrow shows the subendocardial area – an artifact of magnetic susceptibility, characteristic of blood surrounded by an area of increased MR signal. B. LV short axis at the basal level, PSIR sequence late post-contrast series, the arrow shows the area of MR signal loss surrounded by an area of increased MR signal.
планирования хода процедуры. Нередкими находками являются добавочные леворасположенные верхние полые вены или единственная леворасположенная верхняя полая вена, что приводит к изменению тактики оперативного лечения пациента, включающее как увеличение времени процедуры, так и изменение доступа для имплантации устройств. КТ венозного русла сердца позволяет визуализировать анатомию венозного русла сердца и определить подходящую по расположению и диаметру вену [27]. Установка активного имплантированного устройства в этом случае затруднительно не только тем, что приходится переходить направо в ходе операции, но и тем, что коронарный синус при данной патологии, как правило, значительно дилатирован, что затрудняет его адекватную окклюзию при контрастировании и, соответственно, поиск целевой вены для установки электрода [28].
Отдельно хочется обратить внимание на необходимость предоперационной оценки коронарного венозного русла для оценки и выбора наиболее подходящей коронарной вены перед имплантацией электрода. А также во избежание фатальных последний при редких врожденных патологиях, таких как отсутствие или стеноз коронарного синуса [27], что может привести к интраопе-рацонной перфорации с развитием осложнений во время каню- ляции венечного синуса. Программа трёхмерного сканирования сердца на магнитно-резонансном томографе позволяет получить изображения венозного коронарного русла сердца надлежащего качества, достаточного для достоверной оценки анатомии [29]. Проведение программы после контрастного усиления даёт более полную оценку анатомии и расположения коронарного синуса и главных коронарных вен, позволяя рассчитать их размеры и на дооперационном этапе определить подходящую для имплантации электрода вену [30]. Возможности современных рабочий станций постпроцессорной обработки позволяют сопоставлять зоны фиброза с анатомией коронарных вен, тем самым выбирая лучшую вену по расположению и соотношению к фиброзно-измененному миокарду [17].
ЗАКЛЮЧЕНИЕ
Пространственные и тканевые возможности томографических методов визуализации позволяют выявить ранние и отсроченные осложнения антиаритмического лечения. Понимание процессов возникновения осложнения облегчает диагностический алгоритм и позволяет достоверно выявить патологию и в ряде случаев своевременно предупредить развитие жизнеугрожающих состояний при возникновении осложнений.
A
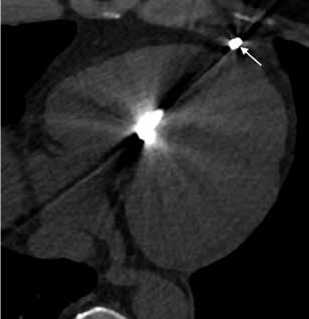
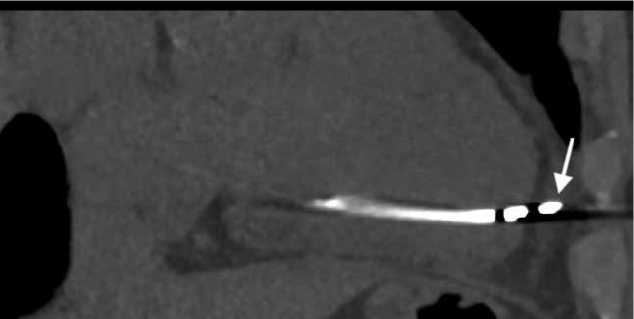
Рисунок 5. КТ сердца, перфорация миокарда электродом:
A. аксиальная плоскость. B. Мультипланарная реконструкция (МПР).
Picture 5. Cardiac CT, perforation of the myocardium with an electrode:
A. Axial slice. B. Multiplanar reconstruction (MPR).
Список литературы Магнитно-резонансная и компьютерная томография у пациентов с нарушениями ритма после кардиохирургических вмешательств
- Артюхина ЕА, Кузнецов НМ, Таймасова ИА, Ревишвили АШ. Первый опыт применения криобаллонного катетера POLARx для изоляции легочных вен у пациентов с фибрилляцией предсердий: серия клинических случаев. Вестник аритмологии. 2022;29(4):47-52. https://doi.org/10.35336/VA-2022-4-07
- G.S. Shroff, M.S. Guirguis, E.C. Ferguson, S.A. Oldham, B.K. Kantharia. CT imaging of complications of catheter ablation for atrial fibrillation. Clin Radiol. 2014;69(1):96-102. https://doi.org/10.1016/j.crad.2013.08.018
- E. Yang, E.G. Ipek, M. Balouch, Y. Mints, J. Chrispin, J.E. Marine, R.D. Berger, H. Ashikaga, J. Rickard, H. Calkins, S. Nazarian, D.D. Spragg. Factors impacting complication rates for catheter ablation of atrial fibrillation from 2003 to 2015. Europace. 2017;19(2):241-249. https://doi.org/10.1093/europace/euw178
- Сухинина Т.С., Шахнович Р.М., Певзнер Д.В., Веселова Т.Н., Жукова Н.С., Меркулова И.Н., Шитов В.Н., Стукалова О.В., Миронов В.М., Терновой С.К., Староверов И.И. Случай развития интрамуральной гематомы левого предсердия после проведения чрескожного коронарного вмешательства. Атеротромбоз. 2019;(2):80-92. https://doi.org/10.21518/2307-1109-2019-2-80-92
- S. Fukuhara, K.R. Dimitrova, Ch.M. Geller, D.M. Hoffman, R.F. Tranbaugh. Left atrial dissection: an almost unknown entity. Interactive Cardio Vascular and Thoracic Surgery. 2015;20(1):96-100. https://doi.org/10.1093/icvts/ivu317
- Бокерия О.Л., Меликулов А.Х. Возможные осложнения катетерной аблации различных видов тахиаритмий. Анналы аритмологии. 2011;8(3):14-20.
- Kolandaivelu. Role of cardiac imaging (CT/MRI) before and after RF catheter ablation in patients with atrial fibrillation. J Atr Fibrillation. 2012;5(2):523. https://doi.org/10.4022/jafib.523
- 7. J.G. Ravenel, H.P. McAdams. Pulmonary venous infarction after radiofrequency ablation for atrial fibrillation. Am. J. Roentgenol. 2002;178:664-6. https://doi.org/10.2214/ajr.178.3.1780664
- Бокерия Л.А., Макаренко В.Н., Александрова С.А., Шляппо М.А. Состояние паренхимы легких у пациентов с фибрилляцией предсердий. Компьютерно-томографические находки при осложненном течении. Бюллетень НЦССХ им. А.Н. Бакулева РАМН Сердечно-сосудистые заболевания. 2014;15(6):51-56.
- V. Paul, R. Meenakshisundaram, A.R. Jamal, T.Bin Farooq. Left atrio-oesophageal fistula after atrial fibrillation ablation. BMJ Case Rep. 2020;13(12):e232508. https://doi.org/10.1136/bcr-2019-232508
- Han HC, Ha FJ, Sanders P, et al. Atrioesophageal Fistula: Clinical Presentation, Procedural Characteristics, Diagnostic Investigations, and Treatment Outcomes. Circulation: Arrhythmia and electr ophysiology.2017;10(11):e005579. https://doi.org/10.1161/CIRCEP.117.005579
- H. Celik, V. Ramanan, J. Barry, S. Ghate, V. Leber, S. Oduneye, Y. Gu, M. Jamali, N. Ghugre, J.A. Stainsby, M. Shurrab, E. Crystal, G.A. Wright. Circ Arrhythm Electrophysiol. Intrinsic contrast for characterization of acute radiofrequency ablation lesions. 2014;7(4):718-27. https://doi.org/10.1161/CIRCEP.113.001163
- D. Filomena, T. Dresselaers, J. Bogaert. Role of cardiovascular Magnetic Resonance to assess cardiovascular inflammation. Front Cardiovasc Med. 2022;9:877364. https://doi.org/10.3389/fcvm.2022.877364
- B. Dinov, S. Oebel, S. Hilbert, S. Loebe, A. Arya, A. Bollmann, P. Sommer, C. Jahnke, I. Paetsch, G.Hindricks. Characteristics of the ablation lesions in cardiac magnetic resonance imaging after radiofrequency ablation of ventricular arrhythmias in relation to the procedural success. Am Heart J. 2018;204:68-75. https://doi.org/10.1016/j.ahj.2018.06.014
- K. Tampakis, S. Pastromas, A. Sykiotis, S. Kampanarou, G. Kourgiannidis, C. Pyrpiri, M. Bousoula, D. Rozakis, Andrikopoulos G. Real-time cardiovascular magnetic resonance-guided radiofrequency ablation : A comprehensive review. World J Cardiol. 2023 Sep 26;15(9):415-426. https://doi.org/10.4330/wjc.v15.i9.415
- A. Fusco, A. Luciano, M. Cesareni, E. De Ruvo, A. Borrelli, G. Tufaro, A.M. Ferrazza, M. Chiocchi, L. Calò, M. Stefanini. Complication detection in MRI guided cardiac ablation: Atrial wall damage and hepatic oedema. Radiol Case Rep. 2024 Sep;19(9):3613-3617. https://doi.org/10.1016/j.radcr.2024.05.046
- T. Deneke, V. Kutyifa, G. Hindricks, P. Sommer, K. Zeppenfeld, C. Carbucicchio, H. Pürerfellner, F.R. Heinzel, V.B. Traykov, M. De Riva, G. Pontone, L. Lehmkuhl, K. Haugaa, A. Sarkozy, A. Gimelli, C. Tondo, S. Ernst, M. Antz, M.Westwood. Pre- and post-procedural cardiac imaging (computed tomography and magnetic resonance imaging) in electrophysiology: a clinical consensus statement of the European Heart Rhythm Association and European Association of Cardiovascular Imaging of the European Society of Cardiology. Europace. 2024;26(5):euae108. https://doi.org/10.1093/europace/euae108
- Голухова Е.З., Ревишвили А.Ш., Базаев В.А., Филатов А.Г., Макаренко В.Н., Малиованова И.М., Рябинина М.Н., Демкина А.Е. Дислокация желудочкового электрода электрокардиостимулятора в правую легочную вену. Вестник аритмологии. 2012;67(67):66-71.
- Калинин Р.Е., Сучков И.А., Поваров В.О., Шитов И.И., Потехинский С.С., Соловов Д.В., Пешков С.А. Клиническое наблюдение внутрисердечного перелома электрода электрокардиостимулятора. Казанский медицинский журнал. 2020;101(6):908-912.
- Шляппо М.А., Сафонова Н.И., Александрова С.А., Макаренко В.Н., Темирбулатов И.А., Фридрих О.А., Терехов М.И., Зеликова Л.В. Традиционная рентгенография органов грудной клетки и имплантированные кардиосистемы. Креативная кардиология. 2022;16(1):102-12. https://doi.org/10.24022/1997-3187-2022-16-1-102-112
- Клиническая аритмология. Ред. Проф. А.В. Ардашева - М.Ж. ИД «Медпрактика-М», 2009, C. 1220.
- German S.A., Haad R.R. Reel syndrome: an unusual complication of cardiac pacemaker implantation. Arq Bras Cardiol. 2015;104(3):e26. https://doi.org/10.5935/abc.20140204
- S. Domagata, M. Domagata, J. Chyła, C. Wojciechowska, M. Janion, A. Polewczyk. Postepy Kardiol Interwencyjnej. Complications of electrotherapy - the dark side of treatment with cardiac implantable electronic devices. 2018;14(1):15-25. https://doi.org/10.5114/aic.2018.74351
- Баранович В.Ю., Стефанов С.А., Максимкин Д.А., Илларионова Е.В., Хайрутдинов Е.Р. Перфорация правого желудочка как осложнение имплантации электрокардиостимулятора. Вестник Российского университета дружбы народов. Серия: Медицина. 2009;1:31-33.
- Ishikawa K, Cida K, Taniguchi T, et al. Myocardial perforation and/or penetration by a permanent endocardial electrode of the pacemaker in autopsy cases. J Arrhythmia. 1999;15:29-44.
- Бокерия О.Л., Филатов А.Г., Яхьяев Я.Б. Эндокардиальная имплантация ресинхронизирующих устройств. Анналы аритмологии. 2017; 14(1): 49-56. https://doi.org/10.15275/annaritmol.2017.1.7
- A. Sirajuddin, M.Y. Chen, C.S. White, A.E.Arai. Coronary venous anatomy and anomalies. J Cardiovasc Comput Tomogr. 2020;14(1):80-86. https://doi.org/10.1016/j.jcct.2019.08.006
- Маринин В.А., Клюквин А.С., Грохотова В.В., Петрова В.Б., Яковлев Д.А., Громов А.А., Лебедева У.В., Рида О. Двуэтапная имплантация СРТ-системы эндо-эпикардиальным доступом у пациента с персистирующей левой верхней полой веной и выраженной дилатацией коронарного синуса. Вестник аритмологии. 2016;(86):55-56.
- J.F. Younger, S. Plein, A. Crean, S.G. Ball, J.P. Greenwood. Visualization of coronary venous anatomy by cardiovascular magnetic resonance. J Cardiovasc Magn Reson. 2009. 11(1):26. https://doi.org/10.1186/1532-429X-11-26
- М.А. Шляппо, С.А. Александрова, Л.А. Юрпольская, В.Н. Макаренко, Л.А. Бокерия. Венозное коронарное русло по данным Магнитно-Резонансной Томографии. Бюллетень НЦССХ им. А.Н. Бакулева РАМН. 2015: 16(6):16-20.


