Магнитно-резонансная томография с парамагнитным контрастированием в проспективной оценке субэндокардиального повреждения миокарда у пациентов с артериальной гипертонией, леченных методом радиочастотной аблации почечных артерий
Автор: Мочула Ольга Витальевна, Ситкова Екатерина Сергеевна, Мордовин Виктор Федорович, Богунецкий Антон Александрович, Лукьяненок Павел Иванович, Усов Владимир Юрьевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.29, 2014 года.
Бесплатный доступ
Цель исследования: адаптировать и оптимизировать методику контрастированной магнитно-резонансной томографии (МРТ) для оценки нетрансмурального повреждения миокарда у пациентов с медикаментозно-резистентной артериальной гипертонией (АГ) в динамике лечения методом радиочастотной аблации почечных артерий (РЧА ПА). ЭКГ-синхронизированная МРТ сердца выполнялась 10 пациентам с медикаментозно-резистентной АГ и выраженной гипертрофией левого желудочка (ГЛЖ) исходно и через 6 мес. после РЧА ПА. В ходе МР-исследования оценивались: индекс усиления (ИУ) интенсивности сигнала, объем включения контрастного препарата, масса миокарда левого желудочка (ММ ЛЖ). Показано, что контрастированная МРТ - эффективный метод выявления и контроля некоронарогенного нетрансмурального повреждения миокарда при ГЛЖ у пациентов с медикаментозно-резистентной АГ По данным МРТ с применением парамагнитного контрастирования, РЧА ПА приводит к достоверному регрессу ГЛЖ и регрессу субэндокардиального повреждения миокарда.
Контрастированная магнитно-резонансная томография миокарда, резистентная артериальная гипертония, субэндокардиальное повреждение миокарда, радиочастотная аблация почечных артерий
Короткий адрес: https://sciup.org/14919966
IDR: 14919966 | УДК: 616.122
Текст научной статьи Магнитно-резонансная томография с парамагнитным контрастированием в проспективной оценке субэндокардиального повреждения миокарда у пациентов с артериальной гипертонией, леченных методом радиочастотной аблации почечных артерий
АГ – один из ведущих факторов риска сердечно-сосудистых заболеваний и смертности. У пациентов с высоким артериальным давлением (АД) часто имеют место нарушения структуры и/или функции миокарда, в частности ГЛЖ. ГЛЖ – важный независимый фактор риска не только общей и сердечно-сосудистой смертности, но и внезапной сердечной смерти [4], как правило, обусловленной латентным нетрансмуральным повреждением миокарда. Повреждение миокарда обусловлено тем, что систолическое напряжение миокарда достоверно превышает перфузионное давление в коронарных артериях, и одновременно есть диастолическая дисфункция утолщенного и механически ригидного гипертрофированного миокарда. В результате субэндокардиальные слои миокарда в зонах максимального напряжения оказываются кровоснабжаемыми меньшую часть сердечного цикла в диастолу, тогда как в систолу и начальный период диастолы практически не перфузируются. В результате развивается локальная дистрофия миокарда и повреждение эндотелиального гистогематического барьера, хорошо визуализируемые средствами МРТ сердца с контрастным парамагнитным усилением [3].
В последние годы одним из наиболее эффективных методов лечения пациентов с АГ, приводящим к стойкому снижению АД у пациентов с медикаментозно-резистентной АГ, стала РЧА симпатических сплетений ПА. Однако состояние миокарда, наличие очагов повреждения у этих пациентов не исследовано. В частности, остается открытым вопрос о патофизиологическом субстрате участков отсроченного контрастирования, их связи с объемными показателями ЛЖ, ММ ЛЖ и клиническим течением заболевания [2]. Cубэндокардиальное повреждение миокарда при гипертрофии и перегрузке может быть выявлено средствами МРТ сердца при контрастировании в Т1-взвешенном спин-эхо режиме или при использовании дополнительного импульса инверсия-восстановление, однако для пациентов с резистентной АГ таких исследований до настоящего времени не проводилось, тем более при проспективном наблюдении изменений в миокарде у таких пациентов до и после РЧА ПА.
Цель исследования: адаптировать и оптимизировать методику контрастированной магнитно-резонансной то- мографической оценки нетрансмурального повреждения миокарда у пациентов с медикаментозно-резистентной АГ в динамике лечения методом РЧА ПА.
Материал и методы
Для оценки субэндокардиального повреждения миокарда была обследована группа из 10 пациентов (50% мужчины) с медикаментозно-резистентной АГ и выраженной ГЛЖ в возрасте 56±10 лет исходно и через 6 мес. после ренальной денервации ПА. У всех пациентов был подтвержден резистентный характер АГ, исключены ее вторичные формы. Стаж АГ составил 18±11 лет. АД до проведения эндоваскулярного лечения по данным “офисных” измерений составило 172,89±15,76/97,65±3,52 мм рт. ст., по данным суточного мониторирования – 156,75±12,34/90,30±15,27 мм рт. ст. У исследуемых пациентов в анамнезе отсутствовали инфаркт миокарда, нарушения ритма сердца, воспалительные заболевания сердца.
Всем пациентам была проведена ЭКГ-синхронизиро-ванная МРТ сердца с контрастированием парамагнетиком на томографе Toshiba Titan 1,5 T. Пациенты исследовались в положении лежа на спине. Магнитно-резонансное исследование (МР-исследование) проводилось в Т1-, Т2-взве-шенных режимах, выполнялись также функциональная кино-МРТ, контрастированная МРТ в Т1-взвешенном спин-эхо режиме и времени обратного восстановления. В исследовании анализировались изображения, полученные в Т1-взвешенном режиме и исследования с контрастированием.
В начале для получения нативных (исходных) срезов проводилось МР-исследование в Т1-взвешенном режиме с синхронизацией по ЭКГ на конец диастолы, с получением срезов по длинной и короткой осям ЛЖ. Толщина срезов составляла 7–8 мм, матрица 256x192 воксе-лей, при времени эхо (TE)=20 мс, времени повторения (TR)=420–570 мс и в режиме обратного восстановления время инверсии (TI) варьировалось в пределах 240–320 мс. Контрастированное МР-исследование сердца выполнялось спустя 8–15 мин после внутривенного введения контрастного препарата Омнискан в дозе 2 мл 0,5 М р-ра/10 кг массы тела.
Для работы с МРТ-изображениями использовался
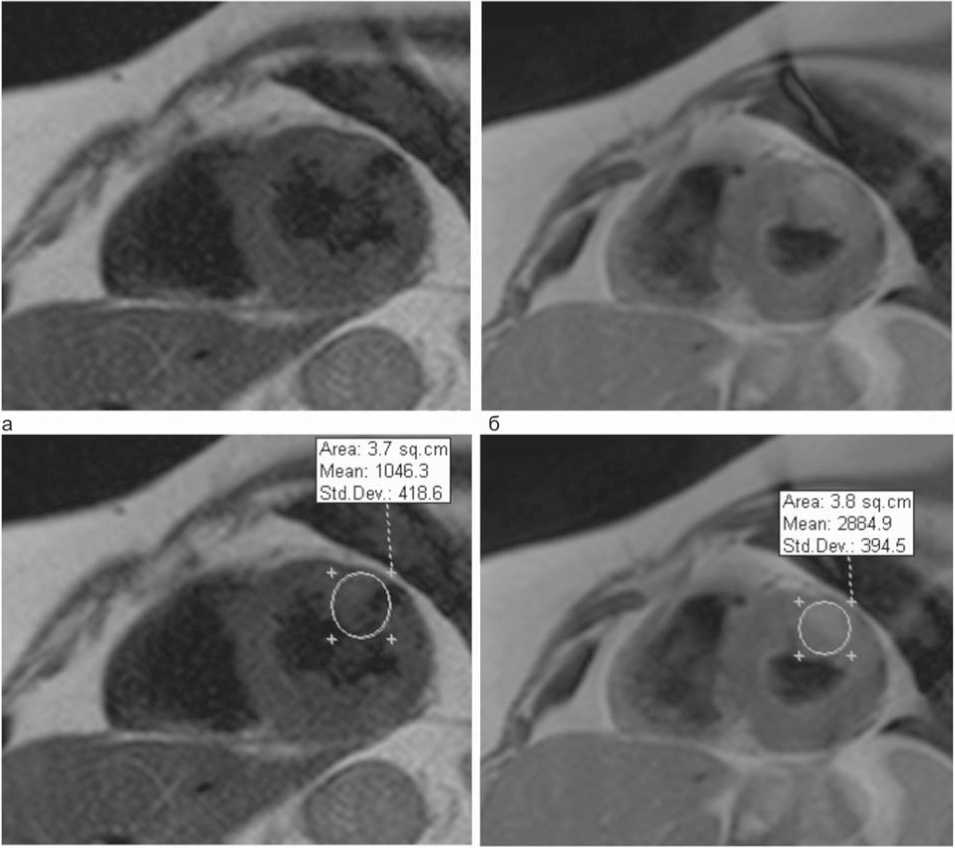
Рис. 1. Выделение области сердечной мышцы, накапливающей парамагнетик по данным МР-томографического исследования миокарда в Т1-взвешенном спин-эхо режиме: а, в – исходные изображения по короткой оси; б, г – изображения с контрастным усилением. В переднем сегменте стенки ЛЖ определяется участок накопления контрастного вещества, интенсивность исходного изображения 1046,3±418,6 апп. ед. Интенсивность после контрастирования 2884,9±394,5 апп. ед. ИУ интенсивности сигнала соответственно равен 2,8
программный пакет eFilm Workstation. По данным ЭКГ-синхронизированной МРТ сердца рассчитывались величины толщины миокарда ЛЖ, в частности в области включения контраста в стенку миокарда, определялась локализация включения контрастного препарата, объем включения контрастного препарата в ЛЖ, ИУ интенсивности Т1-взв. изображения, ММ ЛЖ.
Для расчета ИУ визуально выделялся участок накопления контраста на Т1-взвешенном спин-эхо изображении после контрастирования, определялась его интенсивность. Аналогично для исходного (до контрастного исследования) Т1-взвешенного изображения определялся участок, соответствующий накоплению контраста, и его интенсивность. Затем рассчитывался ИУ интенсивности сигнала как отношение интенсивности сигнала после контрастирования к интенсивности сигнала до контрас- тирования (рис. 1): ИУ=Инт.Т1-взв.МРТк/Инт.Т1-взв.МРТи, где ИСк– интенсивность МР-изображения после контрастирования, ИСи – исходная интенсивность МР-изобра-жения до контрастирования.
ММ ЛЖ рассчитывалась по формуле R.B. Devereux и N. Reichek (рис. 2):
ММ ЛЖ=1,04x([КДР+ТЗС ЛЖ+ТМЖП]3–[КДР]3)–13,6 [6].
Статистическая обработка полученных данных выполнялась с помощью пакета прикладных программ SPSS 16.0 Statistics (IBM, USA). Так как полученные выборки подчинялись нормальному закону распределения, то применялись параметрические методы анализа. Для сравнительного анализа данных использовался T-тест для парных зависимых выборок. Для корреляционного анализа применялся коэффициент Пирсона. Различия в сравниваемых группах считались достоверными при уровне статистической значимости 95% (р<0,05).
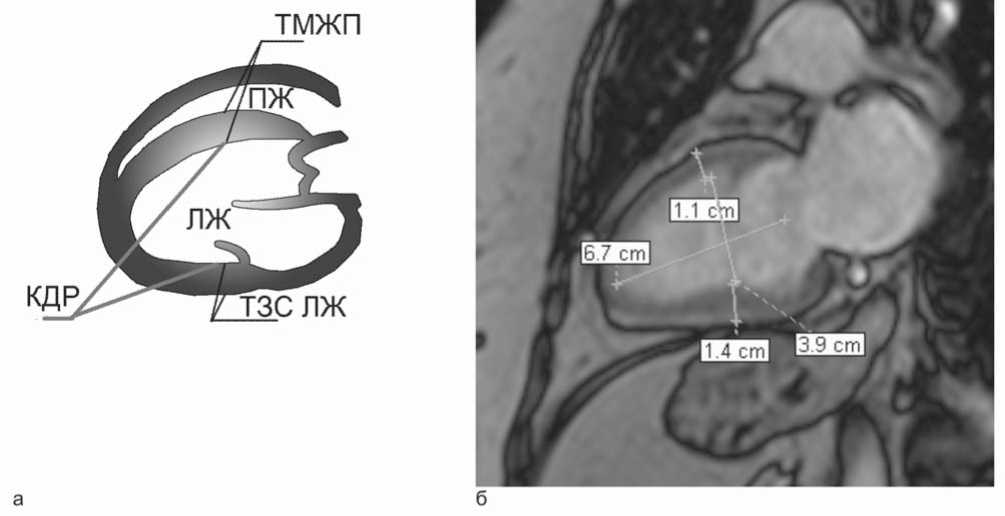
Рис. 2. Измерение показателей для расчета ММ ЛЖ: а – схематическое изображение; б – пример измерения, КДР –3,9 см, ТЗС ЛЖ – 1,4 см, ТМЖП – 1,1 см, ММ ЛЖ – 197,34 г
Результаты и обсуждение
Известно, что высокие значения АД при АГ приводят к перегрузке левых отделов сердца, нарастающая нагрузка на сердечную мышцу приводит к ГЛЖ. Наряду с этим, как правило, развивается и диастолическая дисфункция утолщенного и механически ригидного гипертрофированного миокарда. В результате развивается локальная дистрофия миокарда [3].
В настоящее время проведено большое количество исследований, в которых проанализирована динамика изменений АД при различных методиках терапии АГ [1], в том числе и при медикаментозно-резистентной, однако изменения в миокарде, сопутствующие стойкому повышению АД и гипертрофии, на практике недостаточно изучены и систематизированы. В частности, несмотря на быстрый прогресс и массовую доступность методов МРТ сердца с отсроченным контрастированием парамагнетиками, проспективный анализ состояния миокарда этими высокоинформативными методами до сих пор не проведен.
Анализ общеклинических показателей включенных в исследование пациентов показал, что в среднем значения систолического и диастолического АД в группе снижаются достоверно с 156,75±12,34/90,3±15,27 мм рт. ст. до 149,63±16,32/85,13±11,14 мм рт. ст. Однако у 3 пациентов из 10 наблюдалось увеличение значения АД по данным суточного мониторирования.
Отсутствовала достоверная корреляция между показателями АД, с одной стороны, и ИУ, объемом включения контрастного препарата в миокард и ММ ЛЖ, с другой.
В ходе проспективного наблюдения в динамике РЧА у наших пациентов оказалось, что объем включения парамагнетика в ткани миокарда достоверно снижался у всех пациентов после проведения РЧА ПА, так что снижение средней величины было весьма выраженным — с 2,054±1,31 см3 до 0,745±0,73 см3 (при уровне значимости р=0,04).
Также в результате проведенного лечения происходит статистически значимое снижение показателя ММ ЛЖ – c 262,5±69,6 до 232,6±66,6 г (р=0,03). В свою очередь ИУ интенсивности сигнала уменьшался лишь в 7 из 10
Таблица
Сравнительный анализ двух зависимых выборок
|
№ |
Пары |
Статистика для парных выборок |
Коэффициент корреляции |
Вероятность ошибки р |
||
|
Средние значения |
Стандартные отклонения о |
Стандартные шибки средних |
||||
|
1 |
ИУ до РЧА ПА ИУ после РЧА ПА |
1,8310 1,7230 |
0,32658 0,72815 |
0,10327 0,23026 |
r=0,683 p=0,029 |
0,556 |
|
2 |
Объем включения ПМ до РЧА ПА Объем включения ПМ после РЧА ПА |
2,05460 0,74560 |
1,317814 0,731789 |
0,416729 0,231412 |
r=0,588 p=0,074 |
0,04* |
|
3 |
ММ ЛЖ до РЧА ПА ММ ЛЖ после РЧА ПА |
262,45 232,592 |
69,61496 66,55521 |
22,01418 21,04660 |
r=0,941 p=0,0001 |
0,03* |
Примечание: изменения значимы на уровне 95%.
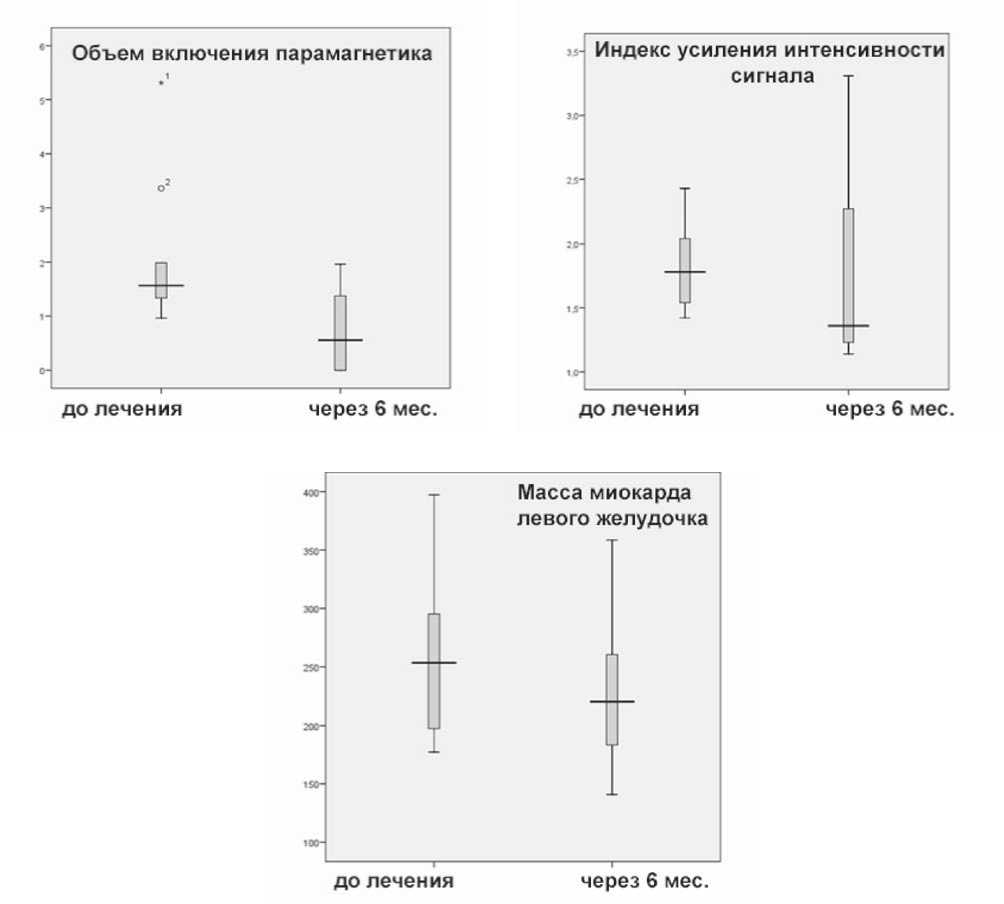
Рис. 3. Показатели МР-томографии миокарда с контрастным усилением до и после проведения РЧА ПА: а – объем включения парамагнетика в ткани миокарда; б – ИУ интенсивности сигнала; в – ММ ЛЖ
случаев, так что в среднем этот показатель уменьшился с 1,83±0,33 до 1,72±0,73, но изменения данного показателя не являлись достоверно значимыми (таблица).
Распределения значений объема включения ПМ, ММ ЛЖ, ИУ интенсивности сигнала, их средние, экстремальные и аномальные значения представлены на диаграммах (рис. 3).
Необходимо отметить, что для показателя ИУ интенсивности сигнала после лечения происходит увеличение разброса значений относительно среднего. Но в целом среднее значение интенсивности сигнала в группе пациентов после лечения снижается по сравнению с величинами до проведения РЧА ПА у этих пациентов.
Проведенный корреляционный анализ показал наличие статистически достоверной связи средней силы между ИУ интенсивности сигнала до лечения и объемом включения контрастного препарата после проведения РЧА ПА
(r=0,668, p=0,035). Также установлена сильная взаимосвязь между ИУ интенсивности сигнала после лечения и значениями объема включения как до, так и после процедуры десимпатизации (r=0,738, p=0,015 и r=0,824, p=0,003 соответственно). Эти данные позволяют считать, что тяжесть локального повреждения миокарда, оцениваемая по величине ИУ, достоверно связана с объемом, протяженностью патологического повреждения в миокарде. Такая взаимосвязь выглядит патофизиологически логичной и позволяет использовать ИУ и объем включения парамагнетика в миокард одновременно для исчерпывающей характеристики тяжести патологического процесса. Статистически значимой корреляции между остальными показателями выявлено не было.
Была статистически проанализирована также и взаимосвязь коэффициентов исследуемых показателей в динамике РЧА ПА. Под коэффициентами понимается отно- шение значения показателя после лечения к значению этого же показателя до лечения. Установлена статистически достоверная отрицательная высокая корреляционная взаимосвязь между коэффициентами объема включения контраста и ММ ЛЖ (r=0,738; p=0,015). Это доказывает, что избыточная гипертрофия в первую очередь приводит к повреждению субэндокардиальных отделов миокарда у пациентов с резистентной гипертензией.
В целом можно видеть, что показатели, характеризующие повреждение субэндокардиальных отделов миокарда у пациентов с нетрансмуральным поражением на фоне гипертрофии миокарда и перегрузки АД являются независимыми от общепринятых клинических показателей тяжести АГ, с одной стороны, а с другой, достоверно доказывают регресс субэндокардиального повреждения миокарда после успешной терапии повышенного АД. Иными словами, по представленным здесь данным, РЧА ПА приводит к достоверному регрессу субэндокардиального повреждения и обладает органопротективным действием в отношении миокарда.
Метод РЧА ПА зарекомендовал себя как безусловно эффективный в лечении медикаментозно-резистентной (т.е. наиболее тяжелой) АГ [8]. Неоднократно доказано, что в результате проведения РЧА ПА формируется стойкое снижение АД с улучшением в том числе прогноза жизни [5]. Однако состоянию миокарда и собственно почечной паренхимы у этих пациентов практически не уделяется внимания [7]. Нам удалось установить, что не коррелируя со степенью снижения АД, происходит значительное улучшение состояния миокарда в наиболее чувствительных – субэндокардиальных отделах. Вероятно, в улучшении состояния миокарда принимают участие ряд факторов – наряду с механическим снижением давления как таковым, это и снижение симпатической стимуляции, и улучшение функции почек после РЧА ПА.
Однако уже здесь можно считать доказанным, что по данным контрастированной МРТ, вне прямой связи со степенью снижения АД происходит достоверное улучшение состояния миокарда и регресс субэндокардиального повреждения, вызванного избыточной массой и перегрузкой.
Выводы
-
1. МРТ с использованием контрастного усиления является эффективным методом выявления и контроля не-коронарогенного нетрансмурального повреждения миокарда при ГЛЖ у пациентов с медикаментознорезистентной АГ.
-
2. По данным контрастированной МРТ, РЧА ПА приводит к достоверному регрессу ГЛЖ и снижению эндокардиального повреждения миокарда.
Список литературы Магнитно-резонансная томография с парамагнитным контрастированием в проспективной оценке субэндокардиального повреждения миокарда у пациентов с артериальной гипертонией, леченных методом радиочастотной аблации почечных артерий
- Чазова И.Е., Ощепкова Е.В., Рогоза А.Н. и др. Диагностика и лечение артериальной гипертонии. Клинические рекомендации. -М.: Министерство здравоохранения Российской Федерации, 2013. -64 с.
- Ларина О.М. Диагностическое значение магнитно-резонансной томографии при гипертрофии миокарда левого желудочка различного генеза. Литературный обзор//Вестник РНЦРР МЗ РФ. -2010. -№ 10 -С. 36-42.
- Усов В.Ю. Парамагнитное контрастирование при магнитно-резонансной томографии миокарда у пациентов с ишемической болезнью сердца. -Томск: STT, 2012. -104 с.
- Фомина И.Г., Дьякова Т.А. Гипертрофия левого желудочка при артериальной гипертензии и риск развития аритмий//Кардиоваскулярная терапия и профилактика. -2006. -Т. 5(8). -С. 83-89.
- Bhatt D.L., Kandzari D.E., O’Neill W.W. et al. A Controlled Trial of Renal Denervation for Resistant Hypertension//N. Engl. J. Med. -2014, Mar 29. (Epub ahead of print).
- Devereux R.B., Reichek N. Echocardiographic determination of left ventricular mass in man: anatomic validation of the method//Circulation. -1977. -Vol. 55. -P. 613-618.
- Esler M.D., Krum H., Schlaich M. et al. SYMPLICITY HTN-2 Investigators. Renal sympathetic denervation for treatment of drug-resistant hypertension: one-year results from the SYMPLICITY HTN-2 randomized, controlled trial//Circulation. -2012. -Vol. 126(25). -P. 2976-2982.
- Leong K.T., Walton A., Krum H. Renal sympathetic denervation for the treatment of refractory hypertension//Ann. Rev. Med. -2014. -Vol. 65. -P. 349-365.


