Магнитно-резонансная томография сердца с парамагнитным контрастным усилением в оценке механизмов формирования наджелудочковых аритмий у пациентов с резистентной артериальной гипертонией
Автор: Мочула Ольга Витальевна, Попов Сергей Валентинович, Фальковская Алла Юрьевна, Мордовин Виктор Федорович, Шелковникова Татьяна Александровна, Зюбанова Ирина Владимировна, Лукьяненок Павел Иванович, Усов Владимир Юрьевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.31, 2016 года.
Бесплатный доступ
Данная статья посвящена магнитно-резонансной оценке состояния левого предсердия (ЛП) у пациентов с резистентной артериальной гипертонией (РАГ) и гипертрофией левого желудочка (ГЛЖ) в динамике их лечения с помощью транскатетерной ренальной денервации. Для этого оценивалась динамика состояния ЛП в ходе лечения, анализировались взаимосвязи между показателями массы миокарда левого желудочка (ММ ЛЖ) и степенью дилатации левого предсердия (ЛП). В обследовании, которое проходило на базе НИИ кардиологии (Томск), приняли участие 40 пациентов. Всем пациентам трижды проводилось магнитно-резонансное (МР) исследование: исходно, через 6 и 12 мес. после лечения. Было выявлено следующее: объем ЛП статистически значимо снижался (p
Транскатетерная ренальная денервация, резистентная гипертония, магнитно-резонансная томография сердца, наджелудочковые нарушения ритма, объем левого предсердия
Короткий адрес: https://sciup.org/14920146
IDR: 14920146 | УДК: 616.125.2-122
Текст научной статьи Магнитно-резонансная томография сердца с парамагнитным контрастным усилением в оценке механизмов формирования наджелудочковых аритмий у пациентов с резистентной артериальной гипертонией
Введение причин, приводящих к формированию мозговых инсуль тов и инфаркта миокарда. Нарушения ритма, в большин-АГ, несмотря на очевидные успехи в борьбе с этим стве своем наджелудочкового генеза, играют в патогене-заболеванием, продолжает оставаться одной из главных зе осложнений АГ весьма важную роль [3]. В частности, ремоделирование сердца, которое происходит в результате прогрессирования АГ, с одной стороны, выступает в качестве компенсаторной реакции, которая дает сердцу возможность работать в условиях повышенного давления, а с другой, является одним из этапов прогрессирования изменений сердца к формированию дисфункции левого желудочка (ЛЖ) и развитию сердечной недостаточности [10]. Ремоделирование сердца у больных АГ отождествляют, прежде всего, с ГЛЖ. ГЛЖ может не только выявляться у лиц, уже имеющих повышенное артериальное давление, но и предшествовать развитию АГ [5].
Практически неизбежно и одновременно с изменениями массы миокарда и биомеханики ЛЖ развиваются и предсердные биомеханические и электрофизиологические нарушения [1, 3]. Их важнейшей клинической манифестацией является формирование пароксизмальных наджелудочковых тахиаритмий (ПНЖТ), а впоследствии и мерцательной аритмии.
Магнитно-резонансная томография (МРТ) в последние годы зарекомендовала себя как надежный метод всесторонней функциональной и морфологической диагностики состояния сердца, в первую очередь, миокарда желудочков. У пациентов с ишемическими поражениями она позволяет эффективно прогнозировать состояния, при возраст составлял 56,6±8,4 лет (p>0,05). Из их общего числа было 52,5% мужчин (n=21), средний возраст – 55,8±8,5 лет (p>0,05), и 47,5% женщин (n=19), средний возраст – 57,4±8,5 лет (p>0,05). У всех пациентов, по данным ультразвукового и электрокардиографического исследования, были отмечены признаки ГЛЖ.
Исследование пациентов проводилось на МР-томог-рафе фирмы Toshiba Vantage Titan, с индукцией магнитного поля 1,5 Т, с синхронизацией по ЭКГ, при этом общая продолжительность составляла в среднем 35–50 мин. Для охвата зоны интереса была использована поверхностная 16-канальная катушка с высоким соотношением сигнал/шум с большим полем обзора (до 500х500 мм). Локалайзер центрировался на область верхушечного толчка. Длительность задержки дыхания составляла от 4–6 до 12–17 с в зависимости от импульсной последовательности (ИП). Были выполнены следующие протоколы исследования сердца в ЭКГ-синхронизации:
– Исходно: позиционирующие ИП в аксиальной, сагиттальной, двухкамерной проекции по короткой оси и четырехкамерной проекции по длинной оси сердца; ИП GRE-SSFP (ИП с устойчивым состоянием свободной прецессии, изображения с “темной кровью”) в Т1- которых наджелудочковые нарушения ритма сердца наиболее вероятны [2]. Однако оценка состояния предсердий у пациентов с РАГ пока не проводилась. Поэтому мы попытались оценить состояние предсердий, в первую очередь, ЛП, у пациентов с РАГ и ГЛЖ в динамике лечения методом транскатетерной ренальной денервации. В частности, для этого количественно оценивалась динамика состояния ЛП в ходе лечения АГ методом транскатетерной ренальной денервации, анализировались взаимосвязи между показателями ГЛЖ и степенью дилатации ЛП.
Материал и методы
В период с 2014–2016 гг. на базе отделения рентгеновских и томографических методов диагностики НИИ кардиологии (Томск) было обследовано 40 пациентов. Основным критерием включения пациентов в исследование было показание к проведению денервации почечных артерий.
В исследование были включены пациенты с РАГ, которым в связи с неэффективностью медикаментозной терапии была проведена транскатетерная двусторонняя ренальная денервация почечных артерий. Всего было обследовано 40 пациентов, при этом средний
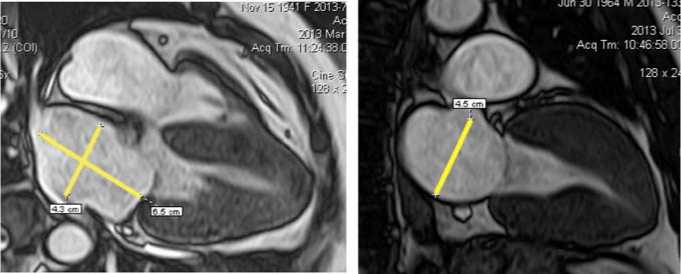
б
Рис. 1. Определение объема ЛП. Кино-режим (импульсная последовательность SSFP). Изображения сердца в четырехкамерной (а) и двухкамерной (б) проекциях по длинной оси в фазу систолы ЛЖ
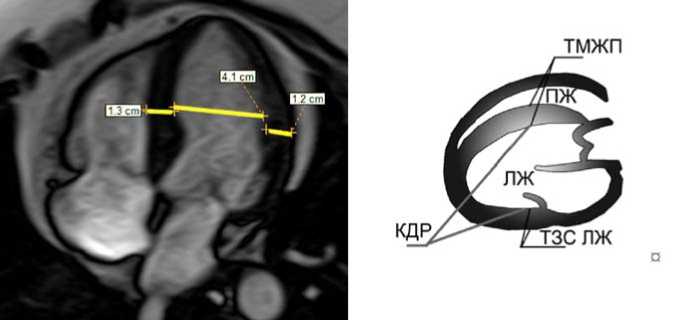
а б
Рис. 2. Определение ММ ЛЖ. Кино-режим (импульсная последовательность SSFP). Изображения сердца в двухкамерной (а) проекции по длинной оси в фазу диастолы ЛЖ. Схематическое представление измеряемых параметров (б)
и Т2-взвешенности; кино-режим, изображения с “яркой кровью” в двухкамерной проекции по короткой оси и четырехкамерной проекции по длинной оси сердца.
– После введения парамагнетика-контраста: для оценки раннего контрастирования исследовался первый пассаж контрастного препарата (1–3 мин после введения препарата) с использованием сверхбыстрых градиентных последовательностей (GRE) с инверсией и Т1-взвешенностью или быстрый кино-режим.
Для анализа полученных изображений был использован программный пакет eFilm Workstation.
Для сбора данных волюметрических показателей миокарда использовался кино-режим в проекциях по короткой и вертикальной длинной оси сердца.
Определялись следующие параметры.
Определение объема левого предсердия (ОЛП, см3). Для расчета ОЛП была использована модель эллипсоида, которая предполагает, что ЛП может быть представлено в виде вытянутого эллипса с объемом, который рассчитывается по следующей формуле:
4n L ( Di/ Y D2/ ) /3 (/2)( /2 )( /2 ),
где L – длина длинной оси, D1 и D2 – ортогональные поперечные размеры ЛП [4].
Объем ЛП определялся на изображениях, полученных с помощью ИП SSFP в двухкамерной и четырехкамерной проекциях по длинной оси в фазу систолы ЛЖ (рис. 1). Также данная последовательность была использована для расчета ММЛЖ. Параметры сканирования представлены в таблице 1.
Определение ММ ЛЖ . Для определения ММ ЛЖ применялась формула R.B. Devereux и N. Reichek (рис. 2): ММ ЛЖ=1,04х([КДР+ТЗС ЛЖ+ТМЖП]3–[КДР]3)–13,6 [9].
Для определения геометрии ЛЖ необходимыми данными являются: толщина межжелудочковой перегородки (ТМЖП), толщина задней стенки (ТЗС) ЛЖ и конечно-диастолический размер (КДР) ЛЖ. Эти параметры могут быть непосредственно измерены при МРТ в кинорежиме в конце диастолы.
Протокол исследования был одобрен этическим комитетом НИИ кардиологии. Исследование проводилось с соблюдением международных принципов Хельсинской декларации и всех этических стандартов по защите людей и животных в процессе выполнения научной работы. У всех пациентов, включенных в исследование, было получено информированное согласие.
Таблица 1
Параметры сканирования сердца для получения киноизображений сердца (ИП SSFP)
|
Параметры |
Значения |
|
TR, мс |
3,7 |
|
TE, мс |
1,9 |
|
FA, градусы |
72 |
|
Толщина среза, мм |
8 |
|
Матрица, пиксел х пиксел |
128x240 |
Статистический анализ данных выполнялся с помощью пакета прикладных программ STATISTICА 8.0 (StatSoft). Для проверки закона распределения был использован критерий согласия Шапиро–Уилка W – объем выборки равен 40 , т.к. выборки не подчинялись нормальному закону распределения, данные представлены в виде: Ме(Q1; Q3), где Ме – медиана, Q1 – 1-й квартиль (25%), Q3 – 3-й квартиль (75%) . Для определения значимости различий в выборках применялся парный критерий Вилкок-сона для зависимых выборок Т. Для корреляционного анализа применялся коэффициент Спирмена (т.к. величины не подчинялись нормальному закону распределения). Различия в сравниваемых группах считались статистически значимыми при уровне статистической значимости 95% (р<0,05).
Результаты и обсуждение
Мы оценивали то, как влияет ОЛП на развитие пароксизмальных наджелудочковых нарушений ритма у данных пациентов (рис. 3). Из всей группы пациентов с АГ и сформировавшейся на ее фоне ГЛЖ при отсутствии у всех пациентов митральной регургитации более первой степени у одного была диагностирована частая пароксизмальная мерцательная аритмия, спонтанно не купировавшаяся, а требовавшая в большинстве случаев медикаментозной терапии либо электроимпульсного лечения. У 6 пациентов имели место частые эпизоды ПНЖТ.
Анализ ОЛП у данных пациентов показал, что у всех, кроме одного пациента с частыми ПНЖТ, он существенно выше 70 см3 (от 74 до 89 см3). У одного пациента с меньшим ОЛП (58 см3) отмечалось наличие множественных очагов повреждения стенки, визуализирующихся как предсердные включения парамагнитного контраста мелкоочагового характера. Как было показано ранее [6, 7], это является дополнительным независимым фактором, провоцирующим формирование пароксизмальных наджелудочковых нарушений ритма, в частности, за счет формирования множественных очагов re-entry. Среди пациентов, у которых пароксизмальных аритмий зафиксировано не было, показатели ОЛП были существенно меньше.
При проведении транскатетерной ренальной денервации почечных артерий у пациентов с частыми ПНЖТ или мерцательной тахиаритмией во всех случаях в послеоперационном периоде отмечалось умеренное снижение ОЛП, причем у 2 из 6 ПНЖТ практически прекратились. В связи с малостью размеров выборки эти показатели недостаточны для достоверного утверждения о соответствующем антиаритмогенном эффекте радиочастотной аблации (РЧА) на ОЛП, однако тенденция к послеоперационному снижению вероятности развития ПНЖТ у таких пациентов очевидна.
Таким образом, величина ОЛП оказывается наиболее существенной в аспекте прогноза пароксизмальных наджелудочковых нарушений ритма у пациентов с АГ, подобным образом для случаев с ишемической болезнью сердца и перенесенным инфарктом миокарда [2].
При этом дискриминантное значение ОЛП, разделяющего пациентов с низким и высоким риском ПНЖТ при
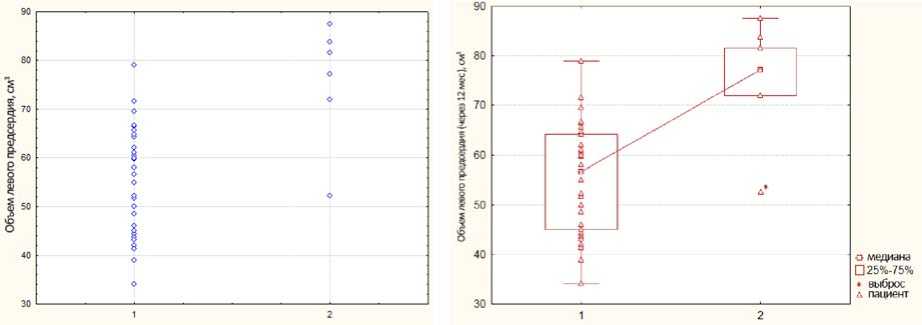
а
б
Рис. 3. Показатели ОЛП в группах пациентов с АГ и синусовым ритмом (1) и наличием частых ПНЖТ (2). Данные представлены как медиана с межквартильным размахом (а), и как распределение индивидуальных значений (б). Можно видеть, что, несмотря на различия в количестве пациентов в этих группах, пациенты группы 2 в большинстве находятся по показателю ОЛП выше величины 70–75 см3, тогда как в группе с синусовым ритмом (1) величина ОЛПу всех пациентов кроме двух ниже этой величины
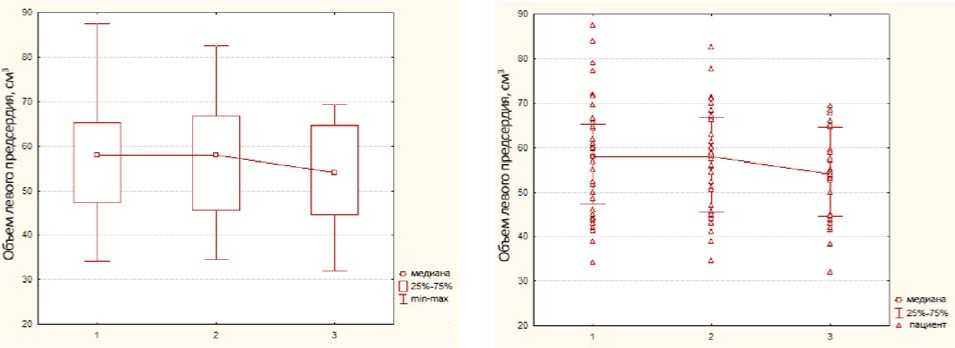
б
Рис. 4. Динамика ОЛП. Данные представлены как медиана с межквартильным размахом (а), и как распределение индивидуальных значений (б): исходно (1), через 6 (2) и 12 (3) мес. после лечения
АГ, было практически тем же, что и при перенесенном остром инфаркте миокарда (ОИМ) – 70–74 см3 [7].
Ни в одном из случаев мы не наблюдали, чтобы процедура РЧА оказывала дополнительное повреждающее воздействие на предсердия, в частности, на состояние стенки, с формированием дополнительных зон фиброза и самое главное – увеличением их размеров и объема. Это является дополнительным аргументом в пользу основного антиаритмического эффекта в дополнение к гипотензивному.
В настоящем исследовании мы не оценивали дополнительно, как влияет состояние симпатической иннервации на состояние предсердий, в частности уровень адреналина и норадреналина в крови у этих пациентов. Однако, учитывая доказанное в различных группах больных с АГ снижение норадреналина в плазме [8], рационально полагать, что у наших пациентов картина носит сходный характер.
По данным МР-исследования сердца обследуемых пациентов с РАГ и ГЛЖ в динамике их лечения ОЛП незначительно увеличился относительно исходного уровня 57,95 (47,28; 65,16) см3 до 58 (45,6; 66,9) см3 через 6 мес. после лечения и снизился до 54 (44,58; 64,73) см3 через 12 мес. после лечения (рис. 4).
ОЛП статистически значимо снижался (p<0,05) относительно исходного значения 57,95 (47,28; 65,16) и спустя 12 мес. после лечения 54 (44,58; 64,73), а изменения показателя через 6 мес. после лечения не были статистически значимы 58 (45,6; 66,9) см3 (p>0,05).
Через 6 мес. после лечения у 40% пациентов мы наблюдали снижение ОЛП, у 35% пациентов наблюдалось увеличение объема, а у 25% изменений не было.
Через 12 мес. после лечения уже у 57,5% пациентов наблюдалось снижение ОЛП, у 27,5% пациентов отмечалось увеличение объема, а у 15% изменений не было. Причем из числа тех 10 пациентов, у которых не было
Таблица 2
Изменение ОЛП у пациентов через 6 и 12 мес. после лечения (n=40)
Таблица 3
Изменение массы миокарда у пациентов через 6 и 12 мес. после лечения (n=40)
Сроки Уменьшение Увеличение Без изменений
Через 6 мес. после лечения 16 14 10
Через 12 мес. после лечения 23 11 6
Сроки Уменьшение Увеличение Без изменений
Через 6 мес. после лечения 26 13 1
Через 12 мес. после лечения 32 8 0
а
б
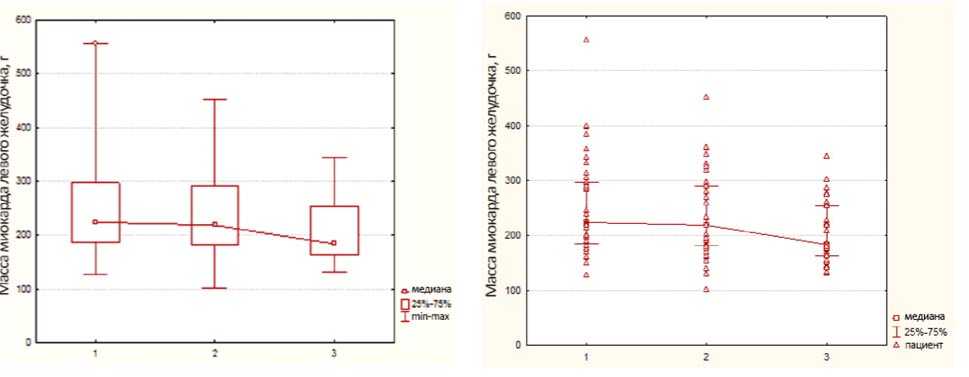
Рис. 5. Динамика ММ ЛЖ. Данные представлены как медиана с межквартильным размахом (а), и как распределение индивидуальных значений (б): исходно (1), через 6 (2) и 12 мес. (3) после лечения
Объем левого предсердия (исходно), см*
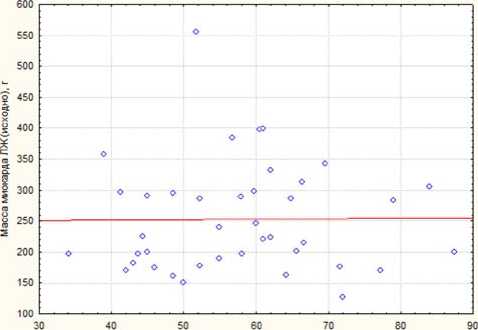
Рис. 6. График, отражающий взаимосвязь между показателями: ММ ЛЖ и ОЛП до лечения (коэффициент Спирмена=0,065, р=0,69)
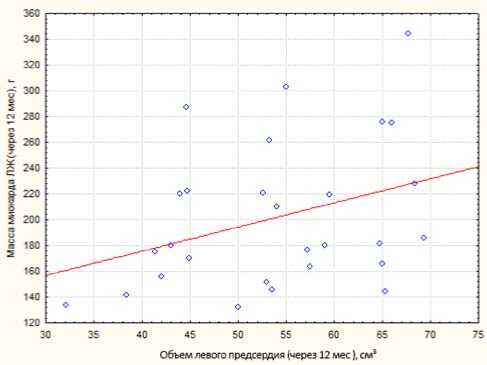
Рис. 7. График, отражающий взаимосвязь между показателями: ММ ЛЖ и ОЛП после лечения, через 12 мес. (коэффициент Спирмена=0,37, р<0,05)
изменений ОЛП через 6 мес. после лечения, уже через 12 мес.: у 6 пациентов уровень объема остался на прежнем значении от исходного; у 3 пациентов произошло уменьшение объема, а у 1 пациента объем увеличился (табл. 2).
Данные МР-измерений показали, что ММ ЛЖ также имела тенденцию к снижению после лечения, а именно, ММ ЛЖ статистически значимо снижалась относитель- но исходных измерений 224,15 (185,79; 296,87) г, рисунок 5:
– через 6 мес. после лечения ММ ЛЖ статистически значимо снизилась до 218,84 (181,98; 290,44) г, p=0,002;
– через 12 мес. после лечения ММ ЛЖ статистически значимо снизилась до 183,67 (163,76;254,5) г, p<0,001.
Через 6 мес. после лечения мы определили, что у 65% пациентов наблюдалось снижение ММ ЛЖ, у 32,5% – увеличение, у 2,5% – изменений не наблюдалось.
Через 12 мес. после лечения уже у 80% пациентов наблюдалось снижение ММ ЛЖ, у 20% пациентов наблюдалось ее увеличение. У пациента, у которого через 6 мес. после лечения не отмечалось изменения динамики ММ ЛЖ, через 12 мес. она увеличилась (табл. 3).
Для нас было важно определить, имеется ли взаимосвязь между ОЛП и ММ ЛЖ, поскольку увеличение камер сердца, в частности ЛП, может свидетельствовать об увеличении венозного возврата к сердцу, в результате чего увеличивается преднагрузка на ЛЖ и, как следствие, развитие его гипертрофии.
Корреляционный анализ данных показал (критерий Спирмена), что между ОЛП и ММ ЛЖ исходно, до выполнения процедуры транскатетерной ренальной денервации, не было выявлено взаимосвязи: коэффициент Спир-мена=0,065, р=0,69 (рис. 6).
При корреляционном анализе данных показателей спустя 12 мес. после лечения определялась слабая взаимосвязь, при этом коэффициент Спирмена был равен 0,37, р<0,05, это говорит в пользу того, что данный показатель является независимым (рис. 7).
Выводы
Таким образом, есть все основания считать, что транскатетерная ренальная денервация у пациентов с АГ обладает статистически значимым антиаритмогенным эффектом, в первую очередь, за счет уменьшения механического напряжения и уменьшения объемных показателей предсердий у таких пациентов в результате транскатетерной ренальной денервации. Представляется, что основным практическим следствием этого факта является то, что при наличии у пациента с РАГ частых наджелудочковых нарушений ритма процедура транскатетерной ренальной денервации оказывается показанной в первую очередь.
Список литературы Магнитно-резонансная томография сердца с парамагнитным контрастным усилением в оценке механизмов формирования наджелудочковых аритмий у пациентов с резистентной артериальной гипертонией
- Искендеров Б.Г., Лохина Т.В., Шибаева Т.М. и др. Динамика электрофизиологических показателей сердца у больных артериальной гипертонией в зависимости от суточного профиля артериального давления; геометрии левого желудочка и метаболических нарушений//Тер. архив. -2006. -Т. 78, № 9. -С. 12-17.
- Шомахов Р.А., Голухова Е.З. Возможности магнитно-резонансной томографии с контрастным усилением у пациентов с нарушениями ритма сердца: взгляд кардиолога//Креативная кардиология. -2014. -№ 4. -С. 75-83.
- Потешкина Н.Г., Джанашия П.Х. Структурно-функциональное ремоделирование миокарда и прогнозирование аритмий у больных артериальной гипертонией//Артериал. гипертен. -2005. -Т. 11, № 4. -С. 249-251.
- Рекомендации по количественной оценке структуры и функции сердца//Рос. кардиол. журн. -2012. -№ 3 (95), приложение 1. -С. 1-28.
- Туев А.В., Ховаева Я.Б. Особенности структурно-функциональных показателей сердца у лиц с разным уровнем артериального давления//Рос. кардиол. журн. -2002. -№ 5. -С. 38-41.
- Усов В.Ю., Бабокин В.Е., Мочула О.В. и др. Контрастированная магнитно-резонансная томография у пациентов с перенесенным инфарктом миокарда и предсердными тахиаритмиями//Рос. кардиол. журн. -2014. -№ 12(116). -С. 38-43.
- Усов В.Ю., Бабокин В.Е., Мочула О.В. и др. Магнитно-резонансная томография сердца с контрастным усилением в прогнозировании риска предсердных тахиаритмий у пациентов с перенесенным инфарктом миокарда//Рос. электронный журнал лучевой диагностики. -2014. -Т. 4, № 4. -С. 16-21.
- Пекарский С.Е., Баев А.Е., Мордовин В.Ф. и др. Эндоваскулярная денервация сегментарных ветвей почечной артерии для лечения резистентной АГ -рандомизированное контролируемое исследование эффективности и безопасности в сравнении с существующим методом симпатической денервации почек//Тезисы XII Всероссийского конгресса "Артериальная гипертония 2016: Итоги и перспективы". -М.: ИнтерМедсервис, 2016. -С. 62-63.
- Devereux R.B., Reichek N. Echocardiographic determination of left ventricular mass in man: anatomic validation of the method//Circulation. -1977. -Vol. 55. -P. 613-618.
- Levy D., Garrison R.J., Savage D.D. et al. Prognostic implications of echocardiographically determined left ventricular mass in the Framingham Heart Study//N. Engl. J. Med. -1990. -Vol. 322 (22). -P. 1561-1566.


