Магнитные наночастицы Cu/Fe с противоопухолевой активностью
Автор: Бакина Ольга Владимировна, Глазкова Елена Алексеевна, Сваровская Наталья Валентиновна, Коровин Матвей Сергеевич, Фоменко Алла Николаевна, Лернер Марат Израильевич, Августинович Александра Владимировна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.17, 2018 года.
Бесплатный доступ
Применение биметаллических наночастиц биосовместимых металлов с магнитными свойствами является новым подходом для борьбы с опухолевыми клетками. Наночастицы из несмешивающихся металлов Fe/Cu с разделенными фазами на уровне одной частицы синтезировали методом электрического взрыва железной и медной проволок в атмосфере аргона. Для характеристики наночастиц Cu/Fe использовали рентгено-фазовый анализ, просвечивающую электронную микроскопию, термодесорбцию азота и энергодисперсионный анализ. Наши исследования показали, что синтезированные наночастицы обладают противоопухолевой активностью по отношению к клеткам линий Neuro 2A и J 774. Такие частицы могут быть перспективны для создания препаратов для магнитной целевой доставки.
Магнитные наночастицы, электрический взрыв проводников, структура ядро-оболочка, сегрегированная структура, опухолевые клетки
Короткий адрес: https://sciup.org/140254157
IDR: 140254157 | УДК: 616-006:546.711:57.085.23 | DOI: 10.21294/1814-4861-2018-17-1-19-25
Текст научной статьи Магнитные наночастицы Cu/Fe с противоопухолевой активностью
В настоящее время усилия ученых направлены на поиск новых эффективных препаратов для борьбы с онкологическими заболеваниями. В области биомедицины проявляется все большее внимание к наночастицам с магнитными свойствами как к перспективным агентам для целевой доставки лекарственных препаратов [1], подавления роста опухолевых клеток [2], магнитной сепарации [3], в качестве контрастных веществ для магнитно-резонансной томографии [4]. Наночастицы металлов могут стать лекарственными средствами для борьбы с опухолевыми клетками благодаря своим уникальным свойствам, связанным с высокой активностью и большой площадью доступной поверхности. Наиболее исследованы в этом отношении наночастицы золота и серебра, противоопухолевое действие которых подтверждено и детально описано в обзоре [5]. Однако цитотоксичность наночастиц Ag [6, 7] и Au [8] значительно ограничивает их применение в комплексной терапии рака, основной целью которой является подавление раковых клеток с минимальным повреждением нормальных тканей. В связи с этим разработка наночастиц для борьбы с опухолевыми клетками, способных быть доставленными в нужную точку действия, безусловно, является актуальной. Применение биметаллических наночастиц, содержащих два металла, с разделенными компонентами на уровне одной частицы со структурой «ядро – оболочка» (рис. 1а) или «янус» – наночастицы (рис. 1б), позволяет совмещать противоопухолевые свойства одного металла с магнитными свойствами другого.
О применении в биомедицинских целях биметаллических наночастиц сообщается в большом количестве современных публикаций, причем

Рис. 1. Изображение наночастиц со структурой: а) «ядро – оболочка», б) «янус» – наночастицы противоопухолевая активность наночастиц сильно зависела от топологического распределения элементов по частице [9]. Биогенные наночастицы «ядро-оболочка» Ag/Pd, полученные методом «зеленого синтеза» [10], значительно ингибировали рост раковых клеток MCF 7 и HEPG2 по сравнению с нормальными клетками. Химическим синтезом были получены наночастицы Au/Fe, на которые адсорбировали препарат доксорубицин, он, в свою очередь, связывался с оболочкой из золота и постепенно десорбировался [11]. Наночастицы из ядра из Ag, покрытые оболочкой из полимеров (поливинилового спирта, полиэтиленгликоля, поливи-нилпирролидона), проявляли противоопухолевую активность по отношению к клеткам рака молочной железы (MCF-7) [12]. Авторы [13] предложили применение наночастиц Ag–TiO2 со структурой ядро-оболочка в качестве новых высокоэффективных противоопухолевых препаратов.
В данной статье мы сообщаем о получении магнитных биметаллических наночастиц Cu/Fe с разделенными фазами методом электрического взрыва проводника. Противоопухолевая активность наночастиц меди уже была подтверждена [14], например, по отношению к следующим клеточным линиям: MDA-MB-231 [15], HeLa [16], transplanted sarcoma и Pliss’s lymphosarcoma [17]. Установлено
[18], что наночастицы меди имели избирательную токсичность только для раковых клеток, оставляя нормальные клетки почти незатронутыми.
Цель исследования – изучить противоопухолевую активность частиц Cu/Fe, полученных электрическим взрывам проводников, по отношению к клеткам линий Neuro 2a и J 774, что показывает возможность будущего использования таких наночастиц в качестве современных противоопухолевых препаратов.
Материал и методы
Наночастицы Cu/Fe получали методом совместного электрического взрыва железной и медной проволок в атмосфере аргона [19]. Содержание металлов в проволочках составляло не менее 98,0–99,0 % масс., диаметр каждой проволочки 0,2 мм. Перед использованием проволочки очищали органическим растворителем для удаления загрязнений с поверхности и предварительно скручивали между собой. Электрический взрыв проволочек производили на установке УДП-2М по методике, схема которой представлена на рис. 2.
Сначала проволоки из меди и железа предварительно скручивали между собой (рис. 2) и помещали в электровзрывную установку. На две проволоки подавали импульс тока высокой плотности (~107 A/см2), получаемый при разряде батареи конденсаторов заданной емкости. При прохождении импульса тока через проволоки происходило взрывное диспергирование металла и быстрое расширение продуктов взрыва - аэрозоля из паров металлов - в окружающий газ (аргон). При этом продукты взрыва охлаждались и образовывались наночастицы Cu/Fe. Поскольку непосредственно после синтеза нанопорошки пирофорны, перед использованием их пассивировали методом медленного напуска воздуха. Поэтому поверхность частиц покрыта тонкой оксидной пленкой.
Морфологию и размер наночастиц и их агломератов определяли методом просвечивающей электронной микроскопии (электронный микроскоп JEOL 2000FX, Япония). Для определения среднего размера наночастиц по данным электронной микроскопии строились гистограммы распределения частиц по размерам. Полученные гистограммы аппроксимировали нормально-логарифмическим законом. Для построения каждой гистограммы измеряли размеры не менее 3000 частиц. Фазовый состав наночастиц определяли с помощью рентгенографического метода на дифрактометре Дрон-7 (CoKα-излучение в режиме сканирования в интервале углов 20 от ~45 до 95°, с шагом 0,02°). Идентификацию фаз проводили с помощью программного комплекса PDF-2 Release 2014 database. Удельную поверхность образцов определяли на приборе Сорбтометр М (Sorbtometer M, Katakon, Russia) по низкотемпературной адсорбции азота и рассчитывали 5-точечным методом БЭТ. Для исследования кинетики растворения нанопорошка Fe/Cu в буфере Дульбекко (рН=7,1) в него помещали нанопорошок и через определенные промежутки времени отбирали пробы объемом 0,1 мл и измеряли концентрацию железа и меди методом инверсионной вольтамперометрии (CTA, Россия).
Цитотоксическое действие наночастиц определяли при помощи MTT-теста на культурах базальных клеток нейробластомы мыши Neuro 2a и гистиоцитарной саркомы мыши J 774 (культуры предоставлены Государственным научным центром вирусологии и биотехнологии VECTOR, Россия). Конечная концентрация клеток составила 1×104 клеток/100 мкл в лунке 96-луночного микропланшета. Клетки Neuro 2a (J 774) выращивали в виде монослоя в среде MEM (DMEM) с добавлением 10 % FCS, 2mML-глутамина и 1 % пенициллин/стрептомицина. Культивирование клеток проводили при температуре 37 ± 1ºС и 5 % CO2 в течение 24 ч. После инкубирования питательную среду удаляли и два раза промывали клетки раствором фосфатного буфера Дульбекко (DPBS). Для определения цитотоксичности использова- ли суспензии наноструктур в клеточной среде в концентрациях: 0,1 мг/мл, 0,05 мг/мл, 0,01 мг/мл и 0,001 мг/мл. Клетки с наночастицами инкубировали при температуре 37 ± 1ºС и 5 % CO2 в течение 24 ч. Для проведения MTT-теста питательную среду удаляли и два раза промывали клетки раствором DPBS. Затем в каждую лунку добавляли по 100 мкл питательной среды и по 10 мкл раствора MTT (3-4,5-диметилтиазол-2,5 дифенил тетразилия бромида). Инкубирование с раствором MTT проводили в течение 2 ч при температуре 37 ± 1ºС и 5 % CO2. По окончании инкубирования питательную среду осторожно удаляли и добавляли в каждую лунку по 100 мкл диметилсульфоксида для растворения кристаллов формазана. Через 15 мин определяли оптическую плотность на микроплан-шетном спектрофотометре Tecan Infinite M1000 PRO (Tecan, Groding, Автрия) при длине волны 570 нм. Далее вычисляли процент живых клеток (CL) по формуле
CL= (As–Am)/(Ac–Am)×100 %, где As – оптическая плотность исследуемого образца, Ac – оптическая плотность контрольного образца, Am – оптическая плотность среды.
Контрольной группой служили клетки без добавления наночастиц и отдельно с наночастицами Fe и Cu, также полученными электрическим взрывом одиночных проволок в атмосфере аргона. Для статистической обработки данных использовались параметрические методы с уровнем достоверности p≤0,05.
Результаты и обсуждение
При совместном электрическом взрыве железной и медной проволок в атмосфере аргона образовывались сферические частицы, среднечисленный размер которых составляет 63 нм (рис. 3). Частицы содержали 46 % масс. железа и 54 % масс. меди.
Сферическая форма частиц обусловлена механизмом их формирования. Наночастицы сферической формы всегда формируются из жидкой фазы
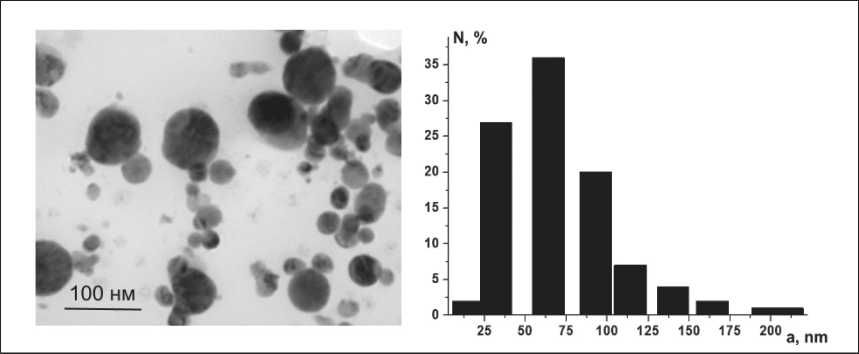
[20]. На ТЕМ-изображениях наночастиц видно, что наночастицы имеют приблизительно одинаковую форму и размер. При детальном исследовании частиц методом элементного анализа EDAX-TEM видно (рис. 4), что медь и железо неравномерно распределены по частице.
В данном случае формируется два вида наночастиц: «янус» – наночастицы, где медь и железо разделены между собой (рис. 4а); частицы со структурой ядро – оболочка, где ядро обогащено
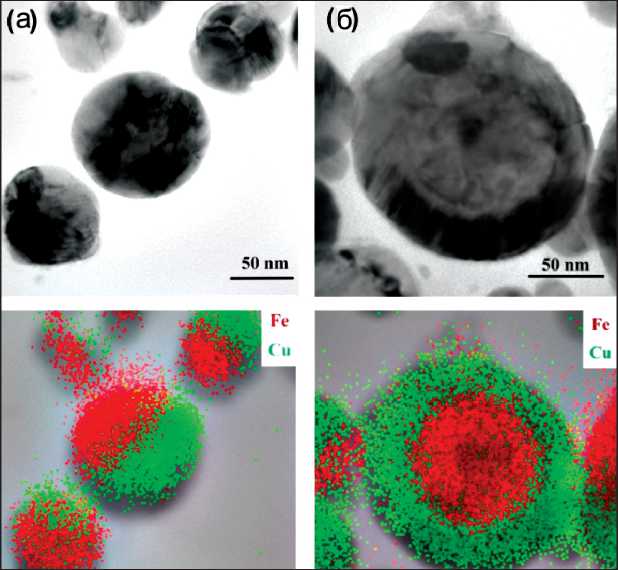
Рис. 4. Распределение элементов по частице Cu/Fe железом, а оболочка – медью (рис. 4б). На диф-рактограмме образца (рис. 5) основные рефлексы соответствуют фазам металлического Fe и Cu. На дифрактограмме можно отметить небольшое плечо при 48° и небольшой пик при 46°, что говорит о присутствии оксида меди (I) и наличии оксидной пленки, которая покрывает поверхность частиц при хранении. Частицы окисляются на воздухе с образованием достаточно толстой оксидной пленки, защищающей поверхность наночастиц от дальнейшего окисления.
Удельная поверхность нанопорошка составляет Sуд(Cu/Fe)=7,8 м2/г и является характерной для металлических нанопорошков. Синтезированные наночастицы обладают достаточно широким распределением по размерам, поэтому далеко не все способны проникать внутрь клеток [21]. Несмотря на это, наночастицы Cu/Fe проявили дозозависимую токсичность по отношению к исследуемым линиям клеток. MTT-тест продемонстрировал выраженный цитотоксический эффект наночастиц по отношению к исследуемым клеточным линиям. Гистограммы, наглядно демонстрирующие величину токсического действия наночастиц Cu/Fe в концентрации 0,1 мг/мл, представлены на рис. 6.
Например, для клеток J 774 количество живых структур составило при воздействии наночастиц Cu/Fe 23,4 %, Cu – 58,6 % и Fe – 69,4 %. Причем биметаллические наночастицы Cu/Fe были наиболее токсичными из всех трех видов наночастиц. Такое повышение цитотоксического воздействия
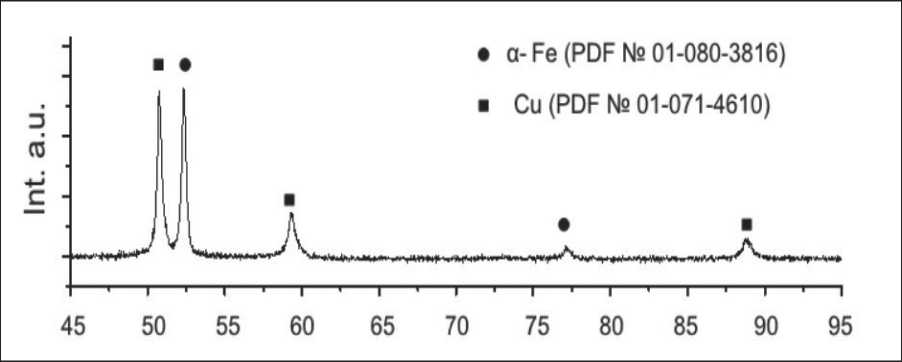
Рис. 5. Дифрактограмма нанопорошка Cu/Fe
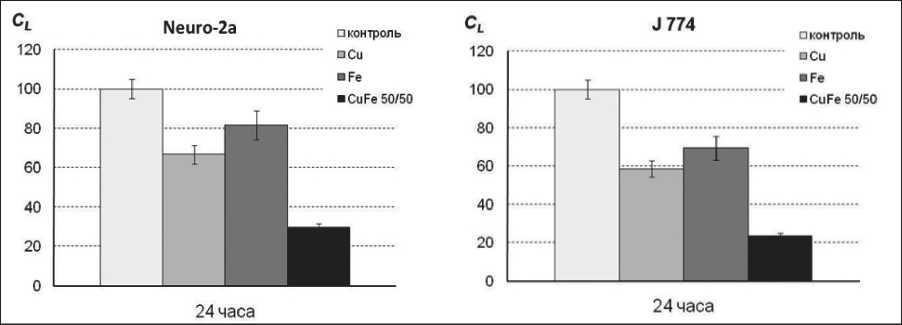
можно объяснить синергетическим эффектом меди и железа, содержащимися в наночастицах Cu/Fe на уровне одной частицы. Железо с медью образуют гальваническую пару. В результате эффективной контактной электрохимической коррозии образуются ионы Fe3+ и Cu2+, которые способны проникать внутрь клетки и оказывать цитотоксическое воздействие. Это подтверждается данными исследования концентрации ионов меди и железа при выдерживании образцов нанопорошков в DPBS. В течение 24 ч экспозиции нанопорошков в DPBS концентрация Fe3+ увеличивалась до 10,0 мкг/мл, ионов Cu2+ – до 4,4 мкг/мл. Изменения концентрации ионов при выдерживании в DPBS монометаллических порошков Cu или Fe составили: Cu2+ – 0,01 мкг/мл (нанопорошок Cu), Fe3+ – 0,03 мкг/мл (нанопорошок Fe). Ранее [22] сообщалось, что ионы Cu2+ способны изменять метаболизм раковых клеток, а также индуцировать их апоптоз.
Список литературы Магнитные наночастицы Cu/Fe с противоопухолевой активностью
- Mody V.V., Cox A., Shah S., Singh A., Bevins W., Parihar H. Magnetic nanoparticle drug delivery systems for targeting tumor. Applied Nanoscience. 2014; 4 (4): 385-392.
- Hervault A., Thanh N.T.K. Magnetic nanoparticle-based therapeutic agents for thermo-chemotherapy treatment of cancer. Nanoscale. 2014; 6: 11553-73.
- Iranmanesh M., Hulliger J. Magnetic separation: its application in mining, waste purification, medicine, biochemistry and chemistry. Chem Soc Rev. 2017 Oct 2; 46(19): 59255934. DOI: 10.1039/c7cs00230k
- Semkina A.S., Abakumov M.A., Abakumov A.M., Nukolova N.V., Chekhonin V.P. Relationship between the Size of Magnetic Nanoparticles and Efficiency of MRT Imaging of Cerebral Glioma in Rats. Bull Exp Biol Med. 2016; 161 (2): 292-295.
- Shi J., Kantoff P.W., Wooster R., Farokhzad O.C. Cancer nanomedicine: progress, challenges and opportunities. Nature Rev Cancer. 2017; 17: 20-37.


