Макрофагальная инфильтрация тканей оси «миокард-почка-селезенка-головной мозг» у пациентов с фатальным исходом инфаркт миокарда-ассоциированного шока
Автор: Керчева М.А., Гомбожапова А.Э., Степанов И.В., Рябов В.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.40, 2025 года.
Бесплатный доступ
Введение. Системная воспалительная реакция (СВР), возникающая в ответ на ишемию у пациентов с инфарктом миокарда (ИМ), − один из значимых механизмов патогенеза заболевания, определяющих его течение и исходы. Содержание одних из ключевых факторов процесса воспаления и регенерации – макрофагов (МФ) как в миокарде, так и в органах-мишенях, взаимосвязь концентрации прои противовоспалительных МФ в ранние и отдаленные сроки инфаркта с его неблагоприятными исходами остаются малоизученными. Цель: комплексно изучить характеристики макрофагальной инфильтрации тканей миокарда, почек, головного мозга (ГМ) и селезенки у пациентов, умерших от инфаркт миокарда-ассоциированного шока (ИМ КШ), охарактеризовать их связь с клиническим портретом пациентов. Материал и методы. Были исследованы фрагменты селезенки (красная (КП) и белая пульпа (БП)), миокарда, почек и ГМ, забранные во время аутопсии пациентов, умерших от ИМ КШ (n = 25). Макрофагальную инфильтрацию тканей оценивали с помощью иммуногистохимического анализа с использованием антител к общему маркеру МФ – CD68 и к маркерам МФ М2 – CD163, CD206, стабилину-1. Результаты. Максимальное и неизменно высокое относительно раннего к отдаленному периоду ИМ содержание всех исследуемых клеток обнаружено в КП селезенки: CD68+ 898 (807; 1049), CD163+ 898 (807; 1049), стабилин-1+ 807 (526; 985), CD206+ 11 (9; 19) клеток. В инфарктной зоне (ИЗ) миокарда, концентрация всех исследуемых клеток возрастала: CD68+ – от 59 (52; 95) до 376 (136; 634), CD163+ – от 82 (34; 285) до 697 (545; 982), CD206+ – от 21 (12; 43) до 99 (31; 249), стабилин-1+ – от 0 (0; 1) до 126 клеток (p < 0,05). Единственный тип клеток среди изученных нами и показавший снижение своей концентрации к отдаленному периоду ИМ – CD206+ клетки в почках: от 6 (5; 8) до 2 (1; 2) (p < 0,005). При анализе межорганных корреляций выявлено большое количество взаимодействий между органами на клеточном уровне, преимущественно в ранний постинфарктный период. Количество CD163+ клеток в ГМ коррелирует с возрастом (r = –0,7, p = 0,0006). Выводы. Комплексный анализ макрофагальной инфильтрации тканей – миокарда, почек, ГМ и селезенки у пациентов с фатальным ИМ КШ показал, что максимальное, неизменно высокое содержание исследуемых клеток (CD68+, CD163+, CD206+, стабилин-1+) характерно для одного из ведущих органов иммуногенеза – селезенки. Активное течение СВР на уровне миокарда у лиц с ИМ КШ нашло свое отражение в повышении содержания всех исследуемых типов клеток в ИЗ миокарда. Снижение регенераторных возможностей организма при ИМ КШ отразилось в снижении содержания количества CD206+ клеток в почках. Большое количество межорганных взаимосвязей между клетками макрофагального ряда в раннем периоде ИМ, а также наличие связей между концентрацией макрофагальных клеток в тканях и клиническими данными подтверждают ценность проведения последующего комплексного анализа клеточного состава ткани инфарцированного миокарда в сочетании с динамикой уровня сывороточных маркеров, отражающих активность СВР у пациентов с ИМ КШ.
Инфаркт миокарда, кардиогенный шок, макрофаги
Короткий адрес: https://sciup.org/149149294
IDR: 149149294 | УДК: 616.127-005.8-036.88:[616.127+616.61+616.411+616.831]:577.27 | DOI: 10.29001/2073-8552-2025-40-3-57-67
Текст научной статьи Макрофагальная инфильтрация тканей оси «миокард-почка-селезенка-головной мозг» у пациентов с фатальным исходом инфаркт миокарда-ассоциированного шока
Керчева М.А., Гомбожапова А.Э., Степанов И.В., Рябов В.В. Макрофагальная инфильтрация тканей оси «миокард-почка-селезенка-головной мозг» у пациентов с фатальным исходом инфаркт миокарда-ассоциированного шока. Сибирский журнал клинической и экспериментальной медицины. 2025;40(3):57–67. https://doi. org/10.29001/2073-8552-2025-40-3-57-67
Compliance standards: with ethical the research was approved by the local committee on biomedical ethics of the Research Institute of Cardiology of the Tomsk National Research Medical Center (protocol No. 128) and was conducted in accordance with the principles of the Declaration of Helsinki. For citation: Kercheva М.А., Gombozhapova A.E., Stepanov I.V., Ryabov V.V. Macrophages of the of the axis “heart-spleen-brain-kidney” in patients with fatal myocardial infarction complicated by cardiogenic shock. Siberian Journal of Clinical and Experimental Medicine. 2025;40(3):57–67.
В настоящий момент накоплено большое количество как экспериментальных, так и клинических данных, указывающих на то, что воспаление служит клеточно-молекулярной основой развития сердечно-сосудистой патологии, в том числе и инфаркта миокарда (ИМ). Системная воспалительная реакция (СВР), возникающая в ответ на ишемию у пациентов с ИМ, вероятно, является одним из значимых механизмов патогенеза заболевания и определяет исходы и течение самого инфаркта и его осложнений [1].
Общее представление о временных и структурных характеристиках постинфарктной воспалительной реакции, ее ключевых участниках уже сформировано [2]. Известно, что ранний постинфарктный период (воспалительная фаза, 1-е 3-и сут) характеризуется активным привлечением в очаг повреждения в миокард нейтрофилов и моноцитов путем регуляции эндотелиальным слоем сосудов их рекрутирования из циркулирующей крови в ответ на высвобождение из некротизированных кардиомиоцитов молекулярных паттернов, связанных с повреждением (damage associated molecular patterns, DAMP) и аларминов [1, 3]. Пришедшие в очаг повреждения моноциты под влиянием микроокружения поляризуются до макрофагов (МФ) воспалительного фенотипа – М1, к 7–10-м сут ИМ в миокарде уже отмечается превалирование МФ с противовоспалительным фенотипом – М2 (фаза регенерации). Таким образом, в целом постинфарктная воспалительная реакция сводится к тому, что МФ удаляют некротизированные клеточные остатки в тканях миокарда и создают среду, необходимую для миграции, пролиферации, дифференцировки фибробластов и эндотелиальных клеток [4].
Несмотря на наличие понимания структуры и временных особенностей течения СВР у пациентов с ИМ, оценка течения воспалительной реакции in vivo в ткани миокарда в настоящий момент является малореализуемой задачей, ввиду чего ее активность определяется преимущественно по изменениям концентрации суррогатных маркеров воспаления, таких как цитокины, хемокины [5]. Однако не ясно, способно ли отражать изменение концентрации этих маркеров в крови активность воспаления, непосредственно протекающего в ткани миокарда, сопоставим ли этот процесс с системным воспалительным ответом. Предпринимающиеся попытки назначения противовоспалительной терапии данной когорте пациентов зачастую были сопряжены с развитием нежелательных явлений, обусловленных иммуносупрессией, что в свою очередь указывает на то, что поиск категории пациентов, у которой противовоспалительная терапия принесет очевидную пользу, является нерешенным, но в то же время перспективным вопросом персонализированной терапии ИМ и его осложнений [6].
Одной из главных проблем неотложной кардиологии в последнее десятилетие является поиск эффективных, влияющих на прогноз и исходы стратегий ведения пациентов с одним из самых грозных последствий ИМ, осложненным развитием кардиогенного шока (КШ) [7]. Данное осложнение представляет собою остро возникшую критическую гипоперфузию тканей, сочетающуюся с несоответствием доставки и потребления кислорода и возникающую вследствие снижения сократительной способности миокарда [8]. Внутрибольничная смертность пациентов с инфаркт миокарда-ассоциированным кардиогенным шоком (ИМ КШ) остается неприемлемо высокой и достигает 30-60%, несмотря на применение всех современных возможностей медикаментозной терапии, своевременной и полной реваскуляризации миокарда, использование средств механической поддержки кровообращения [9]. Предотвращение и эффективное подавление развития ИМ КШ на ранних стадиях может служить ключом к успеху в ведении данной когорты пациентов. В настоящий момент уже известно о существовании некоторых маркеров, косвенно отражающих участие СВР в патогенезе ИМ КШ. Выявлено повышение таких суррогатных маркеров активности СВР, как С-реактивный белок, интерлейкин-6 и фактор некроза опухоли альфа у пациентов с КШ [2], определено наличие взаимосвязи между их уровнем и тяжестью состояния [7]. Возможно, понимание места СВР у пациентов с ИМ КШ в развитии и прогрессировании шока, определение ее ключевых факторов могут послужить основой к новому персонализированному подходу ведения данной когорты пациентов.
Как уже было сказано ранее, активность СВР оценивается преимущественно по концентрации суррогатных маркеров воспаления и ее динамике, однако содержание одних из ключевых факторов процесса воспаления и регенерации – МФ как в миокарде, так и в органах-мишенях, взаимосвязь концентрации про- и противовоспалительных МФ в ранние и отдаленные сроки инфаркта с неблагоприятными исходами у лиц с ИМ и его осложнениями остаются малоизученными. Вся ранее полученная информация преимущественно определена в ходе проведения экспериментальных исследований. Единичные клинические данные разобщены и не систематизированы [10–13]. Системный подход к оценке макрофагальной инфильтрации миокарда, содержания МФ в других жизненно важных органах, таких как головной мозг (ГМ), селезенка и почки у пациентов с ИМ КШ, поиск ассоциаций между концентрацией и изменением количества МФ в миокарде и других перечисленных органах с течением заболевания и его исходами позволят нам продвинуться в понимании особенностей как локального, так и системного воспалительного ответа у лиц с ИМ КШ, его влияния на неблагоприятное течение и исходы заболевания.
Цель исследования: комплексно изучить характеристики макрофагальной инфильтрации тканей миокарда, почек, ГМ и селезенки у пациентов, умерших от ИМ КШ, охарактеризовать их связь с клиническим портретом пациента.
Материал и методы
В наше исследование были включены 25 пациентов, последовательно поступивших в течение года в отделение неотложной кардиологии с диагнозом «острый ИМ I типа», течение которого осложнилось развитием ИМ КШ и наступлением летального исхода (причина смерти – КШ). Диагноз «острый ИМ» был верифицирован в соответствии с 4-м универсальным определением ИМ [14]. Диагноз «кардиогенный шок» был выставлен на основании следующих унифицированных рекомендаций Европейского общества кардиологов по диагностике и лечению острой и хронической сердечной недостаточности (ХСН): сочетание артериальной гипотонии (систолическое артериальное давление менее 90 мм рт. ст.) при нормальной волемической нагрузке сердца с признаками гипоперфузии органов и тканей (холодные конечности, нарушение сознания, головокружение, метаболический ацидоз, повышение уровня сывороточного лактата, повышение уровня сывороточного креатинина) [15].
Критериями исключения являлись: ИМ II–V типов, наличие онкологических заболеваний, инфекционных осложнений (сепсис, пневмония), клапанных пороков, требующих хирургического вмешательства. Всем пациентам в течение первых 24 ч после документирования факта наступления летального исхода была проведена аутопсия. Материалом для нашего дальнейшего исследования послужили забранные во время аутопсии фрагменты селезенок, миокарда, почек и ГМ. При выборе исследуемых тканей мы ориентировались на ранее полученные экспериментальные данные о вовлеченности системы врожденного иммунитета в развитие и прогрессирование острого ИМ, реализующейся на уровне именно этих межорганных взаимосвязей «миокард-селезенка» [10], «миокард-почки» [14]. Фрагменты селезенок включали в себя как зону белой (БП), так и красной пульпы (КП), фрагменты миокарда: зону инфаркта (ИЗ), периинфаркт-ную зону (пери-ИЗ), зону миокарда, отдаленную от области поражения (не-ИЗ).
Забранный материал фиксировали в течение суток в 10% забуференном формалине. Подготовку материала для гистологического исследования реализовали согласно стандартной методике с использованием автомата для гистологической проводки Thermo Scientific Excelsior AS (Thermo Fisher Scientific, США) с последующим фиксированием материала в парафин на модульной системе Tissue-Tek® TEC™ 6 (Sakura, Япония). Согласно срокам наступления летального исхода, пациенты были поделены на 2 группы: 1-я группа – умершие в течение первых 3 сут от начала заболевания (ранний постинфарктный период, воспалительная фаза), n = 13; 2-я группа – умершие после 3 сут от начала заболевания (отдаленный постинфарктный период, восстановительная фаза), n = 12.
Исследование было одобрено комитетом по биомедицинской этике НИИ кардиологии Томского НИМЦ (протокол № 128) и осуществлялось в соответствии с принципами Хельсинкской декларации. Патологоанатомическое вскрытие проводилось согласно приказу Министерства здравоохранения Российской Федерации от 6 июня 2013 г. № 354н. Подписание информированного согласия пациентов не осуществлялось, что не противоречило пра- вилам проведения исследования согласно Хельсинкской декларации («Информированное согласие», пункт 32).
Иммуногистохимическое исследование
С целью проведения иммуногистохимического исследования микротомные срезы исследуемых органов изготавливали при помощи ротационного механического микротома HM 355S (Thermo Fisher Scientific, США). С каждого блока делали по 10 срезов для фрагментов селезенки, почек и ГМ и по 20 срезов для фрагментов миокарда, после чего материал был нанесен на стекла с L-полилизиновым покрытием, по два среза на одно стекло. Макрофагальную инфильтрацию тканей исследуемых органов оценивали два независимых эксперта с помощью иммуногистохимического исследования, проводимого на автоматическом иммуностейнере (Leica BondMax, Германия). Для иммунофенотипирования МФ были использованы мышиные моноклональные антитела к общему маркеру МФ CD68 (Cell Marque, разведение 1 : 500), антитела к маркеру М2 МФ: антитела к CD163 (Cell Marque, разведение 1 : 50), мышиные моноклональные антитела к CD206 (Santa Cruz, разведение 1 : 100), синтезированные в Лаборатории врожденного иммунитета и иммунологической толерантности (университет Гейдельберга) антитела к стабилину-1 RS1 (разведение 1 : 1000).
Для визуализации исследованных маркеров применяли систему HRP-DAB ( horseradishperoxidase-3,3’-diaminobenzidine, пероксидаза-3, 3’диаминобензидин ). Иммуногистохимическое окрашивание проводили по стандартному протоколу [12]. Подсчет клеток в селезенке и миокарде производили два независимых исследователя в 10 случайных полях зрения (объектив 40×) на микроскопе Axio Imager M2 (Zeiss, Германия) в светлом поле.
Статистическая обработка
Обработку полученных данных осуществляли с использованием статистического пакета STATISTICA 12.0 (Dell, США). Для проверки выборки на соответствие нормальному распределению использовали критерий Шапиро – Уилка.Все количественные показатели, не имевшие нормального распределения, описывали медианой ( М е ) и и межквартильным интервалом ( Q1; Q3 ), Ме (Q1; Q3) , кроме возраста и температуры тела, описанных средним значением ( М ) и стандартным отклонением ( SD ), M ± SD . Категориальные показатели представлены абсолютными ( n ) и относительными (в %) частотами. Для сравнения количественных показателей в двух независимых группах использовали критерий Манна – Уитни, для сравнения категориальных признаков в этих группах – χ 2-критерий Пирсона или точный критерий Фишера. Статистически значимые корреляционные связи между количеством клеток и клинико-анамнестическими показателями выявляли с помощью коэффициента корреляции Спирмена. Проверку статистических гипотез проводили при уровне значимости р = 0,05.
Результаты
При анализе клинических данных исследуемой нами выборки было обнаружено, что в ранние сроки ИМ чаще погибали пациенты с передней локализацией ИМ, в то время как в отдаленные сроки ИМ среди умерших от ИМ КШ пациентов преобладала задняя локализация ИМ
(табл. 1). Развитие постинфарктной стенокардии было характерно для лиц, умерших в отдаленный срок ИМ. Примечательно, что в 48% случаев у пациентов исследуемой нами группы в анамнезе была ХСН, в 56% случаев ИМ был повторным и чаще был представлен фенотипом ИМ с подъемом сегмента ST.
Общее содержание клеток макрофагального ряда в тканях миокарда, почек, селезенки и ГМ, а также их содержание в ранний и отдаленный период ИМ у лиц с фа- тальным ИМ КШ отображены в таблице 2, рисунке 1.
Интересным представляется тот факт, что на фоне значимого повышения содержания всех исследуемых типов клеток в ИЗ миокарда относительно раннего к отдаленному периоду ИМ в периферических органах обнаружена динамика только одного типа клеток – CD206+ . Содержание CD206+ клеток в почках снижалось относительно раннего периода ИМ к отдаленному (см. табл. 2).
При анализе ассоциаций между клетками в миокар-
Таблица 1 . Клинико-анамнестические данные пациентов, умерших от инфаркта миокарда, осложненного развитием кардиогенного шока
Table 1 . Clinical and anamnestic data of patients with fatal MI CS
|
Параметры |
Все пациенты |
1-я группа |
2-я группа |
р |
|
Количество пациентов, n |
25 |
13 (52%) |
12 (48%) |
– |
|
Возраст, лет |
74 ± 9 |
70 ± 8 |
78 ± 9 |
0,31 |
|
Мужской пол, n (%) |
11 (40) |
6 (48) |
4 (30) |
0,7 |
|
ИМспST, n (%) |
25 (88) |
13 (100) |
9 (75) |
0,09 |
Характеристики ИМ
|
Тромболизис |
8 |
8 |
0 |
0,03 |
|
Тромболизиc + ЧКВ |
3 |
3 |
0 |
0,2 |
|
первичное ЧКВ |
7 |
3 |
4 |
0,6 |
|
отсроченное ЧКВ |
2 |
0 |
2 |
0,2 |
|
Время реперфузии, мин |
240 (169; 360) |
235 (169; 270) |
360 (143; 895) |
0,51 |
Локализация инфаркта
|
Передний ИМ, n (%) |
8 (32) |
7 (56) |
1 (8) |
0,03 |
|
Задний ИМ, n (%) |
6 (24) |
1 (8) |
5 (40) |
0,07 |
|
Циркулярный, n (%) |
11 (44) |
5 (35) |
6 (48) |
0,6 |
Факторы риска ишемической болезни сердца
|
Сахарный диабет, n (%) |
7 (28) |
3 (24) |
4 (32) |
0,6 |
|
Гипертоническая болезнь, n (%) |
25 (100) |
13 (100) |
12 (100) |
1,0 |
|
Ожирение, n (%) |
10 (40) |
6 (48) |
4 (32) |
0,7 |
|
Дислипидемия, n (%) |
7 (28) |
2 (16) |
5 (40) |
0,2 |
|
Курение, n (%) |
4 (16) |
2 (16) |
2 (16) |
1,0 |
Наличие в анамнезе
|
Повторный ИМ, n (%) |
14 (56) |
6 (48) |
8 (64) |
0,4 |
|
Предынфарктная стенокардия, n (%) |
10 (40) |
5 (35) |
5 (35) |
1,0 |
|
ХСН, n (%) |
12 (48) |
4 (32) |
8 (64) |
0,1 |
|
ХБП, n (%) |
10 (40) |
3 (24) |
7 (56) |
0,1 |
Лабораторные данные (на момент госпитализации)
|
Уровень креатинина, мкмоль/л |
193 (109; 242) |
159 (100; 262) |
208 (153; 232) |
0,78 |
|
СКФ, мл/мин/1,73м2 |
27 (16; 55) |
28 (15; 60) |
27 (16; 30) |
0,85 |
|
АЛТ, Ед/л |
78 (18; 110) |
105 (68; 110) |
18 (11; 84) |
0,16 |
|
АСТ, Ед/л |
101 (28; 242) |
160 (99; 242) |
32 (26; 198) |
0,34 |
|
КФК-МВ, нг/мл |
49 (19; 127) |
95 (24; 135) |
31 (14; 61) |
0,36 |
|
Уровень лактата, ммоль/л |
6 (4,8; 10) |
10 (10; 10) |
5,4 (4,2; 9,5) |
0,00001 |
Консервативная терапия
|
ДДТ, n (%) |
23 (92) |
11 (84) |
12 (100) |
0,5 |
|
иАПФ, n (%) |
4 (16) |
1 (8) |
3 (25) |
0,3 |
|
БАБ, n (%) |
10 (40) |
2 (15) |
8 (67) |
0,01 |
|
Антикоагулянты, n (%) |
24 (96) |
12 (92) |
12 (100) |
1,0 |
Поражение коронарного русла, стенозы более 70%
|
Передняя нисходящая артерия, n (%) |
13 (52) |
5 (40) |
8 (64) |
0,2 |
|
Огибающая артерия, n (%) |
11 (44) |
4 (32) |
7 (56) |
0,3 |
|
Правая коронарная артерия, n (%) |
10 (43) |
3 (24) |
7 (56) |
0,1 |
Маркеры активности системной воспалительной реакции (на момент госпитализации)
|
Уровень лейкоцитов в крови, количество клеток*109/л |
12,5 (9; 15,6) |
13,2 (10,4; 15) |
11,3 (8,8; 18) |
0,6 |
|
t тела, ˚ |
36,2 ± 1,3 |
35,8 ± 2,1 |
36,6 |
0,5 |
Осложнения ИМ
|
Аневризма ЛЖ, n (%) |
5 (20) |
3 (24) |
2 (16) |
1,0 |
|
Постинфарктная стенокардия, n (%) |
8 (32) |
1 (8) |
7 (56) |
0,01 |
|
Срок наступления летального исхода, сут |
2 (1; 10) |
1 (1; 2) |
12 (8; 16) |
0,000002 |
Примечание: * – статистически значимые различия между группами, АЛТ – аланинаминотрансфераза, АСТ – аспартатаминотрансфераза, БАБ – бета-адреноблокаторы, ДДТ – двойная дезагрегантная терапия, иАПФ – ингибиторы ангиотензин-превращающего фермента, ИМ – инфаркт миокарда, ИМспST – инфаркт миокарда с подъемом сегмента ST, КФК – креатинфосфокиназа, ХСН – хроническая сердечная недостаточность, ХБП – хроническая болезнь почек, СКФ – скорость клубочковой фильтрации, ЛЖ – левый желудочек, ЧКВ – чрескожное коронарное вмешательство.
Таблица 2 . Концентрация CD68+, CD163+ , CD206+ и стабилин+ клеток в исследуемых тканях у пациентов с ИМ КШ с фатальным исходом
Table 2 . Quantity of CD68+, CD163+, CD206+ and stabilin+ cells in the studied tissues in patients with fatal MI CS
|
Параметры (клетки) |
Все пациенты, n = 25 |
1-я группа, n = 13 |
2 группа, n = 12 |
р |
|
CD68+ (ИЗ миокарда) |
106 (56; 376) |
59 (52; 95) |
376 (136; 634) |
0,0001 |
|
CD68+ (пери-ИЗ миокарда) |
78 (44; 154) |
48 (36; 83) |
154 (85; 232) |
0,005 |
|
CD68+ (не-ИЗ миокарда) |
67 (38; 115) |
44 (33; 75) |
95 (61; 141) |
0,04 |
|
CD68+ (селезенка БП) |
312 (260; 348) |
334 (286; 336) |
312 (256; 360) |
0,8 |
|
CD68+ (селезенка КП) |
898 (807; 1049) |
884 (792; 1052) |
912 (818; 1046) |
0,9 |
|
CD68+ (почки) |
30 (23; 51) |
30 (24; 49) |
35 (23; 51) |
1 |
|
CD68+ (головной мозг) |
32 (20; 67) |
44 (20; 74) |
29 (23; 54) |
0,4 |
|
CD163+ (ИЗ миокарда) |
460 (62; 846) |
82 (34; 285) |
697 (545; 982) |
0,002 |
|
CD163+ (пери-ИЗ миокарда) |
82 (49; 135) |
62 (42; 78) |
135 (82; 220) |
0,007 |
|
CD163+ (не-ИЗ миокарда) |
66 (45; 93) |
70 (45; 87) |
63 (59; 121) |
0,4 |
|
CD163+ (селезенка БП) |
312 (260; 348) |
334 (286; 336) |
312 (256; 360) |
0,8 |
|
CD163+ (селезенка КП) |
898 (807; 1049) |
884 (792; 1052) |
912 (618; 1046) |
0,9 |
|
CD163+ (почки) |
55 (32; 97) |
55 (34; 72) |
58 (32; 97) |
0,8 |
|
CD163+ (головной мозг) |
10 (5; 14) |
10 (6; 13) |
8 (1; 17) |
0,6 |
|
CD206+ (ИЗ миокарда) |
31 (12; 106) |
21 (12; 43) |
99 (31; 249) |
0,02 |
|
CD206+ (пери-ИЗ миокарда) |
24 (12; 41) |
16 (11; 29) |
36 (15; 43) |
0,1 |
|
CD206+ (не-ИЗ миокарда) |
15 (4; 33) |
16 (5; 36) |
14 (4; 16) |
0,2 |
|
CD206+ (селезенка БП) |
2 (1; 5) |
2 (2; 5) |
2 (1; 6) |
0,8 |
|
CD206+ (селезенка КП) |
11 (9; 19) |
15 (10; 20) |
11 (9; 16) |
0,4 |
|
CD206+ (почки) |
4 (2; 6) |
6 (5; 8) |
2 (1; 2) |
0,0001 |
|
CD206+ (головной мозг) |
7 (3; 9) |
6 (2; 9) |
7 (6; 8) |
0,7 |
|
Стабилин-1+ (ИЗ миокарда) |
1 (0; 102) |
0 (0; 1) |
126 (42; 216) |
0,0003 |
|
Стабилин-1+ (пери-ИЗ миокарда) |
1 (0; 13) |
0 (0; 2) |
24 (1; 70) |
0,02 |
|
Стабилин-1+ (не-ИЗ миокарда) |
0 (0; 3) |
0 |
0 (0; 13) |
0,2 |
|
Стабилин-1+ (селезенка БП) |
64 (47; 135) |
108 (54; 140) |
56 (40; 115) |
0,3 |
|
Стабилин-1+ (селезенка КП) |
807 (526; 985) |
898 (561; 934) |
640 (483; 1028) |
0,7 |
|
Стабилин-1+ (почки) |
2 (1; 3) |
1 (1; 4) |
2 (1; 2) |
0,8 |
|
Стабилин-1+ (головной мозг) |
8 (5; 12) |
8 (3; 12) |
10 (6; 16) |
0,4 |
Примечание: БП – белая пульпа, ИЗ – инфарктная зона, КП – красная пульпа.
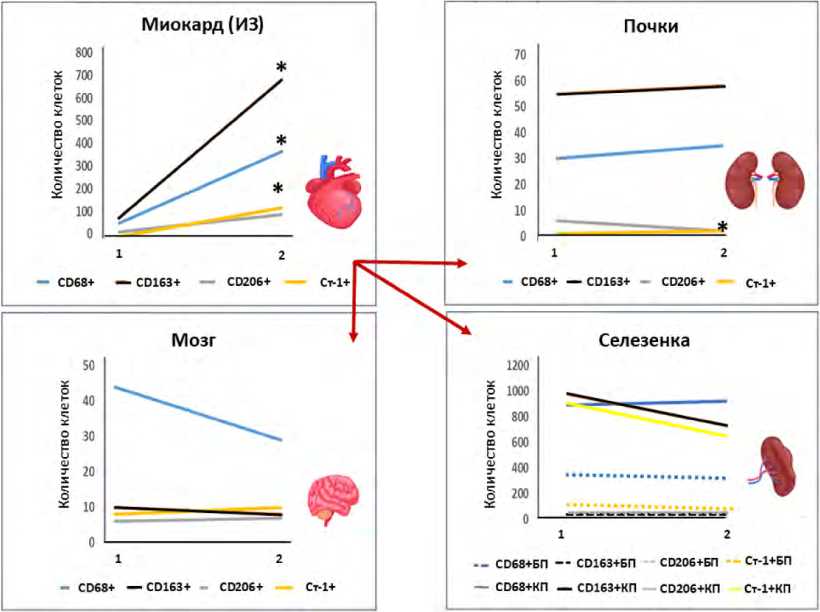
Рис. 1. Изменение концентрации всех исследуемых клеток в тканях у больных с фатальным ИМ КШ в зависимости от срока наступления летального исхода. 1 – 1-я группа, 2 – 2-я группа.
Примечание: БП – белая пульпа, ИЗ – инфарктная зона, КП – красная пульпа.
Fig. 1. Changes in the concentration of all studied cells in tissues of patients with fatal MI CS depending on the time of death.1 – group 1, 2 – group 2.
Note: BP – white pulp of the spleen, IA – infarct area, RP – red pulp of the spleen.
де было обнаружено, что большее содержание CD68+ в ИЗ миокарда ассоциировано с большей концентрацией CD163+ ( r = 0,7; p = 0,0004) и стабилин-1+ клеток ( r = 0,7; p = 0,000002). В отдаленной же от ИМ зоне миокарда количество CD163+ клеток было ассоциировано с количеством стабилин-1+ клеток ( r = 0,7; p = 0,0002).
При анализе межорганных корреляций обращает на себя внимание большое количество межорганных взаимодействий на клеточном уровне в ранний постинфарктный период, чего нельзя сказать об отдаленном периоде наблюдения (табл. 3).
Количество CD163+ клеток в ГМ статистически значимо коррелировало с возрастом ( r = –0,7; p = 0,0006).
Таблица 3 . Межорганная корреляция между клетками макрофагального ряда в миокарде и остальными исследуемыми органами у пациентов с ИМ КШ
Table 3 . Interorgan correlation between macrophage cells in the myocardium and other investigated organs in patients with MI CS
|
A |
CD68+H3 |
D68+ ери ИЗ |
Стабилин- Стабилин- CD163+ |
CD2O6+ CD2O6+H3 пери-ИЗ |
|||
|
1+ ИЗ |
1+ пери-ИЗ CD163+M3 пери-ИЗ |
||||||
|
CD68+почки |
0.301269 |
0.362392 |
0.291735 |
0.240927 0.163178 |
0.066359 |
■0.201337 |
0.303876 |
|
CD2O6+ почки |
-0,583694 |
-0,362895 |
-0,391116 -0,114122 0,513365 |
-0,417044-0,365293 |
-0,298499 |
||
|
CD163+почки |
0,231968 |
0.167075 0.253353 |
0.071878-0.063521 |
-0.136696 |
-0.062376 |
-0,109617 |
|
|
Стабилин-1+ почки |
0.259720 |
0.232353 0.093357 |
-0.045869-0.050336 |
0.080435-0,224648 |
0.009800 |
||
|
СО68+БП |
-0,186902 |
-0.133922-0.113685 |
-0.259810-0.488595 |
-0,402504-0.392811 |
-0,107306 |
||
|
СО68+КП |
0,050000 |
-0,008824 |
0,285539 |
-0,006294-0,205882 |
-0.055407 |
-0.419896 |
0,113896 |
|
СО163+БП |
0,026529 |
0.179809 0.090775 |
0,120635 0,409728 |
0,395703 0,523548 |
0,679636 |
||
|
CD163+КП |
-0.447059 |
-0.379412-0.095130 |
-0.561721 -0.255882 |
-0.396783 -0.430946 |
0.104784 |
||
|
С02О6+БП |
0.161826 |
0,005994 0,151726 |
0.064128 0.482482 |
0.591550 0.504275 |
0.063101 |
||
|
СО206+КП |
-0,245384 |
-0,094606 |
0,185175 |
0.198492 0,038434 |
0,052112 |
-0,152778 |
-0,508010 |
|
Стабилин-1+БП |
-0,060339 |
0,147167-0.141339 |
-0,007873 0.176600 |
0,085868 |
0,237900 |
-0,004566 |
|
|
Стабилин 1+ КП |
-0.481236 |
-0.412068 |
0.003073 |
-0.314134-0.391464 |
-0,411081 |
-0.381746 |
-0,349315 |
|
СО163+ГМ |
-0.200662 |
0.030837 |
0,014902 |
0.058531 -0.253095 |
-0.329325 0,096554 |
0,301258 |
|
|
CD206+ГМ |
0,410859 |
0.592933 |
0,354528 |
0,447272 0,335192 |
0,527454 -0,027342 |
0,544725 |
|
|
Стабилин-1+ ГМ |
0,027544 |
0.018114 |
0,207399 |
0,221080 0,130498 |
-0.169227 0,092564 |
0,015329 |
|
|
CD68+ ГМ |
-0,295601 |
-0.128028 |
-0,114765 |
0,076761 0,041231 |
-0,290637 |
-0,065150 |
0,162791 |
|
Б |
CD68+ Стабилин- Стабилин- CD163+ |
CD206+ |
|||||
|
CD68+ ИЗ |
пери-ИЗ 1 |
+ ИЗ |
+ пери-ИЗ СО161+ИЗ пери-ИЗ |
ED206+M3 пери-ИЗ |
|||
|
CD68+ почки |
0,487117 |
0,511043 |
0,551435 |
0.274734 0,411441 |
0,276708 |
-0,395577 |
0,226309 |
|
CD206+ почки |
-0,236603 |
-0,121683 |
0,400491 |
0.588559 -0,064594 |
0,096275 |
-0,143267 |
0.189445 |
|
CD163+ почки |
0,458614 |
0,491723 |
0,383184 |
0,174786 *0,116484 |
0,034965 |
*0.270722 |
*0,269124 |
|
Стабилин-1+ почки |
0,472001 |
0,472790 |
0,158400 |
0,013648 -0,119204 |
0,086683 |
*0,040929 |
0,031969 |
|
CD68+ БП |
0,126131 |
-0,342356 |
-0,764093 |
-0.76409 3 -0.576600 |
-0.69 5725 |
-0.635764 |
0,132353 |
|
CD68+ КП |
0,035714 |
0,000000 |
-0,400892 |
-0,400892 -0,714286 |
-0,542857 |
-0,667124 |
0,463817 |
|
CD 163+ БП |
-0,054056 |
0,666694 |
0,539360 |
0,539360 0,540562 |
0,405840 |
0,411377 |
0,602941 |
|
CD163+ КП |
-0,678571 |
-0,571429 |
-0,75 7240 |
-0.757240 -0,571429 |
0.885714 |
■0,630062 |
0,000000 |
|
CD206+ БП |
0,037062 |
0,333562 |
0,231125 |
0,231125 0,704187 |
0,516100 |
0.384615 |
-0,123208 |
|
CD206+ КП |
-0,46429 |
-0,32143 |
0,22272 |
0,22272 0,28571 |
0,42857 |
0.18531 |
-0.69573 |
|
Стабилин-1+ БП |
0,035714 |
0,464286 |
0,489979 |
0,489979 1,000000 |
0,657143 |
0.852437 |
0,318874 |
|
Стабилин-1* КП |
-0.792825 |
-0,738769 |
-0,516887 |
-0,516887 -0,306319 |
-0,428571 |
-0,373979 |
-0,279412 |
|
CD163+TM |
-0,395217 |
0,047619 |
-0,463713 |
-0,280945 -0,750000 |
-0,657143 |
-0,296500 |
-0,144943 |
|
СО206+ГМ |
0,584337 |
0.778457 |
0,631144 |
0.745122 0,575500 |
0.89 8645 |
0,785355 |
0,514706 |
|
Стабилин-1+ГМ |
-0,298621 |
-0,252787 |
0,109316 |
-0,027319 -0.152224 |
-0.424004 |
-0,287037 |
0,046610 |
|
СО68+ГМ |
-0,566713 |
-0,429161 |
-0,191415 |
-0,102210 0.237762 |
-0.363536 |
-0,211018 |
0.369761 |
|
В |
CD68+ Стабилин- Стабилин- |
:di63+ |
CD206+ |
||||
|
СО68+ИЗ пери-ИЗ 1+ |
ИЗ 1+пери-ИЗ CD163+ИЗ |
тери-ИЗ С0206+ИЗ |
пери-ИЗ |
||||
|
CD68+почки |
0,262071 |
0,226209 |
0.308012 |
0,298893 0.013793 |
0,102070 |
-0,127660 |
0.309524 |
|
CD2O6+почки |
0,026836 |
0,053671 |
-0,135855 |
0,054347 -0,116288 |
0,023854 |
0,059005 |
•0.5 75720 |
|
CD163+почки |
0,153846 |
-0,016484 |
0,266850 |
-0,036164 0,159341 |
-0,148352 |
0,236364 |
0,095238 |
|
Стабилин-1+ почки |
0,264117 |
0,284650 |
0,214523 |
-0,050517 0,158470 |
0,255313 |
-0,287881 |
0,242634 |
|
СО68+БП |
-0,383333 |
-0,083333 |
-0,209207 |
-0,059849 0.683333 |
-0,633333 |
-0.542857 |
-0,600000 |
|
CD68+КП |
0,116667 |
0,166657 |
0,577411 |
0,307794 0,033333 |
0,016667 |
*0,257143 |
*0,500000 |
|
СО163+БП |
-0.166667 |
-0,116667 |
-0.167365 |
-0,282144 0,200000 |
0.283333 |
0,485714 |
0,400000 |
|
СО163+КП |
-0,150000 -0,166667 |
0.267785 |
-0,367642 0,016667 |
-0.083333 |
-0.142857 |
-0,100000 |
|
|
СО2О6+БП |
0,075955 |
0,016879 |
0,063562 |
-0,164516 0,5 31688 |
0,573886 |
0,927634 |
0,400000 |
|
СО2О6+КП |
0,217575 |
0.435150 |
0,491597 |
0,390648 0,075314 |
0,125524 |
-0,142857 |
*0,200000 |
|
Стабилин-1+ БП |
-0,083683 |
0.133892 |
-0,302521 |
-0,231813 -0.083683 |
-0,100419 |
0,115954 |
*0.205196 |
|
Стабилин-1+КП |
-0,550000 |
-0,433333 |
-0,125524 |
-0,350543 -0,515667 |
-0.583333 |
-0,428571 |
-0,700000 |
|
CD163+ГМ |
0,200000 |
0,028571 |
0,714285 |
0.347863 0.314285 |
0,314286 |
0.400000 |
1.000000 |
|
СО2О6+ГМ |
0,144943 |
0.405840 |
0,637748 |
0,250000 0.492805 |
0,492805 |
-0,400000 |
1,000000 |
|
Стабилин-1+ ГМ |
0,078788 |
0,115152 |
0,097265 |
0,401303 -0,042424 |
-0,175758 |
0,071429 |
•0,257143 |
|
СО68+ГМ |
0,285716 |
0,370822 |
0,210366 |
0,532572 0,036474 |
0,012158 |
0,357143 |
-0,257143 |
Примечание: БП – белая пульпа, ГМ– головной мозг, ИЗ – инфарктная зона, КП – красная пульпа. А – вся выборка, Б – ранний постинфарктный период, В – отдаленный постинфарктный период.
Обсуждение
В настоящий момент одним из ключевых аспектов ведения пациентов с ИМ КШ является восстановление и поддержание оптимальных параметров гемодинамики путем использования современных достижений фармакологии и сердечно-сосудистой хирургии. Однако, как показывает реальная клиническая практика, данный подход достиг своего предела в отношении влияния на исходы и прогнозы данного осложнения ИМ [9]. Одним из возможных механизмов развития и прогрессирования ИМ КШ является развитие СВР в ответ на возникающую гипоксию и гипоперфузию органов, а также зачастую сочетанное воздействие инфекционной патологии [10]. Понимание клеточно-молекулярных изменений, происходящих как на системном, так и на органном уровне, позволит нам приблизиться к пониманию места и роли СВР в процессе развития ИМ КШ.
Само течение постинфарктной воспалительной реакции в тканях миокарда было описано ранее, имеются данные о вовлеченности в этот процесс межорганных связей – кардиоренальной, кардиоспленальной и кар-диоцеребральной [10–12]. Влияние СВР на возникновение таких осложнений, как развитие острого почечного повреждения, острого делирия при ИМ также активно изучается исследователями. Ряд косвенных данных указывают и на вовлеченность СВР в их развитие и прогрессирование [16]. Однако большинство ранее полученной информации о месте и роли СВР в развитии и прогрессировании ИМ и его осложнений не систематизировано, отсутствует комплексная оценка полученных данных, зачастую исследования носят экспериментальный характер. Несмотря на тот факт, что ранее нами были освещены отдельные аспекты данного исследования, настоящая статья служит аккумуляцией полученных данных с их комплексной обработкой.
Безусловно, для полного понимания активности течения воспалительной реакции при ИМ как на локальном, так и на системном уровне нам не хватает комплексного понимания динамики уровня циркулирующих в крови маркеров активности СВР и ее последующего сопоставления с клеточными изменениями, происходящими на органном уровне. Кроме того, значимый вклад в понимание данного процесса внесла бы прижизненная оценка активности течения воспалительного процесса в миокарде с последующим определением когорты пациентов с неадекватным воспалительным ответом, возникающим в ответ на ишемию миокарда. Однако в настоящий момент сам вопрос «адекватности» воспалительной постинфарктной реакции, маркеров ее выявления и сроков их оценки остается открытым, равно как и понимание того, какая постинфарктная воспалительная реакция является «неадекватной», «неоптимальной» и связанной с неблагоприятными исходами.
Клинические характеристики исследуемой нами группы пациентов с ИМ КШ сопоставимы с мировыми данными. Среди исследуемых нами пациентов количество лиц с ИМ с подъемом сегмента ST преобладало, что соответствует мировой статистике [17]. Известно, что ИМ с подъемом сегмента ST в 2 раза чаще осложняется развитием КШ. Кроме того, помимо фенотипа ИМ существуют и иные предпосылки к большей вероятности развития ИМ КШ у лиц с острым ИМ, такие как передняя локализация ИМ, блокада левой ножки пучка Гиса, анамнез предшествующего ИМ, наличие трехсосудистого поражения ко- ронарного русла, пожилой возраст, гипертония, сахарный диабет, возникновение других механических осложнений острого ИМ [17]. Для исследуемой нами выборки пациентов была характерна большая частота повторного ИМ (более чем 50% случаев). Кроме того, интересен и тот факт, что помимо ранее перенесенного острого ИМ зачастую пациенты исследуемой выборки имели в анамнезе ХСН, что также могло вносить определенные коррективы в полученные данные относительно клеточного состава миокарда и других органов, так как существует информация о том, что врожденная иммунная система является более активной у лиц с рецидивирующими событиями [2].
При анализе концентрации исследуемых клеток в миокарде и других органах было обнаружено, что их количество возрастает в ИЗ миокарда, тогда как «на периферии» – в тканях ГМ, селезенки и почек какой-либо динамики исследуемых клеток отмечено не было, кроме снижения уровня CD206+ клеток в почках.
Наиболее интенсивный рост количества изучаемых клеток в ИЗ и пери-ИЗ миокарда был характерен для стабилин-1+ клеток. Стабилин-1+ представляет собою рецептор-мусорщик класса H4, который экспрессируется на тканевых МФ и синусоидальных эндотелиоцитах. Экспрессия данного рецептора увеличивается на выше-обозначенных клетках при хронических воспалительных процессах и при онкогенезе. Данные рецепторы активно принимают участие в поглощении продуктов апоптоза и коагуляции крови, обеспечении контакта клеток с экс-траклеточным матриксом. Вероятно, они участвуют в кофакторном связывании отдельных бактерий и продуктов их деградации, что, в свою очередь, ведет к развитию умеренного клеточного стресса и ограничению провоспа-лительной активности МФ и, возможно, эндотелиоцитов. Эти процессы в совокупности обеспечивают регенерацию (включая ангиогенез) в норме и при разрешении воспаления [18]. Вероятно, значимый рост количества данных клеток отражает активность регенераторной фазы и подтверждает результаты эксперимента, указывающие на преобладание МФ М2 типа в регенераторную фазу ИМ. Однако, возможно, высокая концентрация стабилин-1+ клеток в ИЗ миокарда на фоне сохраняющейся высокой концентрации клеток с воспалительным фенотипом – CD68+ не способна в оптимальном режиме обеспечить регенераторные потребности миокарда, что в свою очередь связано с неблагоприятным исходом.
Подобную информацию о сочетанно протекающих процессах воспаления и регенерации подтверждает и факт наличия взаимосвязи между уровнем стабилин-1+ и CD68+ клеток в ИЗ миокарда. Связь между активностью течения СВР и неблагоприятным исходом подтверждают и данные о наличии корреляции между концентрацией CD68+ клеток в КП и развитием осложнения ИМ – аневризмы левого желудочка. Это может указывать на то, что неадекватная затяжная СВР при ИМ сопряжена с неблагоприятными исходами [2]. Сам по себе CD68 является рецептором-мусорщиком класса D и широко представлен на моноцитах и стромальных МФ [19]. Данный тип клеток участвует как в фагоцитозе патогенов, так и в фагоцитарной активности тканевых МФ: во внутриклеточном лизосомальном метаболизме и во внеклеточных взаимодействиях «клетка – клетка», причем последняя функция является более выраженной [19].
Помимо вышеуказанной корреляции уровень стаби-лин-1+ клеток также был взаимосвязан с количеством других клеток макрофагального ряда М2 типа в не-ИЗ миокарда – CD163+ клеток. CD163 представляют собой рецепторы-мусорщики класса I, экспрессирующиеся на МФ, клетках ретикулоэндотелиальной системы, тимуса, микроглии, моноцитах. Данный тип клеток является участником иммунных и гомеостатических процессов, участвует в фагоцитозе старых эритроцитов и продуктов метаболизма железа, проявляет как противовоспалительную, так и умеренную провоспалительную активность [20]. Высокая концентрация данного типа клеток в ИЗ миокарда сопряжена с низким содержанием данного типа клеток в ГМ, что ввиду существования определенного дуализма в отношении понимания роли и места CD163+ клеток в процессе течения воспалительной реакции может указывать на то, что активность воспалительной реакции максимально выражена в органе-мишени и по остаточному принципу распределена на периферии; а также возможно, что регенераторная потребность в миокарде в условиях его ишемии значимо больше, чем на периферии. Подобное предположение также подтверждает наличие обратной взаимосвязи между уровнем CD163+ в ИЗ и СD206+ в почках. Интересен и тот факт, что количество CD163+ клеток снижалось с возрастом, что подтверждалось наличием обратной корреляции между этими показателями. Кроме того, у лиц с наличием ХСН в анамнезе концентрация СD163+ клеток в миокарде была ниже, что, возможно, указывает на истощение запаса данного типа клеток в ходе хронического течения заболевания.
Меньшее количество CD163+ клеток в КП, равно как и меньшее число CD68+ клеток, было ассоциировано с более редкой встречаемостью осложнений ИМ, таких как рецидив ИМ и развитие аневризмы левого желудочка. КП выполняет фильтрационную функцию, и, вероятно, ее клеточный состав может служить косвенным отражением активности течения СВР в организме [18]. Это может подтверждаться тем, что со временем количество CD68+, стабилин-1+ и CD163+ клеток в ИЗ миокарда нарастает и становится сопоставимым с их концентрацией в КП селезенки, что, возможно, также характеризует ее фильтрационную функцию. Однако помимо корреляций между уровнем данных клеток в КП также были обнаружены корреляции между количеством CD206+ клеток в БП селезенки c концентрацией CD206+ и CD163+ клеток в ИЗ миокарда, что, вероятно, также свидетельствует о роли БП селезенки в процессах иммуногенеза [10] и может подтверждать тот факт, что несмотря на активный иммуногенез, процесс поступления МФ М2 типа в ткани миокарда либо неоптимальный, либо несвоевременный, что в итоге может приводить к неблагоприятному течению и исходам заболевания. Однако, исходя из наших данных, вероятно, имеет место угнетение иммуногенеза у данной когорты пациентов: несмотря на активный рост количества исследуемых клеток в миокарде, их количество в БП селезенки, основном источнике иммуногенеза, не изменялось.
Количество клеток в КП и БП селезенки было максимальным для всех типов клеток, кроме CD206+; их концентрация была максимальной в ИЗ миокарда. Это, возможно, указывает на то, что истощение резервов иммуногенеза сопряжено с летальным исходом. Кроме того, это подтверждает тот факт, что сниженный генез CD206+ клеток, который отражен как в их малом количестве в БП селезенке, так и в наименее интенсивном приросте к отдаленному периоду ИМ, может указывать на важность своевременного и оптимального содержания концентрации М2 МФ в процессах постинфарктной регенерации [18]. CD206 – маннозный рецептор, рецептор-мусорщик класса Е, экспрессирующийся на дендритных клетка и стромальных МФ различных органов, является маркером альтернативно активированных МФ М2 типа [17]. Рецептор CD206 способствует синтезу противовоспалительных цитокинов (включая IL-10) и высоко экспрессируется на связанных с гемоглобином (Hb) МФ – M-(Hb), которые в свою очередь играют протективную роль при атеросклерозе. Другой интересной находкой было снижение CD206+ МФ в почках у лиц с ИМ КШ, которое в свою очередь было ассоциировано с летальным исходом. Подобные находки, равно как и невыраженный прирост концентрации CD206+ клеток в миокарде, возможно, указывают на тканевое происхождение CD206+ клеток и недостаточную для процессов активной регенерации поляризацию МФ М2 типа.
Интересно, что стабилин-1+ и CD206+ клетки представляют собой один тип МФ – М2, противовоспалительный. Однако содержание данных клеток как в миокарде, так и в периферических органах, а также изменение их концентрации с течением времени несопоставимы, что, вероятно, может отражать их разную природу, в том числе источники происхождения – пришлые или тканевые МФ [18]. Возможно, CD206+ клетки относятся к резидентным, так называемым тканевым МФ, и истощаются в процессе ишемии тканей, в то время как стабилин-1+ клетки представлены преимущественно МФ, поляризованными в условиях ишемии до МФ М2 типа, число которых растет в ответ на ИМ с целью последующей регенерации миокарда, на что указывает их наиболее значимый рост к отдаленному периоду ИМ. Тот факт, что концентрация ста-билин-1+ клеток сопоставима с аналогичной по CD68+ и СD163+ клеткам в ИЗ миокарда, указывает на то, что активность процессов репарации и регенерации миокарда и пополняемость ИЗ моноцитами характерны именно для данных типов клеток.
Как было отмечено ранее, данная статья носит описательный характер, для более глубокого понимания течения воспалительной реакции у пациентов с ИМ и его осложнениями Для оценки ее роли в течении и прогрессировании данного заболевания необходим комплексный анализ, позволяющий сопоставить полученные нами ау-топсийные данные с динамикой суррогатных маркеров течения СВР – сывороточных маркеров, отражающих активность воспалительной реакции. Кроме того, необходимо сравнение представленных результатов с данными об активности течения воспалительной реакции прижизненно как у пациентов с ИМ и его осложнениями, так и у лиц из контрольной группы (здоровые добровольцы).
Немаловажным будет сопоставление полученных данных с клиническим течением самого ИМ, а также его осложнений: сравнение с клинико-анамнестическими данными, параметрами гемодинамики, активностью маркеров некроза миокарда и гемодинамического стресса. Современные возможности лабораторной диагностики, визуализирующих методик позволяют нам приблизиться к решению поставленной задачи. Благодаря совместным усилиям многопрофильной команды кардиологов, анестезиологов-реаниматологов, врачей функциональной диагностики, врачей клинической лабораторной диагностики, специалистов по визуализирующим методикам, патологоанатомов становится возможным поиск роли СВР в развитии и прогрессировании ИМ и его осложнений. Понимание ключевых маркеров развития «неадекватной» воспалительной постинфарктной реакции, конкретизация временных сроков их определения и референсных значений у лиц с ИМ и его осложнениями могут стать ключевыми аспектами в персонализированном подходе ведения данной когорты больных, направленном на улучшение прогноза и исходов и способном оказывать влияние на принятие важных клинических решений, таких как назначение противовоспалительной и эфферентной терапии.
Выводы
Комплексный анализ макрофагальной инфильтрации тканей – миокарда, почек, ГМ и селезенки у пациентов с фатальным ИМ КШ показал, что максимальное, неизменно высокое содержание исследуемых клеток – CD68+, CD163+, CD206+, стабилин-1+ характерно для одного из ведущих органов иммуногенеза – селезенки. Активное течение СВР на уровне миокарда у лиц с ИМ КШ нашло свое отражение в повышении содержания всех исследуемых типов клеток в ИЗ миокарда. Снижение регенераторных возможностей организма при ИМ КШ отразилось в снижении содержания количества CD206+ клеток в почках. Большое количество межорганных взаимосвязей между клетками макрофагального ряда в раннем периоде ИМ, а также наличие связей между концентрацией макрофагальных клеток в тканях и клиническими данными подтверждают ценность проведения последующего комплексного анализа клеточного состава ткани инфар-цированного миокарда в сочетании с динамикой уровня сывороточных маркеров, отражающих активность СВР у пациентов с ИМ КШ.


