Маркеры миокардиального фиброза при коронарной патологии
Автор: Разин Владимир Александрович, Гимаев Ринат Худзятович, Чернышева Елена Владимировна, Каюмова Гюзелия Хатыбуловна, Сапожников А.Н.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Внутренние болезни
Статья в выпуске: 1, 2014 года.
Бесплатный доступ
Статья посвящена изучению плазменных маркеров фиброза (инсулиноподобный фактор роста-1, тканевой ингибитор матриксной металлопротеазы-1, альдостерон) при стенокардии, постинфарктном кардиосклерозе и в острой стадии инфаркта миокарда. Выявлено изменение плазменных концентраций маркеров фиброза при данных патологиях в сравнении с практически здоровыми. Наибольшие изменения концентраций плазменных маркеров фиброза отмечаются при остром инфаркте миокарда.
Инфаркт миокарда, миокардиальный фиброз, инсулиноподобный фактор роста-1, тканевой ингибитор матриксной металлопротеазы-1, альдостерон
Короткий адрес: https://sciup.org/14112963
IDR: 14112963 | УДК: 616.127-005.8
Текст научной статьи Маркеры миокардиального фиброза при коронарной патологии
Введение. Установлено, что при ИБС развивается ряд структурно-функциональных изменений в сердце, которые появляются по мере прогрессирования заболевания и совокупность которых обозначается как «ремоделирование сердца» [2, 4]. В основе процесса ишемического ремоделирования миокарда лежат три фундаментальных механизма: фиброз, гипертрофия и гибель кардиомиоцитов [1, 8].
Развитие острого инфаркта миокарда (ИМ) приводит к комплексным архитектурным изменениям как поврежденного, так и неповрежденного миокарда. Дилатация левого желудочка и истончение в месте инфаркта – наиболее значимые структурные изменения, которые повышают риск развития осложнений. Одним из ведущих механизмов в процессе заживления ИМ является повреждение и потеря экстрацеллюлярного матрикса, что играет ведущую роль в патогенезе ремоделирования миокарда ЛЖ. Матриксные металлопротеазы, которые присутствуют в миокарде и способны привести к деградации всех компонентов экстрацеллюлярного матрикса сердца, являются движущей силой ремоделирования миокардиального матрикса.
Тканевой ингибитор матриксной метал-лопротеазы-1 (ТИММП-1) – это протеин, являющийся естественным ингибитором ме-таллопротеаз. Он образует комплексы с ММП-1 и другими металлопротеазами, необратимо ингибируя их активность. А. Bayes-Genis и соавт. представили гистологические данные об экспрессии в разорванных и эро-зированных бляшках обнаруживаемого при беременности плазменного протеина А (РАРР-А), металлопротеиназы и инсулиноподобного фактора роста-1 (ИПФР-1). Такой экспрессии не отмечалось в стабильных бляшках [7]. Увеличение уровня альдостерона при остром инфаркте миокарда отмечено в работах Л.Т. Малой и соавт. [3]. Этот факт считался результатом активации ренин-ан-гиотензин-альдостероновой системы (РААС) и следствием стимуляции ангиотензином II надпочечникового синтеза альдостерона. Вместе с тем гибель части кардиомиоцитов в результате острого ИМ является пусковым фактором активации миокардиальной РААС, что ведет к избыточному образованию ангиотензина II и альдостерона [5].
Миокардиальное образование альдостерона и ангиотензина II после острого инфаркта миокарда стимулирует образование коллагена и фиброзной ткани в миокарде с дальнейшим изменением структуры и геометрических характеристик левого желудочка, приводя к нарастанию процессов постинфарктного ремоделирования [6].
Цель исследования. Изучение маркеров интерстициального миокардиального фиброза у пациентов с различной коронарной патологией.
Материалы и методы. В соответствии с целью и поставленными задачами проводилась серия открытых одномоментных сравнительных исследований. Из обследованных на первом этапе больных в дальнейшем были сформированы группы в соответствии с диагнозом. Обследовано 35 пациентов со стабильной стенокардией 2–3 ФК, 31 пациент с инфарктом миокарда левого желудочка и 36 пациентов с постинфарктным кардиосклерозом. Исследуемые группы были сопоставимы по полу и возрасту. Группу сравнения составили 42 практически здоровых человека, репрезентативных по полу и возрасту.
Концентрацию альдостерона плазмы определяли с использованием иммунофермент-ного анализа (ИФА) при помощи набора реактивов EIA-4128 фирмы DRG (Германия). Референтные величины – 40–310 пг/мл.
Концентрация инсулиноподобного фактора роста-1 определялась иммунофермент-ным методом с помощью наборов фирмы DSL (США). Референтные величины – 81–284 нг/мл.
Измерение концентраций тканевого ингибитора матриксной металлопротеиназы-1 производилось с помощью набора фирмы DSL (США). Референтные величины – 92– 116 нг/мл.
Обработка и анализ данных выполнялись на компьютере с использованием статистического программного пакета Statistica 6.0.
Результаты и обсуждение. Полученные результаты наглядно представлены графиком на рис. 1. Как видно из представленных данных, у всех пациентов с коронарной патологией уровень ТИММП-1 в плазме крови имеет статистически значимо более высокие значения (р<0,05), чем в плазме практически здоровых лиц (контрольная группа). Наибольший уровень тканевого ингибитора ММП-1 наблюдается при остром инфаркте миокарда, причем концентрация ТИММП-1 в плазме при остром инфаркте миокарда статистически значимо более высокая, чем в плазме пациентов со стабильной стенокардией 2–3 ФК (р=0,0367). Не отмечено статистических различий в концентрации ТИММП-1 при остром инфаркте миокарда и постинфарктном кардиосклерозе (р=0,053). По имеющимся данным, повышение концентрации ТИММП-1 в острую стадию инфаркта миокарда связано с тем, что толщина фиброзной капсулы атеросклеротической бляшки в значительной степени зависит от активности матриксных металлопротеаз, поскольку эти ферменты способны расщеплять белки межклеточного матрикса.
Как видно из данных, представленных на рис. 2, у пациентов с хроническими формами ИБС концентрация ИПФР-1 имеет статистически значимо более низкие значения, чем в контрольной группе. Так, уровень ИПФР-1 статистически значимо ниже, чем в групп-пе контроля, у пациентов со стенокардией 2–3 ФК (р=0,0015) и с постинфарктным кардиосклерозом (р=0,0066). Иная картина наблюдается в острую стадию инфаркта миокарда. Как видно из графика на рис. 2, в острую стадию инфаркта миокарда наблюдается значительное увеличение концентрации ИПФР-1, причем данное увеличение статистически значимо при сравнении со всеми группами: контрольной группой (р=0,003), группой с хроническими формами ИБС (р<0,0001).
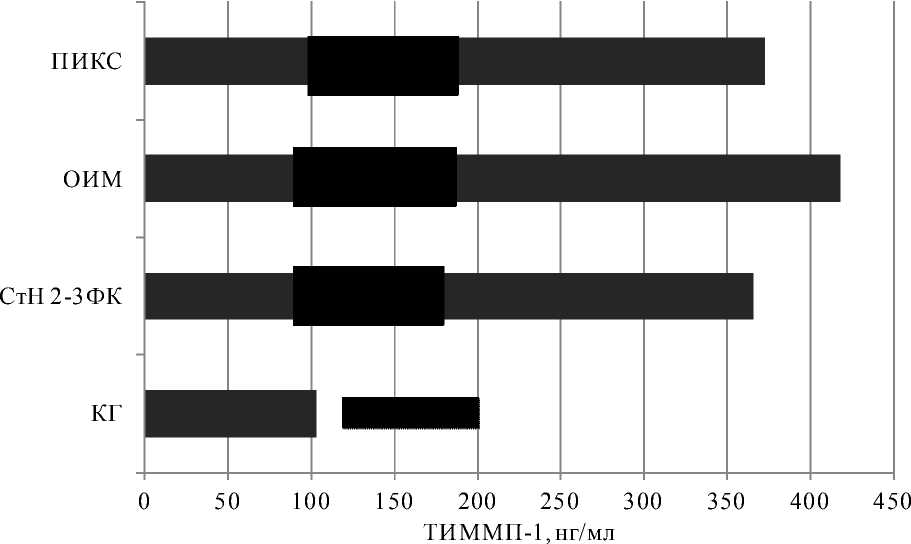
Рис. 1. Уровень ТИММП-1 при коронарных заболеваниях.
* – различие статистически значимо в сравнении с контрольной группой (КГ), р<0,05; # – различие статистически значимо в сравнении с группой пациентов с острым инфарктом миокарда (ОИМ), р<0,05;
СтН – стенокардия напряжения; ПИКС – постинфарктный кардиосклероз
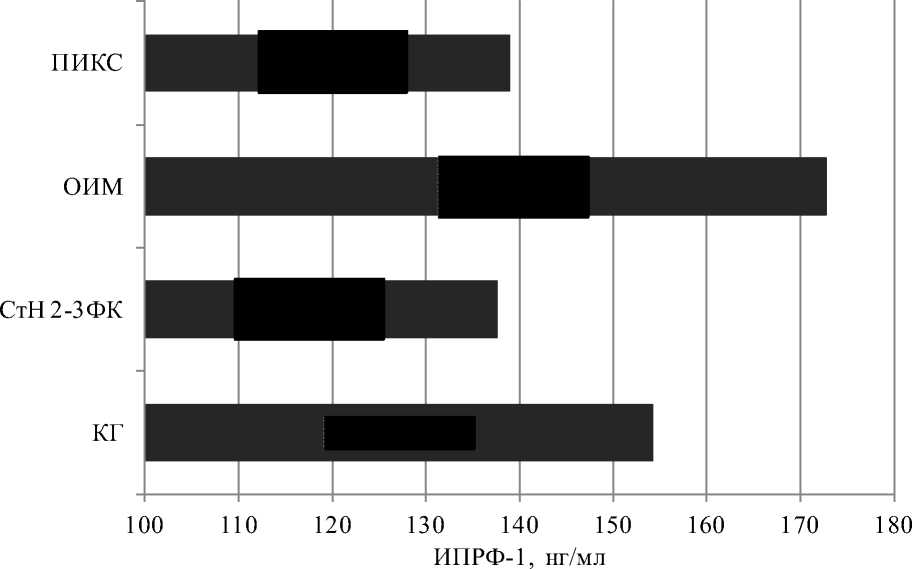
Рис. 2. Уровень ИПФР-1 при коронарных заболеваниях.
* – различие статистически значимо в сравнении с контрольной группой, р<0,05;
# – различие статистически значимо в сравнении с группой пациентов с ОИМ, р<0,05
Полученные результаты исследования концентрации альдостерона в плазме пациентов с коронарными заболеваниями наглядно представлены на рис. 3. Как можно видеть из графика, при коронарных заболеваниях наблюдается статистически значимо (р<0,0001) более высокая концентрация альдостерона в плазме крови, чем у лиц контрольной группы
(практически здоровые). Уровень альдостерона достигает наибольшего значения у пациентов с острым инфарктом миокарда, причем отмечается статистически значимое отличие от концентрации альдостерона в плазме крови пациентов со стенокардией напряжения 2–3 ФК (р=0,0002) и постинфарктным кардиосклерозом (р=0,0058).
ПИКС

ОИМ
СтН 2-3ФК

КГ
82,53\ 25,48
50 70 90 110 130 150 170
Альдостеpон, пг/мл
Рис. 3. Концентрация альдостерона при коронарных заболеваниях.
-
* – различие статистически значимо в сравнении с контрольной группой, р<0,05;
-
# – различие статистически значимо в сравнении с группой пациентов с ОИМ, р<0,05
Таким образом, при коронарных заболеваниях наблюдается статистически значимое увеличение концентрации в плазме крови альдостерона и тканевого ингибитора мат-риксной металлопротеазы-1 по сравнению с практически здоровыми лицами (р<0,05).
Уровень ТИММП-1 у пациентов в острую стадию ИМ составил 418,19±103,77 нг/мл и был статистически значимо выше, чем у практически здоровых лиц – 103,44±7,06 нг/мл (р<0,0001). Уровень ТИММП-1 у пациентов с ОИМ через 2,5–3,0 нед. на фоне проводимой терапии составил 366,70±93,34 нг/мл, причем снижение ТИММП-1, по сравнению с исходным значением в острую стадию, имело статистическую значимость (р=0,046).
Концентрация ИПФР-1 у пациентов с инфарктом миокарда в острую стадию соста- вила 172,81±20,02 нг/мл, через 2,5–3 нед. на фоне проводимой терапии концентрация ИПФР-1 достигала 161,20±22,19 нг/мл. Таким образом, у пациентов с инфарктом миокарда, находящихся на стационарном лечении, отмечается снижение концентрации ИПФР-1 на 6,7 %. Несмотря на то что данное снижение было статистически не значимо (р=0,055), динамика уровня ИПФР-1, по сравнению с исходным значением в острую стадию, имела достаточно выраженную тенденцию к уменьшению.
У пациентов с инфарктом миокарда, находящихся на стационарном лечении, на протяжении 2,5–3 нед. отмечается статистически значимое (р=0,003) снижение концентрации альдостерона в плазме крови на 15,1 % – с 165,12±32,67 до 140,24±22,78 пг/мл.
Выводы:
-
1. В крови пациентов с ишемической болезнью сердца отмечается увеличение концентрации тканевого ингибитора матриксной металлопротеазы-1, альдостерона, которые способствуют появлению и нарастанию дисбаланса между синтезом и распадом коллагена в экстрацеллюлярном матриксе, что приводит к увеличению содержания коллагена в сердце. У пациентов с хроническими формами ишемической болезни сердца отмечается более низкая концентрация инсулиноподобного фактора роста-1 по сравнению с больными артериальной гипертензией и практически здоровыми лицами.
-
2. В острую стадию инфаркта миокарда отмечается значительное увеличение концентрации инсулиноподобного фактора роста-1 и альдостерона. На фоне проводимой терапии наблюдается снижение концентрации инсулиноподобного фактора роста-1 и статистически значимое снижение концентрации альдостерона.
/ Ю. И. Бузиашвили [и др.] // Кардиология. – 2002. – № 10. – С. 88–94.
-
2. Мазур Е. С. Особенности постинфарктного ремоделирования левого желудочка сердца у больных артериальной гипертензией / Е. С. Мазур, В. В. Мазур, Ч. Б. Пун // Кардиология. – 2004. – № 7. – С. 53–56.
-
3. Малая Л. Т. Хроническая сердечная недостаточность: достижения, проблемы, перспективы / Л. Т. Малая, Ю. Г. Горб. – М. : Торсинг, 2002. – 768 с.
-
4. Особенности ремоделирования и состояния диастолической функции левого желудочка у больных с кардиоренальной патологией и хронической почечной недостаточностью / М. М. Дударь [и др.] // Российский кардиологический журн. – 2006. – № 3. – С. 26–30.
-
5. Benjamin I. J. Matrix metalloproteinases: from biology to therapeutic strategies in cardiovascular disease / I. J. Benjamin // J. Invest. Med. – 2001. – Vol. 49. – P. 381–397.
-
6. Delcayre C. Molecular mechanisms of myocardial remodelling. The role of aldosterone / C. Delcayre, B. Swynghedauw // J. Mol. Cell. Cardiology. – 2002. – Vol. 34. – P. 1577–1584.
-
7. Pregnancy-associated plasma protein A as a marker of acute coronary syndromes / A. Bayes-Genis [et al.] // New Engl. J. Med. – 2001. – Vol. 345. – P. 1022–1029.
-
8. Regula K. M. Apoptosis of ventricular myocytes: a means to an end / K. M. Regula, L. A. Kir-shenbaum // J. of Molecular and Cellular Cardiology. – 2005. – Vol. 38. – P. 3–13.
MARKERS OF MYOCARDIAL FIBROSISIN CORONARY ARTERY DISEASE
V.A. Razin1, R.H. Gimaev1, E.V. Chernysheva2, G.H. Kayumova2, A.N. Sapozhnikov1
1Ulyanovsk State University, 2Central Clinical medical unit, Ulyanovsk
Список литературы Маркеры миокардиального фиброза при коронарной патологии
- Ишемическое ремоделирование левого желудочка (определение, патогенез, диагностика, медикаментозная и хирургическая коррекция)/Ю. И. Бузиашвили [и др.]//Кардиология. -2002. -№ 10. -С. 88-94.
- Мазур Е. С. Особенности постинфарктного ремоделирования левого желудочка сердца у больных артериальной гипертензией/Е. С. Мазур, В. В. Мазур, Ч. Б. Пун//Кардиология. -2004. -№ 7. -С. 53-56.
- Малая Л. Т. Хроническая сердечная недостаточность: достижения, проблемы, перспективы/Л. Т. Малая, Ю. Г. Горб. -М.: Торсинг, 2002. -768 с.
- Особенности ремоделирования и состояния диастолической функции левого желудочка у больных с кардиоренальной патологией и хронической почечной недостаточностью/М. М. Дударь [и др.]//Российский кардиологический журн. -2006. -№ 3. -С. 26-30.
- Benjamin I. J. Matrix metalloproteinases: from biology to therapeutic strategies in cardio-vascular disease/I. J. Benjamin//J. Invest. Med. -2001. -Vol. 49. -P. 381-397.
- Delcayre C. Molecular mechanisms of myocardial remodelling. The role of aldosterone/C. Delcayre, B. Swynghedauw//J. Mol. Cell. Cardiology. -2002. -Vol. 34. -P. 1577-1584.
- Pregnancy-associated plasma protein A as a marker of acute coronary syndromes/A. Bayes-Genis [et al.]//New Engl. J. Med. -2001. -Vol. 345. -P. 1022-1029.
- Regula K. M. Apoptosis of ventricular myo-cytes: a means to an end/K. M. Regula, L. A. Kirshenbaum//J. of Molecular and Cellular Cardiology. -2005. -Vol. 38. -P. 3-13.


