Маркеры остеогенеза в периферической крови как патогенетические факторы и предикторы системных эффектов имплантатов для остеосинтеза
Автор: Дружинина Т.В., Хлусов И.А., Карлов А.В., Ростовцев А.В.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2007 года.
Бесплатный доступ
Целью комплексного исследования явился поиск информативных лабораторных показателей для оценки и прогнозирования системных изменений в костной ткани при остеосинтезе длинных трубчатых костей титановыми пластинами с кальцийфосфатным покрытием. Проведены исследования биохимических маркёров костного метаболизма (остеокальцин, CrossLaps, щелочная фосфатаза, кальций) и гормонального статуса (кортизол, соматотропный гормон) в периферической крови 47 здоровых людей (22 мужчин, 25 женщин), пациентов в момент операции биоинертного (13 мужчин, 8 женщин) либо биоактивного (31 мужчины, 26 женщин) остеосинтеза, в динамике (1-6 мес.) биоинертной (21 человек) либо биоактивной (51 пациент) внешней фиксации одиночных переломов бедра или голени. Установлено, что имплантаты с кальцийфосфатным покрытием оказывают системное регулирующее влияние на метаболизм костной ткани. Основной механизм их позитивного действия на репаративную регенерацию костной ткани связан с увеличением депо кальция в организме. Высокое содержание кальция в сыворотке крови является важнейшим предиктором успешного накостного остеосинтеза.
Пациенты, перелом бедра или голени, кальцийфосфатное покрытие, пластины, индексы крови, плотность пяточной кости
Короткий адрес: https://sciup.org/142121061
IDR: 142121061
Текст научной статьи Маркеры остеогенеза в периферической крови как патогенетические факторы и предикторы системных эффектов имплантатов для остеосинтеза
В структуре первичной инвалидности последствия травм опорно-двигательной системы занимают третье место [4, 11] и достигают 3043,4 % общей инвалидности от травм [1, 19]. Снижение этого показателя представляется актуальной социальной проблемой.
В настоящее время улучшение результатов лечения при переломах костей и снижение инвалидизации достигается преимущественно за счет использования новых технологий. Однако процент осложнений и неудовлетворительных результатов проведенного остеосинтеза остается на постоянно высоком уровне и достигает 37 % [12, 21, 22].
Внимание исследователей привлекает возможность усовершенствования метода чреско-стного остеосинтеза посредством активного воздействия на формирование костной ткани и её минерализации [3]. Недавно представлены доказательства позитивного влияния имплантатов с биоактивным (кальцийфосфатным) покрытием на локальные регуляторные механизмы, способствующие оптимальной биомеханике аппаратов внешней фиксации [8]. При этом экспериментальные результаты применения имплантатов с кальцийфосфатным покрытием свидетельствуют о возможности системной минерализации костной ткани [10], подразумевающей участие дистантных регуляторных систем.
Для оценки системного костного метаболизма проводят измерение в крови активности щелочной фосфатазы и ее костного изофермента, остеокальцина, уровней кальция и фосфора и в последние годы – C-концевых телопептидов коллагена I типа
(CrossLaps) [13, 14, 26]. Тем не менее, дистантные биохимические маркеры образования и резорбции кости используются в основном в качестве прогностических критериев остеопороза и риска его развития [7, 25, 26]. В меньшей степени известно их значение, а также значение индикаторов реакции стресс (соматотропный гормон, кортизол), для оценки качества репаративного остеогенеза при остеосинтезе [3, 13, 16, 17].
Целью данного комплексного исследования является поиск информативных лабораторных критериев для оценки и прогнозирования системных изменений в костной ткани при накостном остеосинтезе длинных трубчатых костей биоактивными пластинами с кальцийфосфатным покрытием.
МАТЕРИАЛЫ И МЕТОДЫ
В данной работе проведены исследования биохимических маркёров костного метаболизма в периферической крови 47 здоровых людей (22 мужчин, 25 женщин), пациентов в момент операции биоинертного (13 мужчин, 8 женщин) либо биоактивного (31 мужчина, 26 женщин) накостного остеосинтеза, а также в динамике (1-6 мес.) биоинертной (21 человек) либо биоактивной (51 пациент) внешней фиксации одиночных переломов бедра или голени. Средний возраст пациентов во всех группах составлял 37-40 лет.
Для накостного остеосинтеза использовались титановые пластины с биоинертным или биоактивным (кальцийфосфатным) покрытием, выполненным анодно-искровым способом [9]. Имплантаты имеют регистрационное удостоверение Минздрава РФ № 29/12010200/1190-00 и сертификат соответствия ГОСТ Р № РОСС RU.АЯ 79.В55386.
Венозную кровь собирали, избегая гемолиза, в первые 10 дней после проведения операции био-инертного либо биоактивного остеосинтеза. В пределах каждой группы наблюдения не было выявлено зависимости изучаемых лабораторных показателей от сроков забора крови. Сыворотку от клеток отделяли центрифугированием в течение часа. Образцы немедленно замораживались при температуре -25 °С. Перед проведением исследования все компоненты набора и исследуемая сыворотка выдерживалась при комнатной температуре до достижения ими температуры 18 °С. Все образцы анализировались в дублях в соответствии с требованиями проведения анализа.
Уровни остеокальцина (ОК) тестировали методом иммуноферментного анализа (ИФА) с применением моноклональных антител тест-системы Osteometer BioTech A/S N-MID Osteo- calcin One Step ELISA (Nordicbioscience diagnostics, Denmark). ИФА кортизола проводили наборами фирмы DSL (США) методом конкуренции между немеченым антигеном и фермент-меченым антигеном за ограниченное число мест связывания на антителах. Выявление соматотропного гормона (СТГ) осуществляли наборами фирмы DSL (США) с применением принципа двухстадийного иммуноанализа типа “сэндвич”.
CrossLaps (CL) определяли на автоматическим анализаторе “Elecsys1010” электрохемилю-минисцентным способом при помощи наборов, предназначенных для определения С-концевых телопептидов, образующихся при деградации коллагена 1 типа (β-CrossLaps/serum, “Roche Diagnostics”, Германия). Содержание общей фракции щелочной фосфатазы (ЩФ) и кальция выявляли ферментно-колориметрическим способом [23] на биохимическом анализаторе Hitachi.
Для определения плотности костной ткани проводилась остеометрия обеих пяточных костей на ультразвуковом денситометре “Achilles Express” фирмы Lunar General Electric Medical Systems (США). Диагностика изменений костного метаболизма основывалась на выявлении признаков остеопороза и остеопении, определяемых с помощью Т- и Z-критериев, разработанных рабочей группой ВОЗ (1994 г.). Далее у пациентов полуколичественно регистрировали нормальное (3 балла), остеопеническое (2 балла) или остео-порозное (1 балл) состояние костной ткани.
Статистическую обработку полученных данных осуществляли посредством t-критерия Стьюдента, корреляционного анализа по Спирмену (r), регрессионного анализа с помощью программы Statistica for Windows Version 6,0.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Несмотря на большое количество проводимых лабораторных исследований, референтные пределы ОК, ЩФ, СТГ у здоровых людей значительно варьируют (табл. 1). Крайне мало в литературе сведений по уровням CrossLaps. В меньшей степени разброс “нормальных” (рекомендуемых, референтных) показателей в сыворотке крови относится к концентрации кальция, поскольку значительные изменения буферных систем и кислотно-щелочного равновесия несут грозные последствия для организма.
В связи с этим: 1) с позиций доказательной медицины требовалось уточнить региональные особенности показателей у здоровых людей; 2) у женщин исследуемые показатели более вариабельны, что требует изучения половых различий дистантных маркеров костного метаболизма; 3) в силу “жестких” диапазонов допус- тимых концентраций, сравнительной легкости и экономичности определения кальция в сыворотке крови, его можно рассматривать в качестве наиболее реального претендента в прогностические критерии результатов остеосинтеза.
Исследование региональных среднестатистических уровней биохимических маркёров в периферической крови у 47 добровольцев показало их соответствие рекомендуемым диапазонам (табл. 1, 2). Половые вариации маркеров крови оказались значительными только для среднего содержания кальция и щелочной фосфатазы, повышенных у мужчин. При этом корреляционный анализ позволил установить качественные (функциональные, физиологические) различия системного костного метаболизма у мужчин и женщин (табл. 3).
Коэффициент корреляции рангов Спирмена (r) позволяет установить функциональные изме- нения в гомеостазе, которые рано или поздно приведут к структурным нарушениям органов и тканей. Одним из показателей является количество (плотность) корреляционных связей между индексами, определяющее “жесткость“ корреляционной матрицы.
Таблица 1
Диапазон колебаний биохимических показателей крови у взрослого населения согласно различным литературным источникам
|
Пол |
Соматотропный гормон, нг/мл |
Остеокальцин, нг/мл |
CrossLaps, нг/мл |
Щелочная фосфатаза, ед./л |
Общий кальций, ммоль/л |
Кортизол, мкг/дл |
|
[2; 20] |
||||||
|
Женщины |
менее 5 0-10 |
пременопауза 31,2 постменопауза 41,3 |
– |
менее 160 |
2,2-2,55 2,23-2,57 |
– |
|
Мужчины |
26,3 |
менее 180 |
||||
|
[18] |
||||||
|
Женщины |
0-18 |
пременопауза 0,4-8,2 постменопауза 1,5-11,0 |
– |
38-92 |
2,15 – 2,5 |
– |
|
Мужчины |
0-4 |
3,0 – 13 |
||||
|
Нормы, рекомендуемые фирмой-производителем реагентов |
||||||
|
Женщины |
0,1-7,0 |
пременопауза 11,4-24,4 постменопауза 18,9-37,9 |
пременопауза 0,166-0,476 постменопауза 0,251-0,761 |
менее 240 |
2,19 – 2,55 |
7-25 |
|
Мужчины |
0,1-3,8 |
12,3-30,5 |
0,142-0,522 |
менее 270 |
||
Таблица 2
Среднестатистические значения показателей гормонального статуса и маркеров остеогенеза у жителей Томской области, Х±m
|
Показатель |
Здоровые мужчины (n=22) |
Здоровые женщины (n=25) |
|
Возраст |
39,41±2,01 |
41,52±2,17 |
|
Соматотропный гормон |
1,74±0,21 |
1,71±0,18 |
|
Остеокальцин |
23,38±0,64 |
22,07±0,92 |
|
CrossLaps |
0,28±0,02 |
0,36±0,04 |
|
Щелочная фосфатаза |
233,27±4,43* <0,001 |
196,80±3,78 |
|
Кальций |
2,33±0,02* <0,002 |
2,24±0,02 |
|
Кортизол |
14,84±0,89 |
14,22±0,84 |
Примечание: здесь и в табл. 5-6 (*) – отмечены статистически значимые различия между группами наблюдения; n – число обследованных пациентов.
Таблица 3
Корреляционные связи дистантных маркеров остеогенеза в группе здоровых мужчин и женщин
|
Пол обследуемых |
Общее число корреляций |
Корреляционные связи маркеров остеогенеза |
Коэффициент корреляции рангов Спирмена |
Уровень достоверности |
|
Женщины (n=25) |
10 |
кальций – ЩФ |
-0,404 |
<0,04 |
|
ОК – ЩФ |
0,454 |
<0,02 |
||
|
ОК – CL |
0,629 |
<0,001 |
||
|
Мужчины (n=22) |
5 |
кальций – ОК |
-0,517 |
<0,01 |
Полученные нами результаты свидетельствуют о существенном напряжении систем, отвечающих за метаболизм костной ткани у здоровых женщин (табл. 3): 1) повышено (по сравнению с мужчинами) общее число корреляций и связей между маркерами костной ткани; 2) индексы ремоделирования костной ткани, а именно ОК (r=0,60; p<0,001), CrossLaps (r=0,47; p<0,02) и ЩФ (r=0,53; p<0,006) тесно связаны с возрастными изменениями; 3) в крови отмечается сопряжение индексов гормонального статуса и костного метаболизма: СТГ коррелирует с уровнями ОК (-0,46; p<0,02) и кальция (0,54; p<0,01), кортизол – с концентрацией CL (0,45; p<0,025).
Описанные изменения на системном уровне отражают, по-видимому, отмеченную [14] в динамике старения потерю костной массы у мужчин и, в большей степени, у женщин. Анаболические и рецепторные эффекты СТГ приводят к стимуляции синтеза остеобластами костного матрикса, в том числе коллагена I типа, ЩФ и ОК [24], процессов ремоделирования кости через активацию остеокластов [14]. Высокие дозы глюкокортикоидов, ведущих стресс-реализующих гормонов, подавляют костеобразование и активируют резорбцию костной ткани [14]. В связи с этим описанные изменения являются маркерами, а также патогенетическими звеньями сложных механизмов, способствующих известной предрасположенности женщин к остеопорозу и повышенному риску переломов [14, 15].
В момент операции остеосинтеза бедра или голени (1-10 дни после травмы) биохимические показатели не отличались достоверно, поэтому мы посчитали возможным объединить их в одну группу. Указанные сроки определения не влияли на изменение изучаемых индексов. Более того, вследствие развития стресса половые вариации маркеров, за исключением ОК (131 % от уровня женщин, р<0,015), нивелировались. В сыворотке крови отмечалась однотипная реакция (табл. 4), связанная с гормональными перестройками (2-кратное повышение в сыворотке крови кортизола и падение СТГ) и катаболическими процессами (3-4-кратный рост маркера разрушения кости CL и падение уровня кальция), характерная для развития фазы тревоги общего адаптационного синдрома.
При стрессе корреляционная матрица как у женщин, так и у мужчин упрощалась по сравнению со здоровыми лицами (табл. 3) до 3 и 4 связей соответственно. В связи с этим в дальнейшем мы не учитывали половые различия в уровнях дистантных маркеров.
Индексы минерального гомеостаза у различных пациентов в ответ на травму и последующее хирургическое лечение менялись индивидуально, что зависело от их состояния в момент перелома. Так, например, мужчины на травму бедра или голени отвечали повышением (13 %), отсутствием реакции (13 %) либо снижением концентрации кальция в крови (74 %). Это обстоятельство привело к тому, что среднестатистические значения индексов крови оказались непоказательными вследствие большого разброса показателей (табл. 5). Был проведен линейный регрессионный анализ индивидуального изменения дистантных маркеров по сравнению с таковыми в момент перелома (точка 0), результаты которого представлены в таблице 6.
Таблица 4
Среднестатистические значения показателей гормонального статуса и маркеров остеогенеза в момент перелома длинных трубчатых костей, Х±m
|
Показатель |
Мужчины n=31 |
% от исходного |
Женщины n=26 |
% от исходного |
|
Возраст |
39,57±2,51 |
- |
38,33±2,96 |
- |
|
Соматотропный гормон |
1,26±0,33 |
72 |
0,92±0,24 |
54* <0,013 |
|
Остеокальцин |
24,28±1,70 |
104 |
18,52±1,50 |
84 |
|
CrossLaps |
1,11±0,19 |
391* <0,0004 |
1,00±0,16 |
279* <0,001 |
|
Щелочная фосфатаза |
196,40±14,20 |
84 |
187,33±18,76 |
95 |
|
Кальций |
2,11±0,05 |
91* <0,0002 |
2,08±0,04 |
93* <0,0006 |
|
Кортизол |
31,15± ,55 |
210* <0,0001 |
31,65±1,36 |
223* <0,0001 |
Примечание: * – отмечены статистически значимые различия с исходным уровнем (здоровые лица соответствующего пола); n – число обследованных пациентов.
Таблица 5
Среднестатистические значения показателей гормонального статуса и маркеров остеогенеза (% от исходного уровня) в 1-2 мес. после накостного остеосинтеза в биоактивном либо биоинертном вариантах, Х±m
|
Исследуемые показатели |
Бионертный остеосинтез (n=14) |
Биоактивный остеосинтез (n=29) |
|
СТГ |
119,04±5,13 |
238,33±52,06 |
|
Остеокальцин |
108,81±2,69 |
126,18±6,36 |
|
CrossLaps |
166,83±32,53 |
129,96±11,39 |
|
Щелочная фосфатаза |
102,93±2,43 |
111,95±5,72 |
|
Кальций |
99,38±0,83 |
105,40±1,61* <0,016 |
|
Кортизол |
81,02±2,20 |
77,76±3,46 |
Примечание: исходный уровень – показатели у здоровых лиц обоего пола.
Таблица 6
Средние скорости изменений (усл. ед./мес.) дистантных маркеров остеогенеза в динамике накостного остеосинтеза в биоактивном либо биоинертном вариантах, Х±m
|
Исследуемые показатели |
Бионертный остеосинтез (n=21) |
Биоактивный остеосинтез (n=51) |
|
СТГ |
0,025±0,019 |
0,034±0,024 |
|
Остеокальцин |
0,527±0,177 |
0,777±0,211 |
|
CrossLaps |
0,026±0,009 |
-0,027±0,017* <0,049 |
|
Щелочная фосфатаза |
1,094±0,912 |
-1,341±3,206 |
|
Кальций |
-0,010±0,003 |
0,017±0,007* <0,011 |
|
Кортизол |
-2,048±0,130 |
-2,292±0,231 |
|
Плотность пяточной кости |
2,412±0,150 |
2,222±0,118 |
Примечание: (-) – обозначает убывание признака; усл. ед./мес. – под условными единицами понимаются соответствующие единицы измерения согласно табл. 1 и разделу “материалы и методы”; n – число обследованных пациентов.
Оказалось, что в динамике остеосинтеза кальцийфосфатное (КФ) покрытие способствует насыщению периферической крови кальцием и торможению резорбции костей, зафиксированному по уровню CL. При этом происходят качественные изменения системного метаболизма костной ткани. Так, в случае применения био-инертных имплантатов корреляционную матрицу (рис. 1) можно интерпретировать таким образом, что рост уровня СТГ, посредством прямого анаболического эффекта на остеобласты, вызывает снижение в крови содержания кальция за счет его связывания костной тканью. Это приводит к системному улучшению ее метаболизма, зафиксированному согласно УЗИ пяточных костей.
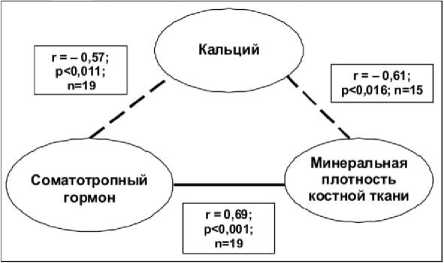
Рис. 1. Корреляционные связи между маркерами крови и инструментальными данными в динамике био-инертного варианта накостного остеосинтеза при переломах длинных трубчатых костей: сплошная линия – прямые корреляции; пунктирная – обратные
В основе действия КФ покрытия лежит системное и локальное насыщение организма кальцием, разрывающее патогенетические связи, характерные для биоинертных пластин. Более того, нарастание концентрации кальция в крови снижает уровень СТГ (r= -0,29; p<0,049; n=48), что уменьшает напряжение гомеостатических систем, характерное для реакции стресс на повреждение. В спокойном состоянии (понятие “нор-мы“) гомеостаз характеризуется минимальным числом корреляционных связей параметров [6].
Средний срок образования костной мозоли составил 4,5 мес. со статистической девиацией 1,5 мес. Именно насыщение крови кальцием в первые 2 мес. после имплантации пластин с кальцийфосфатным покрытием лежит в основе благоприятного влияния на сроки заживления переломов (r= -0,65; p<0,004; n=18), поскольку другие лабораторные показатели не отличались от таковых в случае биоинертного остеосинтеза (табл. 5). В целом, биоактивные имплантаты, в сравнении с биоинертными, стимулируют и снижают индексы крови, отражающие соответственно костную репарацию (СТГ, ОК, ЩФ, кальций) и резорбцию кости (CL, кортизол) [14; 25]. Однако вследствие значительного индивидуального разброса, все маркеры ремоделирования кости, кроме кальция, не могут служить достоверными прогностическими критериями успешной динамики остеосинтеза. Инструментальным маркером уменьшения сроков лечения являются данные УЗИ пяточных костей, поскольку показатели тесно связаны между собой (r= -0,66; p<0,002; n=19).
Интересно, что не только в динамике остеосинтеза, но и в момент перелома уровень кальция в крови также является предиктором системного ответа костной ткани на повреждение. Независимо от вида имплантируемых пластин обнаружена тесная прямая корреляция показателя (r=0,55-0,63; p<0,007) с состоянием пяточных костей, определяемом через 3-6 мес. после остеосинтеза.
В связи с этим основной механизм позитивного действия имплантатов с КФ покрытием связан с увеличением депо кальция в организме для адекватной репарации костной ткани. При этом эффект пластин с КФ покрытием начинается уже в первые дни после их установки. Основные дистантные индексы остеогенеза статистически значимо менялись (рис. 2) по сравнению с биоинертными имплантатами в сторону усиления признаков резорбции костной ткани.
В процессе многолетних исследований, выполняемых в ФГУ «РНЦ “ВТО” им. акад. Г.А. Илизарова», установлено, что репаративный остеогенез в условиях чрескостного остеосинтеза протекает, по меньшей мере, в двух последовательно сменяющих друг друга фазах. Обе фазы – фаза резорбции (пролиферативная) и анаболическая (дифференцировки и минерализации) контролируются компонентами системной нейрогу-моральной регуляции, а именно, адаптивными и остеотропными гормонами и местными фактора- ми роста [3]. Проведенное исследование позволяет сделать заключение, что имплантаты с кальцийфосфатным покрытием оказывают, по-видимому, системное стимулирующее влияние на обе фазы репаративной регенерации костной ткани.
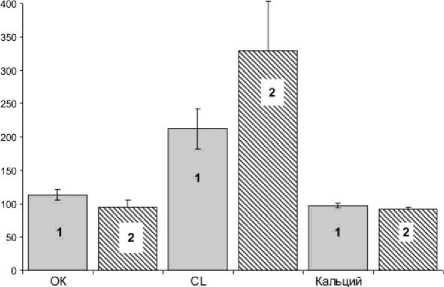
Рис. 2. Концентрация в периферической крови дистантных индексов остеогенеза в момент операции биоинертного (1) либо биоактивного (2) накостного остеосинтеза переломов длинных трубчатых костей: по оси абсцисс – индексы остеогенеза ОК – остеокальцин; CL – CrossLaps; по оси ординат – % от исходного уровня (здоровые лица обоего пола)
ВЫВОДЫ
-
1. Имплантаты с кальцийфосфатным покрытием оказывают системное регулирующее влияние на метаболизм костной ткани.
-
2. Основной механизм их позитивного действия на репаративную регенерацию костной ткани
-
3. Высокое содержание кальция в сыворотке крови как в момент операции, так и в динамике восстановления является важнейшим предиктором успешного накостного остеосинтеза.
связан с увеличением депо кальция в организме.


