Маркирование локусов PL5, PL6 и PL8, контролирующих устойчивость к Plasmopara halstedii у линий подсолнечника селекции ВНИИМК
Автор: Рамазанова С.А., Антонова Т.С.
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 3 (175), 2018 года.
Бесплатный доступ
Современные технологии генотипирования с помощью ДНК-маркеров позволяют существенно ускорить создание новых гибридов подсолнечника, устойчивых к комплексу рас возбудителя ложной мучнистой росы ( P. halstedii) и контролировать наличие генов устойчивости на каждом этапе селекции. Апробированы известные из литературных источников девять STS и три SSR-маркера генов Pl5, Pl6 и Pl8, контролирующих устойчивость к расам P. halstedii. После оптимизации условий проведения ПЦР по каждому праймеру испытания проводили на 15 линиях подсолнечника селекции ВНИИМК, различающихся по устойчивости к расам 730, 710, 330 и 334. Для маркирования локуса Pl6 использовали три STS и три SSR-маркера. Идентификацию локусов Pl5 и Pl8 проводили с использованием шести известных STS-маркеров. Ни один из маркеров не выявил четкой дифференциации между линиями подсолнечника, различающимися устойчивостью к разным расам P. halstedii. Таким образом, испытанные молекулярные маркеры не дифференцировали линии подсолнечника селекции ВНИИМК по устойчивости и восприимчивости к ложной мучнистой росе.
Днк-маркеры, мас, r-гены, устойчивость, подсолнечник
Короткий адрес: https://sciup.org/142216732
IDR: 142216732 | УДК: 631.523:633.854.78 | DOI: 10.25230/2412-608X-2018-3-175-19-27
Текст научной статьи Маркирование локусов PL5, PL6 и PL8, контролирующих устойчивость к Plasmopara halstedii у линий подсолнечника селекции ВНИИМК
The modern technologies of genotyping using DNA-markers allow significantly increasing development of new sunflower varieties resistant to a complex of downy mildew races ( P. halstedii ) and to control existence of resistance gens at the each stage of breeding. We approbated known from literary sources nine STS and three SSR-markers of gens Pl 5 , Pl 6 , and Pl 8 controlling resistance to races of P. halstedii. After optimizing conditions for PCR for each primer, we tested 15 sunflower lines developed in VNIIMK which are differed with their resistance to races 730, 710, 330 and 334. To mark a locus Pl6 we used three STS and three SSR-markers. We identified loci Pl5 and Pl8 using six known STS-markers. No one maker showed a distinct differentiation between sunflower lines with different resistance to races of P. halstedii. Thus, tested molecular markers did not differentiate sunflower lines developed in VNIIMK by their susceptibility or resistance to downy mildew races.
Введение. В нашей стране подсолнечник является ведущей масличной культурой. Основная его ценность – это получение масла, одного из главных продуктов питания человека. Важнейшими факторами, ограничивающими получение высоких урожаев, являются болезни и вредители. Ложная мучнистая роса, вызываемая оомицетом Plasmopara halstedii (Farl.) Berl. et de Toni, относится к числу наиболее вредоносных. Потери урожая при условиях, благоприятных для развития болезни, могут составлять 50–70 %. До настоящего времени в мире уже обнаружено более 45 физиологических рас патогена и наблюдается постоянное возникновение новых, более вирулентных [27; 28; 29]. Одним из наиболее эффективных методов контроля над возбудителями болезней является введение в растение-хозяин доминантных генов устойчивости к ним.
В связи с развитием методов молекулярной биологии в селекции сельскохозяйственных культур все чаще применяются молекулярные маркеры, из них наиболее распространенными и востребованными являются ДНК-маркеры [1]. Применение их в практической селекции получило название MAS (marker-assisted selection), которое имеет несколько вариантов перевода в русскоязычной литературе, такие как «маркер-вспомогательная селекция», «маркер опосредованная селекция», «маркерная селекция» либо «селекция с использованием молекулярных маркеров» и другие. В России исследования по созданию ДНК-маркеров относятся к приоритетным направлениям на ближайшие годы. На сегодняшний день созданы и постоянно продолжают разрабатываться новые ДНК-маркеры для идентификации генов, контролирующих хозяйственно ценные признаки с целью применения их в селекционных программах с использованием MAS.
Одним из важных условий MAS является как можно более тесное сцепление между маркером и геном, контролирующим признак, а затем использование ассоциаций маркер-признак в практических целях для создания новых сортов и селекционных линий [1]. Однако сначала ассортимент разработанных молекулярных маркеров должен проходить верификацию на разном генетическом фоне, включая генетические коллекции изогенных линий, содержащих гены устойчиво- сти к биотическим и абиотическим факторам среды. Рекомендованными для дальнейшего использования в MAS могут быть только маркеры, для которых случаи ложного положительного или отрицательного результата исключены [2]. Именно по этой причине существующий этап развития MAS характеризуется как повсеместная апробация ДНК-маркеров на разном сортовом материале с выявлением универсальных систем для идентификации различных генов, в том числе и контролирующих устойчивость к ложной мучнистой росе.
В настоящее время расшифрованы нуклеотидные последовательности более 20 генов устойчивости у растений, так называемых R-генов. Это гены, определяющие устойчивость к различным типам патогенов (вирусы, бактерии, грибы, животные). Оказалось, что их нуклеотидные последовательности довольно консервативны, т.е. имеют большой процент схожести, что, вероятно, свидетельствует об одинаковой природе возникновения сигнальных событий при формировании защитной реакции у растений [3; 4]. Все R-гены содержат последовательности, кодирующие белки устойчивости, которые в свою очередь включают домены с богатыми лейцином повторами LRR (leucine-rich repeat). Такие повторы ответственны за связывание белка с белком, т.е. отвечают за распознавание патогена [4].
Все R-белки можно разделить на две группы – это внутри- и внеклеточные белки. Последовательности, кодирующие внутриклеточные белки, помимо LRR-домена содержат сайт связывания нуклеотидов NBS (nucleotide binding site) и в некоторых случаях дополнительно мотив (leucine zipper), названый «лейциновая молния», LZ или домен, гомологичный рецепторам Toll, и интерлейкин-1 TIR (Toll and interleukin-1 receptor). А последовательности, кодирующие внеклеточные белки, также содержат LRR-домен, который может быть дополнен сайтом связывания с мембраной и доменом цитоплазматической протеинкиназы [3; 4; 5;
-
6] . Протеинкиназный и нуклеотидсвязы-вающий домены участвуют в фосфорилировании белков и регуляции экспрессии защитных генов соответственно [5].
В настоящее время с помощью метода ПЦР с вырожденными праймерами, построенными на основе аминокислотной последовательности доменов NBS-LRR, клонировано очень много последовательностей ДНК. Так как почти все гены устойчивости их содержат, то это дает возможность их маркировать, а также идентифицировать еще неизвестные R-гены. Такие последовательности получили название аналоги генов устойчивости RGAs (Resistence Gene Analog) или «кандидатов» в гены устойчивости RGCs (Resistence Gene Candidate). Они хорошо подходят для маркирования, так как либо сами являются частью R-гена, либо тесно с ним сцеплены [3; 4]. Причем R-локусы могут находиться в одном из четырёх состояний. Одни имеют один ген с множеством аллелей, другие могут существовать как однокопийный ген, который присутствует в устойчивых линиях и отсутствует в восприимчивых. У многих видов растений R-локус имеет тандемные повторы тесно сцепленных гомологичных R-генов с различной спецификацией. Наконец, в отдельных участках генома R-гены для грибных, бактериальных и вирусных патогенов локализованы в одной хромосоме на очень близком расстоянии друг от друга (1–2 сМ) [7].
Известно, что устойчивость к P. hals-tedii контролируется генами Pl. Они идентифицированы как в культурном, так и дикорастущем подсолнечнике, и в настоящее время всего их насчитывается 25: Pl 1–17 , Pl v , Pl w , Pl x–z , Mw, Mx и Pl arg [8; 9; 10; 11; 12]. Некоторые из них обеспечивают устойчивость к одной расе, тогда как другие – к двум и более [8]. Ген Pl 1 обусловливает устойчивость к расе 100, а Pl 2 к расе 300 [14]. Известно, что гены Pl 1 , Pl 2 и Pl 6 контролируют устойчивость к расам 100, 300, 700, 703, 710, 330, 770 и 730. Они картированы в первой группе сцепления на RFLP (Restriction Fragment Length Polymorphism) генетической карте
-
[6 ] и в восьмой группе сцепления LG на генетической карте SSR (Simple Sequence Repeat) [15]. Относятся они к TIR-NBS-LRR классу R-генов, причем локус Pl 6 представляет собой кластер из 13 генов, близко расположенных друг к другу и относящихся к одному локусу [24]. Bouzidi с соавторами [6] на основе ПЦР с вырожденными праймерами разработали и применили для маркирования этого локуса три STS-маркера HAP1, HAP2 и HAP3. Результаты их работы были опубликованы еще в 2002 г. и с того времени использовались исследователями разных стран для идентификации локуса Pl 6 в генотипах подсолнечника. К примеру, сербские ученые Pancović с соавторами [20] тестировали их на устойчивых и восприимчивых к расе 730 изогенных линиях. Авторам удалось получить отжиг только с праймером HAP3. Однако они не выявили четких различий между восприимчивыми и устойчивыми линиями [23]. Идентифицировать локус Pl 6 в линиях подсолнечника им удалось с помощью трех SSR-маркеров ORS37, ORS166, ORS1043. Проведенный гибридологический анализ позволил определить генетическое расстояние SSR-маркеров от локуса Pl 6 , а также установить их доминантное наследование. Для идентификации гомо- и гетерозиготных образцов они применили CAPS-маркеры Hha I, Rsa I, имеющие кодоминантное наследование [20].
Гены Pl 5 и Pl 8 , контролирующие устойчивость к 16 расам P. halstedii, были также клонированы на основе ПЦР с вырожденными праймерами [10]. Radwan с соавторами [11; 12] показали, что эти два гена сцеплены, относятся к non-TIR-NBS-LRR классу R-генов и картированы в тринадцатой группе сцепления на генетической карте SSR.
В России аналогичные исследования проводил Маркин с соавторами [25]. Ими были генотипированы 16 линий подсолнечника – восстановителей фертильности пыльцы с разной устойчивостью к ложной мучнистой росе по девяти STS-локусам. И только по двум (маркеры на локус Pl 6 ) удалось различить линии, ус-21
тойчивые и восприимчивые к расам 330 и 710 P. halstedii .
В селекционном материале ВНИИМК молекулярная идентификация генов устойчивости к этому патогену не проводилась. В работе по созданию новых генотипов подсолнечника с заданными параметрами комплексной устойчивости к ложной мучнистой росе необходимы знания о наличии генов устойчивости и их аллельном состоянии. Работа по созданию системы маркеров, позволяющей однозначно идентифицировать гены устойчивости к P. halstedii, актуальна.
Целью наших исследований было апробировать известные молекулярные маркеры и изучить возможность их использования для определения наличия генов устойчивости к P. halstedii в линиях подсолнечника селекции ВНИИМК.
Материалы и методы. Объектом исследования послужили 15 линий селекции ВНИИМК, устойчивые и восприимчивые к расам 330, 334, 710, 730, 734 (табл. 2). Оценку степени устойчивости образцов подсолнечника проводили в лабораторных условиях методом искусственного заражения проростков подсолнечника [30].
Для выделения ДНК применяли метод, основанный на использовании лизирующего буфера, содержащего гексадецил-триметиламмоний бромид (СТАВ) с модификациями [16; 17]. Концентрацию ДНК в полученном препарате определяли визуально по интенсивности свечения пробы объемом 10 мкл в ультрафиолетовом свете в 1 %-ном агарозном геле с добавлением 2 мкл бромистого этидия. Электрофорез растворов ДНК проводили при напряжении 100 V в течение 30 мин в трис-ацетатном буферном растворе (ТАЕ).
Для ПЦР анализа применили 12 праймеров, описанных в литературных источниках, их нуклеотидные последовательности представлены в таблице 1 [6; 19; 20]. Полимеразную цепную реакцию выполняли в реакционной смеси (25 мкл) следующего состава: 67 мМ Трис-HCl (рН 8,8); 16,6 мM сульфата аммония; 1,5– 22
3,0 мM MgCl 2 ; 0,01 % Tween 20; по 0,2 мM дезоксирибонуклеозидфосфатов; по 10 пМ праймеров; 10 нг матричной ДНК и 1 ед. рекомбинантной термостабильной ДНК-полимеразы (НПО «Си-бЭнзим», Россия). Реакции проводили в термоциклере S1000тм (BioRad, США) при следующих температурных режимах: начальная денатурация при 95 °С в течение 3 мин, далее 35 циклов с последовательной сменой температур: денатурация при 94 ºС, в течение 10 сек, отжиг праймера при 58–63 ºС (в зависимости от праймера) – 30 сек, элонгация при 72 ºС – 1 мин 30 сек, и заключительная элонгация 10 мин.
Электрофорез продуктов амплификации проводили в геле, содержащем 2 % агарозы и SВ-буфер, с использованием камеры для горизонтального электрофореза SE-2 (Хеликон, Россия), при напряжении ≈ 200 В, силе тока ≈ 100 мА, в течение 30 мин. Гели окрашивали бромистым этидием. Для визуализации и документирования результатов электрофореза применяли систему цифровой документации видеоизображения BIO-PRINT (Vilber Lourmat, Франция).
Таблица 1
Характеристика праймеров, использованных для идентификации локусов Pl 5 Pl 6 и Pl 8
|
Праймер |
5–3’ последовательность |
Локус |
|
HaP1 |
F: GGTAATGGCTGTTGAATTTATGGAGC R: AGCATGATCCGGCTAGAGCCTTCTA |
Pl 6 |
|
HaP2 |
F: GTCTACTACATGGTTTCCGTTTTC R: TGCTTCTTCCTTCTATCTCACTC |
Pl 6 |
|
HaP3 |
F: GTTTGTGGATCATCTCTATGCG R:TGCTTCTTCCTTCTATCTCACTC |
Pl 6 |
|
Ha-P1 |
F: GCCCAAAATTGAAAGAAAGGTGTG R: GGCGAAATTGGTTCCCGTGAGTCG |
Pl 5, Pl 8 |
|
Ha-P2 |
F: AATCTTGAGTCATTACCCGAGC R: CAGCGTCTCTGGTAGATCGTTCACC |
Pl 5, Pl 8 |
|
Ha-P3 |
F: GCTGTTACTGCCCTCTTCAAAGTC R: TTTGAAAGATAAGTTCGCCTCTCG |
Pl 5, Pl 8 |
|
Ha-P4 |
F: GCTGTTACTGCCCTCTTCAAAGTC R: CCCAACTCGACATATCTTCAAACC |
Pl 8 |
|
Ha-P5 |
F: TAGTTAACCATGGCTGAAACCGCTG R: CCCCATATTGACAAAGAGTTGAGG |
Pl 8 |
|
Ha-P6 |
F: TAGTTAACCATGGCTGAAACCGCTG R: CGTCTCTGGTAGATCGTTCACCTT |
Pl 8 |
|
ORS37 |
F:CACAATGCAAAAAAACCCAG R: CAAGGCACATCGCAATTTC |
Pl 6 |
|
ORS166 |
F:CAGCCACATGCCCTCTGA R: TGTTAAGAACCGCGACAACTG |
Pl 6 |
|
ORS1043 |
F: CCAAACCGTCATGTTCTATGTTC R: AGTGTGATTGCGAATTGTAGTGC |
Pl 6 |
Результаты и обсуждение. На первом этапе работы провели оценку линий подсолнечника на устойчивость к ложной мучнистой росе в лабораторных условиях методом искусственного заражения проростков зооспорами оомицета. Образцы оценивались на устойчивость к расам 330, 334, 710 и 730. В результате эксперимента линии разделились на 4 группы. Первая состоит из двух линий Л 1942-14 и Л 2018-1, устойчивых ко всем расам. Во вторую группу вошли семь линий (Л 673-15, Л 686-15, Л 678-15, Л 665-15, Л 689-15, Л 700-15, Л 699-15), устойчивых к 330, 730, 710, но восприимчивых к 334 расе. Третья группа – линии ВК 920 и ВК 917, устойчивые только к 330 расе. И четвертая группа включает четыре линии СЛ 24, СЛ 4, ВК 935, ВК 934, восприимчивые ко всем расам (табл. 2). Таким образом, изучаемые линии контрастно различались по степени устойчивости к возбудителю ложной мучнистой росы подсолнечника, что позволило протестировать STS-маркеры на возможность использования их в качестве вспомогательного инструмента в селекции на устойчивость к патогену.
Таблица 2
Оценка линий подсолнечника селекции ВНИИМК на устойчивость к расам Plasmopara halstedii
|
№ п/п |
Линия, гибрид |
Устойчивость к ЛМР |
|||
|
334 |
330 |
730 |
710 |
||
|
1 |
Л1942-14 |
+ |
+ |
+ |
+ |
|
2 |
Л 2018-1 |
+ |
+ |
+ |
+ |
|
3 |
Л 693-15 |
- |
+ |
+ |
+ |
|
4 |
Л 697-15 |
- |
+ |
+ |
+ |
|
5 |
Л 678-15 |
- |
+ |
+ |
+ |
|
6 |
Л 665-15 |
- |
+ |
+ |
+ |
|
7 |
Л 689-15 |
- |
+ |
+ |
+ |
|
8 |
Л 700-15 |
- |
+ |
+ |
+ |
|
9 |
Л 699-15 |
- |
+ |
+ |
+ |
|
10 |
ВК 920 |
- |
+ |
- |
- |
|
11 |
ВК 917 |
- |
+ |
- |
- |
|
12 |
СЛ 24 |
- |
- |
- |
- |
|
13 |
СЛ 4 |
- |
- |
- |
- |
|
14 |
ВК 935 |
- |
- |
- |
- |
|
15 |
ВК 934 |
- |
- |
- |
- |
Примечание: знаками «+» и «-» обозначены устойчивые и восприимчивые линии соответственно
Локус Pl 6 контролирует устойчивость в общей сложности к 11 расам, в т.ч. к 710,
730 и 330, но не к 334. В таблице 3 представлена характеристика трех праймеров, фланкирующих гены данного локуса, разработанных Боузиди и его коллегами [6].
Таблица 3
Характеристика локуса Pl 6
|
Название гена |
R/S* |
Пары праймеров |
Размер продукта ПЦР |
|
Ha-NBS 1 |
S |
HaP1 |
1,901 bp |
|
Ha-NBS 2 |
R |
1,484 bp |
|
|
Ha-NBS 3 |
S |
HaP2 |
1,694 bp |
|
Ha-NBS 4 |
S |
1,979 bp |
|
|
Ha-NBS 5 |
R |
1,763 bp |
|
|
Ha-NBS 6 |
S |
1,700 bp |
|
|
Ha-NBS 7 |
R |
1,589 bp |
|
|
Ha-NBS 8 |
R |
1,414 bp |
|
|
Ha-NBS 9 |
R |
1,260 bp |
|
|
Ha-NBS 11 |
R |
HaP3 |
1,811 bp |
|
Ha-NBS 12 |
S |
1,406 bp |
|
|
Ha-NBS 13 |
R |
1,119 bp |
|
|
Ha-NBS 14 |
R |
988 bp |
*
Примечание: – маркер гена, контролирующего устойчивость/восприимчивость
Результаты амплификации образцов ДНК изучаемых линий подсолнечника показали, что ни один из трех маркеров не выявил четких различий между образцами с разной степенью устойчивости к P. halstedii. К тому же, ввиду больших размеров амплифицированных фрагментов (988–1979 п.н.), они плохо воспроизводятся и нечетко различимы на электрофореграммах. Такой результат был получен и иранскими учеными [26]. Применив для идентификации локуса Pl 6 эти же праймерные пары, они не получили амплифицированных фрагментов, из чего сделали вывод, что их линии подсолнечника не содержат данного гена.
Для маркирования локуса Pl 6 в данном исследовании мы применили также три SSR-маркера ORS37, ORS166 и ORS1043 [23]. Для всех пар праймеров были подобраны оптимальные температуры отжига, время элонгации и количество циклов для получения удовлетворительных результатов амплификации. В качестве примера на рисунке представлена электрофореграмма продуктов амплификации, полученных с праймером ORS166. Из рисунка видно, что между устойчивыми и восприимчивыми линиями нет чет-23
ких различий. На дорожках 3–9 представлены продукты амплификации ДНК линий, устойчивых к трем расам, но восприимчивых к 334 расе. У них обнаружены два фрагмента (обведены на дорожке 3), отличающие их от остальных линий, но эти фрагменты не всегда воспроизводимы и поэтому не могут использоваться в практической работе. С праймерами ORS37 и ORS1043 получены аналогичные результаты. Таким образом, протестированные маркеры не выявили четких различий между линиями с разной устойчивостью к P. halstedii .
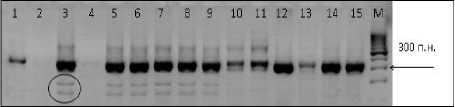
Рисунок – Электрофореграмма продуктов амплификации ДНК линий подсолнечника с праймером ORS166.
Дорожки 1–2 – образцы, устойчивые к четырем расам, 3–9 – восприимчивые к 334 расе, 10–11 – устойчивые только к 330 расе, 12–15 – восприимчивые ко всем расам
В настоящее время перспективным является введение локуса Pl 8 в селекционные образцы. Это обусловлено, как минимум, двумя факторами: во-первых, он обеспечивает устойчивость ко всем распространенным в нашем регионе расам, во-вторых, локус Pl 8 находится в одной группе сцепления с локусом Pl 5 . Что дает возможность использовать их в селекции линий и гибридов подсолнечника с комплексной устойчивостью ко всем расам, распространенным в Краснодарском крае в настоящее время.
В таблице 4 представлена характеристика STS-маркеров локусов Pl5 и Pl8 и фланкирующих их шести пар праймеров, использованных в нашей работе. Для каждого из них были подобраны оптимальные условия ПЦР. В результате реакции со всеми шестью парами праймеров были получены амплифицированные фрагменты ДНК. Однако специфичные фрагмен- ты ДНК для устойчивых и восприимчивых линий не были идентифицированы. Не удалось разделить линии на устойчивые и восприимчивые так, как это описано в работе у Radwan с соавторами [19]. По-нашему мнению, это связано с большим размером фланкируемого праймерами участка ДНК и, как следствие, амплификацией фрагментов длиною более 1000 пар нуклеотидов. К тому же сравнение нуклеотидных последовательностей этих генов показало наличие большого количества участков ДНК, совпадающих по нуклеотидному составу. Это также создает проблемы при маркировании данных локусов. Такой же результат был получен и Маркиным с соавторами у линий подсолнечника с различной устойчивостью к ложной мучнистой росе селекции Донской опытной станции ВНИИМК [25].
Таблица 4
Характеристика локусов Pl 5 и Pl 8
|
STS-маркер |
Локус |
R/S |
Пары праймеров |
Размер продукта ПЦР |
|
Ha-NT8R1 |
Pl 8 |
R |
Ha-P1 |
1,569 |
|
Ha-NT8R2 |
R |
2,119 |
||
|
Ha-NT8R7 |
R |
2,237 |
||
|
Ha-NT8S1 |
S |
1,153 |
||
|
Ha-NT8S2 |
S |
1,610 |
||
|
Ha-NT5R2 |
Pl 5 |
R |
2,021 |
|
|
Ha-NT5S1 |
S |
1,303 |
||
|
Ha-NT5S2 |
S |
1,424 |
||
|
Ha-NT5S3 |
Pl 5 |
S |
Ha-P2 |
387 |
|
Ha-NT8R3 |
Pl 8 |
R |
Ha-P3 |
1,584 |
|
Ha-NT5R1 |
Pl 5 |
R |
1,584 |
|
|
HaNT8R4 |
Pl 8 |
R |
Ha-P4 |
1,840 |
|
HaNT8R5 |
Pl 8 |
R |
Ha-P5 |
2,419 |
|
HaNT8R6 |
Pl 8 |
R |
Ha-P6 |
2,437 |
R/S* – маркер гена, контролирующего устой-чивость/восприимчивость
Заключение. Таким образом, проведена оценка устойчивости 15 линий подсолнечника селекции ВНИИМК к наиболее распространенным в Краснодарском крае расам P. halstedii. С использованием девяти STS и трех SSR-маркеров локусов Pl5, Pl6 и Pl8 линии подсолнечника были генотипированы. Испытанные молекулярные маркеры не дифференцировали линии подсолнечника ВНИИМК по устойчивости и восприим- чивости к ложной мучнистой росе, т.к. маркеры локусов Pl5, Pl6 и Pl8 одинаково представлены у всех генотипов.
Список литературы Маркирование локусов PL5, PL6 и PL8, контролирующих устойчивость к Plasmopara halstedii у линий подсолнечника селекции ВНИИМК
- Леонова И.Н. Молекулярные маркеры: использование в селекции зерновых культур для идентификации, интрогрессии и пирамидирования генов//Вавиловский журнал генетики и селекции. -2013. -Т. 17 -№ 2 -С. 314-325.
- Сколотнева Е.С., Леонова И.Н., Букатич Е.Ю., Салина Е.А. Методические подходы к идентификации эффективных генов, определяющих устойчивость пшеницы к комплексу грибных заболеваний//Вавиловский журнал генетики и селекции. -2017. -Т. 21 -№ 7 -С. 862-869. DOI 10.18699/VJ17.307.
- Martin G.B. Functional analysis of plant disease resistance genes and their downstream effectors//Curr. Opin. Plant Biol. -1999. -V. 2. -P. 273-279.
- Meyers B.C., Chin D.B., Shen K.A., Sivaramakrishnan S., Lavelle D.O. . The major resistance gene cluster in lettuce is highly duplicated and spans several megabases//Plant Cell. -1999. -V. 10. -P. 1833-1846.
- Ellis J.G., Jones D. Structure and function of proteins controlling strain-specific pathogen resistance in plants//Curr, Opin. Plant Biol. -1998. -V. 1. -P. 288-293.
- Bouzidi M.F. Badaoui S., Cambon F., Vear F., De Labrouhe D.T., Nicolas P., Mouzeyar S. Molecular analysis of a major locus for resistance to downy mildew in sunflower with specific PCR-based markers//Theor. Appl. Genet. -2002. -V. 104. -P. 592-600.
- Чекалин Н.М. Генетические основы селекции зернобобовых культур на устойчивость к патогенам. -Полтава: Iнтерграфiка, 2003. -186 с.
- Miller J.F. Registration of five oilseed sunflower germplasm restorer lines (RHA373-377) and two nuclear male-sterile populations (nms 274 and 801)//Crop Sci. -1992. -V. 32 -P. 1298.
- Gascuel Q., Martinez Y., Boniface M.C., Vear F., Pichon M., Godiard L. The sunflower downy mildew pathogen Plasmopara halstedii//Molecular Plant Pathology. -2015. -V. 16 (2). -P. 109-122. DOI 10.1111/mpp.12164.
- Jocic S., Miladinovic D., Imerovski I., Dimitrijevic A., Cvejic S., Nagl N., Kondic-Spika A. Towards sustainable downy mildew resistance in sunflower//Helia. -2012. -No 35 -P. 61-72.
- Bertero de Romano A., Romano C., Bulos M., Altieri E., Sala C. A new gene for resistance to downy mildew in sunflower//Proc. of Intern. Symposium "Sunflower Breeding on Resistance to Diseases" Russia, Krasnodar, 2010, June 23-24. -P. 141-146.
- Bachlava E., Radwan O.E., Abratti G., Tang S., Gao W., Heesacker A.F., Bazzalo M.E., Zambelli A., Leon A.J., Knapp S.J. Downy mildew(Pl8 and Pl14) and rust (RAdv) resistance genes reside in close proximity to tandemly duplicated clusters of non-TIR-like NBS-LRR-encoding genes on sunflower chromosomes 1 and 13//Theor. Appl. Genet. -2011. -V. 122. -P. 1211-1221.
- Vear F., Gentzbittel L., Philippon J., Mouzeyar S., Mestrie E., Roeckel-Drevet P., D.T. de Labrouhe, Nicolas P. The genetics of resistance to five races of downy mildew (Plasmopara halstedii) in sunflower (Helianthus annuus L.)//Theor. Appl. Genet. -1997. -V. 95 (4). -P. 584-589. DOI 10.1007/s00 1220050599.
- Zimmer D.E., Kinman M.L. Downy mildew resistance in cultivated sunflower and its inheritance//Crop Sci. -1968. -V. 12 (6). -P. 749-751. DOI 10.2135/cropsci1972.0011183X 001200060009x
- Liu Z., Gulya T.J., Seiler G.J., Vick B.A., Jan C.-C. Molecular mapping of the Pl16 downy mildew resistance gene from HA-R4 to facilitate marker-assisted selection in sunflower//Theor. Appl. Genet. -2012. -V. 125. -P. 121-131.
- Zolan M.E., Pukkila P.J. Inheritance of DNA methylation in Corpinus cinereous//Mol. Cell Biol. -1986. -Vol. 6. -No 1. -Р. 195-200.
- Saghai-Maroof M.A., Soliman K.M., Jorgensen R.A., Allard R.W. Ribosomal DNA spacer-length polymorphisms in barley: Mendelian inheritance, chromosomal location, and population dynamics//PNAS USA. -1984. -81. -P. 8014-8018.
- Lander E.S., Green P., Abrahamson J., Barlow A., Daly M.J. Lincoln S.E., Newburg L. MAPMAKER: an interactive computer package for constructing primary genetic linkage maps of experimental and natural populations//Genomics. -1987. -V. 1. -P. 174-181.
- Radwan O., Bouzidi M.F., Vear F., Philippon J., D.T. de Labrouhe, Nicolas P., Mouzeyar S. Identification of non-TIR-NBS-LRR markers linked to the P15/P18 locus for resistance to downy mildew in sunflower//Theoretical and Applied Genetics. -2003. -V. 106. -P. 1438-1446. DOI 10.1007/s00122-003-1196-1.
- Panković D., Radovanović N., Jocić S., Satovic Z., Škorić D. Development of Co-Dominant Amplified Polymorphic Sequence Markers for Resistance to Sunflower Downy Mildew Race 730//Plant Breeding. -2007. -V. 126 (4). -P. 440-444. DOI 10.1111/j.1439-0523.2007.01376.x.
- Bert P.F., Tourvieille de Labrouhe D., Philippon J., Mouzeyar S., Jouan I., Nicolas P., Vear F. Identification of a second linkage group carrying genes controlling resistance to downy mildew (Plasmopara halstedii) in sunflower (Helianthus annuus L.)//Theor. Appl. Genet. -2001. -V. 103. -P. 992-997.
- Ивебор М.В. Идентификация рас возбудителя ложной мучнистой росы подсолнечника в регионах Северного Кавказа и выделение устойчивого к ним исходного материала для селекции: дис. … канд. с.-х. наук. ВНИИ Риса, Краснодар, 2009.
- Panković D., Jocić S., Lačok N., Sakač Z., Škorić D. The use of PCR-based markers in the evaluation of resistance to downy mildew in NS-breeding material//Helia. -2004. -No 27. -P. 149-158.
- Gentzbittel L., Mouzeyar S., Badaoui S., Mestrie E., Vear F., Tourvieille de Labrouhe D., Nicolas P. Cloning and molecular markers for disease resistance in sunflower Helianthus annuus L.//Theor. Appl. Genet. -1998. -V. 96. -P. 519-525.
- Маркин Н.В., Тихобаева В.Е., Усатенко Т.В., Горбаченко О.Ф., Усатов А.В. Генотипирование линий подсолнечника с различной устойчивостью к ложной мучнистой росе с помощью STS-маркеров//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2012. -Вып. 2 (151-152). -С. 35-39.
- Soltani Najafabadi M., Abedini R., Eskandari H., Mehrabi R. Monitoring Three Plasmopara halstedii Resistance Genes in Iranian Sunflower Inbred Lines//Iran J. Biotechnol. -2015. -V. 13 (2). -P. 45-50. DOI 10.15171/ijb.1047.
- Virányi F., Gulya T.J., Tourvierille de Labrouhe D. Recent changes in the pathogenic variability of Plasmopara halstedii (sunflower downy mildew) populations from different continents//Helia. -2015. -V. 38. -P. 149-162.
- Sedlářová M., Pospíchalová R., Drábková-Trojanová Z., Bartůšek T., Slobodianová L., Lebeda A. First report of Plasmopara halstedii new races 705 and 715 on sunflower from the Czech Republic -short communication//Plant Protect. Sci. -2016. -52. -DOI 10.17221/7/2016-PPS.
- Spring O., Zipper R. New highly aggressive pathotype 354 of Plasmopara halstedii in German sunflower fields//Plant Protect. Sci. -2018. -V. 54 -P. 83-86. DOI 10.17221/99/2017-PPS.
- Iwebor M., Antonova T.S., Saukova S. Changes in the racial structure of Plasmopara halstedii (Farl.) Berl. et de Toni population in the South of the Russian Federation//Helia. -2016. -V. 39. -P. 113-121.


