Масс-спектрометрическое определение концентрационных соотношений галоген-модифицированных 2'-дезоксиуридинов
Автор: Подольская Е.П., Новиков А.В., Миргородская О.А.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Масс-спектрометрия для биотехнологии
Статья в выпуске: 2 т.14, 2004 года.
Бесплатный доступ
Предложено использование метода масс-спектрометрии для количественной оценки концентрационных соотношений галоген-модифицированных дезоксиуридинов. Показана прямая зависимость между концентрационным соотношением компонентов смеси и интенсивностью сигналов. Установлено, что метод масс-спектрометрии вполне может быть применен к количественному определению галоген-модифицированных дезоксиуридинов, причем имеется возможность не только оценить концентрационное соотношение исследуемых соединений, но и дать достаточно точную количественную оценку.
Короткий адрес: https://sciup.org/14264333
IDR: 14264333 | УДК: 621.384.668.8:
Текст научной статьи Масс-спектрометрическое определение концентрационных соотношений галоген-модифицированных 2'-дезоксиуридинов
Одной из интереснейших и важных задач клеточной биологии является изучение механизма удвоения цепи ДНК при делении клетки. Этот механизм до сих пор является малоизученным, и сложно переоценить важность решения данной задачи [1, 2].
Одним из удобных методов исследования подобных механизмов является использование вместо нативных структурных единиц их модифицированных аналогов. При этом аналоги выбираются таким образом, что их использование не приводит к значительным изменениям в протекающих процессах. При исследовании механизмов, связанных с синтезом ДНК, в качестве аналогов тимидина достаточно часто используют галоген-моди-фицированные дезоксиуридины (рис. 1), которые, встраиваясь на место тимидина, не оказывают влияния на происходящий процесс, и при этом их можно детектировать с помощью соответствующих антител [3].
Спектр задач, решаемых с применением гало-ген-земещенных дезоксиуридинов, достаточно широк. Как пример одной из задач можно привести изучение синтеза ДНК на разных фазах клеточного цикла. При помещении клеток в среду, содержащую тот или иной модифицированный дезоксинуклеотид, во время различных фаз клеточного цикла можно проследить не только место включения метки, но и стадию, на которой произошло данное включение [4–7]. Кроме того, известно, что под действием различных факторов могут происходить нарушения в структуре ДНК. В норме эти повреждения эффективно ликвидируются системой репарации ДНК. По месту включения дезоксиуридинов в процессе репарации мы можем судить о типах повреждений цепи и эффективности их исправлений.
Еще одна задача, решаемая с помощью введения галоген-модифицированных дезоксиуридинов, — изучение транспорта в ядро аналогов нуклеотидов, зачастую являющихся антивирусными и противораковыми препаратами. Чтобы достигнуть клеточной мишени, данные терапевтические нуклеотиды должны преодолеть множество мембран-
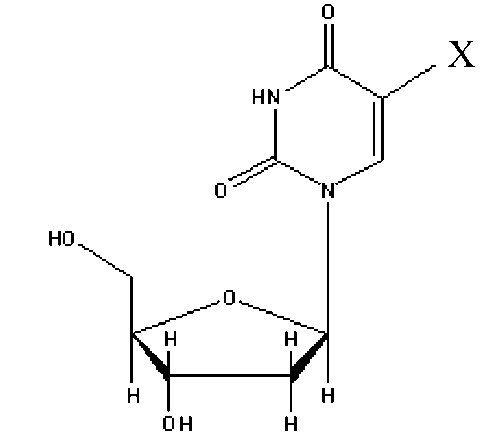
Рис. 1. Галоген-модифицированные дезоксиуридины и тимидин.
Х = Н — тимидин (Tym),
Х = Cl — (CldU),
X = Br — (BrdU),
X = I — (IdU)
ных барьеров, и использование дезоксиуридинов позволяет оценить эффективность проникновения через барьеры и накопления в ядре терапевтических нуклеотидов [8, 9].
При решении всех перечисленных задач особенно важно наряду с обычными качественными оценками иметь возможность количественно оценить степень включения меченых аналогов тимидина.
Обычно в подобных работах оценка встроившихся дезоксинуклеотидов проводится методом иммунофлуоресценции [10] или с помощью ра-диоактивно-меченного H3-тимидина или других радиоактивных меток [8, 11]. Метод иммунофлуоресценции позволяет выявить локализацию участков синтеза ДНК, но не дает точных количественных значений, в то время как для решения ряда задач требуется именно количественная характеристика интенсивности синтеза. В то же время использование радиоактивно-меченного аналога не всегда оправдано.
В настоящей работе мы установили, что метод масс-спектрометрии позволяет не только зарегистрировать наличие интересующих нас галоген-модифицированных дезоксиуридинов, но также провести достаточно точную оценку их количественного соотношения.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперимент проводился на масс-спектрометре "МХ5303", оборудованном электрораспылитель-ным источником ионизации (electrospray ionization, ESI) и времяпролетным масс-анали-затором (TOF), разработанным в Лаборатории экологической и биомедицинской масс-спектрометрии ИАнП РАН. Все спектры получены в режиме съемки положительных ионов. Объем анализируемой пробы 10 мкл. Скорость подачи раствора образца 1–2 мкл/мин.
Образцы растворяли в 50 % ацетонитриле в присутствии 1 % уксусной кислоты в концентрации 5– 20 пмоль/мкл.
Для проведения эксперимента было приготовлено несколько искусственных смесей, содержащих галоген-модифицированные дезоксиуридины в различных соотношениях. Поскольку главной задачей являлось определение количественных соотношений интересующих нас дезоксиуридинов, мы смешали растворы тимидина, CldU, BrdU, IdU (начальная концентрация каждого составляла 10–3 М) в различных соотношениях таким образом, чтобы концентрационные соотношения тимидина и одного из модифицированных дезоксиуридинов, а именно IdU, были постоянными и служили внутренними стандартами.
Смеси готовили так, чтобы мольное соотношение тимидина, хлор-, бром- и иод-производных было соответственно 1:1:1:1, 1:2:2:1, 1:2:3:1, 1:3:2:1 и 1:10:10:10.
Для перевода всех интересующих нас соединений в исключительно натриевую форму к каждой пробе добавляли 10–5 М раствор хлорида натрия, так чтобы его мольное соотношение с одним из стандартов составляло 1:100. Каждую пробу разбавляли ацетонитрилом до конечной конценрации 50 %. Мольные соотношения компонентов в пробе подбирались таким образом, чтобы была возможность затем сравнивать отношения интенсивностей сигналов, полученных в различных экспериментах. Поскольку целью эксперимента было определение количественных соотношений, каждую из проб анализировали 3–5 раз.
В работе использовали реактивы фирмы "Sigma" (США) и ацетонитрил фирмы "Криохром" сорта 0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты оценивали по интенсивности полученных сигналов, соотнося между собой интенсивности одного из стандартов и соединения с варьирующейся концентрацией.
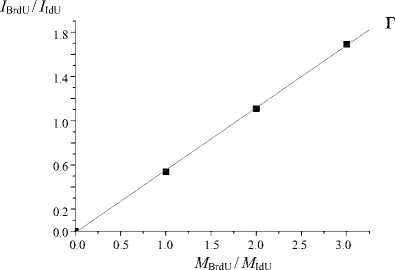
На рис. 2 и в таблице представлены данные, показывающие линейную зависимость между мольным соотношением компонентов смеси и отношением интенсивности полученных сигналов.
Как видно из рис. 2, разброс полученных значений минимален. Точки практически идеально ложатся на график линейной регрессии. Погрешность эксперимента (ошибка среднего) не превышает 3 %. Это означает, что полученные калибровочные графики можно применять для количественной оценки галоген-модифицированных дезоксиуридинов с использованием внутреннего стандарта.
Следует отметить, что, таким образом переходя к реальным пробам, содержащим гидролизованную до отдельных нуклеотидов ДНК, мы можем не только установить, какой процент тимидина был замещен на галоген-дезоксиуридин, но и, введя внутренний стандарт в виде одного из исследуемых соединений, количественно оценить концентрацию и незамещенного тимидина, и его аналогов, особенно если замещение пройдет не полностью. Это является немаловажным для исследования процесса репликации.
Несмотря на то что интенсивность сигнала тимидина гораздо выше, чем галоген-дезо-ксиуридинов, мы также вполне способны количественно оценить и процесс репарации (как и другие процессы, когда происходит только частичное построение цепи ДНК), когда замещение проходит на 10–20 %, добавив сначала раствор стандарта
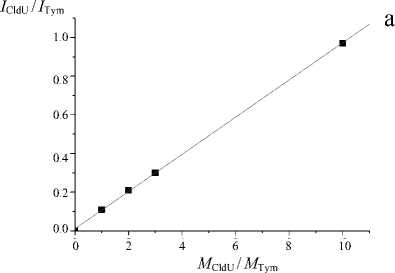
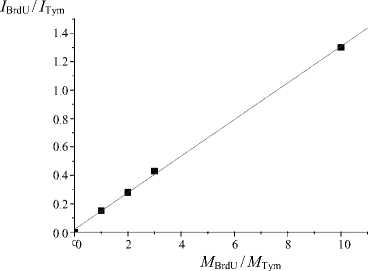
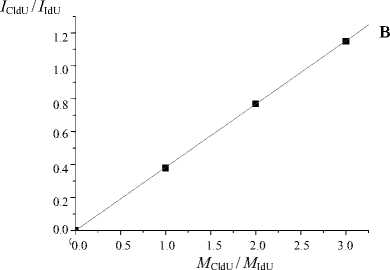
Рис. 2. Зависимости между относительными (к стандарту) концентрациями и относительными (к стандарту) интенсивностями сигнала для соединений с различной концентрацией.
а — CldU, Tym (стандарт); б — BrdU, Tym (стандарт); в — CldU, IdU (стандарт); г — BrdU, IdU (стандарт)
Соотношения интенсивностей сигнала соединения (с варьирующейся концентрацией) и стандарта
|
Относительная концентрация соединения (к стандарту XdU) |
I CldU / I Tym |
I BrdU / I Tym |
I CldU / I I |
I BrdU / I I |
|
1:1 |
0.11 |
0.15 |
0.38 |
0.54 |
|
1:2 |
0.21 |
0.28 |
0.77 |
1.11 |
|
1:3 |
0.30 |
0.43 |
1.15 |
1.69 |
|
1:10 |
0.97 |
1.3 |
— |
— |
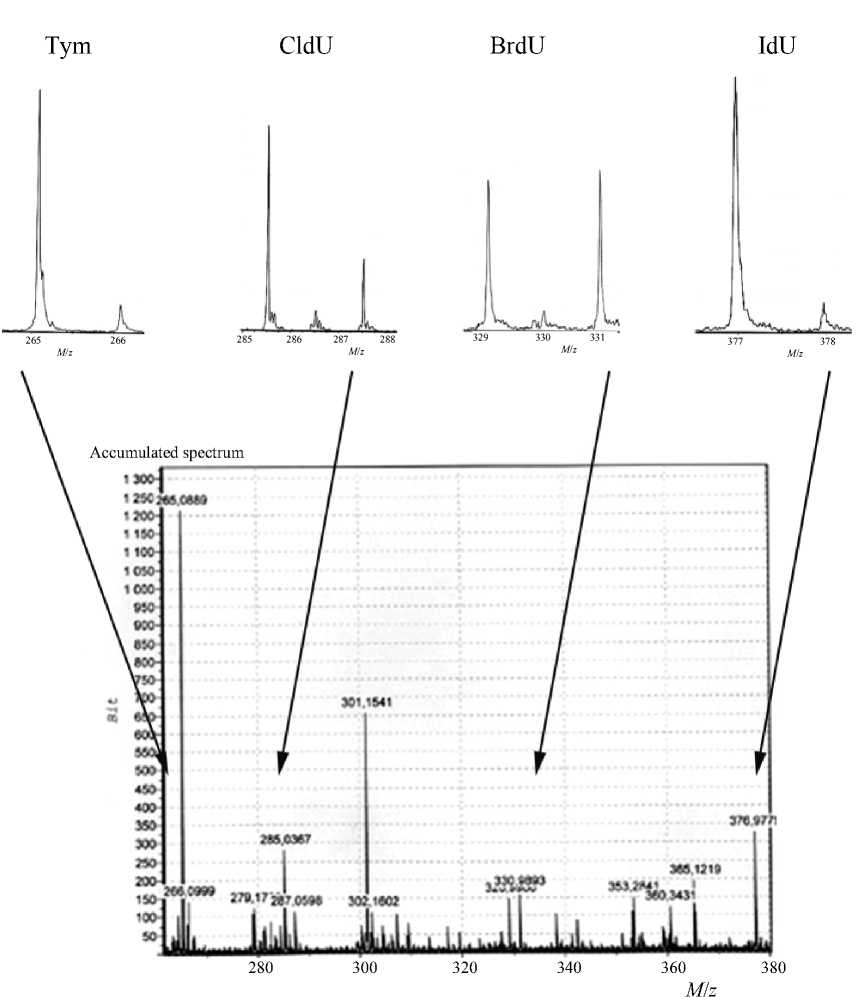
Рис. 3. Масс-спектрометрический анализ смеси тимидина и галоген-модифицированных дезоксиуридинов
с концентрацией, соотносимой с концентрацией введенной метки, и следующим шагом добавив более концентрированный раствор стандарта, чтобы соотнести концентрации его и тимидина. Также следует отметить, что хлор-дезоксиуридин и бром-дезоксиуридин имеют весьма характерное изотопное распределение (рис. 3), что позволяет нам контролировать ошибку эксперимента.
Особенно следует отметить, что если цепь ДНК состоит хотя бы из 2000 пар нуклеотидов, четверть из которых является тимидином, и, пусть, только 10 процентов заместились на галоген-дезо- ксиуридин, то мы из пробы с концентрацией ДНК до гидролиза 10–6 М получим раствор 10–4 М концентрации галоген-модифицированного дезоксиуридина. То есть концентрации, более чем достаточной для успешного анализа. Стоит упомянуть, что большей частью вышеописанные процессы исследуют на хромосомных ДНК, величина которых в основном более 5000 пар нуклеотидов и зачастую достигает миллиона. Соответственно, имеется возможность работать растворами с очень низкой концентрацией ДНК (от 10–7 М и ниже в зависимости от величины цепи ДНК).
Таким образом, в результате проведенного эксперимента было показано, что метод масс-спектрометрии вполне может быть применен к количественному определению галоген-модифицирован-ных дезоксиуридинов, причем имеется возможность не только оценить концентрационное соотношение исследуемых соединений, но и дать достаточно точную количественную оценку.
Список литературы Масс-спектрометрическое определение концентрационных соотношений галоген-модифицированных 2'-дезоксиуридинов
- Anglana M., Apiou F., Bensimon A., Debatisse M. Dynamics of DNA replication in mammalian somatic cells: nucleotide pool modulates origin choice and interorigin spacing//Cell. 2003. V. 114. P. 385-394.
- Cremer T., Cremer C. Chromosome territories, nuclear architecture and gene regulation in mammalian cells//Nat. Rev. Genet. 2001. N 2. P. 292-301.
- Li F., Chen J., Solessio E., Gilbert D.M. Spatial distribution and specification of mammalian replication origins during G1 phase//J. Cell. Biol. 2003. V. 161. P. 257-266.
- Habermann F.A., Cremer M., Walter J. et al. Arrangements of macro-and microchromosomes in chicken cells//Chromosome Res. 2001. N 9. P. 569-584.
- Zink D., Cremer T., Saffrich R., et al. Structure and dynamics of human interphase chromosome territories in vivo//Hum. Genet. 1998. V. 102. P. 241-251.
- Ferreira J., Paolella G., Ramos C., Lamond A.I. Spatial organization of large-scale chromatin domains in the nucleus: a magnified view of single chromosome territories//J. Cell. Biol. 1997. V. 139. P. 1597-1610.
- Malinsky J., Koberna K., Stanek D. et al. The supply of exogenous deoxyribonucleotides accelerates the speed of the replication fork in early S-phase//J. Cell. Sci. 2001. V. 114. P. 747-750.
- Gerstin K.M., Dresser M.J., Giacomini K.M. Specificity of human and rat orthologs of the concentrative nucleoside transporter, SPNT//Am. J. Physiol. Renal. Physiol. 2002. V. 283. P. 344-349.
- Dresser M.J., Gerstin K.M., Gray A.T., Loo D.D., Giacomini K.M. Electrophysiological analysis of the substrate selectivity of a sodium-coupled nucleoside transporter (rCNT1) expressed in Xenopus laevis oocytes//Drug Metab. Dispos. 2000. V. 28. P. 1135-1141.
- Keller C., Hyrien O., Knippers R., Krude T. Site-specific and temporally controlled initiation of DNA replication in a human cell-free system//Nucleic Acids Res. 2002. V. 30. P. 2114-2123.
- Van Leeuwen F., Kieft R., Cross M., Borst P. Biosynthesis and function of the modified DNA base beta-D-glucosyl-hydroxymethyluracil in Trypanosoma brucei//Mol. Cell. Biol. 1998. N 18. P. 5643-5651.


